Тераностика: 3 в 1 современной медицины

Вплоть до середины XX века медицина была основана на диагностике заболевания путем сбора анамнеза и изучении клинических симптомов. Разработка новых лекарств расширяла перечень заболеваний, доступных для лечения, а развитие технологий позволило использовать для диагностики визуализацию с помощью рентгенографии, КТ, МРТ и УЗИ. Постепенно, с открытием новых заболеваний, у врачей появилась потребность в индивидуальном подходе для лечения пациента, а также в использовании одного препарата в качестве как диагностического, так и терапевтического средства одновременно. Так появилась тераностика.
Впервые термин «тераностика» был введен в августе 1998 года, причем это понятие было тесно связано с прецизионной и персонализированной медициной. Прецизионная медицина объединяет официальную научно-обоснованную классическую медицину и последние открытия исследователей, в то время как персонализированная медицина нацелена на поиск клинико-диагностических решений с учетом индивидуальных генетических и метаболических особенностей пациента. Тераностика — это комплекс решений для диагностики, визуализации и терапии с помощью одного и того же вещества.
Такая комбинация визуализации биомаркером с молекулярной терапией лекарственным средством может быть применима в различных аспектах персонализированной медицины:
- выявление заболевания на начальных стадиях;
- диагностика различных стадий заболевания;
- выбор лекарственного средства;
- выявление побочного эффекта препарата на ранней стадии;
- планирование лечения с помощью одного агента.
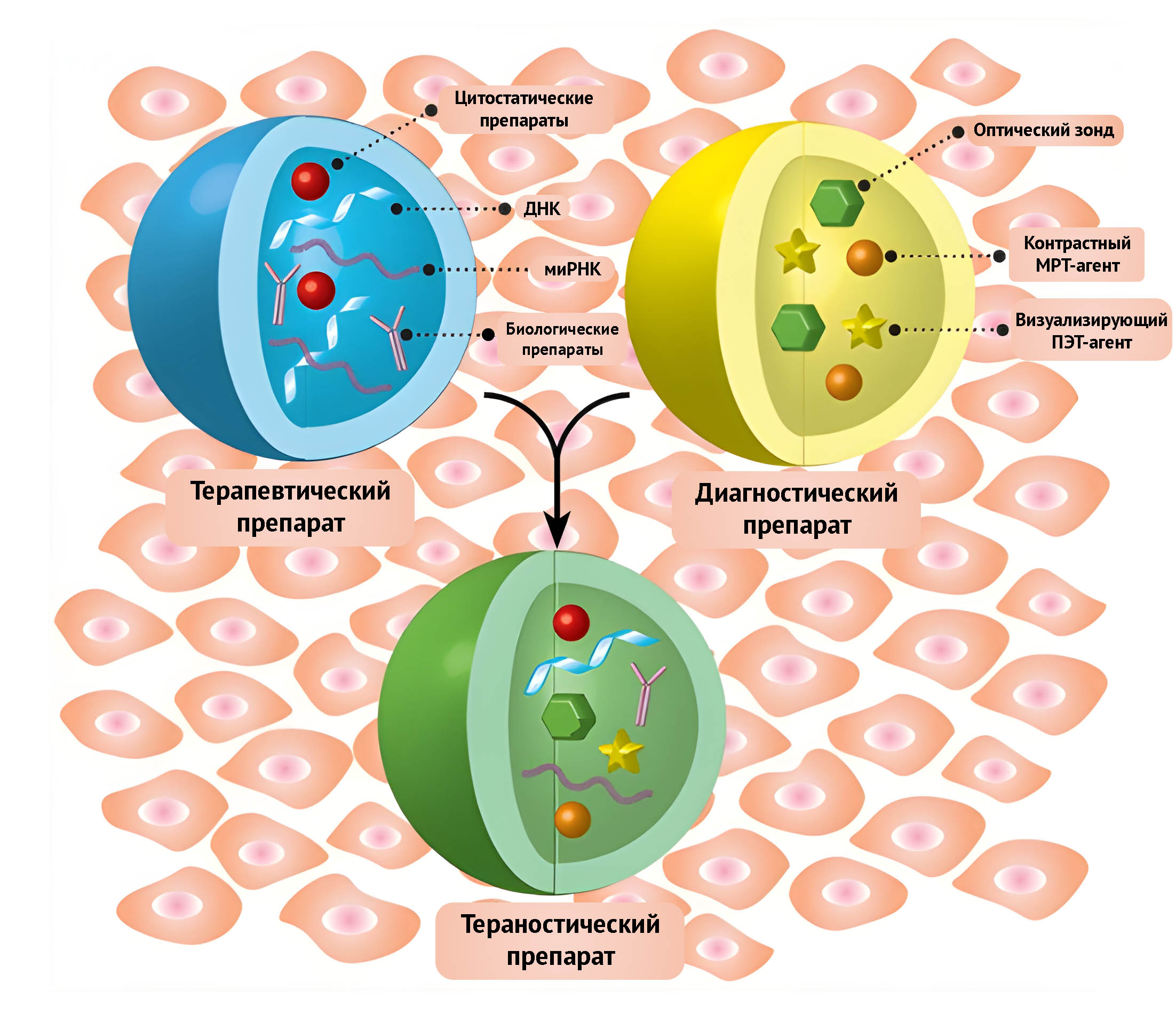
Рисунок 1 | Тераностика как комплекс решений для диагностики, визуализации и терапии
Тераностика обладает рядом преимуществ в сравнении с методами классической медицины:
- Контроль эффективности лечения. Тераностические препараты обеспечивают высокую разрешающую способность визуализации. Поэтому, если эффективность препарата будет снижаться, врач сможет это быстро заметить и вовремя назначить другой препарат. Это особенно важно для лечения онкологических заболеваний, так как в опухолевых клетках происходят новые мутации, снижающие эффективность препарата.
- Персонализированный подход. Тераностика, как уже отмечалось, тесно связана с персонализированной медициной. Ее методы позволяют находить уникальный подход к лечению конкретного пациента.
- Избирательность действия. Одна из фишек тераностики — направленная доставка лекарства. Препарат действует только на патологически измененные клетки, не затрагивая здоровые. За счет этого лечение становится более безопасным, снижается риск серьезных побочных эффектов.
Какие проблемы решает тераностика?
Первой появилась радионуклидная тераностика, а первым ее оружием стал иод-131. Во всем мире его уже давно используют для диагностики и лечения рака щитовидной железы. Позднее более широкое применение в тераностике получили и другие радиофармацевтические препараты, а также получило развитие такое направление, как молекулярная тераностика. Сегодня она во многом реализуется через нанотехнологии, и появилось даже отдельное название для такого направления — нанотераностика. А также есть препараты, которые сочетают в себе использование и радионуклидов, и нанотехнологий.
На сегодняшний день тераностика позволяет лечить широкий спектр заболеваний.
- Рак — одна из самых смертоносных и сложных клинических проблем. Актуальные проблемы онкологии — не только лекарственная устойчивость опухолевых клеток и метастазирование, но и отсутствие универсального лекарства, поскольку ведь каждый случай рака уникален и двух одинаковых не существует. Еще одна из важнейших задач — ранняя диагностика рака. Но и она может быть невероятна сложна, так как некоторые типы рака крайне затруднительно диагностировать на первых стадиях.
- К счастью, методы тераностики уже позволяют это сделать. Специально для лечения рака был разработан ряд наноматериалов, позволяющие не только диагностировать и визуализировать новообразование, но и доставлять терапевтический материал в опухолевые ткани. Существуют тераностические препараты, прошедшие клинические испытания для лечения глиобластомы и получившие разрешения для проведения клинических испытаний для лечения рака поджелудочной, молочной и предстательной желез.
- Легочные заболевания — еще одна из основных причин смерти и инвалидности по всему миру. Новейшие методы лечения хронических респираторных заболеваний имеют серьезные негативные последствия, и повышение эффективности лечения является одной из главных задач этого десятилетия. Одна из самых сложных задач — лечение туберкулеза, сопряженного с лекарственной резистентностью. Тераностика уже достигла некоторых успехов в преодолении этой группы проблем. Было проведено исследование с использованием наносфер хитозана для инкапсуляции коктейля плазмидных ДНК, кодирующих весь белок респираторно-синцитиального вируса (RSV). Результат указывает на эффективную профилактическую стратегию интраназального переноса генов для защиты мышей от RSV-инфекции.
- Сердечно-сосудистые заболевания. Летальные исходы от этой группы заболеваний зачастую связаны с атеросклеротическим поражением кровеносных сосудов органов. Для этой группы заболеваний некоторые тераностические препараты уже прошли доклинические испытания.
- Болезни почек. Было обнаружено, что болезни почек можно лечить с использованием нанотехнологий. Анатомическое строение почек позволяет им выводить наночастицы размерами до 10 нм. Были проведены эксперименты с использованием углеродных нанотрубок для неинвазивной диагностики терминальной стадии хронической болезни почек.
- Для нейродегенеративных заболеваний, таких как болезнь Паркинсона или Альцгеймера, главная проблема состоит в прогрессирующей потере функции и строения нейронов. Для тераностических агентов при таких заболеваниях препятствием становится гематоэнцефалический барьер. Но недавно были получены магнитные наночастицы оксида железа очень малых размеров, с помощью которых у животных удалось обнаружить поражения центральной нервной системы, что невозможно для обычного МРТ.
Радионуклидная тераностика
Радионуклиды йода были использованы для лечения рака щитовидной железы в 1946 году. В ходе исследований было показано, что терапия NaI-131 высокоэффективна в борьбе с онкологическими заболеваниями.
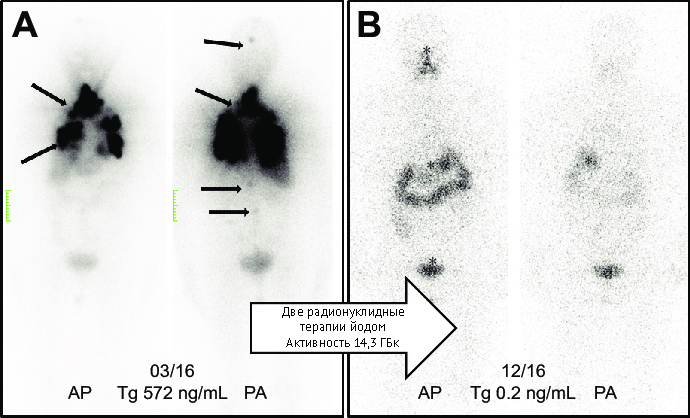
Метод стал тераностическим после раскрытия диагностического потенциала I-131. Его используют для оценки функционального состояния щитовидной железы, сканирования и сцинтиграфии щитовидной железы при различных заболеваниях, в том числе для диагностики дистиреозов, а также А-клеточного рака щитовидной железы и метастазов. Терапевтическое применение I-131 также было расширено, его используют для лечения токсического зоба.
Сегодня радионуклидная тераностика осуществляется не только за счет использования одного и того же изотопа как средства диагностики и терапии одновременно. Основой радиотераностики является использование пары химически и структурно идентичных или почти идентичных радиофармпрепаратов (РФП), меченных разными изотопами. Один РФП — для молекулярной диагностической визуализации, а другой — для молекулярной таргетной радионуклидной терапии одного и того же заболевания. Идеальная тераностическая пара будет использовать разные изотопы одного и того же элемента, которые являются оптимальными для визуализации и терапии (например, Y-86 и Y-90 при нейроэндокринных опухолях или I-124/I-123 и I-131 при заболеваниях щитовидной железы) соответственно. У такой пары будут одинаковые химические свойства для разных изотопов одного и того же элемента (за исключением водорода/дейтерия), скорость реакции в организме. Единственная разница в физических и физиологических эффектах будет обусловлена различиями в физическом периоде полураспада и распада, ограничивающими временной ход фармакокинетики радиофармпрепарата и его метаболитов.
Принципы создания тераностической пары
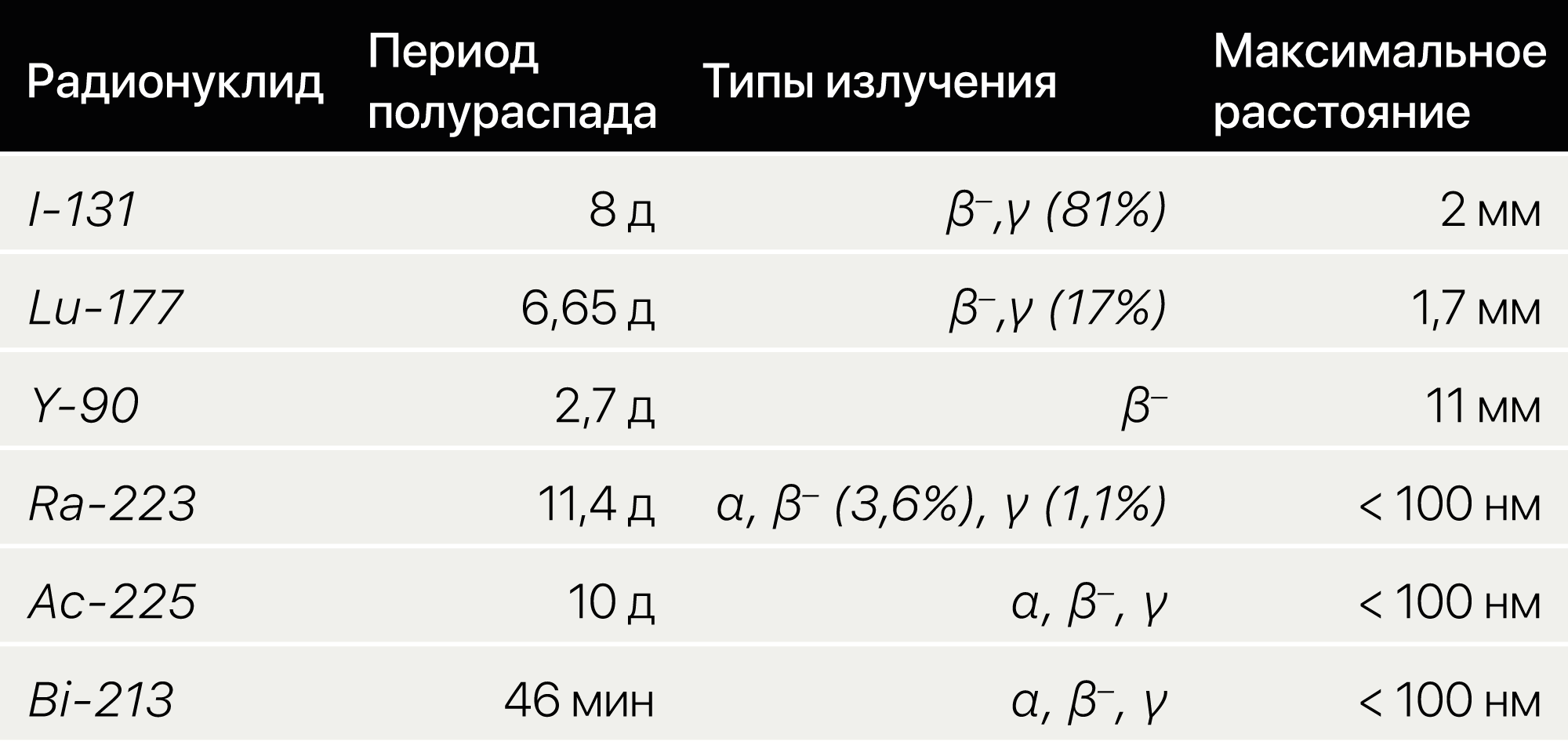
Существенное влияние на свойства радионуклида и на его пригодность для тех или иных целей оказывает тип его излучения. Радионуклид из тераностической пары обязательно должен обладать хотя бы двумя типами излучения, что делает его более эффективным конкретно для этой задачи:
- Гамма-лучи полезны для визуализации (диагностики), поскольку они имеют очень низкое поглощение тканями и передачу энергии, а также очень большую длину пути, что приводит к снижению излучения до цели и увеличению, но излучению энергии низкого уровня для окружающих тканей (испускается, например, I-123).
- Бета-частицы, с другой стороны (испускаемые, например I-131, Lu-177 и Y-90), имеют более высокую передачу энергии к цели при меньшемдлине пути. Бета-излучатели более эффективны для метастазов большого/среднего размера, с их помощью можно проводить терапию опухоли.
- Альфа-частицы (испускаемые, например Ra-223) имеют очень высокую передачу энергии и очень короткую длину пути, которая обычно составляет диаметр нескольких ячеек. Альфа-излучатели считаются более предпочтительными при онкогематологичесих заболеваниях и микрометастазах.
На составление пары влияют физические свойства радионуклидов: типы их излучения, период полураспада, а также в каких областях они применимы отдельно. Помимо этого свою роль может сыграть и домен, на котором расположен радионуклид, даже если он не участвует в самой реакции. В зависимости от ситуации подбор доменов может меняться: подобрать одинаковые домены или взять разные, нацеленные на разные части молекулярных механизмов.
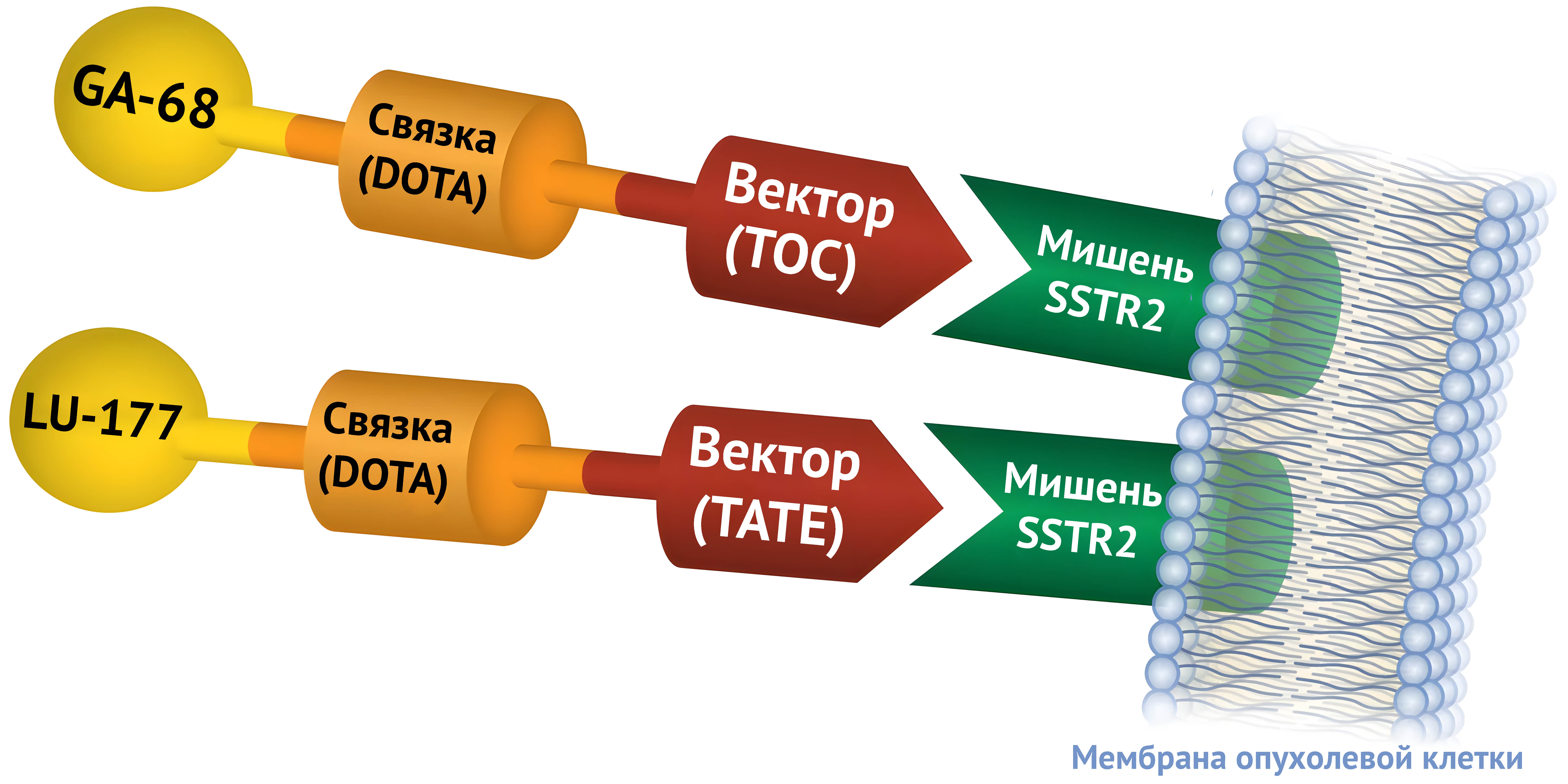
Так в тераностической паре Ga-68 и Lu-177 находятся на домене DOTATATE, так как для применения этой пары важно связывание с определенным рецептором. Другой пример — 99m Tc-метилендифосфонат (бисфосфонат) и 223 Ra-дихлорид (аналог кальция). Оба имеют высокое поглощение в областях ремоделирования кости и связываются с образованием новой костной ткани, и поэтому могут использоваться для диагностики и лечения остеобластных метастатических поражений костей соответственно. Схожим образом используются комбинации Tc-99м как диагностического средства для ПЭТ/КТ и сцинтиграфии и NaF-18, Sm-153, Sr-89.
Таблица 1 | Наиболее распространенные радионуклиды, разрешенные для применения в тераностике и в качестве компонентов тераностических пар.
Радиофармацевтические препараты
Диагностическая фаза тераностики
Рассмотрим на конкретном примере. Опухолевые клетки имеют оболочку, называемую мембраной; на мембране опухолевых клеток находятся определенные белки, такие как рецептор соматостатина (SSTR2), которые могут служить мишенью для лекарств от рака (специфический мембранный антиген).
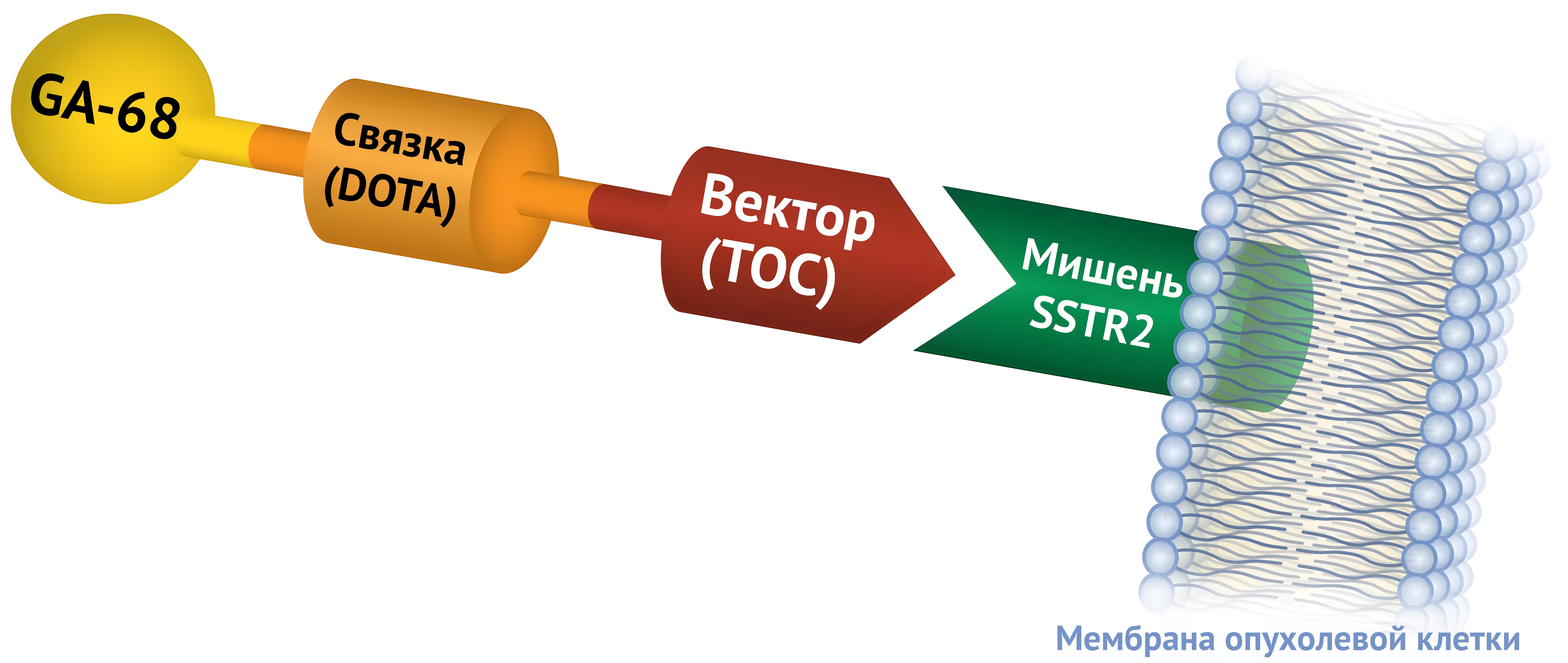
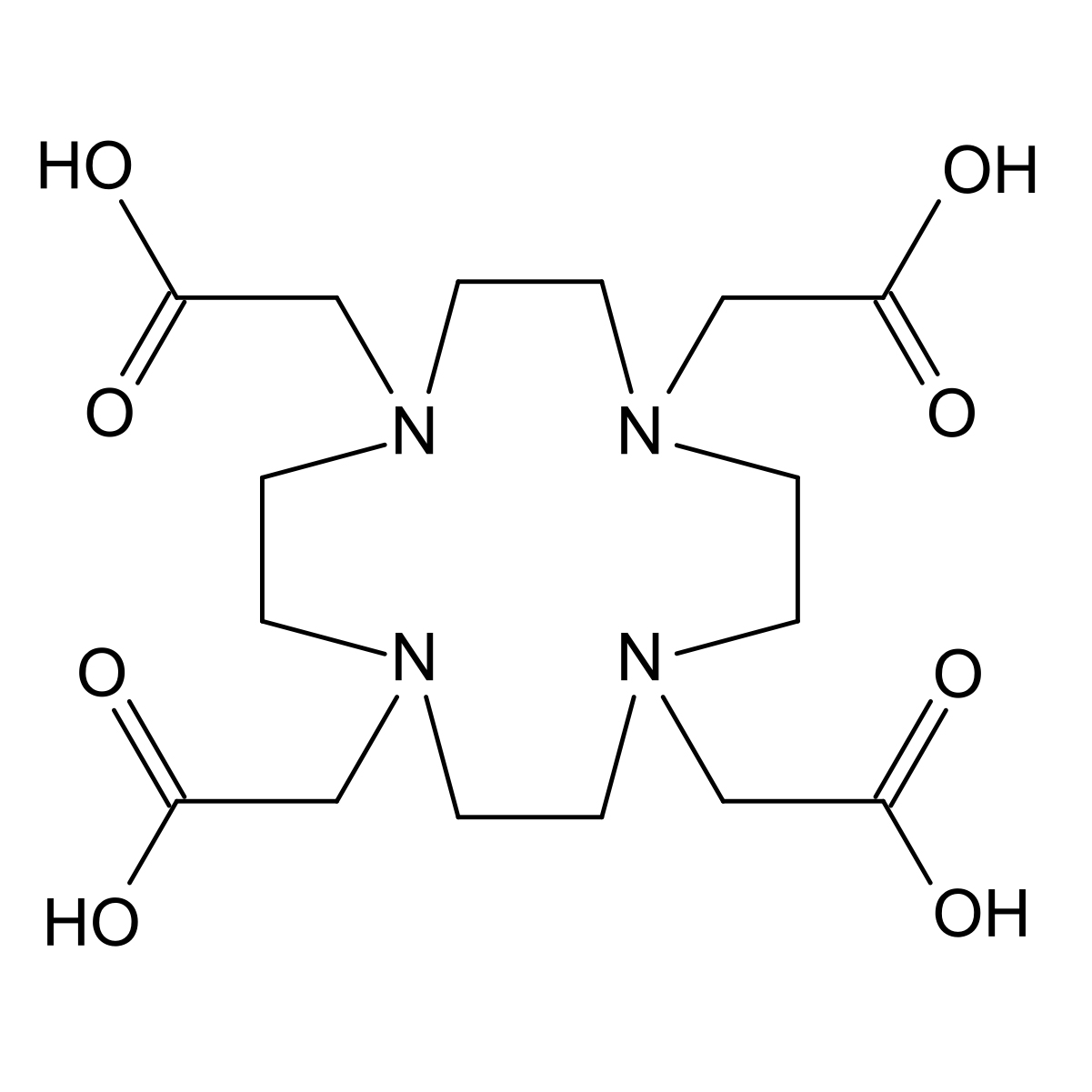
Рисунок 4 | Структура тетраксетана
Ga-68 DOTATOC — это радиоактивный диагностический препарат, который нацелен на SSTR2. Препарат вводится в вену пациента и разносится по кровотоку ко всем органам и тканям организма. Если у пациента нейроэндокринная опухоль с SSTR2 на мембранах опухолевых клеток, Ga-68 DOTATOC будет связываться с рецептором, и опухоль будет светиться при ПЭТ-сканировании.
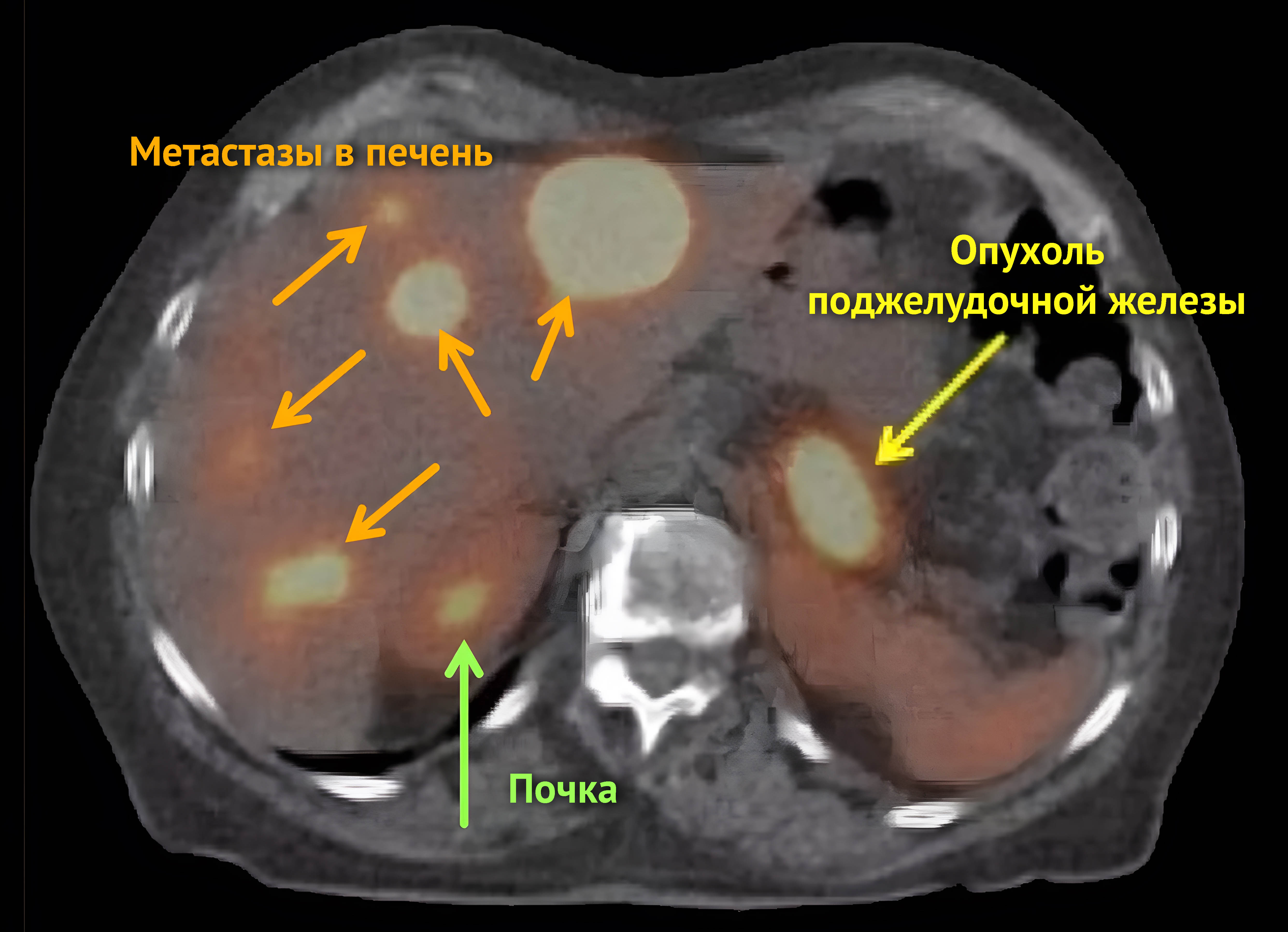
Рисунок 5 | Снимок, полученный с помощью позитронно-эмиссионной томографии.
Подсвеченные области — злокачественная опухоль поджелудочной железы и метастазы в печени и почке.
Терапевтическая фаза тераностики
После того, как опухоль была обнаружена, и диагностирован рак с помощью Ga68-DOTATOC и ПЭТ-сканирования, Ga-68 можно заменить другим радионуклидом, таким как Lu-177 или Y-90, который может поражать и убивать опухолевые клетки, на мембранах которых присутствует SSTR2.
Замечание. DOTA-TATE представляет собой пептид длиной в восемь аминокислот с ковалентно связанным DOTA бифункциональным хелатором.
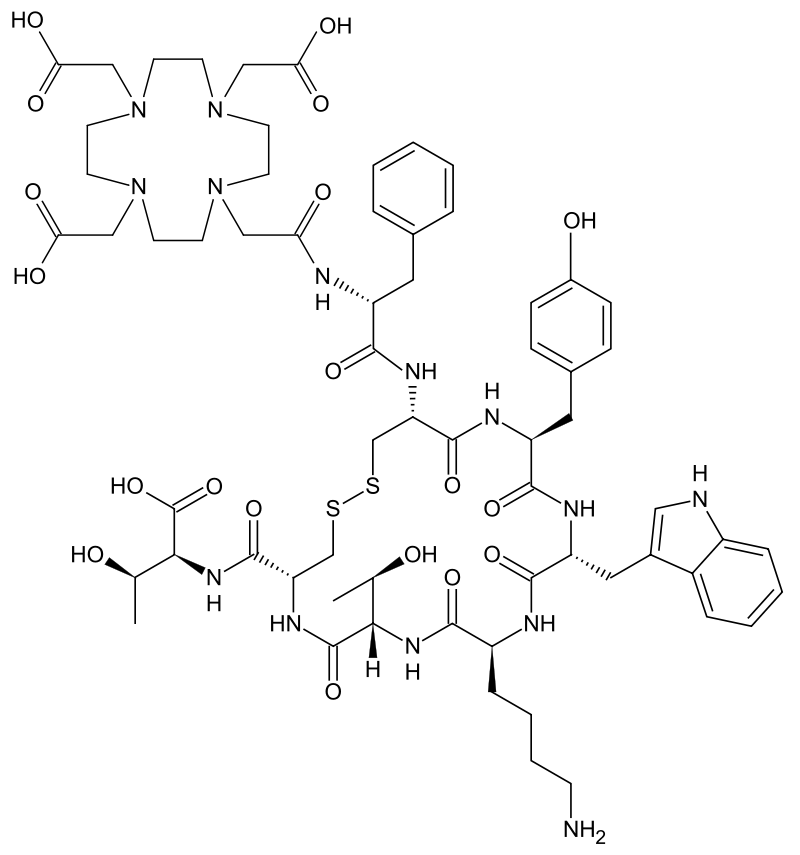
Рисунок 7 | Структура DOTA-TATE
Терапевтические препараты Y-90-DOTATOC и Lu-177-DOTATATE могут вводиться парентерально и доставляться в любую часть тела, в которой есть белки SSTR2. Эти терапевтические препараты связываются с белками SSTR2, как ключ в замке, позволяя лекарству проникать в опухолевые клетки и убивать их, повреждая ДНК этой клетки. На здоровые клетки вокруг опухоли, на мембране которых нет белков SSTR2, препарат не влияет.
Переносчиками радионуклидной части препарата (лигандами) могут являться: моноклональные антитела, пептиды, белки, иные полимеры, а также наночастицы.
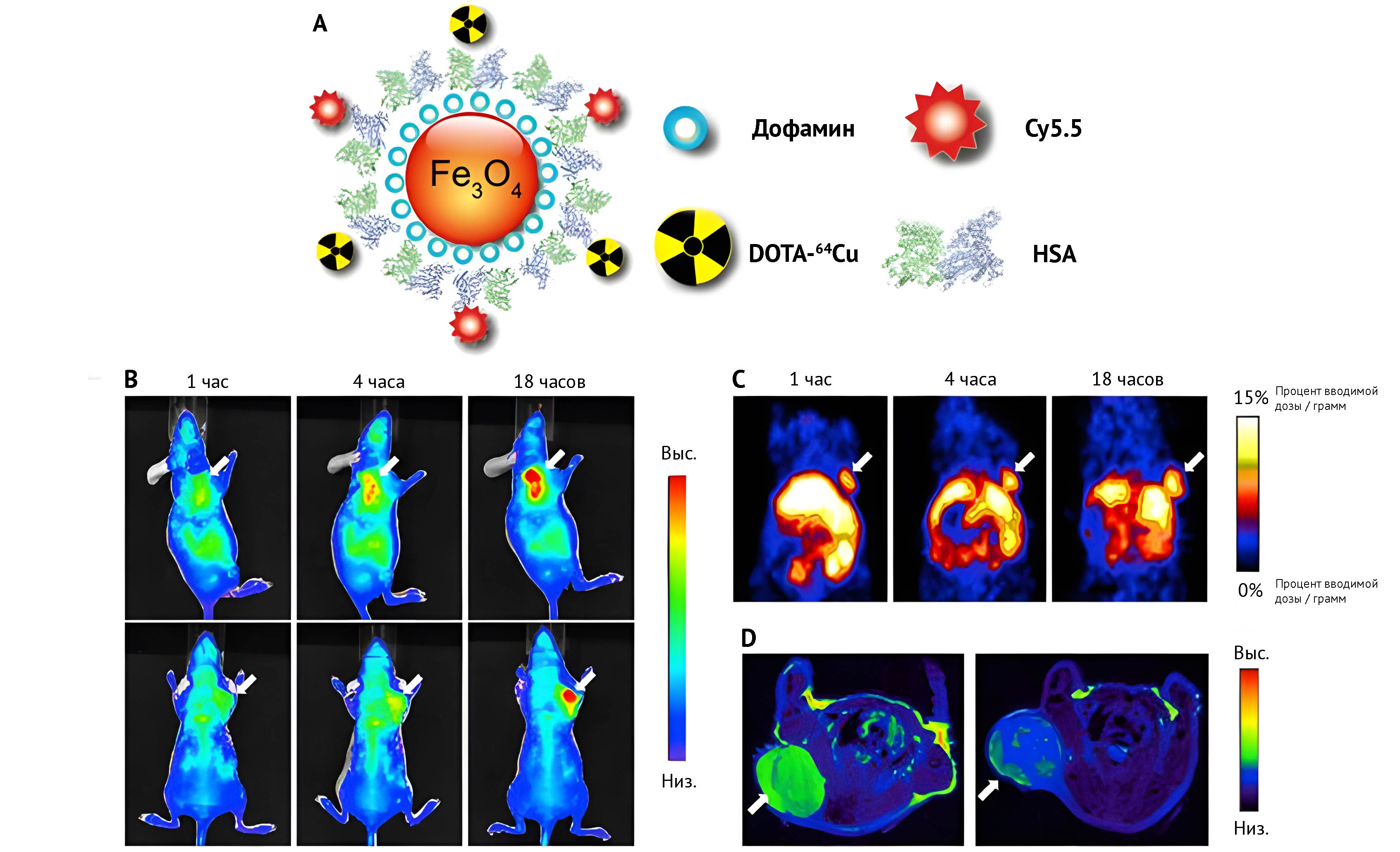
(B) Репрезентативные изображения мыши in vivo, которой вводили HSA-IONPs. Изображения были получены через 1, 4 и 18 ч после инъекции.
(C) Результаты ПЭТ-визуализации мыши in vivo, которой вводили HSA-IONPs. Изображения были получены через 1, 4 и 18 ч после инъекции.
(D) МРТ-изображения, полученные до и через 18 ч после инъекции.
В 2013 году был раскрыт потенциал радионуклидов тербия.
Тербий (Tb) — единственный элемент в периодической таблице Менделеева, предлагающий не только подобранную пару, но и четыре интересных с клинической точки зрения радиоизотопа с взаимодополняющими характеристиками ядерного распада, которые могут быть использованы во всем спектре процедур в ядерной медицине. Таким образом, тербий может служить «швейцарским армейским ножом ядерной медицины» для фундаментальных исследований новых радиофармпрепаратов и для подробного сравнения вариантов таргетной терапии.
Тогда ученые сообщали, что ПЭТ/КТ и ОФЭКТ/КТ-исследования с использованием как диагностических изотопов Tb-152 и Tb-155, так и гамма-излучающих терапевтических изотопов Tb-161 и Tb-149 обеспечили отличную визуализацию опухоли через 24 часа после инъекции. Кроме того, оба терапевтических изотопа обеспечивали значительное торможение роста опухоли у мышей, что приводило к заметной задержке роста опухоли или даже полной ремиссии. В частности, терапия Tb-161 и Tb-149 привела к полной ремиссии в 80 % случаев.
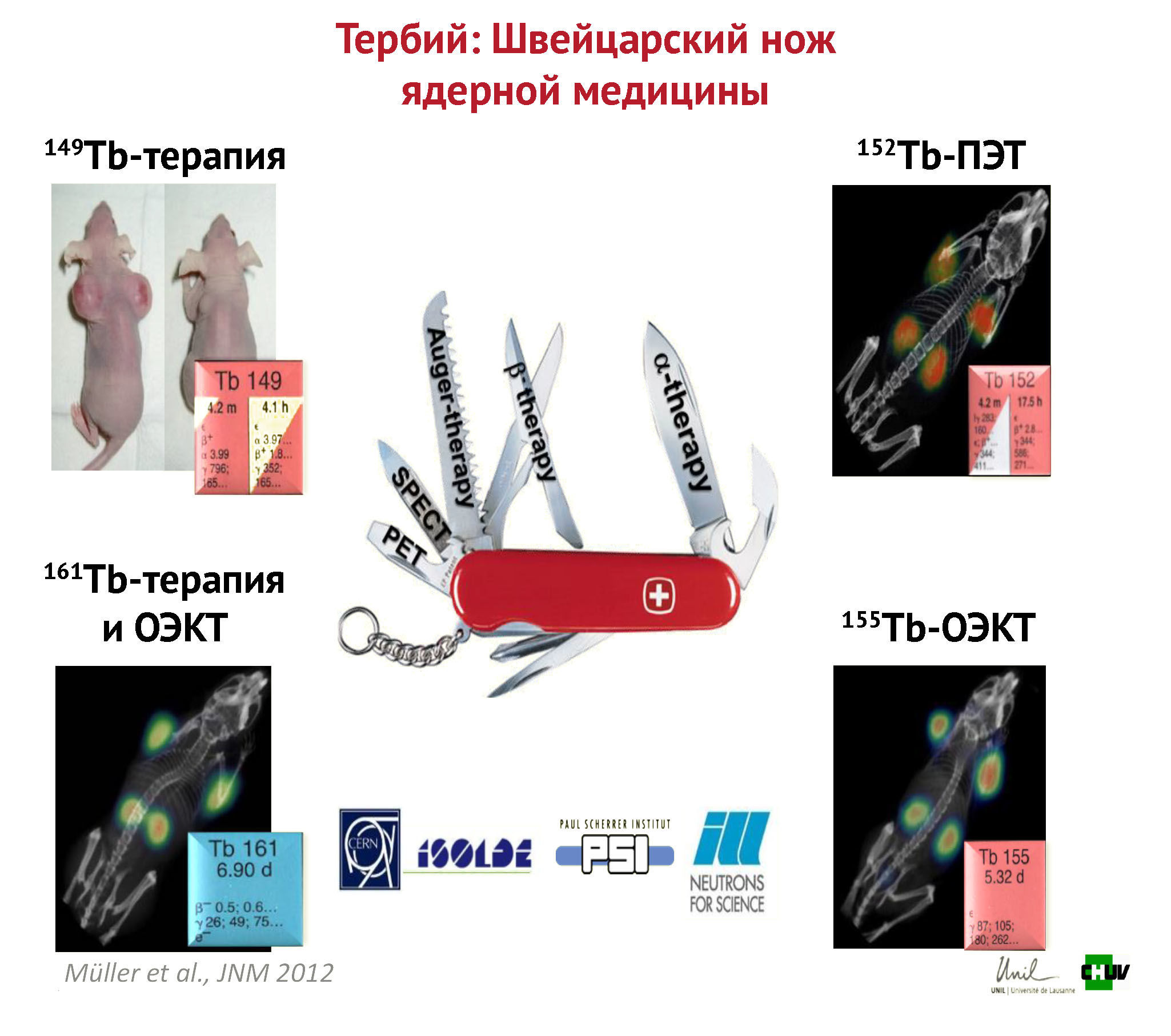
Рисунок 9 | Тераностическое применение радионуклидов тербия
Молекулярная тераностика
Комплекс методов молекулярной тераностики осуществляется посредством биологически активных веществ и лекарств и отличается большим разнообразием подходов по сравнению с радионуклидной тераностикой, так как для создания таких препаратов нужно более детальное понимание молекулярных механизмов и химических взаимодействий веществ. В молекулярной тераностике используются различные флуоресцентные агенты, метки и белки, различные пептиды, препараты с медленным высвобождением, а также наноматериалы и наночастицы.
Трансартериальная химиоэмболизация
Один из первых методов молекулярной тераностики — трансартериальная химиоэмболизация (TACE). Она сочетает диагностику опухолей печени с «маркировкой» опухоли, одновременным лечением опухоли и оценкой лечения в режиме реального времени. С момента первых разработок TACE широко использовался при лечении гепатоцеллюлярной карциномы (ГЦК) и в настоящее время является стандартом лечения пациентов с неоперабельным заболеванием средней стадии в соответствии с Барселонской классификацией стадий рака печени (BCLC). Она также выполняется при других показаниях для пациентов с ГЦК, в качестве этапа до операции, на ранних стадиях или реже при поздней стадии заболевания.
Положительный эффект TACE достигается за счет двух основных механизмов. Большинство опухолей в печени снабжаются соответствующей печеночной артерией, поэтому артериальная эмболизация преимущественно нарушает кровоснабжение опухоли и останавливает рост до неоваскуляризации. Во-вторых, целенаправленное введение химиотерапии позволяет доставить более высокую дозу в ткани при одновременном снижении системного воздействия, которое обычно является фактором, ограничивающим дозу. Этот эффект усиливается тем, что химиотерапевтический препарат не вымывается из сосудистого русла опухоли потоком крови после эмболизации. Это приводит к более высокой концентрации препарата, который контактирует с опухолью в течение более длительного периода времени.
TACE использует тот факт, что нормальные клетки печени преимущественно кровоснабжаются из системы портальной вены, в то время как раковые клетки почти исключительно зависят от артериального кровоснабжения. Двойная система кровоснабжения печени дает уникальную терапевтическую возможность целенаправленно воздействовать на опухоли печени. Из бедренного доступа микрокатетер под контролем рентгеноскопии сверх селективно вводится в соответствующую ветвь (ветви) печеночной артерии, питающей опухоль (опухоли). Инъекция растворимого контрастного вещества на основе йода используется для определения анатомии артерий и демонстрации областей васкуляризации опухоли, что позволяет точно установить микрокатетер в питающие опухоль сосуды, избегая, насколько это возможно, нецелевой эмболизации неопухолевой паренхимы печени. После выбора места инъекции вводится химиоэмболизационный препарат (химиотерапия вместе с эмболизирующим агентом), позволяющий достичь высокой концентрации препарата, которая в противном случае не была бы достигнута при системной доставке, тем самым максимизируя эффективность противоопухолевого препарата при минимизации системной токсичности
Агенты, которые используются для трансартериальой химиоэмобилизации:
- липиодол в смеси с химиотерапевтическими средствами;
- частицы, выделяющие лекарственное средство — медленное, длительное высвобождение загруженного лекарственного средства локально с эмболическим эффектом, приводящим к ишемии опухоли;
- микросферы из поливинилового спирта, наполненные доксорубицином;
- сверхабсорбирующие полимерные микросферы, наполненные доксорубицином;
желатиновые микросферы с цисплатином.
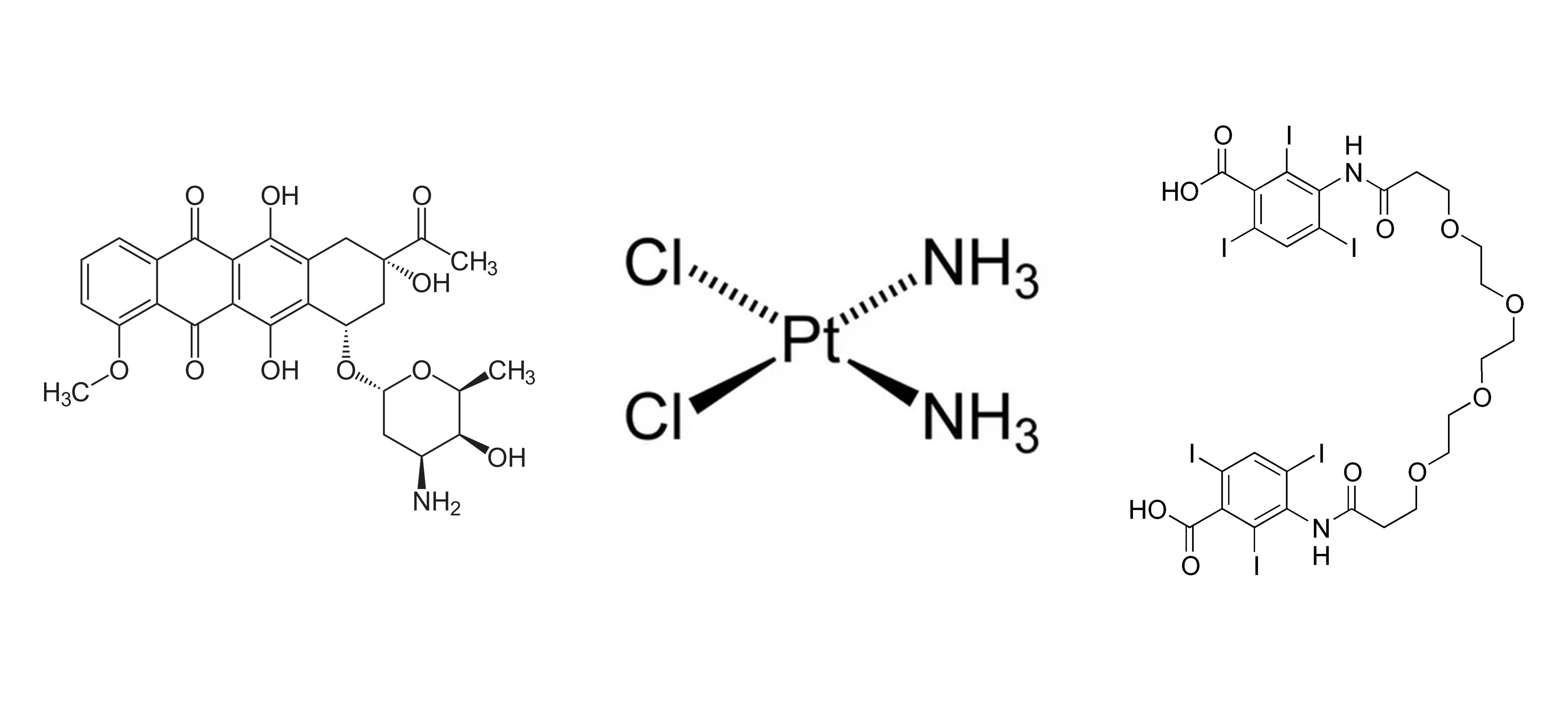
Рисунок 10 | Химические структуры агентов для трансартериальной химиоэмболизации
Слева направо: доксорубицин, цисплатин и липиодол.
Липиодол обладает уникальной способностью избирательно всасываться и надолго сохраняться при ГЦК и других гиперартериализированных опухолях печени. Таким образом, помимо своей роли в TACE, липиодол можно вводить отдельно в печеночную артерию в качестве средства поиска опухолей, позволяющего получить точную картографию опухолей печени. Таким образом, опухоль, которая не видна на УЗИ или КТ, может быть «помечена» и становится видимой на рентгеновских снимках для последующего нацеливания, например, биопсии и/или термической абляции. Кроме того, TACE использует умеренный эмболический эффект липиодола, связанный с его маслянистостью и вязкостью, что позволяет проводить артериальную и даже портальную эмболизацию, приводящую к гипоксии опухоли и гибели клеток. Эмульсия вводится медленно до тех пор, пока не будет проведено все лечение или не будет достигнут сосудистый стаз. За этим следует эмболизация питающих опухоль сосудов с использованием желатиновой губки или микрочастиц, которые дополнительно закупоривают сосудистую сеть опухоли, увеличивая ишемию опухоли и предотвращая быстрое вымывание эмульсии, тем самым увеличивая воздействие цитотоксического агента на опухолевые клетки.
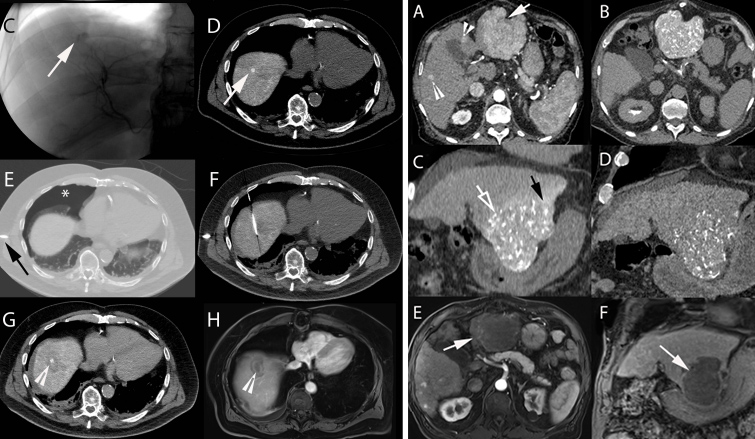
Рисунок 11 | Визуализация опухолей с помощью трансартериальной химиоэмболизации
На снимках слева использовались КТ и МРТ с введением липиодола, на снимках справа — КТ после применения микросфер, наполненных доксорубицином.
Нанотераностика
В последние десятилетия в молекулярной тераностике все чаще используются наночастицы и различные наноматериалы. Нанотераностика предназначена для определения электрических, оптических, биологических и магнитных свойств наряду с контрастирующими агентами. Нанотераностика может быть разработана из двух основных категорий материалов, то есть органических и неорганических. Наиболее клинически применяемыми наноплатформами являются органические наночастицы и специфические биополимеры, включая липопротеины, дендримеры и наночастицы, переносимые с помощью липосом. Неметаллические наночастицы обладают биосовместимостью, могут эффективно воздействовать на целевой участок и часто ковалентно связываются с контрастирующим веществом. Однако металлические наночастицы, такие как суперпарамагнитные наночастицы оксида железа (SPIONs) и квантовые точки (QDs) хорошо изучены и эффективно используются в качестве материала для визуализации. Ограничениями металлических наночастиц в нанотераностике являются плохая растворимость в воде, стабильность и потенциальная токсичность. Исключение составляют наночастицы магнетита, маггемита и гематита. В организме человека налажен метаболизм железа, и такие наночастицы не будут для него токсичны.
Преимущество наночастиц заключается в их малых размерах, которые помогают им проникать глубже в биологические ткани. Но также важно, чтобы они действовали прицельно на пораженные болезнью области. Взаимодействие со здоровыми участками организма может привести к серьезным побочным эффектам. Поэтому отдельное внимание уделяется модификации поверхности наночастиц.
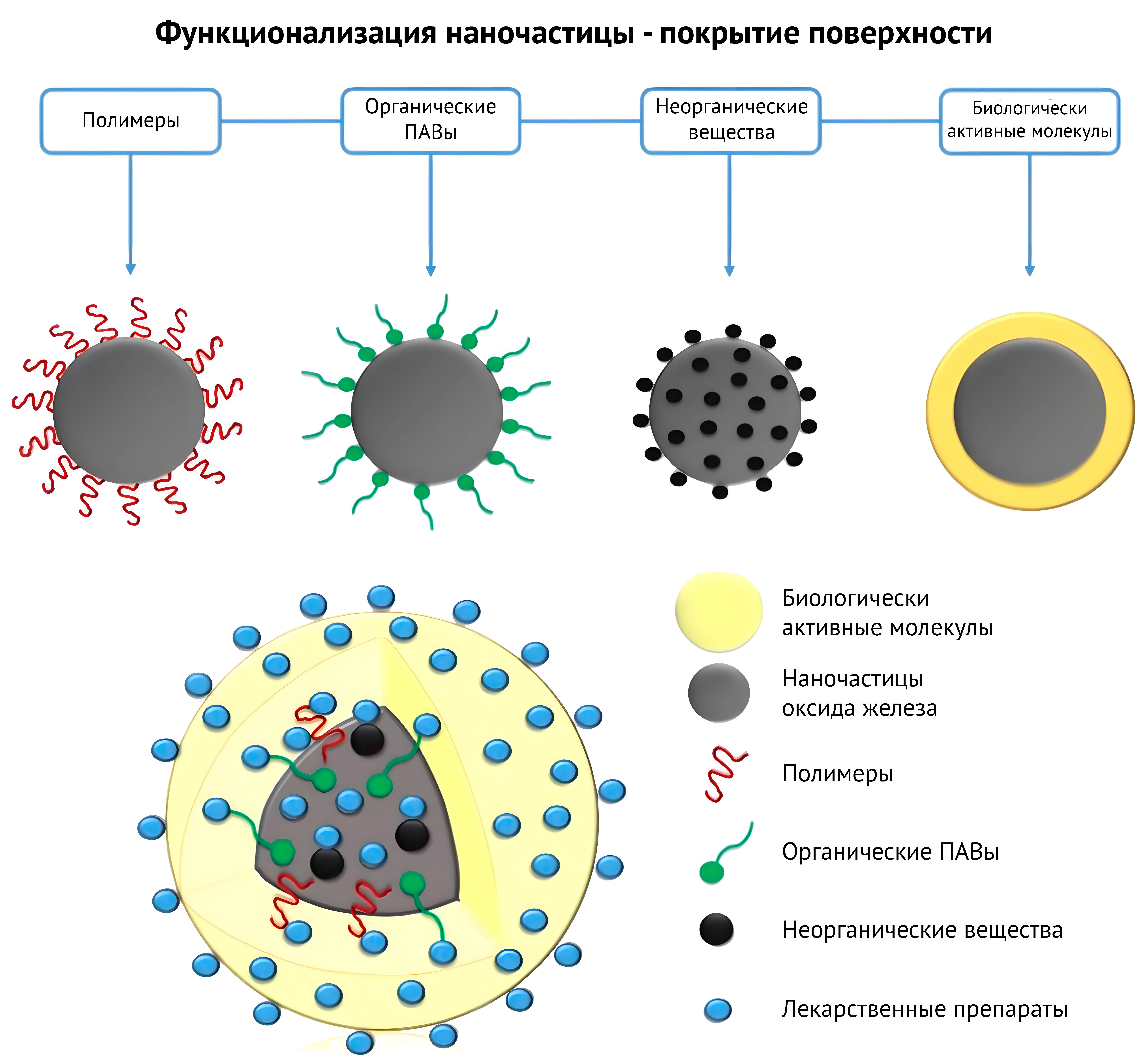
Рисунок 12 | Варианты модификации поверхности наночастиц
Фармакокинетика таких препаратов включает в себя целый ряд этапов, связанных с физико-химической природой наночастиц. Она включает в себя адсорбцию, распределение, метаболизм и выведение наночастиц в организме. Фармакокинетика играет значительную роль в оценке терапевтического эффекта и токсической природы введенного препарата.
Металлические наночастицы
Наночастицы золота, серебра, меди, платины и оксидов железа используются в основном как средства для диагностики, визуализации или локального нагрева. Причем цель их использования зачастую определяется размерами наночастиц. Например, более крупные наночастицы золота хорошо подходят для визуализации, а мелкие (менее 20 нм) для лечебной гипертермии.
Среди металлических наночастиц золото обладает наиболее широким функционалом, помимо визуализации и гипертермии, с его помощью можно усиливать действия препаратов. Таким образом с помощью золотых наночастиц было усилено действие доксорубицина. Наночастицы золота обладают флуоресценцией. Это свойство позволяет использовать их для фототерапии.
Неметаллические наночастицы
Неметаллические наночастицы обладают более разнообразными свойствами, а также являются более биодоступными и менее токсичными, чем металлические наночастицы. Чаще всего с их помощью осуществляют таргетную доставку лекарств. Особенно эффективно это при использовании кремниевых наночастиц, полимерных наночастиц и углеродных нанотрубок.
Квантовые точки
Квантовая точка — это фрагмент проводника или полупроводника, носители заряда (электроны) которого ограничены в пространстве по всем трем измерениям. Они представляют собой полупроводниковые нанокристаллы с флуоресцентными свойствами. Размер квантовой точки должен быть настолько мал, чтобы квантовые эффекты были существенными. Квантовые точки используют в основном для визуализации злокачественных опухолей. Недавно был применен метод по объединению квантовых точек и углеродных нанотрубок в качестве мощного инструмента для лечения рака. Углеродные нанотрубки избирательно разрушают раковые клетки посредством термической абляции и обеспечивают платформу для терапевтических агентов. Квантовые точки же служат в качестве маркера для углеродных нанотрубок, это позволяет отслеживать их активность. Следовательно, комбинация углеродных нанотрубок и квантовых точек предоставляет возможность для диагностики и лечения рака в режиме реального времени.
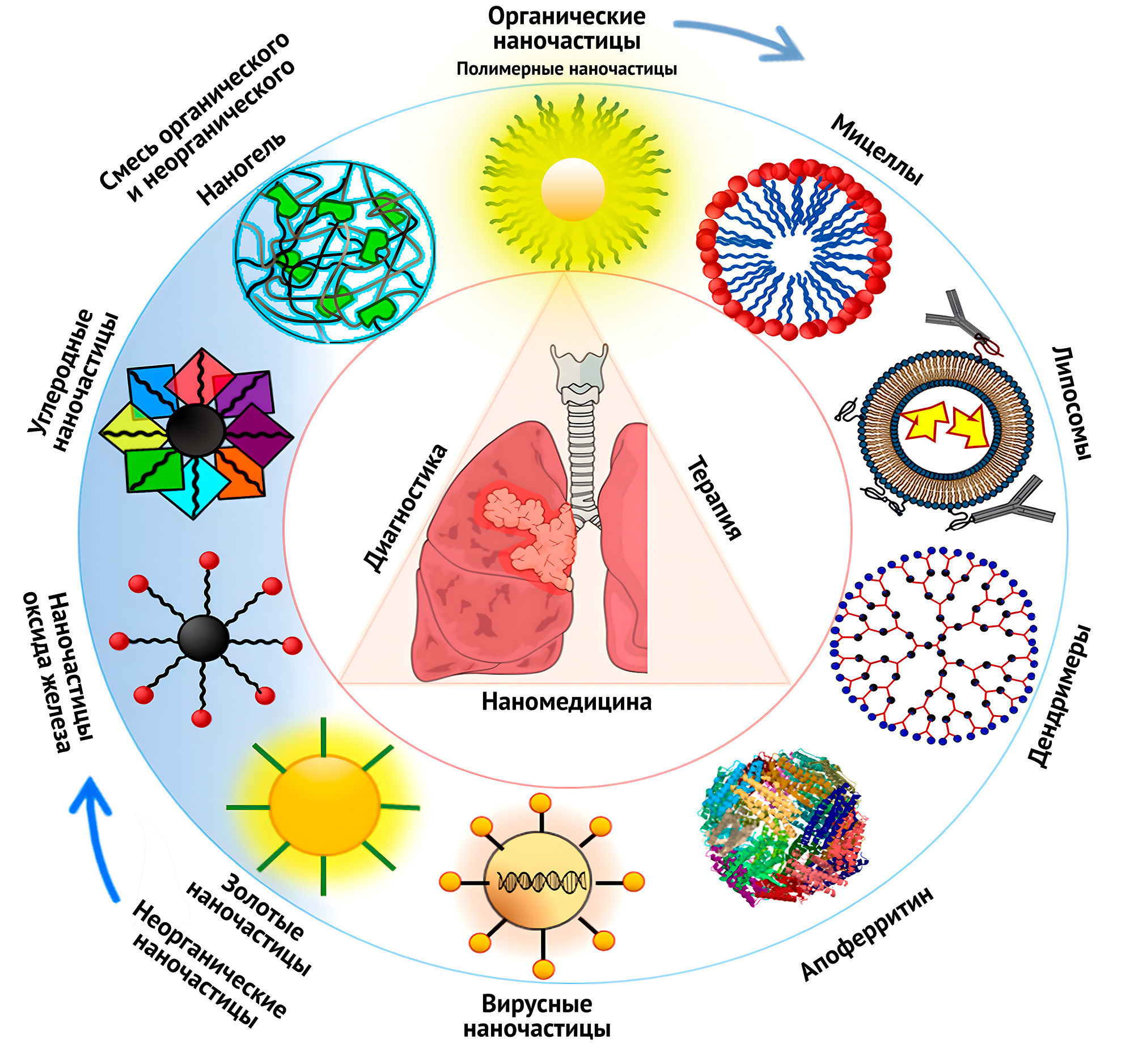
Рисунок 13 | Нанотехнологии молекулярной тераностики
Переносчики наночастиц
Наноносители могут быть классифицированы по таким параметрам, как размер, состав, структура и свойства. По этим параметрам выделяют: мицеллы, липосомы, дендримеры, полимеры с лекарственной нагрузкой, полимерные и твердые липидные наночастицы. Эти наноносители загружаются терапевтическими агентами и зондами для визуализации либо посредством водородных связей, ковалентно, нековалентно посредством электростатического или гидрофобного взаимодействия или даже путем физического захвата в наноматрицу и использования в тераностических приложениях.
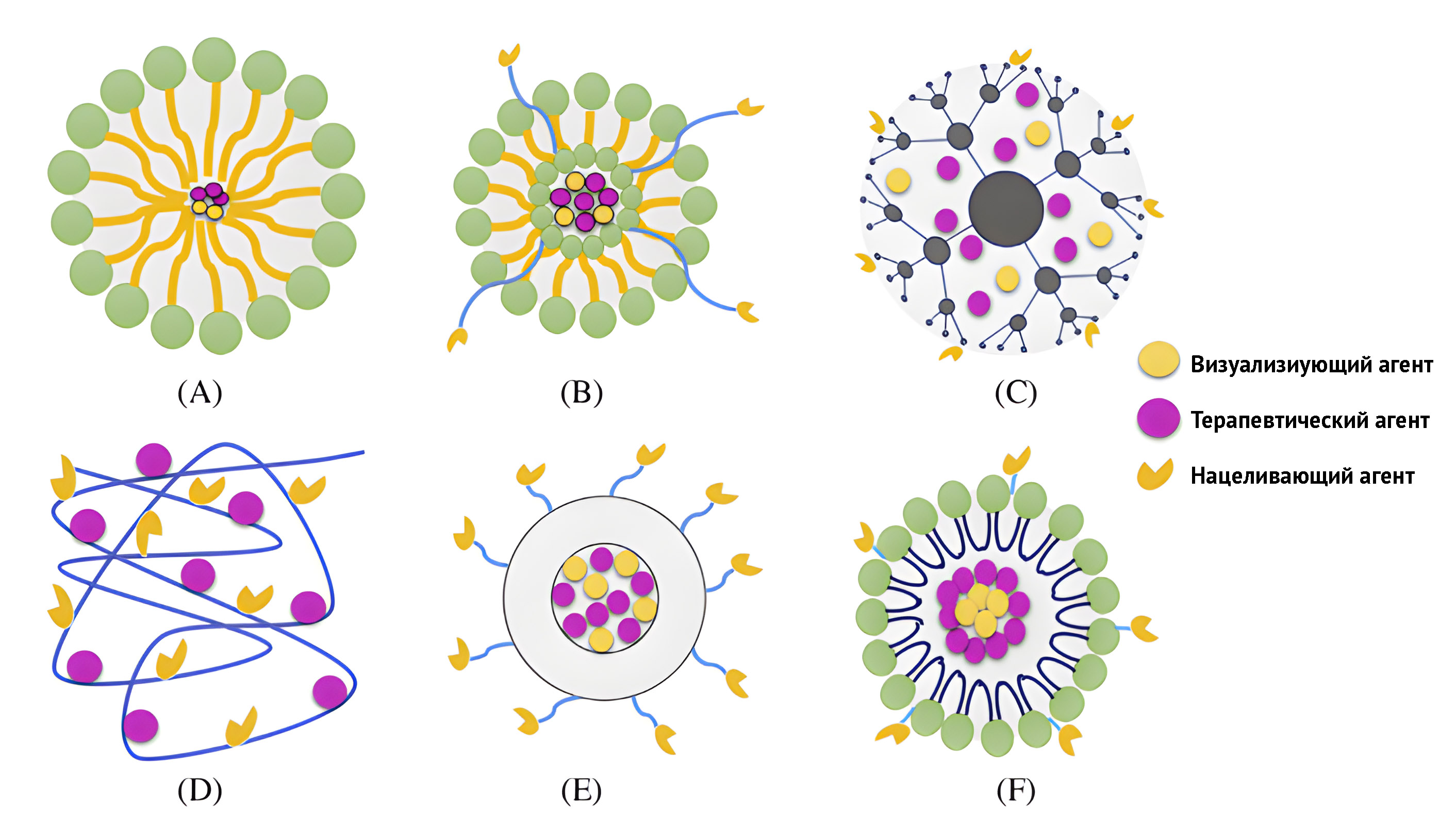
Рисунок 14 | Схемы строения наноносителей.
(A) мицелла, (B) липосома, (C) дендример, (D) полимеры, загруженные лекарственным средством, (E) полимерные наночастицы, (F) твердые липидные наночастицы.
Каждый переносчик обладает рядом преимуществ:
- Мицеллы хорошо работают в качестве усиления растворимости переносимого материала. Такой переносчик — потенциальная альтернатива для биологического введения плохо растворимых в воде материалов. Сила сцепления между терапевтическими агентами и полимерной сердцевиной определяет стабильность мицелл.
- Липосомы являются широко распространенными наноматрицами для разработки терапевтических средств и визуализирующих зондов благодаря их размеру, биосовместимости, гидрофобным и гидрофильным свойствам, низкой токсичности, способности к биологическому разложению и иммуногенности.
- Дендримеры — это сильно разветвленные полимеры с трехмерной архитектурой, которые вызвали большой интерес в недавних биомедицинских приложениях из-за их уникальных свойств, таких как возможность манипулировать молекулярной массой, химическим составом и функцией поверхности.
- Твердые липидные наночастицы отлично подходят для визуализации, а также обладают высокой биодоступностью, низкой частотой побочных эффектов, способностью к разложению.
Перспективы тераностики
За последнее столетие тераностика стала важной частью медицины и одним из подходов к лечению пациентов. Тераностика плотно связана с персонализированной медициной, и у нее есть множество методов и решений. Мы наблюдаем их в ядерной медицине, в развивающихся нанотехнологиях, а также в применении различных высокомолекулярных препаратов. Сейчас мы все чаще видим комбинации этих подходов. При этом тераностика сталкивается с проблемами в каждой из применяемых областей, но все еще остается очень перспективной и востребованной областью. Тераностика и персонализированная медицина успешно помогают нам лечить целый ряд сложных, тяжелых заболеваний. Эффективность этих методов неуклонно растет.
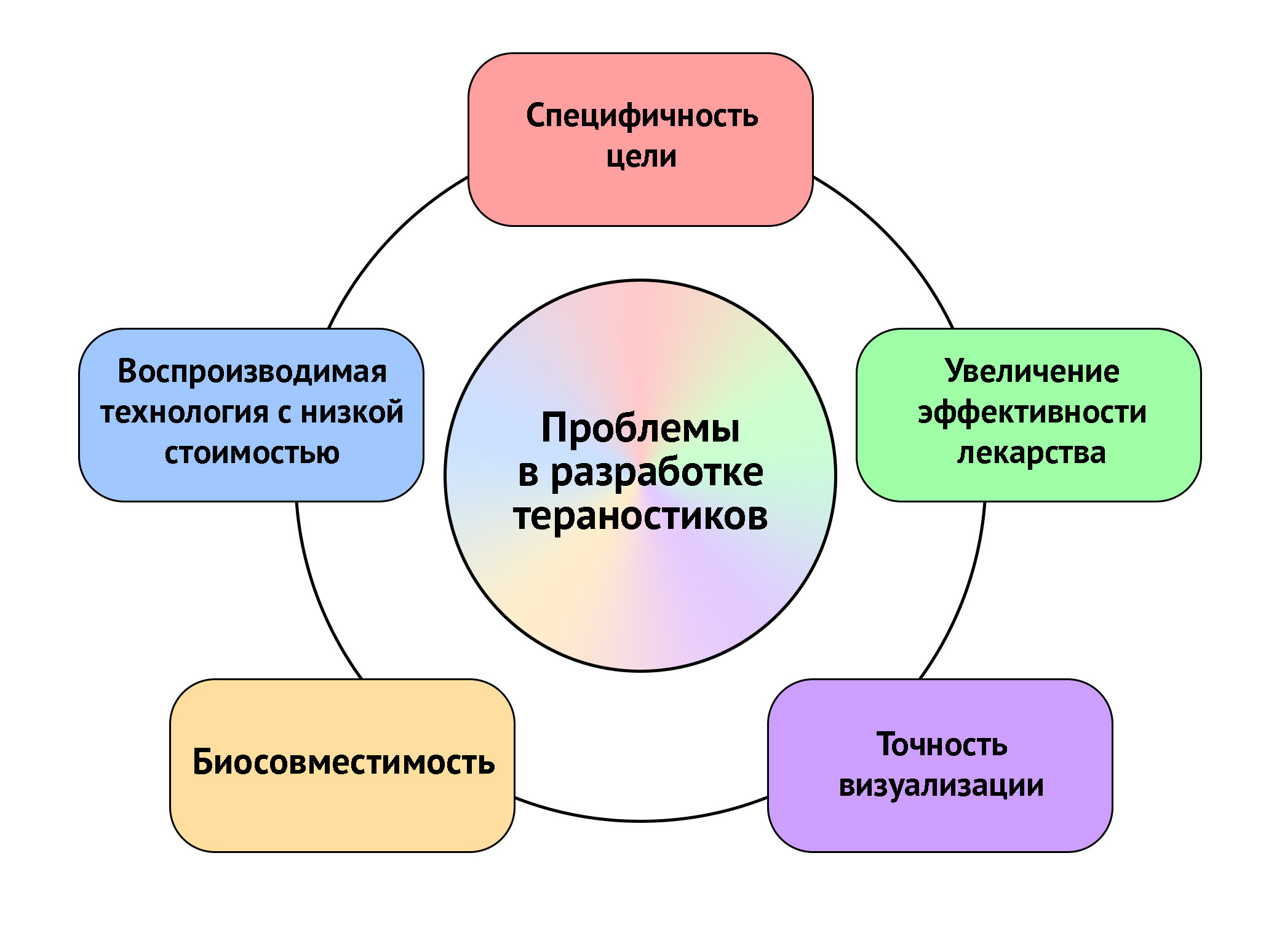
Рисунок 15 | Текущие проблемы при разработке препаратов для тераностики
На сегодняшний день ученые стремятся улучшать уже полученные методы: увеличивать селективность препаратов, их нацеленность на определенные участки и снижать влияние на здоровые органы, развивать точность визуализации, улучшать соотношение биосовместимости и токсичности.
Список литературы
- Мелерзанов А., Москалев А., Жаров В. Прецизионная медицина и молекулярная тераностика //Врач. – 2016. – №. 12. – С. 11-14.
- Siddhardha B., Parasuraman P. Theranostics application of nanomedicine in cancer detection and treatment //Nanomaterials for Drug Delivery and Therapy. – William Andrew Publishing, 2019. – С. 59-89.
- Наркевич Б. Я. и др. Функциональная оптимизация радионуклидных пар в тераностике рака предстательной железы //Онкологический журнал: лучевая диагностика, лучевая терапия. – 2020. – Т. 3. – №. 1. – С. 38-56.
- Yeong C. H., Cheng M., Ng K. H. 核医学放射性核素治疗的研究现状及前景 //Journal of Zhejiang University SCIENCE B. – 2014. – Т. 15. – С. 845-863.
- Terbium: a new “Swiss Army knife” for Nuclear Medicine - Drug Discovery Today
- Radio-Theranostics | Radiology Key
- Zherebchevsky V. I. et al. New Radionuclides for Personalized Medicine //Bulletin of the Russian Academy of Sciences: Physics. – 2021. – Т. 85. – С. 1128-1135.
- Gallivanone F. et al. Targeted radionuclide therapy: frontiers in theranostics. – 2017.
- Xing Y. et al. Radiolabeled nanoparticles for multimodality tumor imaging //Theranostics. – 2014. – Т. 4. – №. 3. – С. 290.
- Li S. et al. Peptide-modulated self-assembly as a versatile strategy for tumor supramolecular nanotheranostics //Theranostics. – 2019. – Т. 9. – №. 11. – С. 3249.
- Degrauwe N. et al. Theranostics in interventional oncology: Versatile carriers for diagnosis and targeted image-guided minimally invasive procedures //Frontiers in pharmacology. – 2019. – Т. 10. – С. 450.
