Клеточные фенотипы мультиформной глиобластомы
Глиобластома — самая частая и опасная форма опухоли мозга [1]. Медиана выживаемости для пациентов, получающих лечение, составляет 12–15 месяцев [2]. Опухоль гетерогенна, быстро прогрессирует и мутирует, что снижает результативность лечения. Это серьезная проблема для врачей и пациентов [3, 4]. Развитие глиобластомы контролируется различными генетическими, эпигенетическими программами. Эта опухоль остается неизлечимой и мало изученной. Точная характеристика остается сложной задачей [3].
Ученые использовали интегративный подход, провели секвенирование РНК отдельных клеток 28 опухолей, генетический анализ 401 образца из Атласа Ракового Генома (англ. The Cancer Genome Atlas — TCGA) или АРГ. Авторы отследили жизненный цикл клетки для получения единой модели клеточных фенотипов, отражающих гетерогенность глиобластомы, и выявили четыре основных клеточных фенотипа клеток глиобластомы, сходных с отдельными типами нейроцитов. Процент конкретного типа клеток варьируется между отдельными опухолями, что зависит от состояния генов, кодирующих: циклин-зависимую киназу 4 (CDK4), рецептор эпидермального фактора роста (EGFR), рецептор А тромбоцитарного фактора роста (PDGFRA) и от наличия мутации в локусе нейрофибромина NF1. Каждый ген ассоциирован с конкретным клеточным фенотипом [5].
Программы подтипов также различаются как внутри отдельного образца опухоли, так и при многообластной выборке опухолей — множественные подтипы могут сосуществовать в разных областях одной и той же опухоли. В результате продольного анализа выявилась зависимость подтипов от времени и терапии. Секвенирование РНК отдельных клеток показало, что разные клетки внутри одной опухоли способны воспроизводить другие фенотипы [5]. Глиобластома захватывает механизмы развития нервной системы и включает подмножества стволовых клеток, которые обуславливают устойчивость к радиотерапии, химиотерапии и способность опухоли метастазировать [3]. Информация о различных маркерах стволовых клеток глиобластомы все время обновляется. Неизвестно, определяют ли разные маркеры стволовых клеток глиобластомы различные или похожие клеточные фенотипы. Также мало изучен тот факт, генерируют ли опухоли фенотипы четко соответствуя подгруппам стволовых клеток глиобластомы, или они способны дать начало глиобластоме разнообразного клеточного состава. Анализ влияния разных клеточных линий на прогресс и развитие глиобластомы, ее биологические свойства также остаются сложной задачей для ученых. Таким образом, необходимо детально изучить причины гетерогенности глиобластомы — генетические, эпигенетические, влияние микроокружения [5].
Изучая глиомы, ученые продемонстрировали модели клеточной архитектуры опухолей, вывели количество хромосомных аберраций и обнаружили мутации в экспрессированных транскриптах. Эти подходы применяют в разных биологических исследованиях, но в случае с глиобластомой все сложнее: связь между генетическими изменениями и разнообразием эпигенетических модификаций остается неясной. Это серьезная проблема. В исследовании ученые использовали интегративный подход для понимания транскрипционной и генетической гетерогенности глиобластомы, сочетая секвенирование РНК отдельных клеток 20 взрослых и 8 детских глиобластом (24 131 клеток), работа с моделями глиобластомы: секвенирование РНК отдельных клеток и отслеживание клеточных линий и анализ 401 образца опухолевой ткани из Атласа ракового генома [5].
Злокачественные клетки глиобластомы представлены четырьмя фенотипами [5]:
1. нейральные прогениторные клетки;
2. прогениторные клетки олигодендроцитов;
3. астроцитоподобные;
4. мезенхимоподобные.
Каждая опухоль включает клетки нескольких видов, относительный процент каждого фенотипа варьируется между опухолями. Авторы показали, что это связано с генетическими изменениями в CDK4, PDGFRA, EGFR и NF1, каждое изменение ассоциировано с определенным состоянием [5].
Результаты
Авторы отбирали злокачественные клетки по дифференцировочному антигену CD45 и в меньшей степени по клеткам CD45+, в общей сложности отобрано 7930 клеток. В среднем, в одной клетке обнаружено 5730 генов. Затем исследователи классифицировали клетки на злокачественные и незлокачественные типы, комбинируя три подхода (Методы STAR: Structured, Transparent, Accessible Reporting) [5]:
— Определили количество копий хромосомных аберраций на основе средней экспрессии 100 генов в каждой хромосомной области, выявили крупномасштабные амплификации и делеции в большинстве клеток, включая признаки глиобластомы — увеличение 7 хромосомы и уменьшение 10 хромосомы (нашли в большинстве взрослых опухолей, но не в детских опухолях).
— Учитывали высокий уровень экспрессии генов, соответствующих маркерам определенных типов клеток - на основании этого некоторые клетки определены как макрофаги, T-клетки и олигодендроциты.
— Выделили три небольших кластера незлокачественных клеток, в которых отсутствуют хромосомные аберрации и отмечен высокий уровень экспрессии маркеров определенных типов клеток.
Оставшиеся клетки, в которых отмечены хромосомные аберрации, образовали четвертый большой кластер (6864 клетки) предполагаемых злокачественных клеток [5].
Внутриопухолевая гетерогенность
Чтобы всесторонне охарактеризовать внутриопухолевую гетерогенность злокачественных клеток, ученые выявили программы экспрессии, которые варьируются между клетками в каждой опухоли, а затем искали рекуррентные программы (метамодули) в разных опухолях [5]:
— Отдельно для каждой опухоли иерархически кластеризовали клетки, учитывая преимущественно экспрессируемые гены;
— Сохранили много кластеров для дальнейшего анализа, включая частично перекрывающиеся;
— Определили для каждого кластера преимущественно экспрессируемые генов.
Примерно 44% этих признаков связаны с генами клеточного цикла. Другие признаки экспрессии проанализировали, чтобы выяснить их биологическую значимость [5].
Профили экспрессии однообразны в разных опухолях — в среднем, каждая характеристика повторяет (уровень ложноположительных результатов <0,01, гипергеометрический тест) характеристики девяти других опухолей. Несмотря на глобальные различия между опухолями, модели внутриопухолевой гетерогенности отражают фундаментальные процессы, общие для опухолей. Авторы сгруппировали признаки, в результате чего выделены четыре основные группы, две из которых разделены на две подгруппы (рис. 1А). Это позволило определить шесть метамодулей, включающих 39–50 генов, которые сильно рецидивируют по перекрывающимся характеристикам из нескольких опухолей, и каждый метамодуль получен по крайней мере из шести опухолей (рис. 1B)[5].
Учитывая преимущественно экспрессируемые гены и функциональное обогащение метамодулей (рис. 1B), выделяют два метамодуля, ассоциированных с высокой экспрессией генов, связанных с мезенхимоподобным фенотипом — VIM (p < 109, гипергеометрический тест). Один из метамодулей тесно связан с генами, ответственными за реакцию на гипоксию — HILPDA, стресс — DDIT3 и гликолиз — ENO2, LDHA. Предположительно, в некоторых опухолях мезенхимальный фенотип ассоциирован с гипоксией и повышенной активностью гликолитических процессов. Авторы определили их как мезенхимоподобные метамодули: независимый от гипоксии MES1 и зависимый — MES2 [5].
Другие четыре метамодуля связаны с генами, отвечающими за развитие нервной системы, характерными для нейрональных/глиальных линий или клеток-предшественников. Они включали [5]:
— маркеры астроцитов в метамодуле № 3: S100B, GFAP, SLC1A3, GLAST и MLC1;
— маркеры олигодендроглиальной линии в метамодуле № 4: OLIG1, OMG, PLP1, PLLP, TNR и ALCAM;
— маркеры стволовых клеток и клеток-предшественников в метамодулях № 5 и № 6, включая маркеры нейральных прогениторных клеток: SOX4, SOX11 и DCX.
Метамодули № 3, № 4 и № 6 преимущественно экспрессированы в астроцитах, прогениторных клетках олигодендроцитов и нейральных прогениторных клетках соответственно (рис. 1С). Метамодули имитируют типы клеток развития, но с существенными искажениями нормальных программ [5].
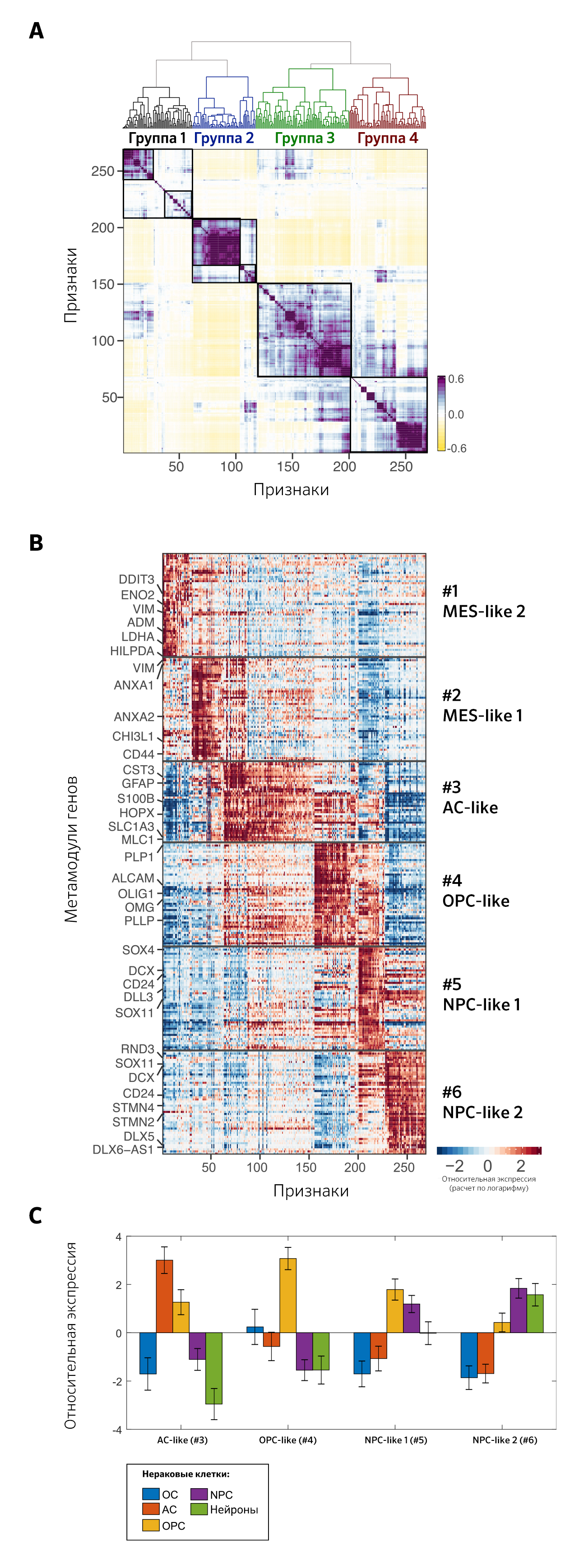
Нейральные прогениторные клетки (NPC) включают две подгруппы — NPC1 и NPC2. Они отличаются набором генов. В NPC1 отмечено наличие генов, характерных для прогениторных клеток олигодендроцитов: OLIG1 и TNR, а в NPC2 генов нейрональных клеток: STMN1, STMN2, STMN4, DLX5-AS1 и DLX6-AS1. Это позволяет предположить, что нейрональные прогениторные клетки потенциально могут дифференцироваться в прогениторные клетки олигодендроцитов или нейроны [5].
Каждый из метамодулей имеет дополнительные функции помимо соответствующих типов клеток, которые могут отражать их искажения по сравнению с программами нормального типа клеток. Таким образом, хотя астроцитоподобный метамодуль преимущественно экспрессируется в астроцитах, он экспрессировался и в радиальной глие, включая ее маркер — HOPX. Внутриопухолевая гетерогенность глиобластомы в значительной степени соответствует клеточным состояниям, напоминающим нейральные прогениторные клетки, прогениторные клетки олигодендроцитов, астроциты и мезенхимальные клетки. Эти состояния схожи между опухолями у взрослых и детей [5].
Пролиферирующие клетки и гибридные фенотипы глиобластомы
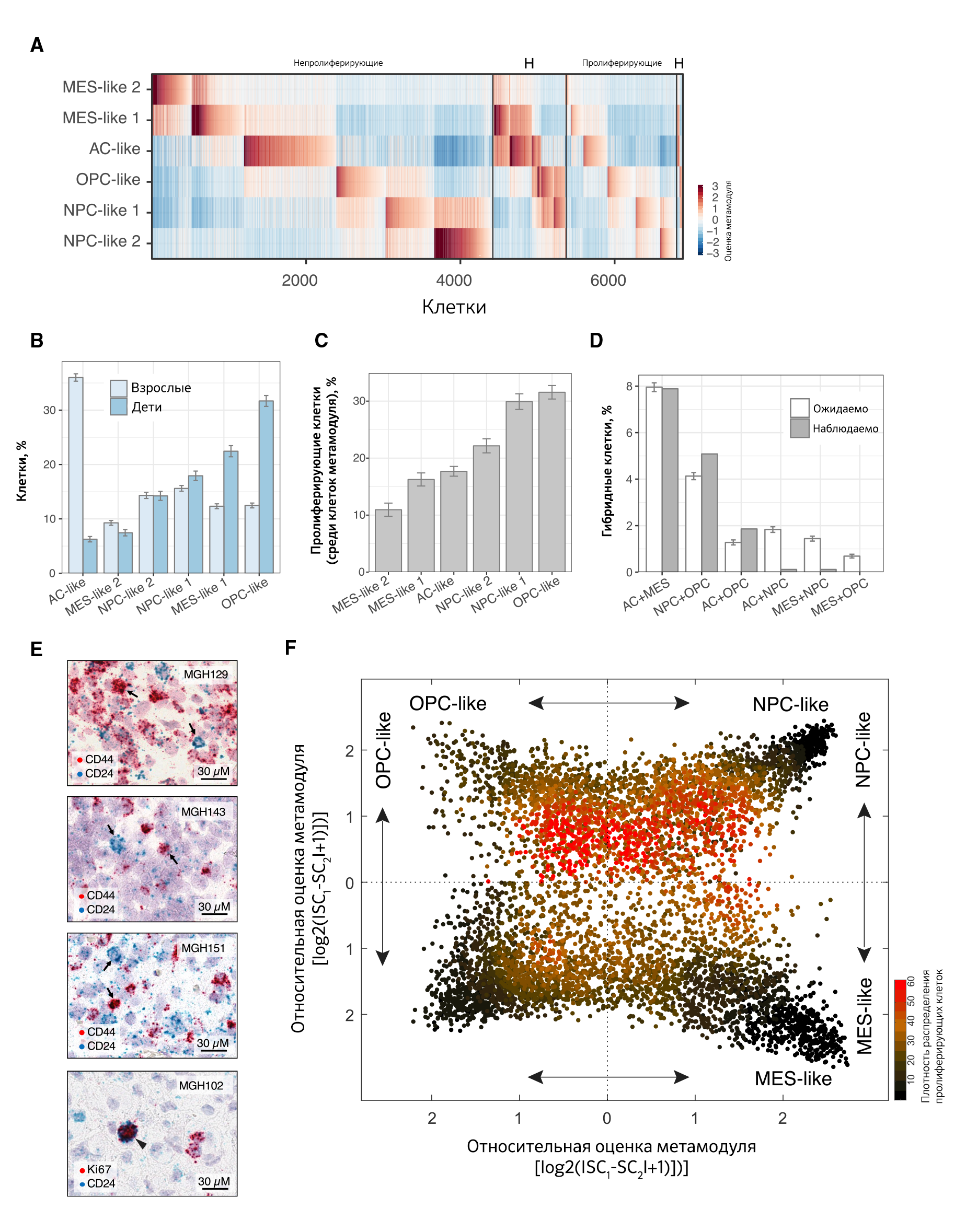
Ученые классифицировали клетки опухолей по экспрессии метамодулей и программам клеточного цикла (рис. 2А, 2В). Примерно 3–51% клеток в каждой опухоли идентифицирован как пролиферирующий на основе экспрессии признаков клеточного цикла. Среди прогениторных клеток олигодендроцитов и нейральных прогениторных клеток отмечено (рис. 2C) больше пролиферирующих клеток, особенно у детей. Это согласуется с пролиферацией нормальных прогениторных клеток олигодендроцитов, нейральных прогениторных клеток и с нашими предыдущими наблюдениями в отношении мутантной глиомы IDH и мутантной H3K27M, которые обусловлены наличием пролиферирующих нейральных прогениторных клеток и прогениторных клеток олигодендроцитов, соответственно. Глиобластома, в отличие от других глиом, включает астроцитоподобные и мезенхимоподобные фенотипы, содержащие значительные подмножества пролиферирующих клеток. Предполагается, что именно это объясняет крайне агрессивную природу глиобластомы (рис. 2C). Большинство клеток глиобластомы соответствовали в основном одному из четырех состояний, но 15% клеток в высокой степени экспрессировали два различных метамодуля и, следовательно, эти клетки определили как «гибридные» фенотипы (рис. 2А, 2D). Некоторые комбинации метамодулей встречались редко, в то время как другие (астроцитоподобные + мезенхимоподобные, нейральные прогениторные клетки + прогениторные клетки олигодендроцитов и астроцитоподобные + прогениторные клетки олигодендроцитов) встречались чаще [5].
Таким образом, данные подтверждают модель, согласно которой клетки глиобластомы включают четыре основных клеточных фенотипа и их смешанные виды. Каждый фенотип обладает пролиферативным потенциалом. Наиболее высокий потенциал пролиферации у нейральных прогениторных клеток и прогениторных клеток олигодендроцитов. Метамодули, гибридные фенотипы и модели пролиферации подтверждены гибридизацией РНК in situ в десяти образцах глиобластомы (рис. 2E) [5].
Источники:
1. Ostrom Q. T. et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2010–2014 //Neuro-oncology. – 2017. – Т. 19. – №. suppl_5. – С. v1-v88.
2. Stupp R. et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma //New England Journal of Medicine. – 2005. – Т. 352. – №. 10. – С. 987-996.
3. Frattini V. et al. The integrated landscape of driver genomic alterations in glioblastoma //Nature genetics. – 2013. – Т. 45. – №. 10. – С. 1141.
4. Meyer M. et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity //Proceedings of the National Academy of Sciences. – 2015. – Т. 112. – №. 3. – С. 851-856.
5. Neftel C. et al. An integrative model of cellular states, plasticity, and genetics for glioblastoma //Cell. – 2019. – Т. 178. – №. 4. – С. 835-849. e21.
