Онкоген BRAF: ключевая роль в развитии меланомы и пути преодоления его влияния.
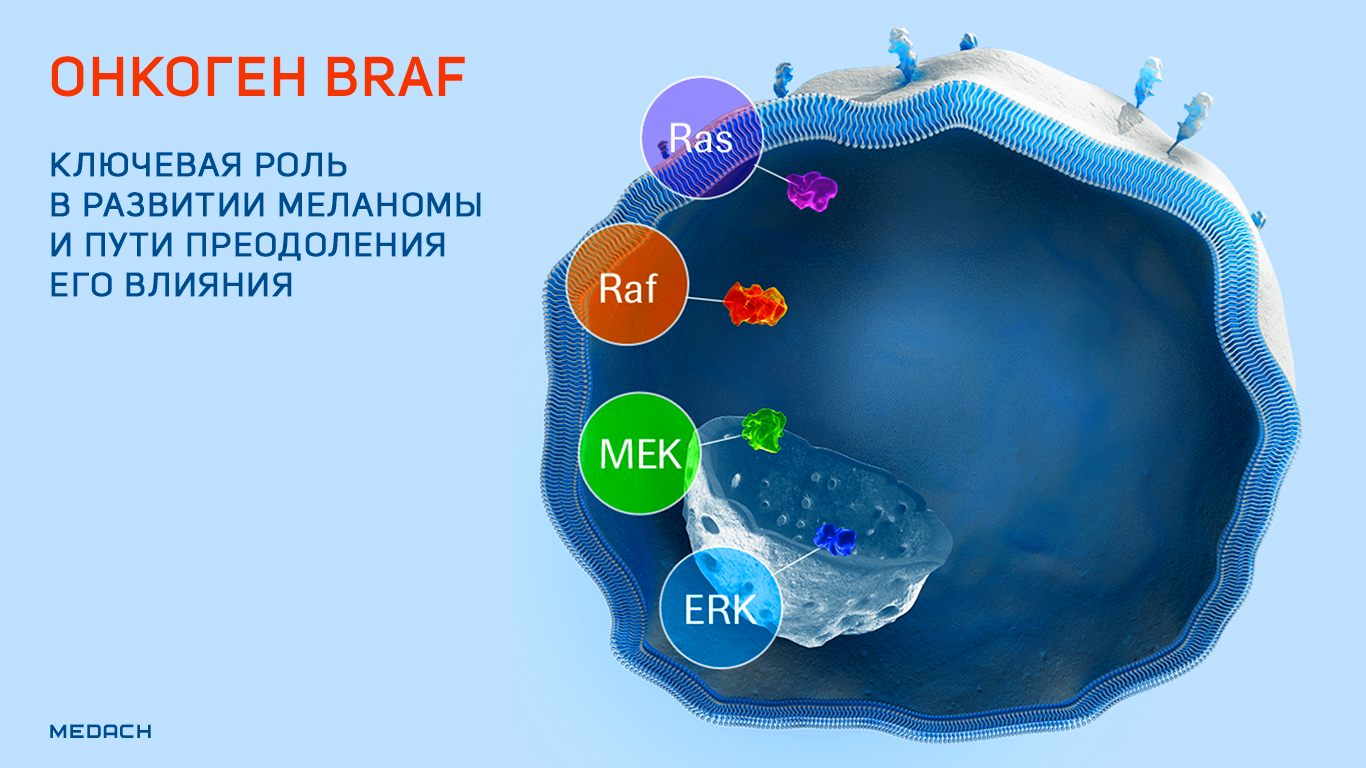
BRAF является достаточно известным онкогеном, а вот приставка V600E после его названия ясна не каждому. Между тем мутация в структуре данного онкогена играет ключевую роль в развитии меланомы — опухоли с одним из самых неблагоприятных прогнозов. В этом материале будут рассмотрены история разработки средств против меланомы с мутацией в гене BRAF и пути преодоления резистентности последнего к современной таргетной терапии.
BRAF представляет собой онкоген, кодирующий белок B-Raf — серин-треонин протеинкиназу, участвующую в функционировании высокоонкогенных сигнальных путей RAS/RAF/MEK/ERK (название одного из перечисленных сигнальных путей и дало имя данному белку и его гену). Продукт BRAF обнаруживается в клетках абсолютно разных типов в неактивном состоянии. Его функциональная активация происходит путем димеризации под действием сигнального пути RAS. Активированный B-Raf фосфорилирует и активирует другие ассоциированные сигнальные пути, и киназный каскад, запускаемый в результате этих процессов, поддерживает выживание клеток и их пролиферацию, одновременно ингибируя дифференцировку [1].
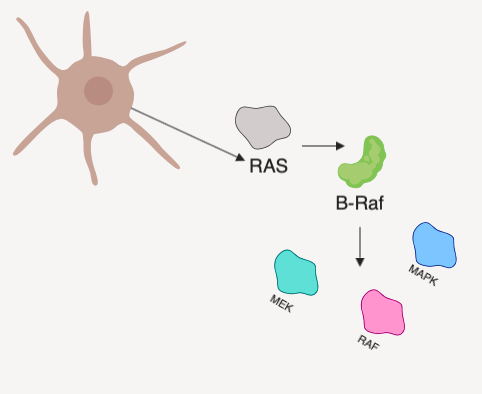
Рисунок 1 | Упрощенная схема активации сигнальных путей, в которых принимает участие протеин B-Raf.
BRAF и его продукт играют критическую роль в формировании опухолей человеческих тканей. Около 7 % всех опухолей связаны с мутацией данного гена, включая 100 % случаев волосатоклеточного лейкоза, 50–60 % случаев меланомы, 30–50 % случаев папиллярной карциномы щитовидной железы, 10–20 % случаев колоректальных опухолей и 3–5 % случаев немелкоклеточного рака легкого. Самой распространенной мутацией является нуклеотидная замена, которая превращает валин в позиции 600 в глутамин (мутация V600E), лизин (мутация V600K) или другую аминокислоту (V600 A/D/G/L и другие). Подобные мутации способствуют тому, что B-Raf перестает зависеть от активации сигнального пути RAS и становится функционально активным в форме мономера [1].
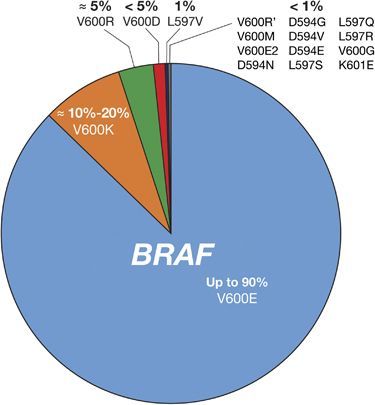
Рисунок 2 | Частота встречаемости наиболее распространенных мутаций BRAF.
Обнаружение активирующих мутаций в данной серин-треонин киназе послужило основой волны последующих исследований того, насколько критическую роль играют ассоциированные с ней сигнальные пути в инициации и прогрессии меланомы и других опухолей. Так, активация ассоциированного с B-Raf сигнального пути МАРК in vivo ассоциируется с пролиферацией клеток меланомы. Доклинические исследования, длившиеся более 15 лет, утвердили, что центральную роль в контроле пролиферации клеток меланомы играет мутация BRAF V600E. Кроме того, данная активирующая мутация оказывает влияние на апоптоз, миграцию, инвазию клеток меланомы, метаболизм глюкозы в них, их адаптацию к гипоксии и ангиогенез формирующейся опухоли. Таким образом, чувствительность опухоли к химиотерапии обретает зависимость не только от функциональной активности B-Raf, но и от скорости протекания в ее клетках процессов, связанных с активацией МАРК [2].
Определение и характеристика мутаций BRAF оказывает существенное влияние на подбор терапии меланомы. Выявление мутаций в структуре этого онкогена осуществляется путем проведения методов генетического секвенирования [3]. Подробнее эти методы рассмотрены в данном материале.
До открытия активирующих мутаций в гене BRAF, меланома крайне тяжело поддавалась терапии. Классическая химиотерапия и пролекарство дакарбазин демонстрировали небольшие терапевтические возможности для клиницистов, стремящихся снизить заболеваемость данным типом опухоли. В 2002 году было обнаружено наличие мутаций BRAF в 60 % случаев меланом, что сыграло огромную роль в определении сущности данного гена в инициации и прогрессировании опухолей кожи. Сегодня известно, что активирующая мутация BRAF обнаруживается в 50 % случаев меланом и в 80 % тканей меланоцитарных невусов. Явная ассоциация данного онкогена с формированием меланоцитарных опухолей дала основу для разработки средств таргетной терапии меланомы, что принесло новую надежду как клиницистам, так и пациентам.
Первый препарат антител, активных против B-Raf, был разработан в 2011 году [4]. Первоначально для таргетной терапии меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность клеток меланомы к формированию резистентности против таких агентов. Одни из наиболее распространенных путей такой фармакорезистентности — это реактивация сигнального пути МАРК, ограничение апоптоза клеток меланомы, а также активация сигнального пути PI3K, стабилизирующего выживаемость меланомных клеток «в обход» МАРК [2, 5].
В настоящее время во избежание формирования терапевтической резистентности при лечении меланомы ингибиторы BRAF комбинируют с ингибиторами другого онкогенного сигнального пути — МЕК (такими препаратами являются биниметиниб и траметиниб). Систематические обзоры и мета-анализы продемонстрировали, что применение подобной комбинации увеличивает общую продолжительность жизни пациентов и замедляет прогрессирование опухоли в сравнении с монотерапией только ингибиторами BRAF [6].
К сожалению, несмотря на обилие современных разработок, меланома по-прежнему ассоциируется с крайне негативным терапевтическим прогнозом и малой общей выживаемостью. Разработки средств таргетной терапии данной опухоли непременно должны продолжаться — возможно, еще одна новая комбинация поможет существенно снизить смертность от этой патологии и сделать диагноз «меланома» менее пугающим.
Источники:
1. The landscape of BRAF transcript and protein variants in human cancer. / Andrea Marranci, Zhijie Jiang, Marianna Vitello [et al]. // Mol Cancer. — 2017. — Vol. 16. — p. 85.
2. Overcoming resistance to BRAF inhibitors. / Imanol Arozarena, Claudia Wellbrock. // Ann Transl Med. — 2017. — Vol. 5, №19. — p. 387.
3. Rapid BRAF mutation tests in patients with advanced melanoma: comparison of immunohistochemistry, droplet digital PCR, and the Idylla mutation platform. / Cornelis Bisschop, Arja ter Elst, Lisette J. Bosman [et al]. // Melanoma Res. — 2018. — Vol. 28, №2. — p. 96-104.
4. BRAF V600E-specific antibody: a review. / Ritterhouse LL, Barletta JA. // Semin Diagn Pathol. — 2015. — Vol. 32, №5. — p. 400-408.
5. BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. / Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano [et al]. // Onco Targets Ther. — 2015. — Vol. 8. — p. 157-168.
6. Combination therapy of BRAF inhibitors for advanced melanoma with BRAF V600 mutation: a systematic review and meta-analysis. / Kim S, Kim HT, Suh HS. // J Dermatol Treat. — 2018. — Vol. 29, №3. — p. 314-321.
