Дьявол в деталях: связь мутаций протоонкогена KRAS с онкопатологиями

В случае онкогена KRAS дьявол кроется в мелочах: всего одна замена нуклеотидов способна привести к формированию одной из самых агрессивных опухолей — немелкоклеточного рака легкого. В этом материале поговорим о том, какие именно мутации KRAS наиболее значимы для онкогенеза, и как снизить их вредоносный эффект у уже имеющих опухоль пациентов.
Семейство RAS (название произошло от Rat Sarcoma) включает три гена, играющих важную роль в онкогенезе: KRAS, HRAS и NRAS. Продуктами всех трех генов являются мономерные ГТФазы. Главная функция этих ферментов — трансформация внеклеточных сигналов во внутриклеточные каскады сигнальных путей. Кроме того, продукты названных генов (KRas, HRas и NRas соответственно) способны связывать гуанозинтрифосфат и превращать его в гуанозиндифосфат. Также они имеют возможность связываться с белками-факторами обмена гуанина (GEF), облегчающими высвобождение связанных гуаниновых нуклеотидов.
Путем альтернативного сплайсинга, продуктами гена KRAS становятся две белковые формы — KRas4A и KRas4B. Известно, что среди всех членов семейства RAS уникальность данного гена заключается в наивысшей частоте мутаций его структуры. Все известные активирующие мутации KRAS приводят к продукции мутантных вариантов как одной, так и другой форм белковых продуктов. Все три гена семейства RAS являются гомологами по отношению друг к другу; вариабельны только их С-концевые участки с изопрениловой группой в своей структуре. Мутации в генах RAS, ассоциированные с опухолями, также обладают большим структурным сходством. Несмотря на эти сходства, на сегодняшний день известно, что мутации KRAS встречаются чаще, нежели структурные изменения других генов семейства [1].
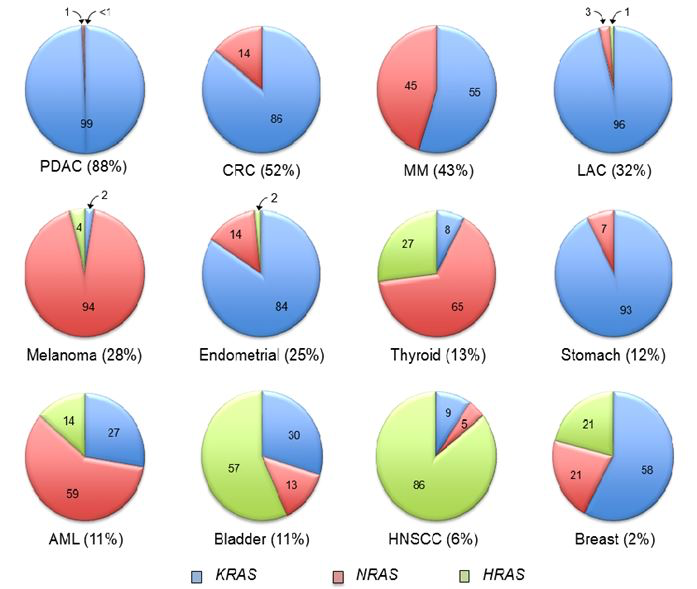
Рисунок 1. Частота встречаемости мутаций генов семейства RAS при различных опухолях.
Мутации KRAS способны запускать процесс онкогенеза и характеризуются сложностью механизма вовлечения в биологию опухоли. Функционально активные мутантные белки KRas взаимодействуют с различными сигнальными путями, факторами роста и генами-супрессорами опухоли. Онкоген KRAS активирует более десяти различных эффекторных сигнальных путей, наиболее изученными из которых являются каскад киназ МАРК, путь PI3K-AKT-mTOR, а также факторы обмена гуанин-нуклеотида (RAL-GEF) [2]. Запуск данных эффекторных сигнальных путей ведет, прежде всего, к усилению клеточной пролиферации, а также к стимуляции выживания клеток, что крайне необходимо при формировании опухоли в первоначально неблагоприятном для нее микроокружении.
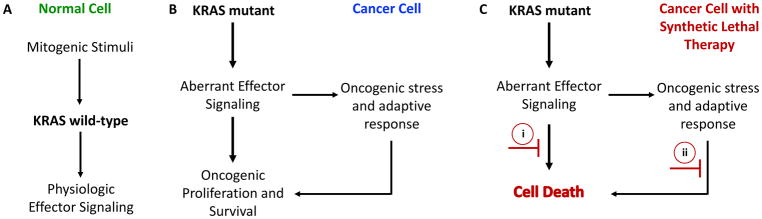
Рисунок 2. Эффекты, получаемые в результате активации дикого и мутантного типов KRAS.
KRAS является одним из наиболее часто мутирующих онкогенов человека. Наибольшему числу мутаций подвергается его 12 кодон. Вероятность возникновения той или иной миссенс-мутации этого кодона находится в зависимости от формирующегося в результате типа опухоли. Так, например, классической мутацией у курильщиков с мутантным KRAS является замена гуанина или цитозина в 12 кодоне на тимин или аденин. Встречаются мутации и в других кодонах: например, в 146 и 117 (при колоректальных опухолях )[1].
Мутации RAS встречаются примерно в 30 % случаев всех опухолей человека, включая большую часть аденокарцином протоков поджелудочной железы, половину колоректальных опухолей и треть всех немелкоклеточных опухолей легких [3] (по другим данным — 25 % немелкоклеточных опухолей легкого [4]). К мутациям гена KRAS более расположены женщины, у мужчин такие мутации чаще ассоциированы с правосторонним типом колоректальных опухолей [3]. Классические мутации KRAS ассоциируются с длительным периодом курения в анамнезе пациента, но они также обнаруживаются и у людей, которые никогда не курили (однако с меньшей частотой). Выявить описанные мутации помогает ряд технологических решений: например, методы секвенирования, о которых уже упоминалось в данном материале.
Прогностическая и терапевтическая роль KRAS остается противоречивой. До настоящего времени мутантный KRAS не рассматривался как клинически значимый потенциальный агент таргетной терапии, особенно, с учетом того, что продукт этого гена не подвергается действию терапевтических средств. Рост научных знаний о биологии опухолей с мутантным KRAS и роли ингибирования сигнальных путей MEK и PI3K/mTOR дал возможность изменить представление о лечении подобных опухолей. В настоящее время терапия опухолей с мутантным KRAS основана на возможностях выявления уязвимостей в сигнальных путях, запускаемых активацией данного гена [4]. Наиболее эффективными в плане воздействия на такие уязвимости сигнальных путей в настоящее время являются ингибиторы МАРК [5].
Исследование 2017 года, проведенное на мышиных моделях, продемонстрировало высокую противоопухолевую эффективность новой мультипептидной вакцины, воздействующей сразу на несколько эпитопов молекулы KRAS. Новая вакцина содержит четыре пептида, которые вызывают сильнейший иммунный ответ у мышей и предположительно могут иметь схожий эффект у людей. Действие вакцины сокращало скорость роста опухоли на 80 %, в сравнении с использованием имеющихся адъювантов. Клетки селезенки, полученные от вакцинированных мышей, были проанализированы на наличие мощного иммунного ответа на введение белков. Кроме того, стимуляция клеток селезенки in vitro вызывает выработку цитокинов, воздействующих на Th1-иммунный ответ. Мультипептидная вакцина была исследована в отношении опухолей легких, однако ее потенциал позволяет получать клинически значимый эффект и в отношении других опухолей с мутантным KRAS, в том числе в сочетании с иными современными препаратами [6].
Еще одними многообещающими терапевтическими агентами в борьбе с немелкоклеточным раком легких стали ингибиторы контрольных точек иммунного ответа. Предполагается, что при выявлении в клетках опухоли мутантного KRAS, такие препараты могут стать настоящим спасением для пациентов с немелкоклеточными опухолями легкого, но исследования в данном направлении должны быть продолжены [7].
Таким образом, узкий спектр мутаций в структуре гена KRAS приводит к масштабным и печальным последствиям. В настоящее время возможности преодоления онкогенного влияния KRAS находятся под пристальным вниманием исследователей и, несомненно, исследования в этой области должны быть продолжены.
Источники:
- KRAS alleles: the devil is in the detail. / Kevin M. Haigis. // Trends Cancer. - 2017. - Vol. 3, №10. - p. 686-697.
- Synthetic lethal vulnerabilities in KRAS-mutant cancers. / Andrew J. Aguirre, William C. Hahn. // Cold Spring Harb Perspect Med. - 2018. - Vol. 8, №8.
- Clinical predictors for KRAS codon 13 mutations in patients with colorectal cancer. / Kwak MS, Cha JM, Cho YH [et al]. // J Clin Gastroenterol. - 2018. - Vol. 52, №5. - p. 431-436.
- KRAS-mutant lung cancers in the era of targeted therapy. / Naidoo J, Drilon A. // Adv Exp Med Biol. - 2016. - Vol. 893. - p. 155-178.
- Selective inhibition of oncogenic KRAS output 2ith small molecules targeting the inactive state. / Patricelli MP, Janes MR, Li LS [et al]. // Cancer Discov. - 2016. - Vol. 6, №3. - p. 316-329.
- Immunoprevention of KRAS-driven lung adenocarcinoma by a multipeptide vaccine. / Jing Pan, Qi Zhang, Shizuko Sei [et al]. // Oncotarget. - 2017. - Vol. 8, №47. - p. 82689-82699.
- Prognostic value of KRAS mutation in advanced non-small-cell lung cancer treated with immune checkpoint inhibitors: a meta-analysis and review. / Jung Han Kim, Hyeong Su Kim, Bum Jun Kim. // Oncotarget. - 2017. - Vol. 8, №29. - p. 48248-48252.
