Темные пути гастроканцерогенеза
Гастроканцерогенез является динамическим процессом с огромным многообразием клеточных повреждений, приводящих к опухолевой трансформации.
«Страх открывает путь к Темной стороне». А что заставляет клетки перейти на сторону зла? И какие пути они проходят, превращаясь из джедаев в ситхов?
Генетические изменения при раке желудка
Секвенирование генома позволило идентифицировать огромное число генетических изменений в опухолевой ткани желудка (Рис. 1) [1,3,5].
Геномные аберрации. Геномный анализ показал наличие ряда мутаций, которые лежат в основе злокачественного фенотипа, так называемые драйверные мутации. Отмечают высокую частоту мутаций в генах TP53, CTNNB1, ARID1A и CDH1, а также хуже описанных генах MUC6, RNF43, CTNNA2, Gli3, белков TGF-β семейства, таких как TGF-β, ELF3 и SMAD4, RHOA. Эти изменения влияют на клеточные сигнальные каскады: сцепленный, Wnt- и TGF-β пути [2].
Драйверные (ведущие) мутации. При некоторых из драйверных мутаций вовлеченные белки так тесно взаимодействуют, что их идентификация в пределах одного пути затруднена. К таким белкам относят TP53, MUC6 и ARID1A [3].
TP53. TP53-мутации одни из наиболее распространенных генетических аберраций у пациентов с РЖ. Эти супрессоры опухоли вызывают остановку клеточного цикла, апоптоз и старение в ответ на множество стрессовых факторов окружающей среды [1]. Изменение функции TP53 отмечается на генетическом и эпигенетическом уровнях (аномальное метилирование генов, регулирующих последующие звенья сигнальных каскадов). Уровень экспрессии белка р53 связан с формой, степенью инвазии, а также локализацией опухоли в желудке [3].
MUC6. Экспрессия MUC6 играет важную роль в защите слизистой оболочки желудка. Пониженная экспрессия MUC6 наблюдалась после инфицирования H. Pylori. Экспрессия MUC6 при РЖ отрицательно коррелирует с размером опухоли, глубинной инвазии, наличием метастазов. MUC6 может действовать в качестве опухолевого супрессора [4].
ARID1A. ARID1A кодирует АТФ-зависимый белок, участвующий в репарации ДНК [11,12,34]. Функциональный анализ белка ARID1A выявил его роль в регуляции клеточного цикла. В сочетании с p53 он подавляет p21 и ограничивает переход G1 фазы в S [5].
«Молчащие» мутации как потенциальные драйверы рака. Путь сцепления (CTNNA2 CTNNB CDH1 RHOA). Адгезионные контакты — динамические структуры, расположенные на поверхности клеток, определяют апикально-базальную ось клеток. Они нужны для взаимодействия между соседними клетками и трансдукции сигналов от внеклеточной среды с ядром, ведущей к транскрипции генов [2]. Водители мутаций при раке желудка, выявленные в пределах генов этого пути: CDH1, CTNNB1, CTNNA1 и RHOA [3,4].
CDH1. CDH1 кодирует E-кадгерин, аномальное функционирование широко представлено при РЖ. CDH1 мутации связаны с 80 % риском развития РЖ, требуя проведения профилактической резекции желудка у надлежащим образом отобранных пациентов. Снижение экспрессии или функции E-кадгерина дестабилизирует связи между клетками, являясь одним из механизмов инвазии и приводя к диффузному типу роста опухоли при РЖ [2].
CTNNB1. CTNNB1 кодирует β-катенин, который участвует в формировании адгезионных контактов. После механического раздражения на клеточной поверхности, β-катенин может стать фосфорилированным, что нарушает его связь с Е-кадгерином и приводит к его ядерной локализации, где он функционирует как фактор транскрипции [2]. Генетические повреждения β-катенина могут привести к его аномальной ядерной локализации, что приводит к транскрипции онкогенов, таких как MYC. Мутации β-катенина могут привести к нарушению клеточной агрегации через отмену функции E-кадгерина, несмотря на его нормальную структуру [3].
CTNNA2. CTNNA2 кодирует катенин-а2, который играет важную роль в регуляции передачи сигналов β-катенина. CTNNA2 может действовать как опухолевый супрессор, предотвращая ядерную транслокацию β-катенина в результате поддержания межклеточной адгезии и ингибирования миграции и инвазии [2].
RHOA. При диффузном типе рака желудка в 14,3 % случаев выявлены уникальные мутации гена RHOA, играющие ключевую роль в уклонении от аноикиса, нарушении плотных контактов и фокальной адгезии. Опухоли диффузного типа, имеющие эти мутации, демонстрируют низкую дифференцировку, локализованы преимущественно в теле и антральном отделе [4].
Wnt-путь (CTNNB1, RNF43). Он регулирует несколько биологических процессов, полярность, адгезию и рост клеток и делится в свою очередь на два пути, оба из которых важны для гастроканцерогенеза. Первый вовлечен в стабилизацию β-катенина (инвазия и метастазирование РЖ), второй путь (независимый от β-катенина) задействован в эмбриональном развитии, формировании клеточной полярности. В свою очередь накопление и высокий внутриядерный уровень β-катенина может быть связан с инактивацией гена APC, мутации которого чаще выявляются при умеренно дифференцированной аденокарциноме желудка [2].
TGF-β-путь. Множество генов семейства TGF-β демонстрируют мутации при РЖ, например, TGFBR2, SMAD4 и ELF3 [3,4]. Снижение чувствительности к TGF- при РЖ связано с развитием более агрессивных фенотипов опухолей [1].
МЕТ. Продуктом протоонкогена c-MET является рецепторная тирозинкиназа c-MET. Ее лигандом является фактор роста гепатоцитов (HGF), который оказывает разнообразное действие на жизнедеятельность клеток, в том числе на их способность к миграции, процессы клеточной дифференцировки и морфогенеза тканей [5].
HER2. HER2 онкоген (c-erB\2) гомологичен гену рецептора эпидермального фактора роста (c-erB\1). Его продукт — гликопротеин с тирозинкиназной активностью, трансмембранный рецептор. Накапливаются исследования, посвященные изучению взаимосвязи клинического течения РЖ с избыточной экспрессией белка c-erbB\2 в первичной опухоли. Избыточная мембранная экспрессия c-erB\2 ассоциирована с плохим прогнозом заболевания и может являться дополнительным показателем для выявления групп больных с более агрессивным течением заболевания [2].
Эпигенетическая нестабильность при раке желудка. Среди эпигенетических механизмов, вовлеченных в патогенез РЖ, описывают метилирование ДНК и микроРНК [5].
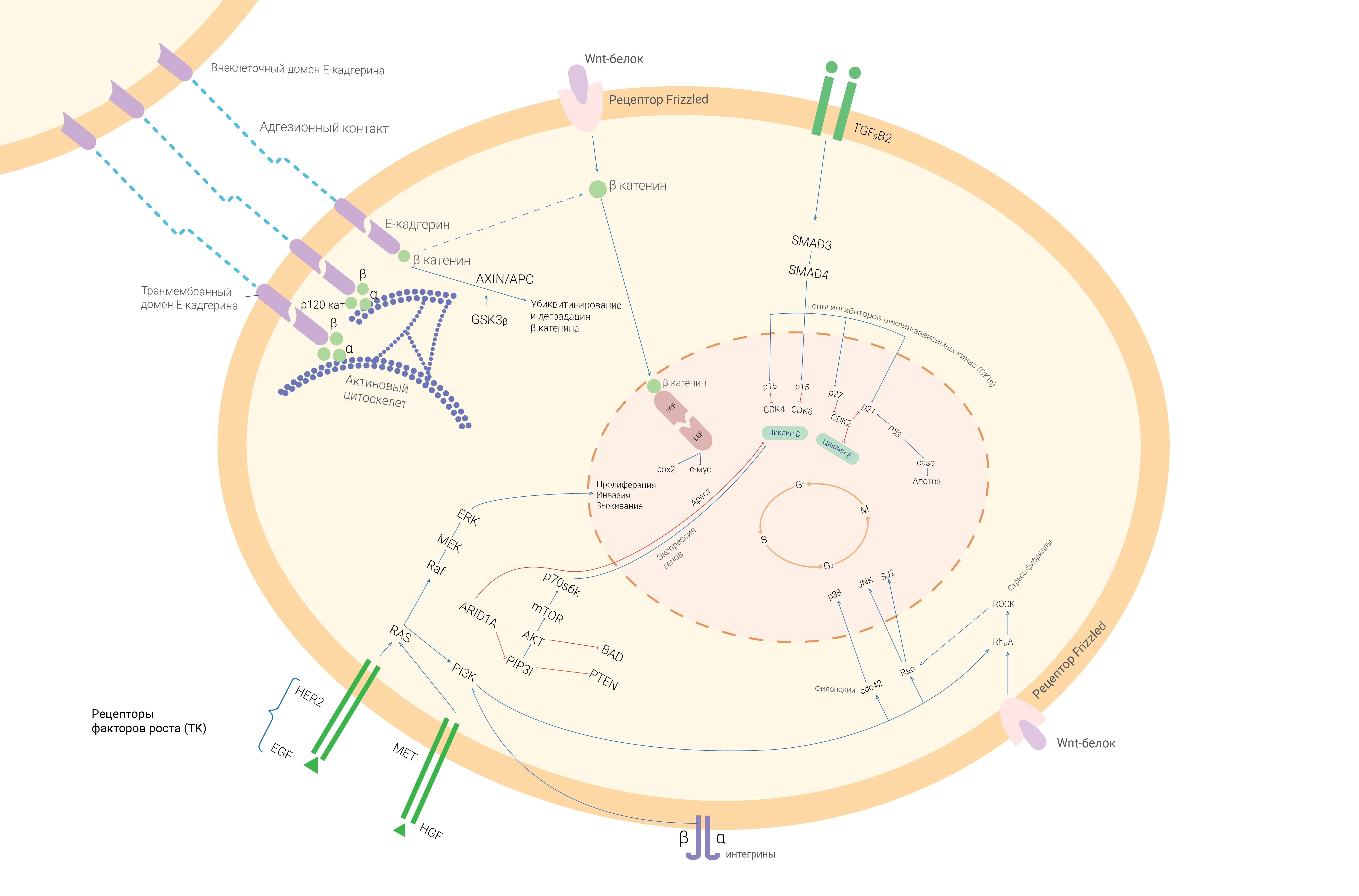
Рисунок 1 | Схема взаимодействия генов в процессе гастроканцерогенеза [1,3,5].
Мы наблюдаем эволюцию подхода «один размер подходит всем» до персонифицированных стратегий, ориентированных также и на канцерпревенцию. Это вполне реальная цель, достижение которой включает 3 этапа:
1) генетический скрининг — выявление и регистрация онкологически отягощенных семей;
2) генетическое консультирование — определение риска развития злокачественного заболевания для родственников больного (прогноз здоровья) и его будущих детей (прогноз потомства);
3) клинико-генетический мониторинг группы повышенного генетического риска.
Источники
1. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study / C. Fitzmaurice [et al.] // JAMA Oncol. — 2017. — Vol.3(4). — P.524–548.
2. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention / P. Karimi [et al.] // Cancer Epidemiol Biomarkers Prev. — 2014. — Vol.23. — P.700–713.1
3. Langner C. Precursors of gastric cancer: Dysplasia and adenoma / C. Langner // Pathologe. — 2017. — Vol.38(2). — P.67–74.
4. Lauren classification and individualized chemotherapy in gastric cancer / J.Ma [et al.] // Oncology Letters. — 2016. — Vol.11(5). — P.2959–2964.
5. Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer / K.Wang [et al.] // Nat Genet. — 2014. — Vol.46. — P.573–582.
