Анализ снижения эффективности фармацевтических исследовательских работ

Аннотация
Последние 60 лет принесли огромные успехи во многих научных, технологических и управленческих сферах, которые должны способствовать повышению эффективности исследований и разработок (НИОКР) коммерческих лекарств. Тем не менее, количество одобренных новых препаратов на миллиард долларов США, потраченных на исследования и разработки, сокращается вдвое примерно каждые девять лет с 1950 г. — то есть примерно в 80 раз с поправкой на инфляцию. Было предложено много решений проблемы снижения эффективности НИОКР. Однако очевидное на данный момент отсутствие их влияния на ситуацию и контраст между улучшением исходных условий и снижением количества новых лекарств дают повод задаться вопросом, были ли проблемы, лежащие в их основе, правильно диагностированы. В этом обзоре авторы обсуждают четыре фактора, которые они полагают основными причинами, и называют проблему «лучше, чем "Битлз"»; проблему «осторожного регулятора»; тенденцию «бросать деньги»; и предубеждение «фундаментальные исследования — грубая сила». Цель обзора — побудить провести более систематический анализ причин снижения эффективности НИОКР.
За последние 60 лет были достигнуты значительные успехи во многих научных и технологических аспектах исследований и разработки лекарственных средств (НИОКР). Например, в течение 1980-х и 1990-х гг. комбинаторная химия увеличила количество потенциальных терапевтических молекул, которые мог синтезировать каждый химик в год, примерно в 800 раз [1–3]; также значительно возрос размер химических библиотек [4]. Секвенирование ДНК стало более чем в миллиард раз быстрее с тех пор, как в 1970-х годах была определена первая последовательность генома [5–7], — это помогает находить новые мишени для лекарственных препаратов. Сейчас для расчета трехмерной структуры белка с помощью рентгеновской кристаллографии требуется как минимум на три порядка меньше человеко-часов, чем 50 лет назад [8, 9], а базы данных трехмерной структуры белка содержат в 300 раз больше записей, чем 25 лет назад (см. веб-сайт базы данных RCSB Protein Data Bank) — это облегчает разработку улучшенных соединений-прототипов с помощью стратегий на основе молекулярной структуры. Результатом внедрения высокопроизводительного скрининга (HTS) с середины 1990-х годов стало десятикратное снижение стоимости тестирования библиотек соединений для поиска белков-мишеней [10]. К этому добавляются новые изобретения (такие как вся область биотехнологии, компьютерный дизайн и скрининг лекарств, а также трансгенные мыши) и достижения в научных знаниях (такие как понимание механизмов болезней, новые мишени для лекарственных препаратов, биомаркеры и суррогатные конечные точки).
Также были предприняты значительные усилия для понимания и улучшения управления коммерческим процессом НИОКР. Накоплен опыт в отношении причин перерасхода средств по проектам [11], факторов, влияющих на финансовую отдачу от инвестиций в НИОКР [12–17], успеха проектов [18] и управления портфелем НИОКР [19–22], способов снижения затрат за счет аутсорсинга, а также того, что может впечатлить или обеспокоить регулирующие органы [23].
Однако параллельно, как нередко уже обсуждалось, эффективность НИОКР, измеряемая просто числом новых лекарств, выведенных на рынок мировой биотехнологической и фармацевтической промышленностью на миллиард долларов США, потраченных на НИОКР, неуклонно снижалась [24]. Авторы обзора называют эту тенденцию «законом Эрума», в отличие от более известного закона Мура («закон Эрума» [Eroom’s Law] — это «закон Мура» [Moore’s Law] наоборот). Закон Мура — это термин, который был придуман для описания экспоненциального увеличения количества транзисторов, которые можно по разумной цене разместить в интегральной схеме. Это число удваивалось каждые два года с 1970-х по 2010 г. Термин используется в более общем смысле для технологий, которые улучшаются экспоненциально с течением времени. Данные на рис. 1а показывают, что количество новых лекарств, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США на миллиард долларов США, потраченных на исследования и разработки в фармацевтической промышленности, сокращается вдвое примерно каждые девять лет с 1950 года с поправкой на инфляцию. Часть контраста между законом Мура и законом Эрума связана со сложностью и ограничениями текущего понимания биологических систем по сравнению с относительной простотой и более высоким уровнем знаний о физике твердого тела [25], но, как обсуждается ниже, есть и другие важные причины.
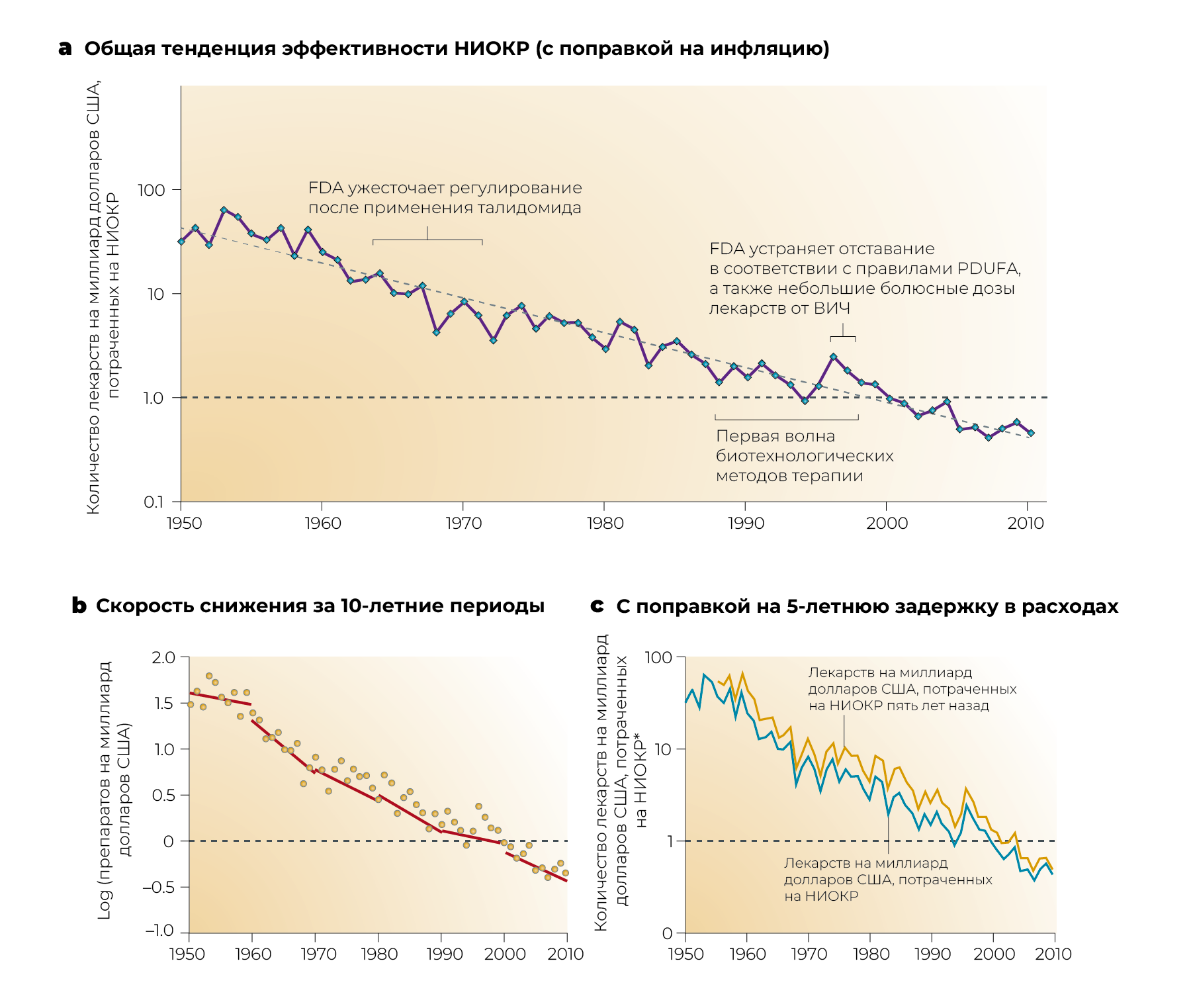
b | Скорость снижения одобрения новых лекарств на миллиард потраченных долларов США примерно одинакова в разные 10-летние периоды.
c | Модель устойчива при различных предположениях о средней задержке между расходами на НИОКР и одобрением лекарств. Для получения подробной информации о данных и основных предположениях см. дополнительную информацию в [24, 86, 87]. Обратите внимание, что затраты на НИОКР основаны на Ежегодном обзоре фармацевтических исследований и производителей Америки (PhRMA) за 2011 г. [86, 87]. PhRMA — торговая ассоциация, в которую входят не все фармацевтические и биотехнологические компании, поэтому показатель PhRMA занижает расходы на НИОКР на отраслевом уровне. Общие расходы отрасли с 2004 г. были на 30–40% выше, чем общие расходы членов PhRMA, которые легли в основу этой цифры. Однако количество новых препаратов представляет собой общее количество новых молекулярных соединений и новых биологических препаратов (если применять то же определение то, что и Munos [24]), одобренных FDA США из всех источников, а не только членов PhRMA. Авторы обзора оценили реальные цифры инфляции затрат на НИОКР по источникам 24 и 87. Общая картина кажется достаточно устойчивой к точным деталям расчетов затрат и инфляции. Панель а основана на цифре, впервые появившейся в отчете Bernstein Research («Долгий взгляд — производительность НИОКР»; 30 сентября 2010 г.).
* С поправкой на инфляцию. PDUFA — Закон о плате за регистрацию рецептурных лекарств.
Несмотря на то, что сопоставлять расходы на НИОКР за очень длительные периоды сложно, закон Эрума оказался достаточно надежным. С 1950-х гг. количество новых лекарств, появляющихся ежегодно, практически не изменилось, а стоимость их неуклонно росла [24]. Наклон кривой, по крайней мере, за десятилетний период существенно не меняется (рис. 1b), а предположения о задержке между инвестициями в исследования и разработки и утверждением препарата не влияют существенно на общую картину (рис. 1c). Для получения более подробной информации о данных, использованных на рис. 1, а также основные предположения см. в таблицах.
Закон Эрума указывает на то, что есть мощные силы, которые перевесили научные, технические и управленческие усовершенствования за последние 60 лет и/или что некоторые из усовершенствований были менее эффективными, чем принято считать. Чем более позитивно кто-либо относится к прогрессу за последние несколько десятилетий, тем более негативно он должен относиться к силам противодействия. Если кто-то сегодня смотрит с оптимизмом на перспективы НИОКР, он, по-видимому, полагает, что противодействующие силы — какими бы они ни были — начинают ослабевать или что произошло внезапное и беспрецедентное ускорение научного, технологического или управленческого прогресса, которое вскоре станет заметным в виде одобрений новых лекарственных препаратов.
Масштабы и продолжительность действия закона Эрума также предполагают, что многие способы, которые были предложены для решения проблемы производительности НИОКР, скорее всего, в лучшем случае будут иметь слабый эффект. Предположим, обнаружилось, что добыча тонны угля из-под земли сегодня стоит в реальном выражении в 80 раз больше, чем 60 лет назад, несмотря на усовершенствование горнодобывающей техники и способности геологов находить угольные месторождения. Можно было бы ожидать, что эксперты и руководители угольной отрасли дадут объяснения примерно следующего содержания: «Разрезные месторождения исчерпаны, и в отрасли остались тонкие пласты, находящиеся далеко под землей в районах, подверженных затоплению и обрушению». Учитывая этот анализ, люди, вероятно, могли бы согласиться с тем, что продолжение инвестирования будет оправдано реалистичной перспективой либо значительного улучшения технологии добычи, либо значительного роста цен на топливо. Если и то и другое маловероятно, с финансовой точки зрения будет целесообразно сократить добычу.
Однако у читателей большей части того, что написано о производительности НИОКР в фармацевтической промышленности, может сложиться впечатление, что закон Эрума можно просто «развернуть обратно» с помощью таких стратегий, как большее внимание руководства к ряду факторов, среди которых — стоимость проекта и скорость реализации [26], путем реорганизации НИОКР в более мелкие специализированные подразделения в одних случаях [27] или в более крупные подразделения с лучшим эффектом масштаба в других [28], за счет аутсорсинга в страны с более низкими затратами [26], путем корректировки управленческих показателей и введения «оценочных карт» НИОКР [29] или каким-то образом делая ученых более «предприимчивыми» [30, 31]. По мнению авторов обзора, эти изменения в незначительной степени могут помочь, но создается впечатление, что большинство из них не решает основную проблему производительности.
Были серьезные попытки описать противодействующие силы или понять, какие улучшения были реальными, а какие — иллюзорными. Однако такие публикации относительно редки. К ним относятся: «Инициатива критического пути» FDA [23]; серия пророческих статей Horrobin [32–34], в которых утверждается, что восходящая наука лишь разочаровывала и отвлекала; статья Ruffolo [35], посвященная в основном нормативным и организационным барьерам; история взлета и падения медицинских инноваций в двадцатом веке Le Fanu [36]; анализ организационных проблем в биотехнологических инновациях Pisano [37]; критика Young [38] и Hopkins с соавт. [39] идеи о том, что высокоаффинное связывание одной мишени с соединением-прототипом является лучшим местом для начала процесса НИОКР; анализ Pammolli с соавт. [19], рассматривающий изменения в наборе проектов в «легких» и «сложных» терапевтических областях; обширная работа Munos [24]; а также ряд других публикаций.
Существует также проблема охвата. Если мы сравним анализы FDA [23], Garnier [27], Horrobin [32–34], Ruffolo [35], Le Fanu [36], Pisano [37], Young [38] и Pammolli с соавт. [19], перекрываться они будут ограниченно. Во многих случаях разные источники обвиняют разные противоборствующие силы. Это говорит о том, что требуется более комплексное объяснение.
И важно найти такое объяснение, потому что закон Эрума — если он выполняется — имеет очень неприятные последствия. Действительно, кажется, что финансовые рынки уже верят в закон Эрума или что-то похожее на него, и его влияние проявляется в мерах по сокращению расходов, принимаемых крупными фармацевтическими компаниями. Судя по ценам на акции фармацевтических компаний, инвесторы ожидают, что финансовая отдача от текущих и будущих инвестиций в НИОКР будет ниже стоимости капитала на уровне отрасли [40], и они предпочли бы меньший объем НИОКР и более высокие дивиденды. В этом инвесторы вполне могут ошибаться. Однако у них меньше оснований для предвзятого оптимизма в отношении вероятности успешного противодействия закону Эрума, чем у тех, кто работает в индустрии или продает ей консалтинговые услуги. Акционеры в конечном итоге назначают руководителей и контролируют распределение ресурсов, поэтому их мнение имеет значение. Вполне вероятно, что Pfizer, Merck & Co., AstraZeneca и Eli Lilly в 2015 году потратят в номинальном выражении меньше, чем в 2011 году, отчасти в ответ на давление со стороны акционеров. Судя по всему, номинальные расходы на НИОКР десяти крупнейших фармацевтических компаний не изменятся до 2015 года, что в реальном выражении означает их снижение (статья написана в 2012 году — прим. перев.). Что еще важнее, комбинированный эффект снижения реальных расходов на НИОКР и закона Эрума (меньше новых лекарств на миллиард долларов США инвестиций в НИОКР с течением времени) заключается в том, что новых препаратов будет меньше, и/или они станут чрезмерно дорогими. Это поставит под угрозу огромные преимущества [41, 42] наличия эффективных и доступных новых лекарств.
С точки зрения авторов обзора, чтобы избежать такого исхода, требуется более систематический анализ факторов, лежащих в основе закона Эрума. Они полагают, что любая серьезная попытка объяснить закон Эрума должна учитывать по крайней мере две вещи: прогрессивный характер снижения количества новых лекарственных препаратов на миллиард долларов США, потраченных на исследования и разработки, и масштаб (~80-кратный) снижения. Эта статья содержит некоторые предложения. Очевидно, что отрасль неоднородна, поэтому во многих случаях обобщения будут ошибочными. Авторы ценят интеллектуальные усилия, предпринятые другими для анализа проблем производительности НИОКР. Авторы отмечают, что выбранный ими показатель эффективности НИОКР основан на стоимости одобренного нового лекарства. Это не объясняет огромные различия в медицинской и финансовой ценности новых препаратов. Несколько революционных препаратов — например, высокоэффективный препарат для лечения болезни Альцгеймера — могут иметь гораздо большую медицинскую и финансовую ценность, чем большое количество новых лекарств, дающих лишь скромные дополнительные преимущества. Авторы также отмечают, что очень долгое время цикла исследований и разработок лекарств означает, что выбранная ими мера производительности является запаздывающим индикатором; возможно что-то и улучшилось, но результат пока не заметен.
Тем не менее, с целью побудить к дискуссии и анализу, здесь обсуждается то, что авторы полагают четырьмя основными причинами закона Эрума: проблема «лучше, чем "Битлз"»; проблема «осторожного регулятора»; тенденция «бросать деньги»; и предубеждение «фундаментальные исследования — грубая сила». Возможно, также присутствует некоторый вклад пятого фактора, называемого проблемой «низко висящих плодов», но, по мнению авторов, он менее важен.
Основные причины
Проблема «лучше, чем "Битлз"»
Представьте, как трудно было бы добиться коммерческого успеха с новыми поп-песнями, если бы любая новая песня должна была быть лучше, чем «Битлз», если бы весь каталог «Битлз» был доступен бесплатно и если бы людям не наскучили старые пластинки «Битлз». Авторы предполагают, что нечто подобное применимо к открытию и разработке новых лекарств. То, что вчера было «бомбой», сегодня — дженерик. Постоянно улучшающийся бэк-каталог одобренных лекарств усложняет процесс разработки новых препаратов и увеличивает доказательные препятствия для утверждения, принятия и возмещения расходов. Это сдерживает НИОКР в некоторых областях, концентрирует их на трудноизлечимых заболеваниях и снижает экономическую ценность еще не открытых лекарств. Проблема прогрессирующая и неразрешимая.
Мало какие другие отрасли страдают от этой проблемы. Если брать упомянутый выше пример с угольной промышленностью, то в ней месторождения в первую очередь разрабатываются открытым способом. Однако уголь сжигается, что увеличивает ценность угля, который все еще находится в земле. В большинстве бизнесов, связанных с интеллектуальной собственностью (например, в сфере моды или издательского дела), людям надоедают прошлогодние творения, что поддерживает спрос на новизну. К несчастью для фармацевтической промышленности, врачи вряд ли начнут прописывать фирменные лекарства от диабета, потому что им наскучил обычный метформин.
Противоязвенные средства — все еще очень ценная терапевтическая область с точки зрения доходов — представляют собой пример тени, которую отбрасывают успешные лекарства. Класс антикислотных агентов, известных как блокаторы кислоты, конкурирующие с калием, такие как сорапразан (в настоящее время снят с производства), вероятно, были бы безопасными и эффективными противоязвенными средствами, а 15 лет назад они могли бы стать «блокбастерами». Сегодня проблема заключается в том, что в настоящее время на рынке существует два класса высокоэффективных и безопасных противоязвенных препаратов: антагонисты Н2-гистаминовых рецепторов (например, непатентованный ранитидин, доступный без рецепта) и ингибиторы протонной помпы (например, дженерик эзомепразол и некоторые другие). Любая разумная система здравоохранения будет платить за пациентов, получающих новый фирменный блокатор кислоты, конкурирующий с калием, только в том случае, если они не реагируют на дешевый генерический ингибитор протонной помпы и/или антагонист Н2-рецепторов, но такие пациенты составляют очень небольшую долю от общей численности населения. Эта общая проблема возникает при диабете, гипертонии, контроле уровня холестерина и многих других показаниях.
Pammolli с соавт. [19] предоставили количественную иллюстрацию проблемы «лучше, чем Битлз». В своем анализе они сравнивали проекты НИОКР, начатые в период с 1990 по 1999 годы, с проектами, начатыми в период с 2000 по 2004 годы. За второй период уровень отсева вырос. Тем не менее, это увеличение может быть в значительной степени объяснено смещением состава проектов НИОКР из коммерчески перегруженных терапевтических областей, в которых историческая вероятность одобрения лекарств была высокой (например, препараты для мочеполовой системы и половые гормоны), в менее загруженные области с более низкой исторической вероятностью одобрения (например, противоопухолевые и иммуномодулирующие средства).
Часто называется еще одна связанная с этим потенциальная причина закона Эрума — проблема «низко висящих плодов», которая возникает в результате постепенного использования более технически податливых мишеней для действия лекарственных препаратов [43]. Стоит уточнить, что проблема «низко висящих фруктов» заключается в том, что плоды, которые легко собрать, исчезли, в то время как проблема «лучше, чем «Битлз»» — в том, что сорванные фрукты уменьшают ценность фруктов, оставшихся на дереве.
С точки зрения авторов, проблема «низко висящих плодов» менее важна, чем проблема «лучше, чем "Битлз"». Во-первых, оценки количества потенциальных лекарственных мишеней [44, 45] по сравнению с количеством уже задействованных мишеней для лекарственных препаратов [46] показывают, что новые мишени останутся на многие десятилетия, если промышленность будет продолжать использовать четыре или пять новых мишеней каждый год. Также становится ясно, что многие лекарства могут проявлять терапевтический эффект от взаимодействия с несколькими белками, а не с одной мишенью. Такие препараты, скорее, можно назвать «волшебными ружьями», нежели «волшебными пулями» [47]. Если это будет работать в более общем плане, то проблема «низко висящих плодов» будет похожа на проблему нехватки нот как угрозы будущему сочинению музыки. По мнению авторов, объяснение проблемы «низко висящих плодов» иногда тавтологично, поскольку «технически простое» обычно отождествляется с «уже открытым» [48]. Действительно, изучение истории разработки лекарств показывает, что некоторые из великих открытий 1940-х и 1950-х гг., такие как противовоспалительное действие кортикостероидов, психиатрическое действие имипрамина или лития или антибактериальное действие пенициллина, не были легкими или очевидными [36, 49–51].
Проблема «осторожного регулятора»
Постепенное снижение толерантности к риску со стороны регулирующих органов, очевидно, поднимает планку для внедрения новых лекарственных препаратов и может существенно увеличить связанные с этим затраты на НИОКР [52]. Каждая реальная или воображаемая оплошность индустрии или настоящая неудача с лекарствами ведет к «закручиванию гаек», которое редко ослабляется, даже если кажется, что этого можно достичь, не создавая значительного риска для безопасности лекарств. Например, тест Эймса на мутагенность может быть рудиментарным нормативным требованием; это, вероятно, немного повышает безопасность лекарств, но отсекает некоторые препараты-кандидаты. Кроме того, на протяжении большей части последних 60 лет крупные и опытные фармацевтические компании, возможно, не были разочарованы ужесточением нормативно-правовой базы, поскольку это ограничивало конкуренцию.
Также кажется, что опасения, что фармацевтические компании могут каким-то образом обмануть систему, побудили осторожный регулирующий орган применить подход к нормативной документации на основе аудита, поскольку чем жестче требования к отчетности, тем труднее обмануть без каких-либо ошибок или несоответствий. Масштаб отчетности был резюмирован главным научным сотрудником Novo Nordisk на телефонной конференции по результатам третьего квартала 2011 года в отношении представления в FDA данных о двух новых методах инсулиновой терапии: «Если распечатать и сложить в стопку многие миллионы страниц документации и в общей сложности девять миллионов электронных ссылок, она превысит высоту Эмпайр Стейт Билдинг».
Влияние проблемы «осторожного регулятора» на закон Эрума видно на рис. 1. Во-первых, оно показывает падение эффективности НИОКР в начале 1960-х гг. после принятия поправки Кефовера Харриса 1962 года к Федеральному закону о пищевых продуктах, лекарствах и косметических средствах, которая была принята после катастрофы с талидомидом. Впервые лекарственные средства должны были продемонстрировать эффективность; также были подняты барьеры безопасности. Это снизило финансовую отдачу от НИОКР примерно на десять лет [12, 14], прежде чем рост цен на лекарства превысил инфляцию затрат на НИОКР и увеличил финансовую отдачу в 1970-х гг. [15]. Интересно, что рис. 1 также показывает рост эффективности НИОКР в середине-конце 1990-х гг., что, вероятно, было связано с двумя факторами, связанными с регулированием: в первую очередь устранением отставания в регулировании со стороны FDA после введения в действие Закона 1992 г. о сборах за лекарства, отпускаемые по рецепту (PDUFA), а также небольшим вкладом быстрой разработки и утверждения нескольких препаратов против ВИЧ. В случае с лекарствами от ВИЧ организованное и политически проницательное лоббирование эффективно уменьшило обычные регуляторные барьеры [53].
Проблема «осторожного регулятора» частично вытекает из проблемы «лучше, чем "Битлз"», поскольку регулятор более терпим к риску, когда существует мало хороших вариантов лечения; или, другими словами, доступность безопасных и эффективных препаратов для лечения данного заболевания поднимает планку регулирования для других лекарств по тому же показанию. Хотя проблема «осторожного регулятора» в принципе решаема, вряд ли можно ожидать сколько-нибудь существенного ослабления давления регуляторной среды. Общество может быть правым, предпочитая более жесткий регулятор, даже если это означает более дорогостоящие НИОКР. Безопасность лекарств важна. И хотя 1950-е и 1960-е гг. могут рассматриваться некоторыми как золотой век с точки зрения терапевтических инноваций [36, 48, 54], маловероятно, что тяжелые неблагоприятные исходы для многих пациентов, принимавших участие в клинических испытаниях в этот период [36], сегодня были бы приемлемы.
Тенденция «бросать деньги»
Тенденция «бросать деньги на это» — это стремление добавлять человеческие и другие ресурсы в исследования и разработку препаратов, что до недавних лет обычно приводило к росту расходов на НИОКР в крупных компаниях и в отрасли в целом. Вероятно, это связано с несколькими факторами, включая хорошую отдачу от инвестирования в НИОКР в течение большей части последних 60 лет, а также плохо изученный и стохастический инновационный процесс, который имеет длительные периоды окупаемости. Кроме того, острая конкуренция между продаваемыми препаратами (где второе или третье место выхода на рынок часто стоит меньше, чем первое) дает обоснование для инвестирования дополнительных ресурсов, чтобы первыми выйти на рынок. Крупные компании также могут приравнивать профессиональный успех к размеру бюджета.
К сожалению людей, работающих сегодня в сфере НИОКР, борьба с тенденцией «бросать деньги» выглядит осуществимой. Инвесторы и многие руководители высшего звена считают, что многие расходы на НИОКР можно сократить без существенного снижения выпуска продукции. Верно ли это, еще предстоит выяснить, хотя, если это так, это может быть единственной стратегией, которая, скорее всего, противодействует закону Эрума в краткосрочной перспективе. Однако риск состоит в том, что отсутствие понимания факторов, влияющих на окупаемость инвестиций в НИОКР, которые способствовали относительно неизбирательным расходам в хорошие времена, может означать, что сокращение расходов будет таким же неизбирательным. Затраты могут снизиться без существенного увеличения производительности.
Предубеждение «фундаментальные исследования — грубая сила»
Предвзятость «фундаментальные исследования — грубая сила» — это тенденция переоценивать способность достижений фундаментальных исследований (особенно в области молекулярной биологии) и методов скрининга «в лоб» (воплощенных в первых нескольких шагах стандартного процесса открытия и доклинических исследований) повышать вероятность того, что молекула будет безопасной и эффективной в клинических испытаниях (рис. 2). По мнению авторов обзора, есть подозрения, что это послужило интеллектуальным основанием для отказа от старых и, возможно, более продуктивных методов выявления препаратов-кандидатов [32–34]. Стоит отметить, что многие комментарии авторов больше относятся к низкомолекулярным лекарственным средствам, хотя данные, использованные для рис. 1, также включают биопрепараты.
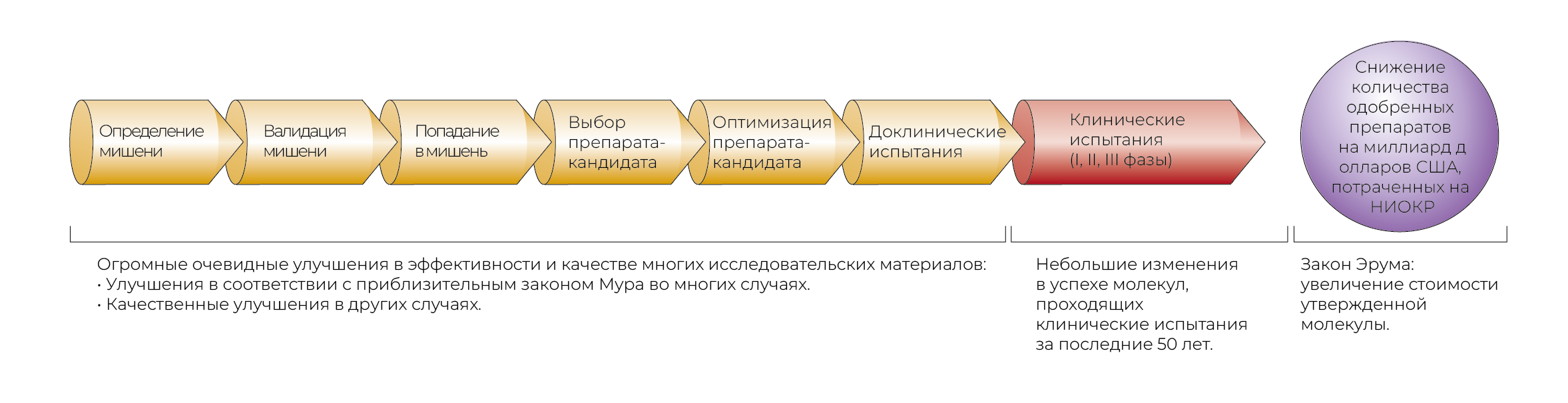
Рис. 2 иллюстрирует стандартную модель большинства исследований и разработок лекарственных средств. По сути, это последовательный процесс поиска, фильтрации и отбора. Научные и технические достижения, по крайней мере на первый взгляд, увеличили ширину охвата (то есть было определено больше потенциальных мишеней и синтезировано больше потенциальных лекарственных молекул). Они повысили эффективность фильтрации на несколько порядков (например, HTS по сравнению с тестированием на дорогих и низкопроизводительных животных моделях). Они также должны были повысить качество фильтрации и отбора (например, применение анализа путей для выбора мишеней, использование трансгенных мышей для валидации мишеней и применение накопленного опыта для отбора молекул, которые, вероятно, имели бы хорошие показатели ADMET (абсорбции, распределения, метаболизма, экскреции и токсикологических характеристик).
Накопительный эффект улучшений на этих ранних этапах должен был заключаться в более высоком отношении сигнал/шум среди лекарств-кандидатов, проходящих клинические испытания; то есть у выбранных потенциальных препаратов должна быть выше вероятность успешно продемонстрировать эффективность и безопасность в этих испытаниях. Это, в свою очередь, должно было повысить эффективность НИОКР, учитывая, что большая часть затрат на разработку новых лекарств связана с затратами на неудачные проекты [22]. Тем не менее, вероятность того, что низкомолекулярный препарат успешно пройдет клинические испытания, оставалась более или менее постоянной в течение 50 лет [21], а общая эффективность НИОКР снизилась [24].
Так как же могут резко улучшаться некоторые части процесса, но важные показатели общей производительности — оставаться неизменными или снижаться? Есть несколько возможных объяснений, но разумно будет задаться вопросом, не поставили ли компании на поток неправильный набор видов деятельности [34, 36, 38]. На первый взгляд, НИОКР были более эффективными несколько десятилетий назад (рис. 1), когда многие исследовательские направления, которые сегодня считаются критическими (например, создание геномных лекарственных мишеней и HTS), не были изобретены и когда преобладали другие подходы (например, клиническая наука, скрининг на животных и итеративная медицинская химия).
По поводу современных исследований было несколько интересных критических замечаний [33, 48, 55], но здесь авторы обзора выделяют две потенциальные проблемы. Во-первых, большая часть исследований и разработок фармацевтической промышленности в настоящее время основана на идее о том, что в основе полезного эффекта лежит высокоаффинное взаимодействие молекулы препарата с одной биологической мишенью, связанной с заболеванием [39]. Однако, если причинно-следственная связь между отдельными мишенями и болезненными состояниями слабее, чем принято считать [38, 56], или если лекарства редко воздействуют на одну мишень, можно понять, почему молекулы, которые на основании этой стратегии попали клиническую разработку, не обязательно будут иметь больше шансов на успех, чем в более ранние периоды.
Действительно, небольшие молекулы потенциальных лекарств имеют тенденцию к беспорядочному связыванию, и иногда оказывается, что это играет важную роль в их эффективности [47, 57], а также в их так называемых ненаправленных эффектах [39]. Мишени входят в состав сложных сетей, приводящих к непредсказуемым эффектам [58], и биологические системы демонстрируют высокую степень избыточности, которая может притупить влияния узконаправленных препаратов [56, 57]. Возможно, это поможет объяснить, почему несколько десятилетий назад, когда вместо дешевых автоматических молекулярных анализов в основе начального скрининга лекарств лежали дорогостоящие и трудоемкие животные модели, процесс НИОКР был более рентабельным (рис. 2) [36, 49–51, 59].
Более поздний анализ также позволяет сделать аналогичный вывод. Лучшее в своем классе низкомолекулярные препараты, одобренные между 1999 и 2008 гг., были обнаружены с помощью фенотипического анализа, а не на основе их мишеней [60]. Одобренные в этот период препараты разработаны тогда, когда подход на основе мишеней преобладал над скринингом, и поэтому можно было бы ожидать большего числа разработок на основе мишеней.
Возможно, подходы на основе мишеней эффективны для следования проверенным терапевтическим гипотезам, но менее эффективны для поиска инновационных препаратов, имеющих больше шансов преодолеть барьер «лучше, чем "Битлз"».
Вторая потенциальная проблема следует из природы химического пространства и сдвига от итеративной медицинской химии, сопряженной с параллельным анализом (до 1990-х гг.) к серийной фильтрации, которая начинается с HTS статичной библиотеки соединений, воздействующих на мишень.
Направленная итерация — даже если каждый цикл протекает медленно — может быть более эффективным способом поиска крупного и многомерного химического пространства, нежели быстрый HTS предопределенного набора соединений (вставка 1).

Кроме того, биологические препараты оказались успешнее малых молекул после того, как они из исследований перешли в клинические испытания. Уровень одобрения биопрепаратов составил примерно 32% по сравнению с примерно 13% для низкомолекулярных препаратов, впервые испытанных с участием людей в период с 1993 по 2004 гг. [21]. Это неудивительно для копий или близких аналогов эндогенных сигнальных молекул (например, инсулинов, эритропоэтинов или гормонов роста) или для агентов, замещающих дисфункциональные белки (например, факторы свертывания крови, лизосомные ферменты и т. д.). Высокие показатели успеха в клинических испытаниях моноклональных антител (и родственных слитых белков), пожалуй, более примечательны [61]. Можно было бы ожидать, что они будут страдать от тех же проблем с однонаправленной эффективностью, что и малые молекулы (хотя и с меньшими побочными эффектами). Тем не менее, они открыли новые наборы терапевтических мишеней, которые могут меньше страдать от проблемы «лучше, чем "Битлз"». Возможно, их успех также является функцией ограниченного набора их мишеней — либо белков клеточной поверхности, либо белковых внеклеточных сигнальных молекул. В обоих случаях цепочка причинно-следственной связи между связыванием мишени и терапевтическим эффектом относительно короткая. Из 34 моноклональных антител или других таргетных биологических препаратов (таких как слитые белки или аптамеры), которые были одобрены FDA, 13 направлены на антигены, специфичные для лейкоцитов (например, CD20), и используются для лечения гематологических злокачественных опухолей или иммуносупрессии; три — на рецепторы из семейства рецепторов эпидермального фактора роста человека и используются в онкологии; семь — на фактор некроза опухоли или интерлейкины и используются для иммуномодуляции при аутоиммунных заболеваниях; и четыре нацелены на варианты фактора роста эндотелия сосудов, которые используются в онкологии или офтальмологи.
По мнению авторов обзора, есть несколько причин, по которым предубеждение «фундаментальные исследования — грубая сила» стало доминировать в исследованиях лекарственных средств. Во-первых, к началу 1980-х уже появилось ощущение, что темпы фармацевтических инноваций замедляются. Проблема «осторожного регулятора» была очевидным препятствием [52, 54, 62]. Начала возникать проблема «лучше, чем "Битлз"» с жалобами на то, что новые лекарства лишь ненамного эффективнее тех, что уже доступны [62]. Высказывались опасения по поводу проблемы «низко висящих плодов» с растущим ощущением того, что в отрасли закончились хорошие модели на животных для скрининга лекарств против все еще трудноизлечимых заболеваний [52, 62].
Во-вторых, предубеждение «фундаментальные исследования — грубая сила» соответствовало научному духу времени [48], особенно потому, что старые подходы к исследованиям и разработкам лекарств на ранних стадиях, казалось, приносили меньше результатов. То, что можно было бы назвать «молекулярным редукционизмом», стало доминирующим течением не только в фармацевтической промышленности, но и в биологии в целом [33, 34, 55]: «С 1970-х годов почти все направления биомедицинских исследований вели к генам» [63]. Генетика и молекулярная биология рассматриваются как обеспечивающие «наилучшие» и наиболее фундаментальные способы понимания биологических систем и последующего воздействия на них [64]. Интеллектуальные задачи редукционизма и его необходимого синтеза («-омики») кажутся многим ученым-биомедикам более привлекательными, чем беспорядочный эмпиризм старых подходов.
В-третьих, предубеждение «фундаментальные исследования — грубая сила» совпадало с политикой многих коммерческих менеджеров, консультантов по вопросам управления и инвесторов. Старая модель, основанная на итеративной медицинской химии, скрининге на животных и клинической науке, считалась «слишком зависимой либо от неэффективной позиционной войны, либо от непредсказуемого появления, казалось бы, капризных гениев, таких как Джеймс Блэк, Пол Янссен, Даниэль Бове, Гертруда Элион. или Джеральд Хитчингс» [33]. Автоматизация, систематизация и измерение процессов сработали и в других отраслях. Зачем позволять команде химиков и биологов действовать неопределенное время методом проб и ошибок, когда можно быстро и эффективно отобрать миллионы потенциальных клиентов относительно мишени, найденной с помощью геномики, а затем просто повторить тот же промышленный процесс для следующей цели, а затем и для следующей? В начале 1990-х гг. лишь немногие компании думали, что смогут процветать или выживать, не двигаясь к процессу разработки лекарств с помощью HTS и продуктов человеческого генома.
Здесь можно вспомнить дискуссию [25] о повышении эффективности клинических испытаний, инициированную редакционной статьей Энди Гроува [65], бывшего исполнительного директора Intel — человека, на собственном опыте знакомого с законом Мура. Гроув отметил «разочаровывающие результаты» исследований и разработок в фармацевтической промышленности и предложил радикально изменить клинические испытания, более широко используя электронные медицинские данные [65]. Некоторые ученые-биомедики, вероятно, находят вмешательство Гроува раздражающим, учитывая простоту и предсказуемость физики полупроводников по сравнению с «загадками биологии» [25]. Однако акционеров и налогоплательщиков убедили финансировать большое количество НИОКР, потому что ученые-биомедики (и руководители фармацевтической промышленности) сказали им, что благодаря молекулярному редукционизму исследования и разработки скоро станут более предсказуемыми [63], более продуктивными и менее загадочными.
По мнению авторов, предубеждение «фундаментальные исследования — грубая сила» поддерживается ошибкой выживших среди проектов НИОКР. Это делает открытие и разработку лекарств более рациональными в перспективе, чем есть на самом деле. Почти все лекарства продаются с биологической историей, которая звучит как молекулярный редукционизм и что иногда, но не всегда, оказывается правдой: например, «лекарство х работает, связывая рецептор а, который влияет на путь b, который регулирует физиологический процесс с, который облегчает болезнь d». Такие истории путают с предсказаниями, потому что мы очень мало слышим о подавляющем большинстве других проектов, которые также были инициированы на основе высокоаффинного связывания вероятного кандидата с вероятной мишенью и которые имели такие же правдоподобные биологические истории до определенного момента, в котором по тем или иным причинам потерпели неудачу.
Было бы интересно посмотреть, насколько хорошо предполагаемые оценки правдоподобия коррелируют с последующей убылью. В качестве иллюстрации можно взять противоопухолевый препарат инипариб. Посетителей собрания Американского общества клинической онкологии (ASCO) в 2010 г. или читателей журнала New England Journal of Medicine [66] можно простить за то, что они поверили во впечатляющее влияние инипариба на метастатический рак молочной железы в испытании II фазы, поскольку он ингибировал специфическую мишень — поли(АДФ-рибоза) полимеразу 1 (PARP1, которая участвует в репарации ДНК), и, следовательно, усиливает химиотерапию. Тем не менее, в следующем, 2011, году результаты исследования фазы III, представленные на конференции ASCO, показали, что инипариб не очень хорошо действует при раке молочной железы [67], и, по-видимому, он также не очень сильно ингибирует поли(АДФ-рибозо)полимеразу 1 [68].
К счастью, к проблеме «фундаментальные исследования — грубая сила» можно подойти несколькими способами. Во-первых, в нескольких терапевтических областях исследовательский процесс, по-видимому, дает лучшее понимание на системном уровне, лучшие мишени (или наборы мишеней) и лучшие лекарства-кандидаты. Онкология — самый яркий пример. Трудно смотреть на появление таких препаратов, как кризотиниб [69], вемурафениб [70] или висмодегиб [71], и считать их просто «случайно выжившими». Кроме того, в онкологии регулирующие органы менее осторожны, а бэк-каталог одобренных препаратов далек от «битловского». Возможно, подобными онкологии могут быть одна-две области исследований заболеваний с простой генетикой. Во-вторых, больше внимания можно было бы уделить итеративным подходам, скринингу на животных или даже раннему доказательству клинической эффективности у людей, а не прогностической способности высокоаффинного связывания с мишенью молекулы из статической библиотеки. Novartis — одна из компаний, которая уделяет особое внимание проверке концепции лекарств от редких заболеваний, в которых существует высокая неудовлетворенная потребность и убедительное соответствие между механизмом действия препарата и заболеванием. Только в случае успеха компания вкладывает средства в более дорогие испытания препаратов против более распространенных заболеваний, при которых способ действия лекарства может быть более умозрительным или при которых соотношение риска и пользы может быть менее ясным. В-третьих, в некоторых терапевтических областях люди могут просто перестать верить в нынешнюю прогностическую способность скрининговых подходов «фундаментальные исследования — грубая сила» и сопротивляться искушению подвергнуть молекулы клиническим испытаниям, не имея более убедительных доказательств обоснованности соответствующей терапевтической гипотезы.
Конечно, невозможно вернуться в прошлое, чтобы увидеть, насколько хорошо более современные подходы к НИОКР работали бы в 1940-х и 1950-х годах. Вполне возможно, что исследования стали намного лучше переводить нужные молекулы в клинику, но эти улучшения были затоплены проблемами «лучше, чем "Битлз"», «низко висящих фруктов» и «осторожного регулятора».
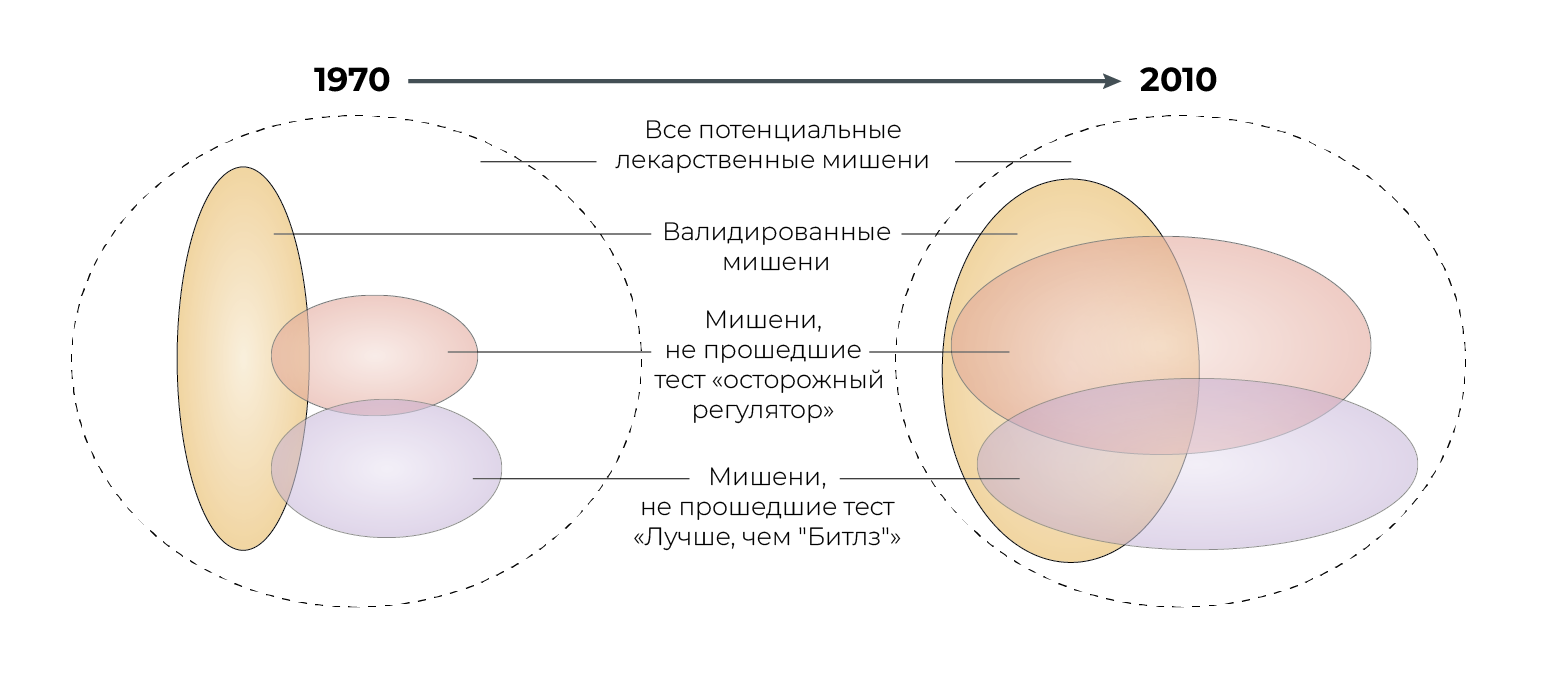
По иронии судьбы, однако, если отрасль действительно поступает правильно, окончательный прогноз может быть более мрачным. Возможности для НИОКР можно рассматривать с точки зрения диаграммы Венна: по мере совершенствования науки и техники некоторые наборы факторов расширяются (например, набор мишеней, поддающихся воздействию лекарств, набор препаратов-кандидатов и набор мишеней, на которые лекарства действуют), тогда как другие — сокращаются (например, набор экономически выгодных и все еще неизлечимых болезней или набор приемлемых ненаправленных эффектов). Очевидно, что производительность НИОКР может снизиться, несмотря на улучшение вводимых ресурсов, если сократится область пересечения коммерчески привлекательных и одобренных препаратов-кандидатов. Эта идея проиллюстрирована на рис. 3, в котором условный набор проверенных мишеней растет в период с 1970 по 2010 гг., но делает это недостаточно быстро, чтобы компенсировать рост набора мишеней, который либо обеспокоил бы осторожного регулятора, либо не прошел бы тест «лучше, чем "Битлз"».
Наконец, как отмечают авторы обзора, было бы легче улучшить отношение сигнал/шум для препаратов, которые проходят клинические испытания, если бы во-первых, было детальное понимание того, почему лекарства терпят неудачу в клинике; во-вторых, если бы это привело к обнаружению небольшого числа общих причин неудач; и в-третьих, если это знание могло бы быть использовано для изменения ранних стадий процесса НИОКР. Если нецелесообразно проводить ретроспективный анализ точных молекулярных механизмов неудач клинических испытаний, или если такие ретроспективные анализы показывают, что испытания терпят неудачу по многим редким и неординарным причинам, или если время цикла настолько велико, что полученные уроки устаревают к тому времени, как они будут усвоены, тогда постепенное улучшение будет более трудным. И регулирующие органы [23] и промышленность [18] заинтересованы в анализе неудач, но ему уделяется меньше внимания, чем можно было бы ожидать, учитывая доминирующую роль неудач в затратах на НИОКР.
Вторичные симптомы
Четыре предложенные основные причины закона Эрума, рассмотренные выше, привели к возникновению нескольких «симптомов», которые имеют тенденцию к дальнейшему увеличению затрат, особенно затрат на клиническую разработку. Некоторые из этих симптомов рассмотрены ниже.
Проблема узости клинического поиска
Проблема узости клинического поиска заключается в переходе от подхода, в котором широко рассматривался терапевтический потенциал биологически активных агентов, к подходу, который ищет точные эффекты от молекул, разработанных с учетом единственной лекарственной мишени. В 1950-х и 1960-х гг. первоначальный скрининг обычно проводился на животных, а не in vitro или in silico, и лекарства-кандидаты на ранних стадиях процесса разработки предоставлялись ряду врачей. Открытие в некоторой степени задействовало способность врачей выявлять закономерности посредством тщательного клинического наблюдения, особенно в терапевтических областях, в которых легко наблюдаются улучшения симптоматики, таких как психиатрия [36, 49–51]. Иногда такой подход отвергают как полагающийся на счастливую случайность, но он делает возможным обнаружение новых терапевтических эффектов. Даже в последнее время оказывается, что многие — возможно, большинство — новых терапевтических средств были открыты мотивированными и наблюдательными клиницистами, работающими с пациентами в реальном мире [72]. Некоторые фармацевтические компании, особенно мелкие и средние, осознают эту возможность и активно перепозиционируют существующие препараты.
Однако проблема «осторожного регулятора» и предубеждение «фундаментальные исследования — грубая сила» подтолкнули большую часть фармацевтической промышленности к узкой стратегии клинического поиска. Если лекарство оказывает эффект, и не тот эффект, на который рассчитывали разработчики исследования, то испытание терпит неудачу. Возможности для интуитивных прозрений активно разрабатываются вне системы. Возможно, слишком рискованно позволять умным врачам с большим количеством пациентов проводить широкие клинические наблюдения или позволять творческим ученым рыться в богатых наборах клинических данных на случай, если они обнаружат что-то неожиданное, что нужно будет объяснить осторожному регулятору, который затем закрывает проект. Современные многоцентровые исследования, как правило, распределяют пациентов настолько малыми группами, что врач, который действительно хочет найти закономерности, может их не заметить. В испытаниях фазы II, которые, возможно, представляют собой наилучшую возможность узнать что-то новое, среднее число пациентов на многоцентровый исследовательский центр сейчас очень невелико: от пяти до десяти пациентов в исследованиях онкологии, патологий центральной нервной системы и респираторных заболеваний [73].
Проблема крупных клинических испытаний
Первое рандомизированное контролируемое исследование, опубликованное в 1948 г., включало 109 пациентов и рандомизировало 107 из них [74]. В период с 1987 по 2001 гг. количество пациентов, принимавших участие в базовом исследовании антигипертензивных препаратов, выросло примерно с 200 до примерно 450 [75]. Между 1993 и 2006 гг. среднее число пациентов в основных исследованиях нового перорального противодиабетического препарата увеличилось примерно с 900 до более 4000 [76]. В первом базовом исследовании симвастатина (препарата, снижающего уровень холестерина) компании Merck, опубликованном в 1994 г., приняли участие около 4400 пациентов [77]. В ключевом испытании анацетрапиба компании Merck, исследовательского препарата, модулирующего уровень холестерина, который предполагается использовать в дополнение к таким препаратам, как симвастатин, в настоящее время принимают участие около 30 000 пациентов.
Такое расширение является следствием нескольких факторов. Во-первых, проблема «лучше, чем "Битлз"» увеличивает размер клинических испытаний. При прочих равных условиях размер клинического испытания должен быть обратно пропорционален квадрату величины эффекта. Если величина эффекта уменьшится вдвое, чтобы сохранить ту же статистическую мощность, в исследование должно быть включено в четыре раза больше пациентов. Проблема в том, что терапевтические эффекты в дополнение к уже эффективному лечению обычно меньше, чем терапевтические эффекты по сравнению с плацебо. Кроме того, испытания фазы III превратились в беспорядочную смесь науки, регулирования, связей с общественностью и маркетинга. Попытка преодолеть эти множественные ограничения приводит к повышению их размера и стоимости.
Лучшим клиническим испытанием для демонстрации эффективности было бы относительно небольшое исследование на однородной выборке пациентов, набранных из как можно меньшего числа центров — медицинский эквивалент хорошо контролируемого эксперимента. Но это, как правило, вызывает беспокойство у осторожного регулятора, учитывая разнообразие моделей практики и пациентов. А как насчет редких побочных эффектов (FDA недавно потребовало постмаркетинговых испытаний бронходилататоров длительного действия примерно на 53 000 пациентах)? Небольшие испытания также плохо способствуют маркетингу и имеют плохой доступ к рынку в мире доказательной медицины. Лучше привлечь старших врачей крупных центров. За последнее десятилетие число главных исследователей каждого препарата в клинических испытаниях удвоилось [73]. Следствием этого являются многоцентровые исследования, которые добавляют шум и неоднородность и, следовательно, являются более масштабными и дорогими.
Проблема множественности клинических испытаний
Проблема «лучше, чем "Битлз"» усложнила медицинскую практику. В некоторых областях, где когда-то существовали только один или два варианта лечения, теперь существует богатый бэк-каталог. Например, при лечении пациентов с диабетом второго типа весь выбор был между инсулином или диетой и физическими упражнениями, но теперь терапия может включать комбинацию препаратов примерно из десяти различных классов: бигуаниды, тиазолидиндионы, сульфонилмочевины, меглитиниды, ингибиторы альфа-глюкозидазы, ингибиторы дипептидилпептидазы 4, аналоги глюкагоноподобного пептида 1, аналоги амилина, аналоги инсулина длительного и короткого действия, а также различные человеческие инсулины и смеси инсулинов. Лечение пациентов с раком толстой кишки когда-то было состояло в выборе между хирургической резекцией или паллиативной помощью, но теперь рекомендации по терапии рака толстой кишки Национальной комплексной онкологической сети содержат до 100 страниц подробных алгоритмов лечения.
Осторожный регулирующий орган не склонен допускать, что безопасность и эффективность новых лекарств могут быть распространены на такие разнородные и фрагментированные группы пациентов. Чувствительные к затратам спонсоры здравоохранения также проявляют осторожность. Это означает более узкие показания и большее количество клинических испытаний для каждого препарата. Первый аналог инсулина длительного действия — гларгин — был одобрен FDA в 1999 г. после трех основных испытаний фазы III. Новейший аналог инсулина пролонгированного действия — деглудек — был подан на одобрение регулирующих органов в 2011 году после 12 ключевых испытаний (и, как упоминалось выше, стопки документации величиной с Эмпайр Стейт Билдинг). Некоторые успешные препараты в сложных терапевтических областях требуют в течение своего жизненного цикла десятков испытаний фазы III [78].
Проблема длинного цикла
В 1950-х и 1960-х годах время цикла было удивительно коротким по современным стандартам. Регулирующие органы были не так осторожны, и перед проверкой агентов на эффективность на животных моделях и у пациентов было меньше молекулярного редукционизма. Это ускоряло инновации. Первый антидепрессант — имипрамин — был синтезирован около 1951 г. Почти сразу же он был проверен на крысах и лично протестирован несколькими учеными фармацевтической компании Geigy [51]. Затем его без особого успеха испытали на различных группах пациентов в 1952 г., снова испытали в 1953 г., в 1954 г. было обнаружено, что он вызывает проблемы у пациентов с психозом, и еще раз испытали в 1955 г., прежде чем в 1956 г. он был определен как антидепрессант. Он завершил доклиническую разработку и имел не один, а три клинических цикла в течение пяти или шести лет. В 2005–2006 гг. типичный период клинической разработки нового препарата составлял более девяти лет [21]. Наибольшее увеличение времени разработки произошло между 1960-ми и 1980-ми гг [21].
Идея: ГДМЛ
Эта статья призвана побудить к дальнейшему анализу сил, противодействовавших научным, техническим и управленческим усовершенствованиям за последние 60 лет. Авторы избегали темы лечения отчасти потому, что соотношение опубликованных терапевтических методик к диагнозам уже слишком велико. Однако у авторов есть одна идея, которую также можно рассматривать как мысленный эксперимент.
Авторы предлагают всем крупным фармацевтическим компаниям ввести новую должность на уровне совета директоров, которую они назвали Главным директором по мертвым лекарствам (ГДМЛ). Его функция будет сосредоточена на неудачах лекарств на всех этапах НИОКР, и у ГДМЛ будет фиксированное время — например, 18 месяцев — с момента назначения для составления подробного отчета, целью которого станет объяснение причин закона Эрума. Отчет будет представлен совету директоров компании, включен в годовой отчет компании перед акционерами, а также представлен для публикации в научном журнале и отправлен в такие организации, как FDA и Национальные институты здравоохранения США. Вознаграждение за эту работу будет структурировано таким образом, чтобы обеспечить сильный стимул для предоставления точного прогноза будущей производительности НИОКР компании и отрасли в целом. Например, возможно, зарплата может быть относительно скромной, но ГДМЛ может иметь право на огромную премию, если их прогнозы по истечении десятилетнего периода будут не более чем на 10% слишком оптимистичными или не более чем на 30% слишком пессимистичными.
Эта идея, по словам авторов, нравится им по нескольким причинам. Во-первых, у ГДМЛ нет стимула к иррациональному оптимизму. Во-вторых, в затратах на НИОКР преобладает цена неудачи [73]. Большинство молекул терпят неудачу. Большинство ученых-исследователей тратят большую часть своего времени на продукты, которые терпят неудачу. Кажется уместным, что кто-то из членов правления должен сосредоточиться на продуктах, которые потребляют большую часть времени, энергии и денег организации, занимающейся исследованиями и разработками. В-третьих, экспертиза лекарственной неудачи должна квалифицировать ГДМЛ для хорошего объяснения закона Эрума.
Отчет ГДМЛ должен быть направлен на объяснение масштабов изменения производительности. В нем должны быть указаны и ранжированы по степени важности основные факторы, ответственные за ее прогрессирующее снижение. Следует учитывать то, как относительная важность этих факторов менялась с течением времени. Возможно, изменения в FDA преобладали с 1960 по 1970 год, но сейчас доминирует что-то другое? Анализ должен сравнивать различные терапевтические области и оценивать, в какой степени можно влиять на те или иные факторы. Нужно предприняты определенные усилия для количественной оценки проблем «лучше, чем "Битлз"» и «низко висящих фруктов», а также потенциальной ценности не полностью используемых лекарственных мишеней. Следует обратить внимание на регулирующие механизмы. Какие требования будут наиболее дорогостоящими и наименее ценными? От каких требований можно убедить отказаться регулирующий орган? Какая доля затрат на НИОКР является прямым следствием тенденции «бросать деньги»? В каких терапевтических областях молекулярный редукционизм и методы скрининга грубой силы лишь отвлекают внимание, а в каких они действительно полезны? Чем объясняется различие между этими терапевтическими направлениями? Возможно, ГДМЛ мог бы провести их количественный анализ с помощью серии диаграмм Венна, подобных тем, что показаны на рис. 3, чтобы определить, какие множества и пересечения выросли и насколько, а какие — сократились. Также следует попытаться измерить достоверность предыдущих диагностических и прогнозирующих мероприятий. Насколько точны внутренние прогнозы одобрения лекарств и их коммерческого успеха? Изменилось ли это со временем? Каковы были наиболее распространенные виды ошибок?
Если ГДМЛ дает хорошее объяснение, согласующееся с идеей о том, что противодействующие силы ослабнут или будут преодолены, тогда все в порядке. Если объяснение неубедительно или указывает на силы, которые кажутся непреодолимыми, то проблемы очевидны. По крайней мере, это продвинет обсуждение того, как сбалансировать права собственности акционеров и финансовую ответственность советов директоров компаний с более широкими преимуществами безопасных, эффективных и доступных новых лекарств.
Прогноз для закона Эрума
Подобно тому, как авторы обзора избегали обсуждений методов лечения, они не хотят слишком много говорить и о прогнозе для закона Эрума. Однако совсем ничего не говорить показалось бы странным.
Несмотря на устойчивость тенденции на рис. 1, было бы удивительным, если бы закон Эрума сохранялся на отраслевом уровне в течение следующих 5–7 лет. Точка зрения авторов вытекает из двух в определенном роде механических факторов и еще одной интересной причины.
Если говорить о первом из механических факторов, то объем затрат на НИОКР не будет увеличиваться. Большинство компаний с разной степенью интенсивности борются с тенденцией «бросать деньги». Вторым механическим фактором служит обременительный путь одобрения биосимиляров, возникающий в Соединенных Штатах. Каждый аспект процесса производства биосимиляра может быть тщательно изучен юристами производителя, и это повышает вероятность бесконечных блокирующих судебных разбирательств. Следовательно, разработчики биосимиляров рассчитывают, что по крайней мере некоторые из этих продуктов будут одобрены с помощью стандартного процесса утверждения новых биологических препаратов (процесс подачи заявки на получение лицензии на биопрепараты [BLA] FDA). Эти продукты будут одобрены подобно новым агентам, поэтому они будут увеличивать количество новых разрешений при очень низких затратах на исследования и разработки.
Говоря об вышеупомянутой интересной причине, авторы подозревают, что отношение сигнал/шум может улучшаться среди соединений, разрабатываемых для онкологических показаний. Похожая ситуация возможна еще для одной-двух терапевтических областей. Возможно, намеки на это есть в одобрении новых лекарств FDA в 2011 году. Всего их было 30, больше всего с 2004 года, хотя Munos [24] показал, что распределение новых лекарств, одобренных FDA за год, напоминает результат пуассоновского процесса, поэтому авторы обзора не хотят переоценивать значение одного удачного года (если бы новые утверждения лекарств следовали пуассоновскому процессу со средним числом 26 с 1980 по 2010 год, можно было бы ожидать, что 30 лекарств будут одобряться случайным образом примерно раз в пять лет). При более подробном рассмотрении природы 30 новых препаратов восемь были противоопухолевыми средствами (брентуксимаб ведотин, вандетаниб, кризотиниб, ипилимумаб, аспарагиназа, вемурафениб, руксолитиниб и абиратерона ацетат). В итоговых показателях за 2011 г. также просматривается акцент на редких и плохо поддающихся лечению заболеваниях; 11 из 30 новых препаратов были орфанными препаратами, а орфанные препараты включали семь из восьми новых противоопухолевых средств. Орфанные препараты менее подвержены многим факторам, описанным выше, в том числе проблеме «лучше, чем "Битлз"», проблеме «осторожного регулятора» и проблеме крупных клинических испытаний.
Неизменные или снижающиеся затраты на НИОКР, а также болюсное введение онкологических препаратов, увеличение количества орфанных препаратов и BLA биосимиляров могут положить конец закону Эрума на отраслевом уровне. Улучшит ли это ситуацию в достаточной степени, чтобы обеспечить достойную финансовую отдачу от инвестиций отрасли в НИОКР, — это другой вопрос. Финансовые рынки так не думают, а руководители отрасли — да. Было бы интересно узнать, что думают ГДМЛ.
