Циркадные ритмы иммунной системы

Активность иммунной системы крайне разнится в течение дня. Первые исследования по выявлению зависимости иммунных реакций от циркадных ритмов появились в 1960-е годы. Тем не менее только в последнее десятилетие появились свидетельства о том, какие молекулярные факторы управляют этими иммунными ритмами. Эти работы приоткрывают завесу сложной картины взаимосвязанности иммунной системы и ритмичности работы ее клеток с микроокружением. В данной работе авторы предоставляют общий обзор циркадности работы иммунной системы, сосредотачиваясь на недавних открытиях быстро развивающейся ветви медицинской науки — циркадной иммунологии.
ВСТУПЛЕНИЕ
Работа биологических часов основана на повторяющихся сигналах окружающей среды, таких как длина светового дня и приемы пищи. Для подавляющего большинства физиологических процессов, очередность ритмов составляет примерно 24 часа. Эти биологические циклы служат хорошей поддержкой организма перед регулярными повторяющимся событиями в окружающей среде. Иммунная система — не исключение. Ее активность строго регулируется циркадными ритмами все 24 часа как в состоянии относительного покоя, так и в период активности.
Впервые работа биоритмов иммунитета была обнаружена на примере врожденной иммунной системы в 1960 году [1]. Десять лет спустя ученые выявили зависимость от времени суток и компонентов адаптивного иммунитета [2]. Теперь по прошествии более полувека нам известно, что насыщенность клетками иммунитета, их миграция и функции регулируются циркадными ритмами. Количество циркулирующих лейкоцитов в крови млекопитающих колеблется, достигая максимума во время фазы покоя (поведенческий отдых) у ночных мышей (днем) [3] и у людей, ведущих дневной образ жизни (ночью) (см. информационный бокс 1) [4]. Также биологические часы обусловливают миграцию лейкоцитов по всему телу, контролируя их количество в определенных областях тела в течение дня [3, 5–7]. Кроме того, от времени суток зависят эффекторные функции лейкоцитов, а также способность активированных иммунных клеток пролиферировать и вырабатывать цитокины [8–11]. Весьма вероятно, что эти биоритмы иммунной системы развились для предотвращения перегрузок от возникающих дневных пиков после контактов с патогенами. Например, такое может возникать вследствие повышения социального взаимодействия или приемов пищи [12], что наблюдается преимущественно в период поведенческой активности.
Хотя практически все виды обладают способностью «распознавать» повторяющиеся с регулярной очередностью явления окружающей среды и адаптироваться к ним, молекулярные основы поддержания циркадных ритмов, а также сам их порядок у разных организмов различаются [13, 14]. У млекопитающих основой работы циркадных ритмов являются тесно взаимосвязанные факторы транскрипции, формирующие несколько петель обратной связи «транскрипция-трансляция», благодаря которым происходят взаимные активация и ингибирование, что и управляет 24-часовыми ритмами на молекулярном уровне [15]. Эту сеть часто называют главными биологическими часами, и она состоит из факторов транскрипции BMAL1 [т.н. «подобных ядерному транслокатору арилуглеводородных рецепторов мозга и мышц» (ARNT) 1; кодируется геном Arntl], CLOCK (“clock”-мутанты), PER1/2/3 (гомологи циркадных белков) и CRY1/2 (криптохромы 1/2) [15, 16]. Если рассматривать устройства белков, BMAL1 и CLOCK формируют гетеродимерный транскрипционный фактор, который связывается с энхансерными (Е)-областями генов-мишеней, в том числе в локусе генов отрицательных регуляторов Per1/2/3 и Cry1/2, индуцируя их экспрессию [15]. Экспрессированные PER и CRY также образуют гетеродимерный комплекс факторов транскрипции, который ингибирует экспрессию BMAL1 и CLOCK до тех пор, пока концентрации репрессоров не станут достаточно низкими, чтобы перезапустить цикл [15-17]. Кроме того, ядерный рецептор REV-ERB α/β [ядерные рецепторы из подсемейства 1 группы D (NR1D); кодируется геном Nr1d1/2], и «рецепторы-сироты», связанные с рецептором ретиноевой кислоты, составляют петлю обратной связи второго уровня, которая стабилизирует главные молекулярные часы [15, 16]. Однако важно отметить, что циркадные ритмы могут возникать и в безъядерных клетках, где ритмы управляются колебаниями окисления белков пероксиредоксина [18].
Большинство исследований, посвященных циркадным колебаниям иммунной системы, сосредоточены на роли BMAL1, потому что это единственный ген, чье отсутствие нарушает всю ритмичность работы биологических часов [17]. Исследования, в которых экспериментально нарушалась работа молекулярных часов за счет удаления BMAL1, будут отличаться по исходам от тех, где нарушался общий механизм работы часов. Результаты последних должны подтверждаться наличием мутаций в других звеньях молекулярного механизма часов (когда это возможно).
Отсутствие различных компонентов часов, как например, гена Bmal1 или же двойной нокаут генов Cry1 и Cry2 или Per1 и Per2, связано с разными измененными фенотипами при воспалении, что указывает на критически важную роль циркадных ритмов в правильном функционировании иммунной системы млекопитающих [16]. В этом обзоре авторы рассуждают, как циркадная регуляция клеточного состава лейкоцитарной формулы, их миграция и эффекторная активность влияют на функцию иммунной системы.

ВРОЖДЕННЫЙ ИММУНИТЕТ
Реакции на бактерий и их компоненты
Липополисахариды (ЛПС) входят в состав внешней мембраны грамотрицательных бактерий. ЛПС связываются с Toll-подобным рецептором 4 (TLR4) и инициируют воспалительный сигнальный каскад реакций. Такова суть наиболее известной модели воспаления, подходящей для определения циркадных ритмов в случае развития врожденных иммунных реакций. Впервые эта модель была продемонстрирована в 1960-х годах на мышах: у животных, которым вводили липополисахарид вечером, смертность была заметно выше, чем у тех, которым вводили пробу утром (см.информационный бокс 2) [1]. Несколько лет спустя в ходе экспериментов были получены аналогичные результаты, но уже с применением грамположительных Streptococcus pneumoniae [19, 20]. Большинство генов, вовлеченных в индуцируемый ЛПС сигнальный каскад реакций, экспрессируются с определенной ритмичностью в перитонеальных макрофагах (находящихся в стационарном состоянии). Спленоциты демонстрируют ритмичность в процессе выработки фактора некроза опухоли (TNF-α) и интерлейкина-6 (IL-6) после инфицирования ЛПС [21]. У мышей, которым вводили ЛПС, в момент ZT11 [от англ. Zeitgeber time — дословно «задающий ритм»; т. е. время (в часах) после включения света в эксперименте в условиях 12-часового светового «дня»; соответственно, «вечер и ночь» (LD) также длятся 12 часов ] выявлялись значительно более высокие концентрации ФНО-α в сыворотке, а также у таких животных была повышенная летальность, чем у тех, кому вводили ЛПС в ZT19 (т.е., «ночью») (см. информационный бокс 1) [22]. У мышей с дефицитом рецептора ФНО 1 (TNFR1) не было выявлено различий по уровню смертности в зависимости от времени суток. Это указывает на то, что наблюдаемые временные различия зависят от ФНО-α [22]. Согласно этим данным, врожденный иммунный ответ на ЛПС контролируется циркадными ритмами.
Нарушение циркадного ритма у мышей влияет на иммунный ответ при введении ЛПС. У мышей были рассинхронизированные биологические ритмы — это произошло из-за переключения их с обычного 24-часового (12:12 часов LD) цикла на более короткий 20-часовой (10:10 часов LD) цикл. Исследователям удалось выявить задержку в восстановлении локомоции, а также снижение массы тела после введения ЛПС по сравнению с мышами без нарушений [23]. Кроме того, мыши, переведенные с 12:12-часового режима LD в условия постоянной темноты (DD; см. информационный бокс 1), были восприимчивы к ЛПС в три раза сильнее, по сравнению с мышами, содержащимися в условиях ритмично сменяющихся светового дня и ночи [24]. В периферической крови мышей, которым был введен ЛПС и которые содержались в условиях LD, наблюдалось колебание концентраций таких цитокинов, как ФНО-α, моноцитарный хемоаттрактантный белок-1 (MCP-1), ИЛ-18 и ИЛ-10. Эти колебания напрямую коррелировали со временем. Однако при изменении условий содержания животных на DD, фаза этих колебаний изменялась [24]. Интересно, что эти колебания и различия в выживаемости нельзя полностью устранить у мышей генетических линий Lyz2cre:Bmal1flox или Lyz2cre:Clockflox [24]. Их организм характеризуется прицельным влиянием на циркадные ритмы у миелоидных клеток (в основном гранулоцитов и некоторых субпопуляций макрофагов и моноцитов [25]). Таким образом, продолжительность светового дня может оказывать противовоспалительное влияние на развитие реакции при введении ЛПС у мышей, а ритмичность этого явления, по крайней мере, частично не зависит от миелоидных клеток.
В недавнем исследовании был изучен циркадный транскриптом в иммунокомпетентных клетках легких мышей с помощью полногеномного скрининга. Согласно нему, в середине дня усиливалась экспрессия генов, связанных с поддержанием иммунной функции в состоянии относительного покоя [26]. Однако при введении ЛПС вечером было достигнуто перепрограммирование экспрессии генов, что демонстрирует переход к новому комплексу генов и иммунологических процессов. Кроме того, введение ЛПС сократило среднюю продолжительность циркадного ритма в иммунокомпетентных клетках легких с 24 часов (состояние покоя) до 19,6 часов. Проточная цитометрия показала колебания количества В-клеток и миелоидных клеток Gr1+ в легких мышей, не подвергавшихся введению ЛПС, с достижением пика утром и минимума вечером [26]. Состояние покоя альвеолярных макрофагов сопровождалось ритмом с меньшей амплитудой, достигающим пика, наоборот, в вечернее время. Напротив, у животных, которым вводили ЛПС, наблюдалось снижение амплитуды колебаний количества В-клеток. При этом количество миелопероксидазо-положительных (МПО+) гранулоцитов характеризовалось циркадианными колебаниями [26]. Эти данные говорят о сильном взаимодействии между ритмической средой и последующими иммунными реакциями.

У мышей с дефицитом гена Bmal1 во всем организме, суточные колебания числа гранулоцитов в легких после введения ЛПС полностью прекращаются [26]. Однако до сих пор неясно, каким типам клеток необходима экспрессия гена Bmal1 для индукции подобной ритмичной реакции гранулоцитов. У мышей с субпопуляциями миелоидных клеток с дефицитом гена Bmal1 (генетические линии мышей Lyz2cre:Bmal1flox) по-прежнему отмечались ритмичные реакции на введение ЛПС в ткань легких [27], что свидетельствовало о независимом от клеток миелоидного ряда механизме (аналогично наблюдению выше [24]). Но устранение экспрессии BMAL1 в эпителиоцитах бронхиол (по технологии Ccspcre:Bmal1flox) снижало суточную секрецию хемокинового лиганда 5 с мотивом C-X-C (CXCL5) в ответ на введение ЛПС [27]. Эпителиоцитам бронхиол необходима экспрессия BMAL1, чтобы реагировать на изменение концентраций глюкокортикоидов (ГК) (подробнее см. ниже), а ритмичная выработка ими CXCL5 зависит от экспрессии ГК-рецептора (ГКР) в самой клетке [28]. Тем не менее удаление ГКР из эпителия дыхательных путей не приводило к исчезновению циркадных колебаний в мобилизации гранулоцитов или ритмической экспрессии ФНО-α и ИЛ-6 в легких после введения ЛПС [28]. Таким образом, хотя экспрессии BMAL1 и ГКР в самих эпителиальных клетках бронхиол достаточно, чтобы объяснить колебание синтеза CXCL5, это не пусковой фактор циркадного контроля нейтрофильной инфильтрации в ответ на введение ЛПС. А значит, в процесс вовлечены и другие циркадные механизмы.
Помимо BMAL1 и CLOCK, транскрипционный фактор REV-ERB (еще один компонент системы биологических часов) также задействован в контроле воспаления легочной ткани в ответ на ЛПС [29]. Хотя у мышей дикого типа больше повышена инфильтрация легких нейтрофилами утром (ZT0), чем вечером (ZT12), такая ритмичность отсутствует у животных с дефицитом REV-ERB. В экспериментах с костным мозгом химерных мышей было показано, что это явление обусловлено экспрессией REV-ERB в иммунных клетках. У мышей дикого типа, после пересадки им костного мозга, в клетках которого отсутствовал REV-ERВ, отличия в нейтрофильной инфильтрации в зависимости от времени суток исчезали. Тогда как мыши с достаточным уровнем REV-ERB сохраняли ритмичность нейтрофильной инфильтрации после введения ЛПС. Таким образом, основываясь на этих данных, лейкоцитарный REV-ERB является одним из факторов контроля ритмичной инфильтрации нейтрофилов в легких после введения ЛПС.
Макрофаги и моноциты
На сегодняшний день из всех иммунокомпетентных клеток наиболее изучены циркадные ритмы макрофагов и моноцитов (табл. 1). На примере инфекции S. pneumoniae удалось показать, что фагоцитарная активность макрофагов регулируется BMAL1 [30]. Делеция гена Bmal1 у мышей генетических линий Lyz2cre:Bmal1flox и Cx3cr1cre:Bmal1flox приводит к сильному протективному эффекту, что защищает животных от тяжелой бактериемии и потери массы тела. Дальнейшие эксперименты in vivo и ex vivo определили усиление фагоцитарной функции макрофагов с дефицитом Bmal1, поскольку делеция этого гена в них изменяет организацию актинового цитоскелета и усиливает общую антибактериальную функцию [30]. Исходя из этих данных можно предположить, что BMAL1 является мощным регулятором морфологии и подвижности макрофагов.
Дополнительным ключевым элементом, влияющим на воспалительный статус макрофагов, является циркадная регуляция клеточного метаболизма [31]. В недавнем исследовании было показано, что сигнализация посредством BMAL1 регулирует метаболизм митохондрий в макрофагах M1 при стимуляции их интерфероном (IFN-) и ЛПС [32]. У макрофагов с дефицитом Bmal1 было резко снижено потребление кислорода; с другой стороны, опосредованная сукцинатдегидрогеназой выработка активных форм кислорода усиливалась по сравнению с контрольными клетками. То есть BMAL1 улучшает функцию митохондрий. На механическом уровне эти эффекты могут быть опосредованы посттранскрипционной регуляцией метаболизма [33]. Всестороннее изучение транскриптома и протеома макрофагов из костного мозга (BMDM — от англ. bone marrow–derived macrophages) показало, что только у 15 % т.н. «осциллирующего протеома» в основе лежит осциллирующая мРНК (осциллирующие гены — это гены, чья экспрессия подвержена регулярным колебаниям или периодической цикличности — прим. перев.). Это указывает на то, что экспрессия большей части протеома подвержена колебаниям вследствие посттранскрипционной регуляции [33]. Дальнейший анализ показал, что белки, участвующие в процессах как распада других белков, так и трансляции (например, белки аминоацилирования тРНК и убиквитинлигаза) ритмично обогащаются, что может служить объяснением этому явлению. Помимо этого, белки, связанные с трикарбоновыми кислотами, и скорость потребления кислорода имеют циркадные колебания, что приводит к ритмичности синтеза аденозинтрифосфата [33]. Вместе эти данные показывают, что ген биологических часов Bmal1 может регулировать метаболическую функцию макрофагов.
Цель недавних исследований заключалась в выявлении взаимосвязей между компонентами биологических часов, в частности, REV-ERB, и каскадов реакций инфламмасомы [34–37]. В макрофагах мыши и человека криопирин NLRP3 (основной компонент инфламмасомы) экспрессируется в течение суток под контролем REV-ERB [35]. В мышиной модели фульминантного гепатита NLRP3 модулирует экспрессию и секрецию IL-1 и IL-18 в брюшине, что приводит изменяет тяжесть заболевания в зависимости от времени суток [38]. По результатам тестов иммунопреципитации хроматина (ИХр) удалось показать, что REV-ERB может непосредственно связываться с промоторной областью гена Nlrp3 в BMDM [35, 38]. Фармакологическая активация REV-ERB ингибировала инфламмасому NLRP3, что снижало тяжесть течения молниеносного гепатита [35, 38]. Кроме того, было показано, что REV-ERB подавляет функционирование оси ядерного фактора B (NF-B)/NLRP3, а у мышей с дефицитом REV-ERB активность инфламмасомы NLRP3 оказалась повышенной [38]. Вследствие повышенной активности инфламмасом, мыши оказались более чувствительными к экспериментальному колиту. Это говорит о критическом взаимодействии между циркадными ритмами и регуляцией активности инфламмасом. В этих исследованиях показана мощная противовоспалительная функция REV-ERB, помимо его роли в функционировании биологических часов.
В настоящее время REV-ERB используется в качестве точки воздействия в терапевтических исследованиях, благодаря своей противовоспалительной роли. В одной работе авторы показали, что агонист REV-ERB GSK4112 способен ингибировать экспрессию NLRP3 и снижать выработку IL-1 в модели воспаления, индуцированного введением ЛПС [34]. В другой авторы продемонстрировали, что управляемая NF-B длинная некодирующая РНК (lncRNA) — Lnc-UC — может усиливать экспрессию REV-ERB и по пути отрицательной обратной связи способна инактивировать NF-B и инфламмасому NLRP3 в макрофагах [39]. Кроме того, в более ранних исследованиях сообщалось, что REV-ERB может также регулировать экспрессию цитокина ИЛ-6 и хемокинового лиганда 2 с последовательностью CC (CCL2) в макрофагах [40, 41] и клетках микроглии [42]. Данные выше указывают на то, что REV-ERB является важным медиатором противовоспалительной функции в механизме биологических часов.
Что касается моноцитов, то на примере модели тиогликолят стерильного перитонита и после инфицирования Listeria monocytogenes авторы показали, что мобилизация воспалительных моноцитов Ly6Chigh в очаг воспаления характеризуется суточными колебаниями, регулируемыми внутренними биологическими часами миелоидных клеток [43]. Организм мышей, инфицированных этой бактерией в ZT8 («днем»), лучше контролировал распространение бактерий L. monocytogenes, чем организм, инфицированный в ZT0 («утром»), с повышенными уровнями цитокинов и хемокинов ИЛ-1, ФНО-α, IFN и CCL2. Мыши с популяциями миелоидных клеток с дефицитом Bmal1 (генетическая линия Lyz2cre:Bmal1flox) оказались более восприимчивы к L. monocytogenes. Это проявилось в снижении выживаемости и увеличении в плазме вышеупомянутых провоспалительных цитокинов и хемокинов [43]. Делеция Bmal1 приводила к нарушению суточных колебаний количества моноцитов Ly6Chigh в крови, селезенке и костном мозге, а также в брюшине. Кроме того, исследование ИХр показало, что гетеродимер BMAL1-CLOCK непосредственно связывается с Е-боксом гена Ccl2, контролируя его ритмическую экспрессию [43]. В данной работе авторы предоставляют доказательства решающей роли Bmal1 у воспалительных моноцитов. Таким образом, у макрофагов и моноцитов выявляется выраженный циркадный ритм, особенно относительно компонентов BMAL1 и REV-ERB, которые участвуют в контроле метаболизма, функции и продукции цитокинов этими клетками.
Нейтрофилы
Содержание нейтрофилов в крови колеблется в зависимости от времени суток, а их фенотип характеризуется суточными изменениями, связанными со старением. Оба феномена контролируются геном Bmal1, независимым от самих клеток образом, что показано на генетических линиях мышей hMRP8Cre: Bmal1flox, где изменениям подверглись именно нейтрофилы [44]. Тест ИХр демонстрирует, что BMAL1 может непосредственно связываться с E-box в промоторной области гена Cxcl2, который регулирует старение нейтрофилов посредством влияния на хемокиновый рецептор 2 с последовательностью CXCL2-CXC (CXCR2). CXCR4 же действует как антагонист старения, которое запускается посредством CXCR2, способствуя клиренсу нейтрофилов и защите сердечно-сосудистой системы [44]. Удивительно, но хотя нейтрофилы представляют лишь незначительную фракцию лейкоцитов в негемопоэтических тканях в условиях иммунологического покоя, существуют данные, что они являются важными регуляторами в нишах гемопоэтических стволовых клеток и способны изменять экспрессию генов молекулярных часов в различных органах [5, 45]. К примеру, было показано, что нейтрофилы способны инфильтрировать печень мышей в зависимости от времени суток, что изменяет биологические часы гепатоцитов из-за секреции нейтрофильной эластазы (НЭ) [46]. Численность нейтрофилов достигала пика в печени во время световой фазы дня, где эти клетки секретировали эластазу и активировали передачу сигналов c-Jun N-терминальной киназы (JNK) в гепатоцитах, в конечном итоге запуская экспрессию гена Bmal1. Интересно, что это явление может также происходить и в печени человека, поскольку в образцах пациентов наблюдалась сильная корреляция между активацией JNK, уровнями НЭ и экспрессией BMAL1 [46]. В других тканях нейтрофильная инфильтрация изменяет транскрипционный профиль всего органа [47]. К примеру, инфильтрация нейтрофилами кишечника подавляла экспрессию ИЛ-23 в гистиоцитах, тем самым снижая концентрацию гранулоцитарного колониестимулирующего фактора (G-CSF) в плазме крови [47]. Согласно результатам этих исследований, можно сделать вывод о сильном влиянии циркадных ритмов на нейтрофильные клетки. По-видимому, они играют более значительную роль в различных органах, чем предполагалось ранее, даже если их количество в этих тканях невелико.
Дендритные клетки
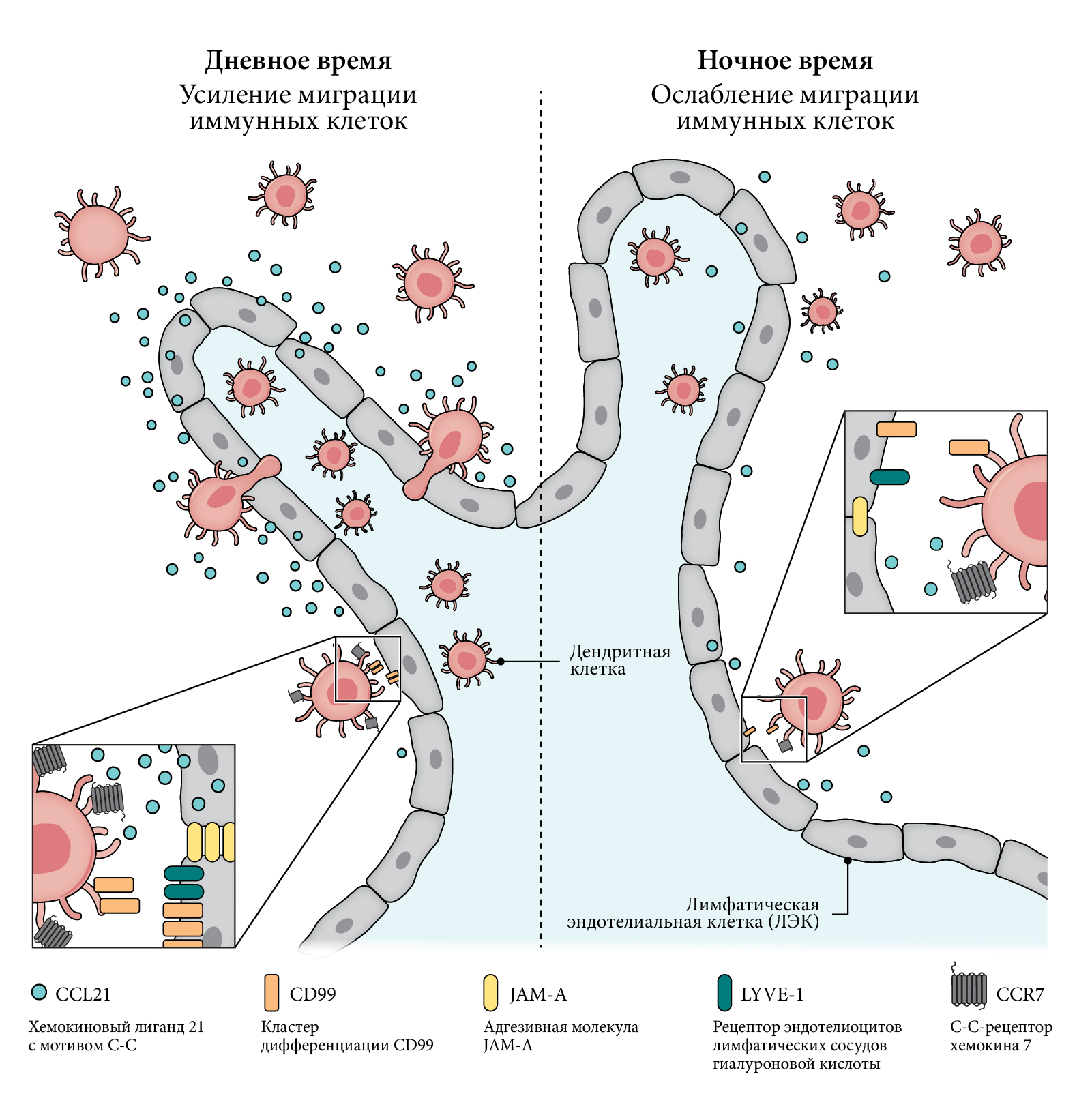
Дендритные клетки (ДК) являют собой фагоцитарные антигенпрезентирующие клетки (АПК), которые осуществляют непосредственную связь между врожденной иммунной системой и адаптивным иммунитетом, собирая антигены в отдаленных областях тела и презентируя их клеткам адаптивной иммунной системы в иммунных органах. Согласно результатам недавнего исследования, миграция ДК мышей в афферентные лимфатические сосуды кожи происходит ритмично, достигая пика в точке ZT7 («днем») и минимума в точке ZT19 (ночью) (рис. 1) [48]. Эта миграция обусловлена ежедневной экспрессией нескольких молекул адгезии на лимфатических эндотелиальных клетках (ЛЭК). Это CCL21, гиалуроновый рецептор 1 эндотелия лимфатических сосудов (LYVE-1), CD99 и соединительная молекула адгезии A (JAM-A), а также экспрессируемый ДК CCR7. Синхронизация дендритных клеток костного мозга (ДККМ) и специфическая для определенных генетических линий абляция функции BMAL1 в обычных ДК (для генетической линии Clec9acre:Bmal1flox), ЛЭК (Prox1creERT2:Bmal1flox) или эндотелиальных клетках (Cdh5creERT2:Bmal1flox) связана как с автономными от ДК, так и с циркадными ритмами ЛЭК (см. информационный бокс 1). Согласно результатам ИХр-исследования, BMAL1 напрямую контролирует экспрессию генов Ccl21 и Ccr7, а также молекулы адгезии Lyve1 [48]. В другом исследовании, где использовались ДККМ в качестве АПК, было продемонстрировано, что размножение антиген-специфических CD8 T-лимфоцитов зависит от времени суток и частично управляется внутренними биологическими часами ДК. Особенно это примечательно, учитывая, что делеция гена Bmal1 в ДККМ нарушает миграцию T-клеток в селезенку после адоптивного переноса [49]. В исследовании ex vivo с использованием REV-ERB– и REV-ERB-дефицитных ДККМ было показано, что исчезновение REV-ERB у ДККМ увеличивает экспрессию маркеров созревания CD86 и главного комплекса гистосовместимости II (MHCII), а также провоспалительных цитокинов, таких как ИЛ-1b, ИЛ-6 и ИЛ-12b [50]. И наоборот, специфичный относительно REV-ERB агонист SR9009 ингибировал экспрессию маркеров созревания и провоспалительных цитокинов в ДККМ. В соответствии с данными о макрофагах [34–37], REV-ERB ответственен за противовоспалительные реакции в ДК, т.е. это — фенотип, который, по-видимому, не зависит от роли этого ядерного рецептора в функционировании биологических часов. Таким образом, функции ДК носят циркадный характер и могут быть изменены путем воздействия на молекулярный механизм биологических часов.
АДАПТИВНЫЙ ИММУНИТЕТ
Учитывая более длительные временные рамки, в сравнении с врожденным иммунным ответом, удивительно, что адаптивный иммунитет также проявляет циркадную ритмичность даже спустя несколько недель после первоначального введения патогена [7, 16, 51–55]. Здесь авторы кратко излагают основные результаты и освещают самые последние новости в этой области.
Развитие лимфоцитов
По современным представлениям развитие Т-клеток в тимусе не зависит от циркадных ритмов, потому что Т-клетки с делецией гена Bmal1 не проявляют признаков нарушений в ходе развития в тимусе [56]. Кроме того, количество CD4+ T-хелперов 17 (TH17) в собственной пластинке слизистой кишечника (LP — lamina propria) у таких мышей не изменилось, свидетельствуя о том, что BMAL1 также не управляет дифференцировкой TH17 в кишечнике [56]. Однако несколько генов циркадного механизма участвуют или даже являются главными регуляторами дифференцировки TH17, как например, Nr1d1 и семейство транскрипционных факторов ROR (гены Rorc и Ror). На примере мышиных моделей было показано, что ядерный рецептор REV-ERB (кодируемый Nr1d1) способствует дифференцировке TH17. Это происходит путем ингибирования экспрессии ядерного фактора, регулируемого интерлейкином 3 (NFIL3), который сам по себе является репрессором RORt (кодируется Rorc) и регулятором дифференцировки TH17 (в положительную сторону) [57–63]. Ритмичность работы этих транскрипционных факторов модулирует дифференцировку TH17. Следовательно, развитию TH17 способствует фаза поведенческого покоя мышей из-за высокой активности NFIL3 во время активной фазы суток. Нарушение циркадных ритмов на примере смены часовых поясов привело к повышению титра клеток TH17 и сделало мышей более восприимчивыми к экспериментальному колиту, вызванному введением декстрансульфата натрия (DSS) [57]. У мышей с мутацией Clock количество клеток TH1 в кишечнике также оказалось сниженным. Это позволяет предположить, что циркадные ритмы играют роль в дифференцировке клеток TH1 в кишечнике, помимо TH17 [57]. Поскольку эти транскрипционные факторы, опосредующие дифференцировку периферических Т-клеток, также являются генами биологических часов, циркадные ритмы могут влиять на тонкую настройку фенотипов Т-клеток в периферических областях организма. Тем не менее необходимы новые исследования для оценки потенциальных, зависящих от времени суток ролей RORt и ROR в стабилизации фиксации TH17. Важно выяснить, влияет ли крайне специфическое для Т-клеток удаление гена BMAL1 на возможность дифференцировки TH17 в контексте циркадных ритмов.
В отличие от Т-клеток, дифференцировка В-клеток зависит от механизма молекулярных часов. У мышей с полным дефицитом продукта гена BMAL1 наблюдается частичная блокада развития В-клеток, о чем свидетельствует значительно сниженный процент зрелых В-клеток фенотипа B220high и значительно повышенный процент клеток с фенотипом B220low от общего числа клеток костного мозга [64]. В экспериментах по адоптивному переносу этот эффект был показан как неавтономный для В-клеток и затрагивающий компартмент стромальных клеток костного мозга [64]. Это согласуется с данными о мышах с B-клеточной делецией гена BMAL1, у которых выявлено нормальное развитие и функция В-клеток [56]. Напротив, при сочетанном дефицитом генов Cry1 и Cry2 (подавляющие BMAL1 компоненты механизма биологических часов), обнаруживаются повышенные титры иммуноглобулина G (IgG) в сыворотке, усиленное фосфорилирование проксимального сигнального пути рецептора В-клеток, а также общий аутоиммунный фенотип [65]. Эти результаты указывают на независимую от взаимовлияния различных клеток роль циркадных ритмов в развитии и дифференцировке В-клеток.
Миграция лимфоцитов
Циркадные ритмы регулируют ритмичное перемещение лимфоцитов между кровью, лимфой (титр этих клеток в обеих средах достигает максимума во время поведенческой фазы покоя) и тканей (максимальный титр в начале фазы активности) [3, 66–71]. К настоящему времени было выявлено три механизма, объясняющих эти миграционные паттерны в течение суток, которые совместно определяют общий фенотип: активность BMAL1 как в лимфоцитах, так и в эндотелиальных клетках [3, 66], активность симпатического звена нервной системы, которая запускается благодаря адренорецепторам 2 типа (AR) и глюкокортикоидным (GC) рецепторам [69-70]. Последние два механизма описаны в следующем разделе.
BMAL1 контролирует миграцию лимфоцитов посредством внутриклеточного и внеклеточного пути. Присущая клеткам экспрессия BMAL1 в Т-клетках и В-клетках регулирует ритмическое изменение содержания клеток в лимфатических узлах (ЛУ), контролируя циркадные колебания экспрессии CCR7 (фактора хоминга ЛУ) и фактора выхода S1pr1 в лимфоцитах [66]. Экспрессия BMAL1 в эндотелиоцитах необходима для циркадной экспрессии белка межклеточных молекул адгезии-1 (ICAM-1) и молекул адгезии сосудистых клеток-1 (VCAM-1) в эндотелиальных клетках, которые управляют ритмичным хомингом лимфоцитов в ткани [3, 66, 72]. Без колебаний экспрессии этих рецепторов адгезии ритмическая мобилизация лимфоцитов в ткани прекращается [3, 66, 72]. Таким образом, BMAL1 как с внешней (посредством влияния на эндотелиальные клетки), так и с внутренней сторон процесса необходим для нормальной циркуляции лимфоцитов между кровью, лимфой и тканями.
Эффекторные функции
Адаптивные иммунные клетки также демонстрируют ритмические эффекторные функции. Т-клетки пролиферируют с зависимостью от биологических часов [10] и продуцируют IFN после стимуляции in vitro, которая тоже характеризуется колебаниями [11]. Кроме того, в нескольких исследованиях показано, что наиболее сильный адаптивный иммунный ответ возникает, если иммунокомпетентные клетки встречают антиген в коже при пиковых значениях клеточности лимфоузлов, что у мышей происходит в предвечернее-вечернее время [66, 69, 70, 73, 74]. Напротив, у мышей, внутривенно иммунизированных ДК, нагруженными овальбумином (OVA), вырабатывалось больше OVA-специфических Т-клеток в селезенке, в случае вакцинации в дневное время (ZT6) по сравнению с вакцинацией ночью (ZT18) [10]. У мышей, в течение дня вакцинированных ДК, нагруженными OVA, через 7 дней после вакцинации процент OVA-специфических эффекторных Т-клеток, продуцирующих IFN, в селезенке оказался значительно выше по сравнению с вакцинацией ночью (CT18) [49]. У этих грызунов также выявилась значительно более низкая бактериальная нагрузка при заражении летальной дозой L. monocytogenes через 7 дней после вакцинации ДК-OVA [49], что подтверждает предыдущие наблюдения. В тех случаях у мышей, инфицированных L. monocytogenes в течение дня (ZT2), наблюдалось усиление выработки ИЛ-2 по сравнению с экспериментальным заражением ночью (ZT14) [56]. Обобщая, можно предположить, что, хотя в развитии адаптивных иммунных реакций наблюдается явная ритмичность, причиной временных сдвигов пикового времени реагирования иммунитета может быть различное время иммунизации.
Колебания Т-клеточного ответа на антигенную стимуляцию обусловлены, по крайней мере, частично, ритмическими изменениями реакции наивных Т-клеток на стимуляцию в течение циркадного цикла. Различия по времени в развитии Т-клеточного ответа на вакцинацию коррелируют с колебаниями экспрессии мРНК регуляторов сигнального пути Т-клеточного рецептора (TCR) [49]. Титры положительных регуляторов активации Т-клеток (ZAP70, AKT и фосфолипаза C-) достигали пика в течение дня, когда введение ДК-OVA, приводило к выраженным реакциям Т-клеток. Напротив, отрицательные регуляторы передачи сигналов TCR (SHP1 — малый гетеродимерный партнер 1), CSK (С-концевая Src-киназа), PTEN-фосфатаза и гомолог тензина) достигают пика ночью [49]. Это говорит о том, что наивные Т-клетки способны реагировать на антигены в зависимости от времени суток и наряду с миграцией и функцией ДК (которые ритмичны) ответственны за колебания реакций на введение иммуногена.
В-клетки демонстрируют ритмичность эффекторных реакций с помощью экспрессии внутриклеточного белка TLR9, управляемой биологическими ритмами [73]. Когда мышей стимулировали CpG-OVA (прим. перев. — участки молекулы ДНК «цитозин-фосфатный остаток-гуанин», нагруженные овальбумином; агонист TLR9) при пиковой экспрессии TLR9 в В-клетках лимфоузлов (что происходит около ZT19, т.е., ночью), у них наблюдались повышенный синтез цитокинов и пролиферация, по сравнению со стимуляцией в период более низкой экспрессии TLR9 [73]. Таким образом, подобно Т-клеткам, В-клетки также могут демонстрировать выраженные циркадные эффекторные реакции.
Ритмическая эффекторная функция также может влиять на тяжесть аутоиммунных заболеваний. У мышей с дефицитом BMAL1 в Т-клетках, после экспериментальной индукции аутоиммунного энцефаломиелита (АЭ; животная модель рассеянного склероза) отмечались сниженные показатели тяжести заболевания [66]. Кроме того, было показано, что в коже мышей ритмичная экспрессия мРНК рецептора ИЛ-23 (IL-23R) в Т-клетках коррелирует с тяжестью псориаза, вызванного имихимодом (IMQ) [75]. ИЛ-23 выделяется ДК и макрофагами при псориатических поражениях; этот хемокин стимулирует клетки, экспрессирующие IL-23R, к выделению ИЛ-22 и ИЛ-17, что еще больше усугубляет течение заболевания [76]. Результаты ИХр показали, что CLOCK связывается с промоторной областью IL-23R в Т-клетках [75]. С другой стороны, мыши с мутацией потери функции в гене Clock (Clock19) утрачивали ритмическую экспрессию IL-23R на Т-клетках, а экспрессия ИЛ-22 снижалась. У таких грызунов в значительной степени уменьшалась выраженность псориаза по сравнению с мышами дикого типа [75]. Также было показано, что REV-ERB контролирует продукцию воспалительных цитокинов в Т-клетках в контексте индуцированного имихимодом псориаза [77]. У мышей с дефицитом REV-ERB значительно увеличилось количество T-клеток, экспрессирующих ИЛ-17. Напротив, стимуляция REV-ERB синтетическим агонистом SR9009 подавляла выработку IL-17 Т-клетками и снижала выраженность индуцированного имихимодом псориаза [77]. Это свидетельствует о решающей роли транскрипционных факторов механизма биологических часов в патогенезе аутоиммунных заболеваний.
Имеются данные о том, что длительное нарушение биоритмов в организме влияет на функционирование адаптивных иммунных клеток. У старых мышей, страдающих хроническим синдромом смены часовых поясов (CJL — от англ. chronic jetlag), продолжительность жизни сокращается [78], а длительность CJL порядка 85 недель, начиная уже с раннего возраста, усугубляет старение иммунной системы и повышает смертность [79]. CJL приводит к значительному увеличению числа PD-1+CD44+CD4+ Т-клеток, PD1+CD44+CD153+CD4+ Т-клеток, Т-клеток фолликулярных хелперов (Tfh) и Т-регуляторных клеток (Tregs) в селезенке — это всё фенотипы, которые связывают со старением Т-клеток [79]. Кроме того, данное явление сопровождалось значительным повышением абсолютного и относительного чисел В-клеток герминативного центра лимфоузлов (B220+CD19+CD95+GL7+) [79]. Во втором исследовании использовались данные высокопроизводительного секвенирования РНК из Атласа ракового генома. Задачей стала демонстрация того, что нарушенные циркадные ритмы в новообразованиях коррелируют с повышенной иммунологической толерантностью Т-клеток к раку у человека [80]. В 716 образцах и 29 типах рака экспрессия отрицательных регуляторов молекулярных часов была снижена, тогда как положительный регулятор ARNTL2 был активирован в большинстве изученных типов рака. Это позволяет предположить, что у опухолей утрачена ритмичная экспрессия мРНК генов молекулярных часов [80]. Более того, наблюдалась высокая корреляция экспрессии генов биологических часов с уровнями маркеров иммунологической толерантности Т-клеток в опухолевых образцах. Например, таких как белок запрограммированной клеточной гибели 1 (PD-1) и цитотоксическими Т-лимфоцит-ассоциированный белок 4 (CTLA-4) [80]. Эти выводы указывают на связь между нерегулируемой экспрессией генов молекулярных часов и иммунологической толерантностью Т-клеток в опухолях. Можно сделать вывод, что циркадные ритмы влияют на ускоренное старение адаптивных иммунных клеток, в том числе и в контексте злокачественных новообразований.
НЕЙРОЭНДОКРИННЫЙ КОНТРОЛЬ ИММУННОЙ СИСТЕМЫ
Нервная система напрямую передает внешние и внутренние циркадные сигналы иммунной системе, обеспечивая таким образом «настройку» лейкоцитов на ритмы окружающей среды. Адренергическое звено симпатической нервной системы находится под циркадным контролем и посредством катехоламинов (адреналина и норадреналина) в качестве нейротрансмиттеров осуществляет передачу циркадных ритмов [81]. Центральная часть биологических часов, расположенная в супрахиазматическом ядре (СХЯ) гипоталамуса (см. информационный бокс 1), синхронизирует ритмический синтез и секрецию катехоламинов, что в конечном итоге приводит к периферическому контролю миграции иммунокомпетентных клеток посредством адренергической стимуляции [52].
Одно из первых доказательств адренергического контроля над миграцией гемопоэтических клеток было обнаружено в ходе наглядной демонстрации регуляции молекулярными часами транспорта стволовых клеток и клеток-предшественников (HSPC — от англ. hematopoietic stem and progenitor cell) [82]. Циркадные часы синхронизируют локальную секрецию норадреналина, который активирует адренорецепторы 3-AR типа на стромальных клетках костного мозга. Затем адренергическая сигнализация приводит к деградации транскрипционного фактора S1P и подавлению экспрессии факторов удержания клеток в костном мозге VCAM-1 и CXCL12 (суть действия т.н. факторов удержания клеток в костном мозге сводится к обеспечению локализации гемопоэтических клеток-предшественников в их клеточных нишах и удержанию их от преждевременной миграции из костного мозга — прим. перев.), а также эндотелиальных селектинов. В конечном итоге это приводит к ритмической мобилизации HSPC из костного мозга в кровь [82]. В последующие годы эти сведения удалось изучить подробнее, выяснилось, что сходный процесс происходит при мобилизации HSPC в костный мозг, а также миелоидных клеток в скелетные мышцы [72]. Эти ритмы хоминга обусловлены циркадными колебаниями экспрессии VCAM-1, P-селектина и E-селектина в синусоидах костного мозга, а также экспрессией ICAM-1 и CCL2 в эндотелиальных клетках скелетных мышц как на уровне мРНК, так и на уровне белка [72]. Исключение возможности передачи нервных адренергических сигналов посредством хирургической, химической или генетически-обусловленной денервации устраняет циркадные различия в миграции лейкоцитов в костный мозг, мышцы и лимфатические узлы [68, 70, 72]. Дополнительное исследование предложило версию о том, как адренергическая сигнализация регулирует два различных пика активности HSPC в крови и костном мозге в течение 24-часового промежутка времени [83]. Первый пик, индуктором которого считают дневной свет, увеличивает уровень норадреналина. Это запускает пролиферацию и дифференцировку HSPC, что вместе с повышенной проницаемостью сосудов приводит к восполнению объема циркулирующей крови. Наступление темноты увеличивает секрецию TNF-α, индуцируя второй пик активности HSPC и обеспечивая поддержание их функционирования [83]. Эти данные дают представление о том, как адренергическая сигнализация может объяснить два противоположных события, а именно ритмичные выход и возвращение гемопоэтических клеток в костный мозг и из него. Местная адренергическая сигнализация также играет критически важную роль в мобилизации воспалительных лейкоцитов в артерии и вены [72, 84]. В модели TNF-индуцируемого воспаления было показано, что адренергическая сигнализация (2-AR) регулирует ритмическую экспрессию молекул адгезии в сосудистом русле. Это имеет функциональное значение для зависящей от времени суток предрасположенности к внутрисосудистым тромботическим событиям, как например, ритмической адгезии лейкоцитов и тромбоцитов к эндотелиальным клеткам [84]. Согласно этим результатам, миграция лейкоцитов в значительной степени контролируется циркадными колебаниями в симпатической нервной системе.
Адренергическая (2-AR) сигнализация также является важным регулятором эффекторных функций лимфоцитов после иммунизации, зависящей от времени суток. Оказалось, что иммунные реакции были сильнее, когда иммунизация проводилась в ZT17 (ночное время, совпадающее с повышенным адренергическим тонусом), чем в ZT5 (дневное время), у животных с фенотипом, характеризующимся дефицитом 2-AR [70]. Мыши, которым вводили иммуноген в ночное время, демонстрировали более высокие титры IgG1 и IgM-специфических антител, а также повышенные титры АГ-специфических В-клеток герминативных центров ЛУ и клеток Tfh, по сравнению с иммунизированными днем животными. Таким образом, предположительно адренергическая сигнализация играет существенную роль в суточных вариациях адаптивного иммунного ответа, контролируя количество лимфоцитов в лимфатических узлах.
Было показано, что наряду с симпатической, парасимпатическое звено нервной системы регулирует циркадную миграцию HSPC и лейкоцитов [85]. Ночью холинергическая сигнализация парасимпатической нервной системы противодействует симпатической норадренергической сигнализации. Ученые предположили, что это приводит к подавлению последней, особенно 3-адренорецепторов и к уменьшению выхода из костного мозга как HSPC, так и лейкоцитов, тогда как опосредованная 2-AR способность клеток к хомингу костного мозга сохраняется. В дневное время растормаживание норадренергического тонуса приводит к выходу клеток из костного мозга. Возможно, координация между этими двумя ветвями нервной системы приводит к суточным колебаниям HSPC и выходу лейкоцитов из костного мозга [85].
Центральная нервная система также координирует циркадное выделение ГК из коры надпочечников, в зависимости от времени суток. Концентрация ГК достигает пика в начале активной фазы как у мышей, так и у людей; ГК связывается с соответствующим рецептором, способствуя его перемещению в ядро, где этот комплекс действует как транскрипционный фактор. Эти гормоны известны как мощные иммунодепрессанты; однако их более точная роль — иммуномодуляторы. Они ответственны за иммуностимуляцию и иммуносупрессию, помимо регуляции циркадной миграции лимфоцитов [53, 86]. Иллюстрацией этому служит регулируемая ГК экспрессия рецептора интерлейкина 7 альфа (IL-7R) на Т-клетках. Это необходимо для нормальной пролиферации, дифференцировки и выживания Т-клеток. Связывание ГК с ГК-рецепторами в Т-клетках способствует экспрессии белка IL-7R путем связывания с элементами ГК-рецептора (GRE) в энхансере IL7r [69]. Удаление ГК-рецептора или GRE в локусе Il7r в Т-клетках приводит к исчезновению ритмичной экспрессии IL-7R. А мыши, лишенные присущих Т-клеткам ГК-рецепторов или GRE в Il7r, утрачивают циркадные ритмы миграции Т-клеток в кровь и лимфоидные органы [69]. Это связано с утратой экспрессии CXCR4, которая управляется интерлейкином-7. Мыши, лишенные Т-клеточных ГК-рецепторов или GRE в Il7r, характеризуются фенотипом, сходным с T-клетками с дефицитом CXCR4 [69]. Поскольку CXCR4 — это рецептор для CXCL12, имеющий решающее значение для управления процессом миграции лейкоцитов, прерывание этой оси нарушает циркадные колебания в этом процессе [3]. Имеются дополнительные сведения того, что индуцированная ГК экспрессия CXCR4 в большей степени приводит к специфической мобилизации Treg в воспаленные суставы в активной фазе артрита у мышей [87]. Хотя Tregs не проявляют явных колебаний в работе генов молекулярных часов [87], как при гомеостазе, так и при хроническом воспалении эти клетки проявляют признаки циркадной экспрессии CXCR4, которая соответствует изменениям титра ГК в сыворотке [87]. Можно сделать вывод, что ГК играют критически важную роль в управлении миграцией лимфоцитов по организму за счет циркадных ритмов.
ТКАНЕВЫЙ КИШЕЧНЫЙ ИММУНИТЕТ
Существует большое количество доказательств связи циркадных ритмов с функцией пищеварительной системы, кишечной микробиотой и иммунитетом. Время приема пищи в значительной степени влияет на работу периферических биологических часов и вызывает колебания микробиоты, подвижности клеток кишечника и усвоения питательных веществ [88, 89]. Прием пищи также приводит к ритмичному выделению вазоактивного интестинального пептида (ВИП) из нейронов кишечника [90, 91]. Он связывается с рецептором VIP 2, связанным с G-белком (VIPR2). Этот рецептор расположен на таких иммунных клетках, как врожденные лимфоидные клетки кишечника группы 2 (ВЛКК2) и группы 3 (ВЛКК3), влияя на их функцию [88, 90, 91]. Хотя связь приема пищи и активности микробиома с циркадным ритмом организма недавно пересматривалась [88, 89], в этой работе авторы сосредоточились на том, как последний обусловливает функционирование иммунных клеток в кишечнике, особенно ВЛКК3 (рис. 2).
Толерантность кишечного иммунитета
В момент приема пищи (как правило, активная фаза поведения организма) кишечник готов поглощать максимум питательных веществ, что также способствует преодолению кишечного эпителиального барьера микробиотой. Недавнее исследовании показало, что экспрессия белка MHC II на эпителиоцитах тонкого кишечника (ЭТК) мышей является ритмичной, зависит от работы гена Bmal1 и достигает пика в фазе покоя [92]. Это сопровождалось ритмичностью проницаемости тонкой кишки (ТК), которая, напротив, достигает пика во время активной фазы [92]. Ритмическая экспрессия MHC II на ЭТК, состав микробиоты и ритмы кормления — все это способствовало проницаемости ТК, обусловленной циркадными ритмами. На основании этого выдвинуто предположение о том, что ритмическая проницаемость ТК связана с пиками появления микробиоты [92]. Действительно, такую ритмичную экспрессию MHC II на ЭТК можно индуцировать у стерильных мышей после колонизации мышиными сегментоядерными нитчатыми бактериями (SFB, но не крысиными, так как они не способны прикрепляться к мышиным ЭТК) [92]. ЭТК, на поверхности которых не экспрессирован CDC42, необходимый для прикрепления SFB к эпителию кишечника, также утрачивали способность экспрессировать MHC II в течение суток [92]. Кроме того, прекращение экспрессии MHC II на ЭТК (Villin-cre:I-Abflox) снижало количество внутриэпителиальных Т-лимфоцитов CD4+ в кишечнике и усугубляло тяжесть течения патологии в смоделированной болезни Крона у мышей [92]. Основываясь на этих данных можно сказать, что существует тонкий циркадный баланс между повышением проницаемости кишечника для поглощения питательных веществ во время приема пищи и усилением иммунного надзора за кишечной микробиотой во время отдыха животного, что позволяет организму заранее «настроиться» на поглощение питательных веществ при сохранении гомеостаза.
Кишечный микробиом
В последние годы было показано, что функционирование и жизнеспособность микробиоты кишечника в значительной степени зависят от циркадных ритмов макроорганизма и ритмичности приемов пищи. Тот же принцип имеет прикрепление бактерий кишечника к его стенке, а сам микробиом изменяется в своем видовом составе в зависимости от времени суток. Ритмичностью также характеризуется выработка метаболитов микробиотой, что оказывает влияние на ритмы макроорганизма — как локальные в кишечнике, так и в относительно отдаленных местах, как например, печени [93]. Изменения в рационе влияют на микробиом кишечника и могут привести к ослаблению антибактериального иммунного ответа или изменениям в миграции иммунокомпетентных клеток в крови и других тканях [88].
Недавно удалось показать, что циркадный иммунный ответ против Salmonella Typhimurium обусловлен ритмическими изменениями пищевого поведения и, как следствие, активности микробиоты кишечника. Мыши, предварительно получившие стрептомицин, в большей степени восприимчивы к Salmonella Typhimurium при заражении per os в начале дня (т.е., ZT4; наблюдалось более значительное содержание бактерий в толстой кишке и брыжеечных ЛУ) по сравнению с ночным временем (ZT16) [94]. Напротив, у мышей, не получивших антибиотикотерапии, инфицированных перорально Salmonella Typhimurium в ZT12, наблюдалась повышенная бактериальная нагрузка в ТК через 24 часа, а также значительно более высокая смертность, по сравнению с мышами, инфицированными в ZT0 (утром) [89]. Следовательно, сохранение разнообразия микробиоты резко меняет исход инфекции. Это связано с колебаниями экспрессии антимикробных пептидов (АМП), которые индуцированы приемами пищи [89]. Потребление пищи достигает пика в начале активной фазы и способствует связыванию SFB с ЭТК. Это запускает активацию цепи врожденного иммунитета, где MyD88-зависимый (белок 88 первичного ответа миелоидной дифференцировки — прим. перев.) иммунный ответ в миелоидных клетках CD11c+ активирует ВЛКК3 для запуска секреции ИЛ-22, что приводит к работе передатчика сигнала и активатора транскрипции 3 (STAT3) в ЭТК и циркадном синтезе АМП (Reg3g, Lcn2 и S100A8) [89]. Эти колебания полностью исчезают у мышей при голодании или у животных, лишенных SFB. Также эти колебания зависят от экспрессии MyD88 в клетках CD11c+ (Cd11ccre:Myd88flox) и STAT3 в ЭТК (Villincre: Stat3flox) и от присутствия ILC3 в кишечнике [89]. Поскольку Salmonella Typhimurium устойчива к Lcn2 (липокалин — продукт экспрессии данного гена — прим.перев.), она получает конкурентное преимущество в ранней активной фазе (ZT12), вытесняя здоровую микробиоту, восприимчивую к Lcn2 [89]. Эти данные гласят, что циркадный ритм макроорганизма влияет на микробный, который, в свою очередь, определяет ритмическую активность иммунитета хозяина.
Регуляция ВЛКК3
В 2019 г. были опубликованы три статьи по изучению роли циркадных часов в гомеостазе ВЛКК3 [95–98]. Во всех этих работах было показано, что ВЛКК3 экспрессируют в большом объеме мРНК генов молекулярных часов, по сравнению с другими популяциями иммунных клеток в ТК-LP, что согласуется с критической ролью Rorc (ген молекулярных часов, кодирующий фактор транскрипции RORγt) и Nfil3 (ген, ассоциированный с молекулярными часами). Эти продукты экспрессии мРНК — определяющие транскрипционные факторы в развитии ВЛКК3 [90, 95–97, 99–101]. ВЛКК3 также характеризуются циркадными колебаниями ключевых транскрипционных факторов ROR и RUNX1, которые участвуют в их дифференцировке, а также сигнатурных цитокинов ИЛ-17 и ИЛ-22 [90, 96, 97]. ВЛКК3 получают свои циркадные сигналы посредством воздействия световых волн через СХЯ, и удаление этой области мозга электролитическим повреждением или генетической абляцией Bmal1 из переднего мозга (что было продемонстрировано в эксперименте мышей Camk2acre:Bmal1flox) привело к полному исчезновению ритмичности функции ВЛКК3 [95]. Напротив, по всей видимости, микробные или ритмичные сигналы потребления пищи лишь незначительно влияют на ВЛКК3 [95]. Это удивительно, учитывая, что прием пищи значительно влияет на состав бактерий в кишечнике. Удаление механизма молекулярных циркадных часов в клетках, экспрессирующих Rorc (показано в экспериментах с мышами Roccre:Bmal1flox), в число которых входят и ВЛКК3 кишечника, вызывает снижение частоты и количества последних в кишечнике (а не в селезенке, крови или легких) [90, 95–95, 97]. По всей вероятности, это связано с неспособностью ВЛКК3, лишенных механизма часов, мигрировать из брыжеечных ЛУ в кишечник, потому что у этих клеток наблюдается пониженная экспрессия поверхностных белков: молекул кишечного хоминга 47, CCR9 и CXCR4 [95]. Однако ВЛКК3 из ТК-LP, характеризующиеся нарушенной работой молекулярных часов, демонстрировали повышенную частоту экспрессии ИЛ-17+ и ИЛ-22+ (т.е., клетки обладали таким фенотипом) и проапоптотического белка 11 BIM подобного Bcl-2[96, 97]. Все вместе эти данные показывают, что ВЛКК3 (врожденные лимфоидные клетки кишечника группы 3) представляют собой популяцию иммунных клеток, которая в высшей степени функционирует ритмично, а также синхронизируется световыми волнами.
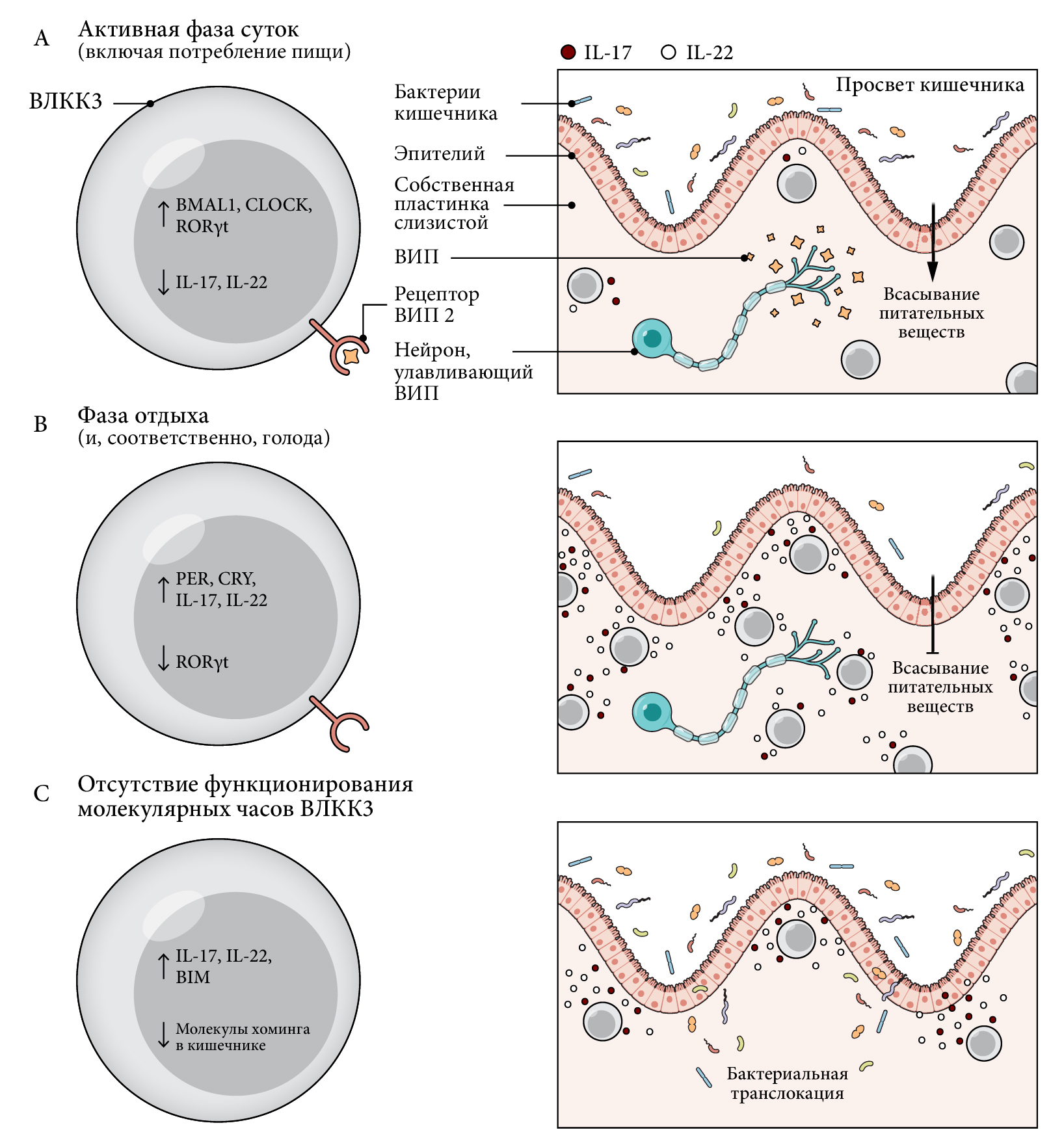
(В) Во время отдыха организма в собственной пластинке слизистой скапливается большое количество ВЛКК3 [96]. В это время они усиленно экспрессируют ИЛ-17 [96,97], а отсутствие потребления пищи приводит к низкому содержанию ВИП, что запускает экспрессию ИЛ-22 [91]. Такие активированные ВЛКК3 выполняют свои антимикробные функции, а также усиливают барьеры в кишечнике, что ведет к снижению всасывания питательных веществ в ТК.
(С) В отсутствие циркадных ритмов количество ВЛКК3 в кишечнике снижается до критических значений [90, 95-97], однако то число клеток, которое удается зафиксировать имеет активированный фенотип [96, 97]. Также у мышей, у которых ВЛКК3 характеризуются дефицитом экспрессии генов молекулярных часов, наблюдается усиленная бактериальная транслокация во время инфекции [95, 97]. Это может привести к повышению содержания ИЛ-17 и ИЛ-22 на поверхности ВЛКК3 собственной пластинки слизистой тонкого кишечника.
Интересно, что эффект абляции циркадных часов различается, в зависимости от различных популяций ВЛКК3. Хотя среди них клеток NKp46+ меньше, но при этом в них происходила повышенная экспрессия белка ИЛ-22, клеток с фенотипом NKp46-CCR6- и CCR6+ (среди ВЛКК3) стало больше и выявилось повышение экспрессии белка ИЛ-17A. Работа молекулярных часов при этом была нарушена утратой REV-ERB. Соответственно этому, у мышей с дефицитом REV-ERB обнаруживается измененная структура хроматина в локусе Il17a [97]. Это предполагает, что отсутствие REV-ERB открывает сайты связывания элементов отклика гена ROR (RORE) для дополнительного связывания факторов транскрипции. В итоге это повышает экспрессию IL-17 в клетках с фенотипом NKp46-CCR6- и CCR6+ среди ВЛКК3 [97]. Дефицит BMAL1 также ухудшает взаимосвязи между кишечными ВЛКК3 и бактериями кишечника. У мышей с ВЛКК3 с дефицитом BMAL1 изменяются суточные колебания популяций микробиоты. Возможно активированный фенотип, проявляющийся в виде отсутствия гена Bmal1, среди ВЛКК3 может быть связан с кишечной микробиотой [95]. Кроме того, когда мышам с клетками ВЛКК3 с дефицитом BMAL1, вводят антибиотики в течение 2 недель (уничтожая, таким образом, большую часть кишечной микробиоты), частота ВЛКК3 с фенотипами ИЛ-17+ и ИЛ-22+ снижается, а общее их количество в кишечнике восстанавливается до уровня, соответствующего животным c достаточными уровнями BMAL1 [96]. В соответствии с этим, когда мышей с BMAL1-дефицитными клетками ВЛКК3 инфицировали Clostridium difficile или Citrobacter rodentium, их ВЛКК3 оказались гиперчувствительными и у них выявилась более выраженная бактериальная транслокация из кишечника в брыжеечные ЛУ или селезенку, соответственно [95, 97]. Кроме того, мышиные ВЛКК3 с дефицитом BMAL1 демонстрировали общее снижение выживаемости при инфицировании C. rodentium, по сравнению ВЛКК3 с достаточным уровнем BMAL1 [95, 97]. Мышиные ВЛКК3 с дефицитом BMAL1 также демонстрировали более тяжелое течение воспаления кишечника (при инфекции). Кроме того, у пациентов с воспалительным заболеванием кишечника обнаруживаются популяции ВЛКК3 с нарушением генов часов, по сравнению с пациентами группы контроля [96]. Резюмируя, эти данные служат убедительными доказательствами того, что циркадная регуляция ВЛКК3 имеет решающее значение для поддержания гомеостаза кишечника и микробиоты, а также борьбы с кишечной инфекцией.
Хотя содержание ВЛКК3, по-видимому, контролируется центральным механизмом часов и количеством дневного света, на функцию этих клеток может оказывать влияние и индуцированная приемом пищи экспрессия ВИП. В начале 2020 года в двух статьях было показано, что ВЛКК3 экспрессируют VIPR2 (рецепторы 2 типа к ВИП) [90, 91]. ВЛКК3 и нейроны, экспрессирующие ВИП, находятся вместе друг с другом в кишечнике, а потребление пищи, что индуцирует продукцию ВИП, изменяет экспрессию ИЛ-22 посредством ВЛКК3 [90, 91]. Хотя в одной статье показано, что стимуляция VIPR2 в условиях in vitro и in vivo приводит к снижению у ВЛКК3 экспрессии белка ИЛ-22 [90], в другой работе продемонстрировано противоположное явление — увеличение ИЛ-22 [91]. Обе группы исследователей утверждали, что обнаруженные ими изменения, вызываемые ВИП, важны для поддержания гомеостаза кишечника в период потребления пищи: либо для уменьшения воспаления за счет повышенного титра ИЛ-22 [90], либо для поддержания эффективного усвоения питательных веществ и баланса микробиоты за счет низкого содержания этого же интерлейкина [91]. Несмотря на различия относительно роли стимуляции VIPR2, было показано, что продукция ИЛ-22 обусловлена ритмичностью у ВЛКК3, и эта ритмичность не может быть полностью устранена путем удаления BMAL1 из клеток [90]. Существует важная связь между циркадным ритмом, продукцией ВИП и гомеостазом ВЛКК3. Однако необходимы дополнительные исследования, чтобы выяснить точную функцию этой нейроиммунной оси в кишечнике.
ИММУННЫЙ ОТВЕТ НА ПАТОГЕНЫ
Хотя изначально фокусом большинства исследований было асептическое воспаление для изучения влияния циркадных ритмов, их важность во время инфицирования патогенами стала ключевым фактором в прогрессировании заболевания. Это стало еще более очевидным в контексте пандемии COVID-19.
Многие аспекты инфекции SARS-CoV-2 и последующих иммунных реакций человека зависят от времени суток. Было выявлено, что проникновение этого вируса в клетки и его репликация в культивируемых моноцитах человека регулируется циркадным образом: в одни периоды времени вирус активнее проникает в клетки и реплицируется, чем в другие [102]. Кроме того, структура секретируемых цитокинов зависела от времени контакта с вирусом. Самая высокая вирусная нагрузка коррелировала с более высокими уровнями белков ИЛ-6, ИЛ-1 и ИЛ-10. Можно предположить, что циркадные ритмы влияют как на вирусную инфекцию, так и на иммунный ответ хозяина. Кроме того, в условиях in vitro было показано, что проникновение и репликация вируса SARS-CoV-2 в клетках эпителия легких человека (культура Calu-3) регулируются циркадным образом, как посредством BMAL1, так и REV-ERB [103]. Компоненты циркадных часов подавляют ангиотензинпревращающий фермент 2, основной рецептор проникновения SARS-CoV-2 в эпителиальные клетки человека, что приводит к ограничению проникновения вируса в клетки и его репликации. Циркадные колебания играют важную роль в заражении клеток вирусами и иммунном ответе организма человека на вирусную инфекцию.
Помимо SARS-CoV-2, «внутренние часы» играют важную роль при других вирусных инфекциях. Вирусная репликация и диссеминация вирусов герпеса и гриппа А зависят от времени заражения: у мышей, инфицированных в ZT0 (утром) вирусом герпеса, экспрессирующим люциферазу (M3:luc MuHV4), репликация вируса оказалась в 10 раз выше, чем у мышей, инфицированных в ZT10 (вечером) [104]. Однако эта разница во времени суток отсутствует у мышей с полным отсутствием гена Bmal1 (фенотип Bmal1-/-), у которых выявляется более высокий уровень вирусной нагрузки, чем у животных дикого типа. Аналогичные результаты были получены для респираторно-синцитиального вируса (RSV) и вируса парагриппа типа 3, характеризующихся более высокой вирусной репликацией обоих вирусов в клетках с фенотипом Bmal1-/- и более тяжелым течением инфекции RSV у мышей Bmal1-/- [105]. Важность BMAL1 в развитии противовирусного иммунного ответа также подчеркивалась в контексте инфекции вирусом Сендай (SeV) [106]. Мыши Bmal1-/- оказались в большей степени восприимчивы к инфекции SeV из-за дефектного контроля репликации вируса, что привело к более высокой экспрессии цитокинов и общему усилению воспаления легких. В контексте инфекции гепатита В REV-ERB непосредственно контролирует экспрессию NTCP (натрий-таурохолат котранспортирующего полипептида) — основного рецептора, с помощью которого вирус гепатита В (HBV) проникает в клетки [107]. Фармакологическая активация REV-ERB агонистом SR9009 замедлила проникновение HBV в клетки, тогда как BMAL1, напротив, связывался с ДНК HBV и усиливал активность вирусного промотора. Кроме того, было показано, что REV-ERB регулируют репликацию ВИЧ-1 посредством модуляции активности промотора длинного концевого повтора ВИЧ-1 [108]. Более того, восприимчивость мышей к инфекции вируса гриппа зависит от времени суток: у животных, инфицированных в ZT11 (вечером), наблюдается более тяжелое течение заболевания и более высокая смертность по сравнению с животными, инфицированными в ZT23 (утром) [109]. И это несмотря на то, что мыши, инфицированные в ZT8 (днем), обладают большим абсолютным количеством CD8+IFN+ T-клеток, по сравнению с мышами, инфицированными в ZT20 (ночью) [66]. Все вместе, эти результаты подчеркивают важность компонентов циркадных часов в развитии противовирусного ответа.
Циркадные механизмы также влияют и на течение бактериальных инфекций. Как упоминалось выше, мыши более восприимчивы к инфекции Salmonella Typhimurium, развивающейся при пероральном заражении (при кормлении через зонд) утром, по сравнению с вечерним временем [94]. Эта повышенная восприимчивость привела к более выраженной колонизации толстой кишки Salmonella Typhimurium и провоспалительной реакции. Зависимая от времени суток восприимчивость к бактериальной инфекции также была показана в контексте легочной инфекции S. pneumoniae: мыши, которых заражали утром (ZT0), испытывали более высокую бактериальную нагрузку в легких и крови спустя 48 часов (после инфицирования) по сравнению с мышами, которых заражали вечером (ZT12) [27]. Другим примером является генитальный патоген Chlamydia muridarum, инфицирующий половые пути и вызывающий бесплодие [110]. Мыши, которых заражали утром (ZT3), обладали более высокой инфективностью C. muridarum, по сравнению с мышами, инфицированными вечером (ZT15). Это сопровождалось усилением патологического поражения и более высоким содержанием белков CXCL1, ИЛ-10, ИЛ-1 и ИФН-1 спустя неделю после заражения [110]. Обобщая вышесказанное, эти результаты подчеркивают зависящие от времени суток механизмы антибактериальной защиты.
Также было показано, что паразитарные инвазии и реакции на них регулируется механизмом часов. Изгнание паразита Trichuris muris из организма контролируется молекулярными часами дендритных клеток [111]. У мышей, зараженных этим паразитом утром, выявлялась более эффективная «система очистки» организма от этой нематоды, что объясняется более сильным иммунным TH2-ответом утром по сравнению с вечерним. Напротив, у мышей с дендритными клетками без BMAL1 (Cd11ccre:BMAL1flox) уже не было подобных различий во времени суток. Важность циркадных ритмов для иммунных клеток также была продемонстрирована на примере инфекции Leishmania major [112]. Инфицирование мышей L. major в утреннее время привело к уменьшению количества паразитов и меньшей выраженности отека подушечек лап по сравнению с заражением животных днем. Это сопровождалось инфильтрацией нейтрофилов и макрофагов в очаг инфекции, что объясняется ритмичным выделением хемокинов. Участие циркадных часов в этих явлениях было подтверждено путем выведения [культур] макрофагов костного мозга от мышей с фенотипом Bmal1-/- in vitro, а также на примере иммунных клеток in vivo (с использованием химер костного мозга от организмов-доноров с дефицитом Bmal1-/- Rag2), что приводило к исчезновению всех описанных колебаний [112]. Это свидетельствует об изменении инфективности паразитов и степени их клиренса в зависимости от молекулярных часов иммунных клеток.
ИММУННЫЙ ОТВЕТ НА ВАКЦИНАЦИЮ
Учитывая важность циркадных ритмов в регуляции многих аспектов иммунного ответа, следует, что они могут быть с успехом использованы в таргетной терапии, как например, протоколах вакцинации [55]. Благодаря новаторской работе удалось продемонстрировать на мышах, что иммунизация OVA ночью (ZT19) с использованием олигодезоксинуклеотидов CpG лиганда TLR9 в качестве адъюванта приводила к усилению индуцированной антигеном пролиферации лимфоцитов и увеличению продукции ИФН по сравнению с вакцинацией днем (ZT7) [73]. Это явление коррелировало с ритмичной экспрессией TLR9 на поверхности макрофагов и В-клеток. Циркадные реакции на вакцинацию также наблюдались в ходе реакции CD8-Т-клеток на внутривенно вводимые дендритные клетки [49]. В значительной степени это было опосредовано молекулярными часами CD8+ Т-клеток и циркадной модуляцией сигнального пути TCR, что усиливало потенциал их активации и пролиферации в течение дня. Эти исследования демонстрируют, что циркадные изменения устойчивой экспрессии иммунных молекул и потенциала активации клеток иммунитета могут оказывать глубокое влияние на силу поствакцинального ответа.
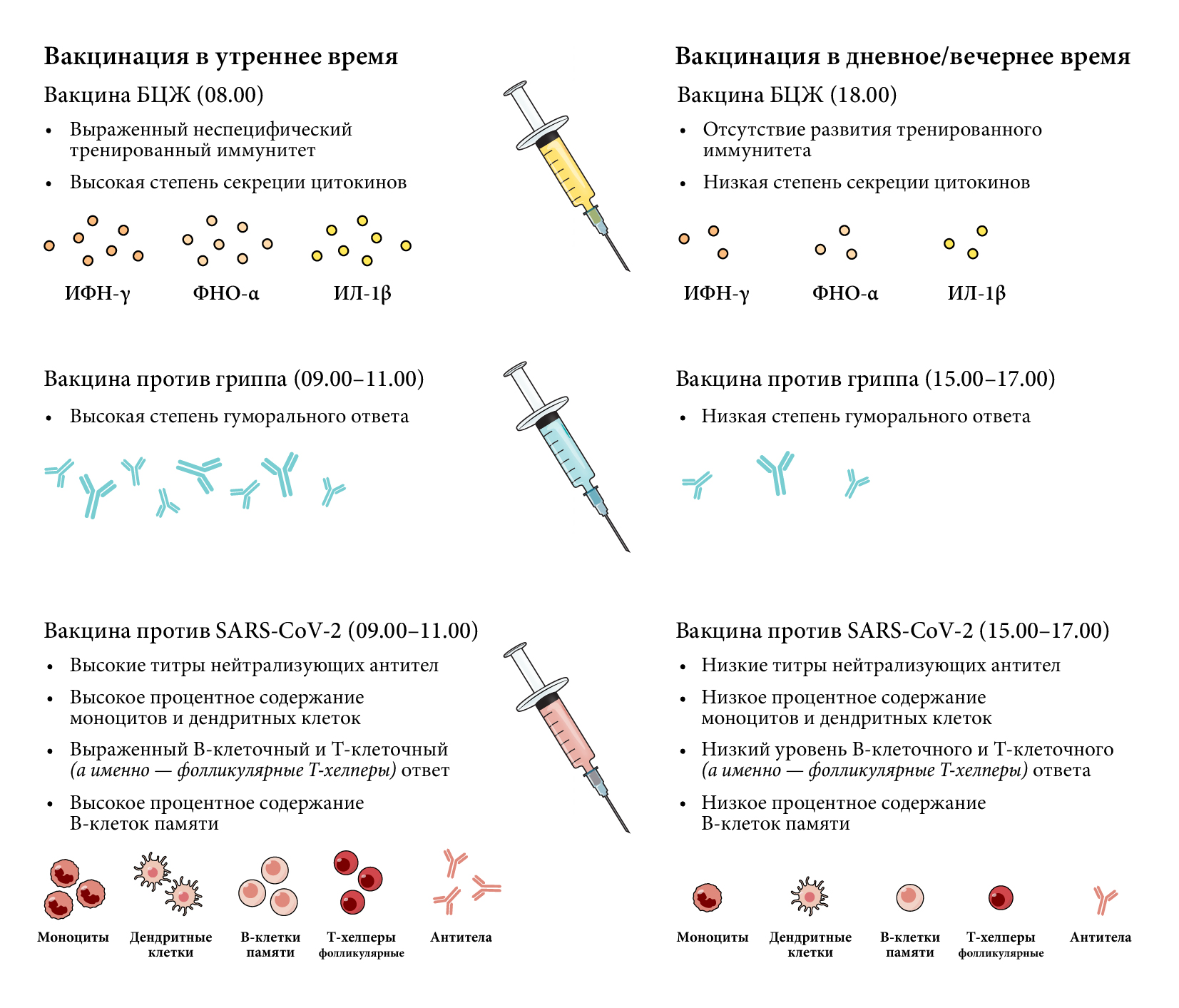
(I) усиленной гуморальной реакции [113, 116];
(II) усиленной краткосрочной иммунной реакции с выраженным синтезом цитокинов (ИФН-γ, ФНО-α- и ИЛ-1);
(III) усиленном длительном иммунитете с повышенным количеством В-клеток памяти [116].
Реакции на вакцинацию у людей также демонстрируют циркадную ритмичность (рис. 3). В когорте из 298 участников (старше 65 лет) вакцинация против гриппа в утренние часы приводила к формированию более выраженного гуморального ответа, по сравнению с дневным временем [113]. В другом исследовании вакцинации против гриппа удалось показать, что время сбора образцов может служить объяснением различиям в титрах антител у испытуемых, вакцинированных утром и днем [114]. Кроме того, оказалось, что вакцинация в утреннее время противотуберкулезным препаратом Bacillus Calmette-Guérin (BCG) приводила к индукции неспецифического тренированного иммунного ответа, по сравнению с тем, когда вакцинацию проводили в более позднее время суток [115]. В контексте текущей пандемии COVID-19 было показано, что введение утром инактивированной вакцины против SARS-CoV-2 на белковой основе (BBIBP-CorV, компания Sinopharm) повышает эффективность вакцины [116]. Испытуемые, получившие дозы препарата в начале дня, демонстрировали более сильный иммунный ответ на вакцинацию (вдвое более высокий уровень нейтрализующих антител), по сравнению с когортой лиц, привитых в дневное время. Также вакцинация утром приводила к более сильным реакциям В-клеток и Tfh-клеток и к более высоким титрам моноцитов и дендритных клеток. Помимо этого, испытуемые, вакцинированные утром, демонстрировали повышенную степень долговременного иммунитета, а также у них было более высокое процентное содержание В-клеток памяти, специфичных к шипиковому белку и РСД (рецептор-связывающему домену) [116, 117]. Аналогичное исследование вакцинации против SARS-CoV-2, проведенное на когорте медицинских работников в Великобритании, вакцинированных мРНК-вакциной компании Pfizer либо аденовирусной вакциной AstraZeneca, показало, что иммунный ответ против шипикового белка оказался выше у людей, которых прививали позже в тот же день, что позволяет предположить, что пиковое время развития иммунного ответа может различаться в зависимости от вакцины или схемы вакцинации [118]. В целом это говорит о том, что циркадные ритмы играют роль в иммунных поствакцинальных реакциях человека, а также, что эти циркадные ритмы можно использовать для оптимизации стратегий вакцинации.
ЗАКЛЮЧЕНИЕ
В последние годы появились весомые аргументы в пользу того, что биологические ритмы существенно влияют на развитие иммунного ответа. Несколько недавних открытий, посвященных кишечному иммунитету, продемонстрировали, что последний, осуществляемый за счет ВЛКК3, различается в зависимости от времени суток. Поскольку гены Nr1d1 и Rorc играют важную роль как в циркадных ритмах, так и в качестве главных регуляторов развития TH17 и ВЛКК3, это указывает на выраженный циркадный контроль развития этих популяций. В будущих исследованиях крайне важно провести разграничение между функцией циркадных биоритмов и ролью этих транскрипционных факторов в развитии иммунокомпетентных клеток.
Клинические данные свидетельствуют о различиях в долгосрочных иммунных реакциях у людей в зависимости от времени суток, указывая на то, что хронобиологические концепции находят свое применение в практике. Хотя большинство данных по развитию потенциальных эффектов во времени суток по-прежнему оцениваются ретроспективно, в дизайн нескольких исследований уже включены пункты по изучению циркадных компонентов для проспективных испытаний. Пройден довольно большой путь, эти достижения также стали импульсом для дополнительных вопросов, остающихся без ответов. Один из вопросов заключается в относительности циркадных ритмов в развитии поствакцинальных реакций. Обеспечивают ли наблюдаемые различия титров антител формирование наилучшего результата после экспериментального заражения? Оценка этого в экспериментальных и клинических условиях имеет крайне важное значение. Кроме того, как определить функции биоритмов в процессе развития адаптивного иммунитета, и как они поддерживаются? Возможно первоначальная реакция в месте введения иммуногена и определяет, будут ли развиваться последующие события циркадным образом. В настоящее время совершенно неясно, как циркадная ритмичность иммунных реакций, наблюдаемая спустя несколько месяцев после первоначального введения патогена, поддерживается организмом, и почему она не уменьшается или даже не увеличивается. Ответ может заключаться в важности циркадных ритмов для поддержания физиологического баланса и протекания необходимых иммунных реакций. Исследования, показывающие, что отсутствие циркадных ритмов может привести к развитию реакций гиперчувствительности, подтверждают это мнение. Недавние весомые достижения в этой относительно новой области иммунологии говорят нам, что ответы на эти волнующие вопросы не заставят себя ждать уже в ближайшие годы.
