Микробиота: на границах Ойкумены

Гладкая, словно у античной статуи, кожа беззастенчиво лжет.
Стоит лишь немного увеличить, как ее гладкость пересекается тысячами складок, отверзается глубокими порами и прорастает толстыми и темными, как бревна, волосами.
Чем ближе, тем больше божественная грация искажается титанической хтоничностью.
Поры, пронизывающие кожу, становятся выстланной бесконечным бактериальным ковром сетью железистых пещер. Каждая складка превращается в усыпанную стадами микробов чешуйчатую равнину, изрытую сочащимися жирной смолой колодцами, из которых торчат заросшие бактериями волосяные стволы. Но вот волосяная роща редеет, сменяется иссушенной пустыней слущивающихся, как прибрежный известняк, кератиноцитов. Пересеки ее — Эгейские кулисы! — и попадешь на плодородные, влажные берега гостеприимного моря. Там у зубодесневой литорали медленно каменеют бактериальные колонии, превращаясь в микроскопические рифы, а на подрагивающей слизистой оболочке, под накатывающей прибоем слюной, за бактериями гоняются, вытекая из себя, аморфные амебы. А под их псевдоподиями в непостижимо медленном геологическом ритме вместо земли пульсирует и движется живая плоть. К зубному мрамору микроскопической Итаки лепятся биопленки бактериальных полисов, где вызревают триремы с безъядерными одиссеями, готовыми вырваться в вязкие волны слюны.
Этот насквозь микробный мир — всего лишь ротовая полость.
Немного истории
Со времен Левенгука, показавшего научному миру «анималькулей» в зубном налете, стало ясно, что в теле человека, кроме него, обитают другие существа [1]. Эти микроскопические организмы настолько отличались от всех ранее известных живых существ, что их положение в таксономической системе на протяжении столетий оставалось традиционно неясным. Хотя Левенгуку они показались скорее «зверушками», в дальнейшем эта таксономическая загадка с завидным постоянством разрешалась в пользу растительной природы микробов — в результате самые разные систематики не находили ничего лучше, чем в очередной раз причислить их к растениям [2, 3].
После того, как Л. Пастер и Э. Ру доказали микробную природу заразных болезней, эти микроскопические существа приобрели громадное значение. Теперь наличие любых микроорганизмов на поверхности или в толще тканей тела человека считалось почти безусловным признаком патологии. На этом фоне всеобщего «микробного предубеждения» в конце ХIХ — начале ХХ вв. возникают первые, пока что тоже достаточно радикальные, представления о нормальной микрофлоре тела. Так, И.И. Мечников признавал обычную, «гнилостную», кишечную флору патологическим явлением, ответственным за «аутоинтоксикационный эффект» и предлагал заменить ее более благоприятной лактобацилльной, употребляя в пищу простоквашу, а то и вовсе устранить хирургическим путем вместе с «исключительно вредными... толстыми кишками» [4, 5]. На это же время приходится расцвет культурального метода в микробиологии, когда были разработаны способы высеивания микроорганизмов и получения чистых культур, в том числе и представителей нормальной микрофлоры. Микроскопия и культивирование — единственно доступные тогда методы идентификации микроорганизмов, составившие фундамент микробиологических исследований на следующие двести лет и послужившие основой микробиологической диагностики в клинике, незыблемой и поныне. Для определения возможной патогенности микроорганизма к ним добавлялся эксперимент — заражение восприимчивых животных, по сути, специфическая разновидность культурального метода. Такой трехступенчатый алгоритм вошел в историю под названием триады Коха и более века оставался стандартной моделью исследования почти любого микроорганизма. Именно на нем основывались представления о заселенности тела человека микроорганизмами вплоть до рубежа 1990–2000 гг., когда возникла метагеномика.
Сохранившаяся терминология отчасти отражает этот исторический путь. К примеру, популярный поныне научный фразеологизм «бактериальная флора», как и термин «микрофлора», является прямым наследием тех времен, когда бактерий относили к растительному царству. Поскольку микроорганизмы в большинстве своем при микроскопии были малоподвижны, а при культивировании образовывали «растительно» растущие колонии, они слабо ассоциировались с привычным представлением о животных. Поэтому все микроорганизмы, выявленные с помощью микроскопии или посева в различных тканях и биологических жидкостях человека, получили собирательное название микрофлоры. Определение для этого термина можно сформулировать так: микрофлора — это совокупность всех микроорганизмов, заселяющих макроорганизм [6]. При различных патологических состояниях наблюдалось изменение микробного пейзажа, характерного для клинически здорового субъекта, поэтому заговорили о нормальной и патологической микрофлоре. Однако сегодня подобные выражения считаются устаревшим и потому нежелательным в современной научной литературе. На замену им предлагается термин «микробиота» — он не содержит нежелательных отсылок к систематическому положению составляющих его организмов, гораздо лучше соотносится с принятой в экологии терминологией и в то же время подходит для обозначения группы любых микроорганизмов, объединенных только общностью места проживания [6]. Нормальная микробиота макроорганизма подразделяется по топологическому принципу на микробиоту кожи, желудочно-кишечного тракта, урогенитального тракта, дыхательных путей и т. д. В зависимости от систематического положения микроорганизмов можно выделить бактериальную, вирусную, грибковую, протозойную микробиоту (для краткости: бактериобиота, виробиота, микобиота). Кроме того, различают микробиоту резидентную, или автохтонную (типичный видовой состав для данного биотопа) и транзиторную, или аллохтонную (спорадически встречающиеся в данном биотопе микроорганизмы, случайно попавшие сюда из других биотопов и обычно быстро элиминирующиеся).
С внедрением в микробиологическую практику молекулярно-генетических методов стало возможно изучение непосредственно генетического материала, содержащегося в образцах, с его качественной и количественной оценкой. Такая совокупность геномов всех организмов, выделенных из одного образца, получила название «метагеном» [7]. Метагеномика, позволившая определять микроорганизм максимально точно при минимуме требуемого биологического материала, буквально совершила революцию в микробиологии, открыв как новые перспективы, так и новые вопросы. Чтобы представить масштабы развернувшихся событий, достаточно только сказать, что из-за метагеномики были пересмотрены даже такие фундаментальные для микробиологии положения, как триада Коха [8]. Новая методология неизбежно требует новых терминов — и вот уже среди них появляются названия для отдельных метагеномов. Для обозначения метагенома, выделенного из биологических материалов, начал использоваться неологизм «микробиом» [9]. Первоначально под микробиомом понимали «экологическое сообщество комменсальных, симбиотических и патогенных микроорганизмов, которые буквально являются совладельцами нашего тела» (именно так определил микробиом в этой статье Джошуа Ледерберг). Но почему человеку, имеющему, откровенно говоря, вполне заурядный микробиом, который не может похвастаться ни уникальной сложностью, ни биоразнообразием среди микробиомов других живых существ, вдруг должен принадлежать приоритет в дефиниции такого универсального термина? Поэтому вскоре микробиомами стали называть метагеномы других животных, растений и даже почвы, в результате чего к настоящему времени сам термин «метагеном» оказался практически вытеснен своим более успешным преемником. Соответственно изменяется и определение микробиома, которое теперь приобретает такой вид: микробиом — это совокупность геномов всех микроорганизмов, населяющих определенный биотоп (в нашем случае — микробиоты макроорганизма, которым является человек) [6]. Как и микробиота, микробиом обозначает микробное сообщество в целом, а следовательно, и классифицируется аналогичным образом. Подобно классификации микробиоты, возможно выделение микробиомов отдельных биотопов макроорганизма и отдельных таксономических групп (бактериом, виром и микобиом), а также резидентного и транзиторного микробиомов. Такая близость между этими двумя понятиями приводит к тому, что термин «микробиом» постепенно утрачивает из дефиниции методологическую специфичность и становится синонимом микробиоты, в результате чего его начинают использовать для обозначения не только совокупности геномов, но и самой совокупности микроорганизмов. Этому же способствует и мода на всевозможные -омы (транскриптомы, протеомы, метаболомы), манифестировавшая появлением целого комплекса т. н. омиксных технологий как раз после приобретения микробиомом широкой известности, когда этот суффикс понимается как обозначение «всей совокупности чего-то». И хотя обнаружение генетического материала микроорганизма все же не тождественно обнаружению самого микроорганизма (в особенности жизнеспособного), сейчас во многих работах термины «микробиом» и «микробиота» взаимозаменяемы и практически тождественны [10].
Война и мир
Итак, все мы с головы до ног покрыты слоем микробов. Микроорганизмы заселяют все поверхности человеческого тела, так или иначе соприкасающиеся с внешним миром: кожные покровы, конъюнктиву и роговицу глаз, желудочно-кишечный тракт, урогенитальный тракт, дыхательные пути.
Как и в любом биотопе, между членами микробиоты любого из этих мест складываются самые разные отношения: мутуализм, комменсализм, хищничество, паразитизм, аменсализм и аллелопатия [11]. Особенность микробиоты заключается в том, что в этом биотопе среда (макроорганизм) в отличие от других экосистем не безответная неживая материя, а такой же живой организм с собственным гомеостазом, который является полноценным членом сообщества и так же вступает во всевозможные взаимоотношения со своими обитателями. Спектр взаимоотношений макроорганизма и микроорганизмов столь же широк, как и у микроорганизмов между собой: от взаимной выгоды (мутуализма) и нейтралитета (комменсализма) до сдержанного антагонизма и потенциального паразитизма оппортунистов. То, как сложатся эти взаимоотношения, в равной степени зависит как от микроорганизма, так и от макроорганизма.
Со стороны микроорганизма таким судьбоносным значением наделена группа морфофункциональных признаков, которые объединяются под названием «факторы агрессии» [12]. Это в первую очередь ферменты, способные к разрушению клеток и тканей макроорганизма, факторы адгезии, эндо- и экзотоксины. Если факторов агрессии нет, а присутствие микроорганизма оказывается чем-то полезно для макроорганизма (например, секрецией каких-то метаболитов), то получается мутуализм. Если же нет ни факторов агрессии, ни полезных метаболитов, получается комменсализм. Если же есть факторы агрессии, то при условии их достаточно низкой активности микроорганизм попадает в разряд оппортунистов, или условных патогенов [13, 14]. При этом колонизация макроорганизма не переходит в инфекционно-воспалительный процесс только благодаря недостаточности факторов агрессии микроорганизмов и действию защитных механизмов макроорганизма. Действие факторов агрессии минимизируется за счет регуляции численности имеющих их микроорганизмов, поэтому для развития инфекции необходимы особые условия, например, иммунодефицитное состояние макроорганизма или особо вирулентный штамм микроорганизма. Механизмы подобной регуляции существуют самые разнообразные: от непосредственного воздействия за счет секреторных иммуноглобулинов до культивирования менее вирулентных конкурентных видов. И здесь уже главную роль играет макроорганизм.
Со стороны макроорганизма существует несколько уровней защитных механизмов. Подобно тому как в лечебном учреждении борьба с внутрибольничной инфекцией начинается с планировки здания, первый уровень защиты макроорганизма заключается в морфофункциональной организации тела. Суть структур и механизмов этого уровня сводится либо к созданию барьера, препятствующего продвижению микроорганизма (обеспечивается морфологической организацией органа или ткани), либо к созданию условий для уменьшения количества микроорганизмов на единицу поверхности органа (за это отвечают физиологические механизмы, которые также могут действовать на основе двух принципов: смывание микроорганизмов током жидкости или создание неблагоприятных условий для их жизнедеятельности). Сюда относятся анатомические и физиологические особенности, обеспечивающие однонаправленный ток биологических жидкостей или содержимого полых органов, тем самым создающие механические препятствия распространению микроорганизмов — система сфинктеров и перистальтика полых органов желудочно-кишечного и урогенитального трактов, мукоцилиарный клиренс респираторного тракта, а также моргание и отток слезной жидкости, омывающей конъюнктиву. К физиологическим особенностям также стоит отнести химически агрессивную среду (относительно экстремальный уровень рН, токсичные для микроорганизмов соединения, активные литические ферменты) экзокринных биологических жидкостей и содержимого полых органов, как это наблюдается в желудочно-кишечном, урогенитальном трактах или секрете потовых желез [15].
Все экзокринные биологические жидкости человека (слизь, слюна, слезы, пот, а также сурфактант — все, что выделяется на поверхность слизистых оболочек и покровов тела и составляет надэпителиальный слой) способны обеспечить защиту подлежащего эпителия, поскольку содержат смесь веществ, обладающих микробостатическим и микробоцидным эффектом: низкоспецифичные секреторные IgA, коллектины, фиколины, лизоцим, а также иммунные клетки (макрофаги, лимфоциты) [15, 16, 17, 18]. Сам эпителий благодаря наличию плотных межклеточных контактов (запирательные пояски) и базальной мембраны превращается в труднопреодолимый физический барьер, который на данный момент считается основным инструментом макроорганизма, позволяющим различать нормальную микробиоту и патогенные микроорганизмы [19, 20, 21]. Дополнительно усиливают защиту эпителия интраэпителиальные лейкоциты (лимфоциты, эозинофилы, моноциты, макрофаги), а также дендритные и тучные клетки [16, 22, 23]. Наличие у эпителиоцитов иммунокомпетентных свойств (достигающих максимальной выраженности у М-клеток ЖКТ, которые представляют собой субпопуляцию иммуноспециализированных эпителиоцитов) вместе с богатой палитрой истинных иммунных клеток подслизистого слоя (макрофаги, дендритные клетки, тучные клетки, эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты), которые в особенно «горячих» зонах (носо- и ротоглотка, ЖКТ) организуются в специализированные лимфоидные органы (миндалины, кишечно-ассоциированная лимфоидная ткань в виде отдельных лимфоидных фолликулов, пейеровых бляшек и диффузной лимфоидной ткани аппендикса), обеспечивает возможно более раннюю элиминацию просочившихся через эпителиальный фильтр микроорганизмов. Подлежащие ткани (подслизистый слой слизистых оболочек, дерма кожи) дренируются лимфатическими сосудами, поэтому если микроорганизму все же удалось миновать этот укрепленный рубеж, то дальше его путь лежит соответственно току тканевой жидкости в лимфатические сосуды, которые ведут прямиком в регионарные лимфатические узлы, где его уже ждут полчища всевозможных типов лимфоцитов. Кроме того, сама лимфа содержит широчайший спектр клеточных и гуморальных противомикробных агентов, аналогичный таковому плазмы крови (см. ниже). Если из подлежащих тканей микроорганизму удастся пробраться в кровоток (наиболее вероятен такой вариант при естественном нарушении непрерывности сосудистой стенки, например, при наличии фенестрированных капилляров, как это наблюдается в ЖКТ), то здесь на этот случай сосредоточены еще более серьезные силы. Это комплемент, пентраксины (С-реактивный белок), разнообразные иммуноглобулины (IgМ, IgG) и большая часть клеток иммунной системы (моноциты, нейтрофилы, эозинофилы, базофилы, лимфоциты) [15, 16]. И если от гуморальных факторов еще могут спасти защитные покровы микроорганизма, то от иммунных клеток ускользнуть не получится — как мы только что видели, ими буквально нафаршированы все пограничные ткани. Каждая микробная клетка несет особые молекулярные «метки» (РАМР (pathogen-associated molecular patterns), или корректнее МАМР (microbe-associated molecular patterns) — высококонсервативные молекулярные структуры, имеющиеся практически у любого микроорганизма), к обладателю которых вне зависимости от его патогенности иммунные клетки настроены враждебно.
Как видим, по направлению от поверхности тела к жидкостям внутренней среды качественное и количественное присутствие защитных иммунных агентов прогрессивно нарастает. И если морфологические и физиологические защитные факторы направлены на предупреждение проникновения микроорганизмов в живые ткани, то иммунологические факторы нацелены на элиминацию микробов, уже попавших вглубь ткани. Есть еще одно принципиально важное и глубокое различие между анатомо-функциональными и иммунологическими защитными факторами: если через первые макроорганизм реализует свой средообразующий потенциал, то посредством вторых макроорганизм проявляется как полноправный, «живой» член микробиологического сообщества. Его условно можно представить в виде огромной популяции одноклеточных микроорганизмов, которая по экологическим взаимоотношениям с другими членами микробиома аналогична популяциям любых других микроорганизмов. К примеру, гуморальные защитные факторы макроорганизма – столь же показательный пример аллелопатии, как антибиотики у микроорганизмов.
Наличие подобных иммунологических защитных факторов определяет так называемый немедленный ответ, перманентно протекающий в любой момент времени и в любом месте макроорганизма, когда иммунная система находится в состоянии относительного покоя [16]. Немедленный ответ осуществляется за счет неактивированных, предсуществующих иммунных факторов — гуморальных и клеточных защитных агентов в надэпителиальном слое, эпителиальном пласте, подлежащих тканях и жидкостях внутренней среды, которые были названы выше. За счет немедленного ответа происходит постоянная инактивация и элиминация микробов, контактирующих с живыми тканями макроорганизма, что предотвращает их колонизацию. В целом, защитная система макроорганизма перманентно активна и построена таким образом, будто бы любой микроорганизм, контактирующий с макроорганизмом, по умолчанию является патогенным. Состояние здоровья, внешне определяемое как гармоничное и стабильное, достигается не чем иным, как насилием — превентивными репрессиями и постоянным безжалостным угнетением собственной микробиоты, которому может позавидовать руководство самого отъявленного тоталитарного режима. Тем не менее благодаря именно этому безжалостному насилию макроорганизм не уступает ни одному микробу без упорной борьбы. В этом случае приобретение всего лишь соответствует цене: заплатив миллион раз миллионами жизней, человек купил право жить в насквозь микробном мире Земли.
Нельзя сказать, что все эти меры избыточны. Современная Земля остается гигантской чашкой Петри, где любой соприкасающийся с ее контаминированными средами организм вынужден становиться их частью. В этих условиях остается лишь контролировать собственное микробное население. Однако даже хорошо управляемые, смирные комменсалы способны учинить восстание, например, именно они примут живейшее участие в разложении останков недавнего хозяина [24]. Они же не прочь при случае начать пиршество пораньше — это свойство нормальной микробиоты позволило некоторым авторам сравнить кишечник в условиях скомпрометированных защитных механизмов с «недренированным абсцессом» [25]. При недостаточности названных механизмов (относительной — если они функционально адекватны, но в организм проник в достаточной дозе патогенный микроорганизм, или абсолютной — если какой-то из них неэффективен, и тогда хватает условно-патогенного микроорганизма) активируются стандартные механизмы иммунного ответа и развивается инфекционный процесс. Вероятно, переход немедленного ответа в ранний индуцибельный и далее в адаптивный обусловлен достижением некой пороговой концентрации РАМР и DАМР, в результате чего растет и концентрация различных цитокинов, что запускает прогрессирующую активацию воспалительного каскада. При этом первые отражают количество контактирующих с живыми тканями микроорганизмов, вторые — степень повреждения этих тканей, а третьи — активность иммунного ответа.
На границах Ойкумены
Учитывая описанные механизмы, нетрудно понять, почему внутренняя среда здорового организма, образованная кровью, лимфой и тканевой жидкостью, а также все внутренние органы (в том числе терминальные отделы различных физиологических трактов вроде дыхательной системы и мочеполового аппарата) всегда считались абсолютно стерильными — этакой непригодной для жизни землей на границах мира бушующей микробной жизни. Напротив, в случае болезни (особенно связанной с инфекционным процессом или повреждением покровных тканей) большая часть этих механизмов нарушается, и тогда микроорганизмы начинают обнаруживаться во внутренней среде. Получается, здоровье и микробы в тканях внутренней среды несовместимы, как несовместимы здоровье и болезнь. А значит, само выявление любых микроорганизмов в тканях внутренней среды должно расцениваться как безусловный и очень грозный признак далеко зашедшего инфекционного процесса [26, 27].
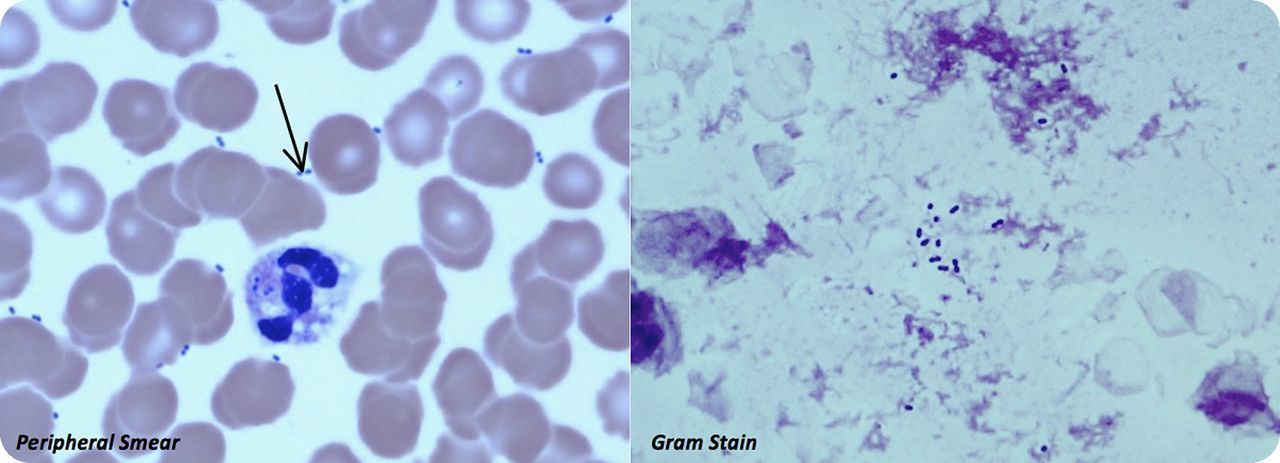
Рисунок 1 | Диплококки в мазке крови пациента с септическим шоком. Слева — окраска по Райту, справа — окраска по Граму. [28].
Примерно к таким умозаключениям пришел еще Роберт Кох [29]. И примерно так и было во времена «гермофобических» настроений ХIХ–ХХ вв., когда бактериемия понималась практически как синоним сепсиса. Однако с тех пор сменилось много концепций, и вот уже давно известно, что сепсис может быть без бактериемии — точно так же, как бактериемия без сепсиса (но по-прежнему с инфекционным процессом) [30]. Осталось только определиться, могут ли присутствовать микробы в тканях внутренней среды, в том числе в крови, без развития инфекции?
Кровь, лимфа и ткани как источник микробиоты
Кровь — это самый крупный и хорошо исследованный компартмент внутренней среды. Ввиду колоссального мирового опыта по изучению образцов крови с помощью самых различных методов (от микроскопии до бактериологического исследования) и патогенетической логичности (наличие у крови бактерицидных свойств) стерильность ее, казалось бы, совершенно аксиоматична и не требует каких-либо специальных доказательств. Однако в научной периодике время от времени появляются сообщения, авторы которых обнаруживают следы присутствия микроорганизмов в крови здоровых людей: раньше это были бактерии при микроскопии или культивировании [31, 32, 33], сейчас это чаще всего косвенные признаки, вроде микробного генетического материала. К примеру, на момент написания этой заметки в материалах «Human Microbiome Project» приводится 75 полученных из крови образцов микробного генетического материала, 3 из которых относятся к генетическому материалу эукариот (идентифицированы как Candida parapsilosis, Candida tropicalis и Candida krusei), а остальные — к бактериальному материалу [34]. И хотя большая часть подобных результатов оказывается невоспроизводима и, вероятнее всего, является всего лишь артефактами — следствием чрезвычайно малого, случайного (и потому неизбежного) микробного загрязнения образцов или реагентов, некоторые случаи оказываются более интересной и сложной головоломкой.
Методом ПЦР из крови здоровых людей выделена рибосомная ДНК бактерий родов Aquabacterium, Stenotrophomonas, Budvicia, Serratia, Bacillus, Flavobacteria, Riemerella, Acidovorax, Propionibacterium, Pseudomonas [35, 36, 37]. Конечно, можно предположить, что бактерии попали в кровь с поверхности кожи при венепункции или в результате нарушения техники забора материала, какой-либо незамеченной ошибки в обработке пробы, приведшей к бактериологическому загрязнению [37]. Если же все эти факторы добросовестно исключены, то необходимо проверить на загрязнение используемые реагенты (вода, буфер, реактивы ПЦР) и сравнить с результатами анализа крови. И если количественно и качественно эти результаты окажутся схожи, то обнаружение «микробиома крови», скорее всего, является следствием загрязнения реагентов. Подобное загрязнение действительно вносит вклад в результаты исследований, поэтому те из них, где не проанализирована вероятность загрязнения каждого реагента, не могут быть достаточно убедительными [35]. Так, обнаружение в образцах нуклеиновых кислот бактерий родов Propionibacterium и Pseudomonas, вероятнее всего, обусловлено реагент-ассоциированным загрязнением (примеси рибосомальных нуклеиновых кислот этих бактерий обнаруживаются в составе реагента ПЦР — Taq-полимеразы), однако ДНК представителей остальных родов чаще выявляется в образцах крови, чем в контроле. А это действительно аргумент в пользу точки зрения, согласно которой кровь сама по себе может содержать бактериальный генетический материал.
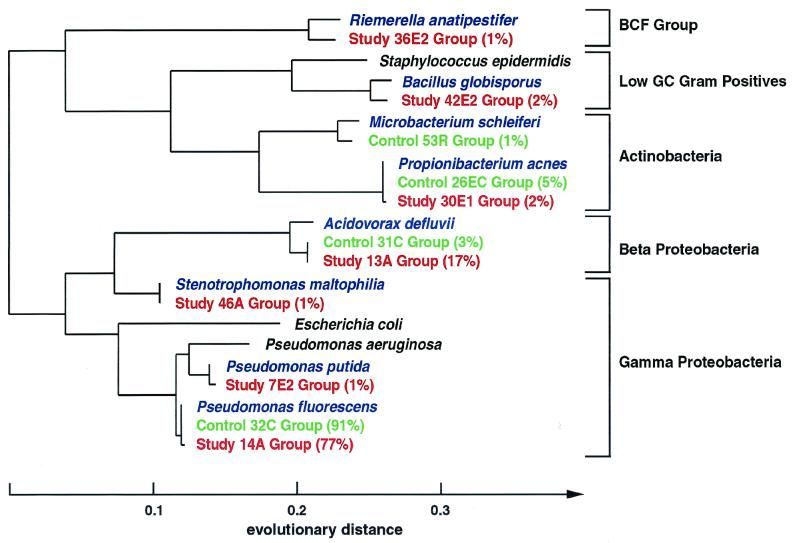
Рисунок 2 | Филогения образцов 16S рДНК, выделенных из крови здорового человека. Красным выделены последовательности, выявленные в крови; зеленым — обнаруженные в контроле (дистиллированная вода); синим — последовательности эталонных штаммов; черным — последовательности эталонных штаммов клинически значимых бактерий, родственных выделенным (добавлены для сравнения). Цит. по [35].
Однако наличие генетического материала бактерий еще не доказывает наличие даже погибших бактерий в крови: к примеру, он мог бы попасть в жидкости внутренней среды из уже погибших бактерий, населяющих слизистые оболочки. Убедительнее могли бы выглядеть сами бактериальные клетки, демонстрируемые с помощью визуализирующих методов в крови здоровых испытуемых, однако подобные объекты обнаруживаются гораздо реже, чем бактериальный генетический материал [38, 39, 40].
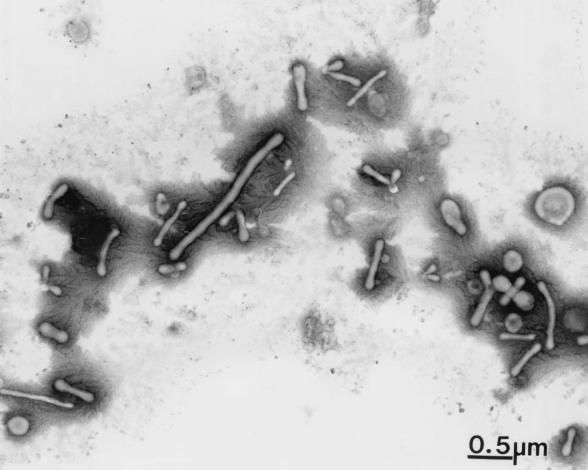
Рисунок 3 | Бактериеподобные структуры из крови. Трансмиссионная электронная микроскопия. Цит. по [38].
Это и правда мог бы быть хороший аргумент в пользу физиологической нестерильности крови, если бы не одно но: в живых тканях и биологических жидкостях (в том числе крови, [41]) могут образовываться микроскопические кристаллы белка и минералов, в первую очередь альбумина и гидроксиапатита, морфологически похожие на очень мелкие бактериальные клетки и демонстрирующие некоторые свойства настоящих живых бактерий (рост и «деление», «культивируемость» с образованием растущих и перевиваемых колоний, индукция иммунного ответа), что поначалу немало запутало исследователей и послужило причиной называть их «нанобактериями», а в итоге даже описать как новый биологический вид [42, 43]. Однако к настоящему времени доказано, что эти специфические преципитаты не являются ни бактериями, ни живыми существами вообще [44, 45, 46]. Структуры на рис. 3, демонстрирующиеся в исследовании McLaughlin et al., подозрительно близки к нанобактериям по размерам и морфологии, что не позволяет с достаточной уверенностью считать обнаружение подобных образований признаком бактериальной контаминации. И хотя в итоге существование настоящих бактерий с экстремально малым размером клетки и полноценным геномом (последний и есть главное отличие настоящих нанобактерий от кристаллических самозванцев), теперь называющихся ультрамикробактериями, все же удалось подтвердить ([47]), не демонстрирующая какой-либо четкой закономерности полиморфность обнаруживаемых в крови частиц также может свидетельствовать в пользу их «нанокристаллической» природы. К тому же по-прежнему не доказано, что они обладают собственным генетическим аппаратом.
Кроме этих бактериеподобных кристаллов, в крови могут обнаруживаться гораздо более похожие на клетки структуры — на порядок больше размером, хотя по-прежнему очень непостоянной формы. Многие авторы отмечают наличие у них цитоплазматической мембраны, хорошо различимой при трансмиссионной электронной микроскопии. Об их существовании известно с 70-х гг. прошлого века — гораздо дольше, чем длятся ПЦР-дебаты о стерильности крови, но все это время их природа остается неясной. Некоторые авторы предполагают, что это L-формы бактерий, которые становятся такими под влиянием агрессивных условий жизни в кровотоке [39].
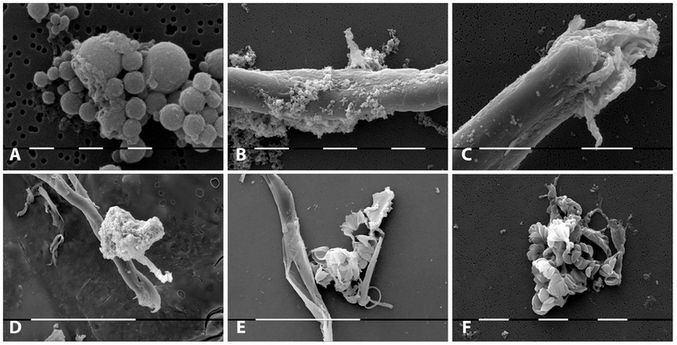
Рисунок 4 | Сканирующая электронная микроскопия структур, похожих на L-формы бактерий. А — кластер сферических телец; В, С, D — филаментозные формы с расположенными рядом маленькими гранулярными, овальными, коккоидными структурами; E, F — конгломераты остатков мембраны и L-нитевидных структур. Цит. по [39].
Однако для них тоже может найтись заурядное объяснение: это могут быть просто фрагменты погибших и поврежденных клеток крови, иными словами — клеточный детрит. Именно такую природу для бактериоподобных структур крови предлагает Martel J. et al., демонстрируя в цитируемой публикации, как с помощью этого механизма может образоваться «бактерия» с любой морфологией [48]. Чрезвычайная полиморфность и частое соседство подобных структур с явными скоплениями клеточного детрита может служить аргументом в пользу этой точки зрения.
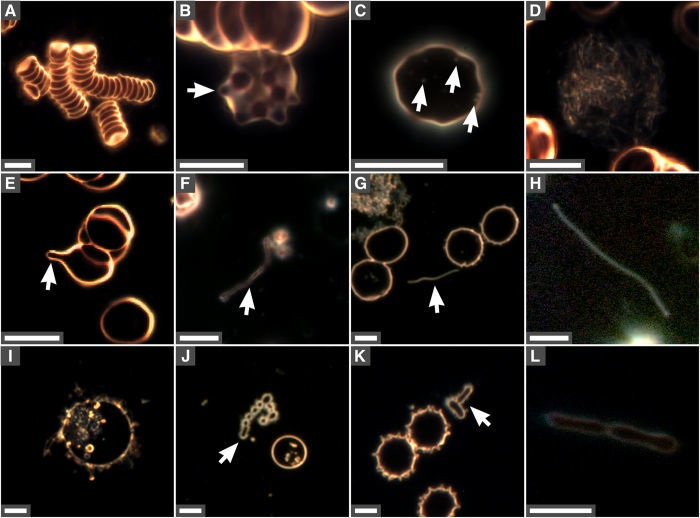
Рисунок 5 | Изменения в эритроцитах и образование бактериеподобных структур в инкубированной крови человека. Аликвоты человеческой крови инкубировали при 30° С в течение семи дней и наблюдали с помощью микроскопии в темном поле без фиксации и окрашивания. A — агрегированные эритроциты; B — эритроцит со спикулами (стрелка); С — частицы внутри эритроцитов (стрелки); D — нитевидный клеточный детрит; E — везикуляция эритроцитов спикулами или образованием канальцев (стрелка); F — мембранные структуры; G, H — удлиненные бактериеподобные формы (стрелка в G) ; I — внутриклеточные везикулы; J — коккоидоподобные везикулы (стрелка); K — бактериеподобные формы (стрелка); L — бактериеподобные структуры, похожие на клетки во время деления. Цит. по [48].
Убедительнее прочих среди исследований, отстаивающих существование микробиоты крови, выглядит работа Panaiotov et al., где авторы использовали практически все возможные методы выявления микробов: ПЦР, электронную микроскопию, световую микроскопию и даже культивирование — и с помощью каждого из них обнаружили микроорганизмы [40]. ПЦР была проведена с учетом реагент-ассоциированного загрязнения и из-за особенностей подготовки материала (использование нуклеаз) должна была учесть только материал, выделенный из лизированных эритроцитов. В итоге полученный генетический материал идентифицировали с точностью до типов как бактериальный (преимущественно тип Proteobacteria) и грибковый (преимущественно Basidiomycota в некультивированных образцах, в культивированных — неидентифицированный тип).
Однако особенный интерес представляют результаты микроскопии и культивирования. С помощью трансмиссионной электронной микроскопии и световой микроскопии с окрашиванием по Граму авторы обнаружили в образцах крови кокковидные образования с грам-положительной сердцевиной и грам-отрицательной оболочкой («плотные тельца») и цепочки более мелких грам-отрицательных «первичных клеток». Однако специфическая окраска на ДНК с акридиновым оранжевым для них оказалась практически безуспешной (как предположили авторы, из-за низкой проницаемости мембраны).
Кроме того, образцы крови были культивированы после специальной «реанимации» при 43° С на среде с человеческой кровью и высоким содержанием витамина К — и после 30 дней инкубации были обнаружены колонии диаметром 0,5-1 мм, в которых при микроскопии обнаруживались те же коккоподобные структуры, а при ПЦР — генетический материал тех же типов (хотя количественное соотношение материала отдельных типов существенно менялось: после культивирования количество генетического материала протеобактерий снизилось до 46 %, а почти всех других типов, напротив, выросло, причем так же изменилось не только относительное количество, но и абсолютное). Но в дальнейшем колонии больше не росли.
Видимо, для проверки жизнеспособности этих структур авторы решили изучить их реакцию на различные повреждающие факторы: механическое разрушение во встряхивательной машине (вортексе) с помощью стеклянных шариков диаметром 0,1 мм, действие микроволнового излучения, ультразвука и даже радиации. Во всех случаях структуры сохраняли целостность — только при особенно длительном воздействии «плотные тела» распадались на «первичные клетки».
В целом, это чрезвычайно интересное и разноплановое исследование, которое могло бы окончательно доказать существование микробиоты крови, но все происходит ровно наоборот. Поскольку из исследования исключены внеклеточные нуклеиновые кислоты, анализировалась только внутриклеточная генетическая информация, и в некультивированных образцах она (вполне предсказуемо) оказалась на 93 % протеобактериальной, поскольку именно от этой группы бактерий происходят митохондрии [49, 50, 51]. Хотя зрелые эритроциты не содержат митохондрий, в них могут оставаться и даже накапливаться их нуклеиновые кислоты [52]. Это же предположение может объяснить значительную убыль протеобактериального генетического материала при культивировании как результат постепенного разрушения митохондриальных нуклеиновых кислот. Таким образом, исследование Panaiotov et al. не доказывает, что выявленный генетический материал принадлежит бактериям, а не является нуклеиновыми кислотами митохондрий, оставшимися в цитоплазме эритроцитов. Однако увеличение абсолютного количества генетического материала других типов во время культивирования все же не позволяет совершенно опровергнуть существование микробиоты крови — скорее напротив, среди всех аргументов статьи этот почти не обсуждаемый авторами факт становится самым веским доводом в пользу этой гипотезы.
Морфологически коккоподобные структуры вполне схожи с некоторыми из описанных Martel J. et al. продуктов деградации эритроцитов, а чрезвычайная устойчивость к повреждающим факторам, включая радиацию, делает их принадлежность к живым бактериям сомнительной. Усомниться в этом же позволяет плохое окрашивание ДНК акридиновым оранжевым, которое возможно попросту по причине ее отсутствия, а не только из-за необъяснимо низкой проницаемости мембраны. Даже образование «первичных клеток» при экстремально длительном повреждении может оказаться аргументом в пользу детритной природы подобных структур, поскольку по размерам они сходны с нанобактериями и также могут оказаться белковыми преципитатами, в том числе образующимися при разрушении мембраны кокковидных «плотных телец». Единственное, что трудно объяснить — это рост колоний при культивировании. Хотя если похожий феномен существует для нанобактерий, почему он не может существовать для более крупных субклеточных структур?
По большому счету работы, описывающие культивирование бактерий из крови здоровых доноров, не особенно убедительны. Не всегда получается доказать, что обнаруженные культуры однозначно являются результатом деятельности бактерий из крови. А если это удается, то не получается достоверно исключить контаминацию крови при заборе [37]. Кроме того, существуют некультивируемые бактерии, к которым могут принадлежать потенциальные члены микробиоты внутренней среды. Вполне вероятно, что некультивируемыми они становятся не только из-за своих физиологических особенностей, но и из-за чрезвычайно высокого разведения, при котором количество бактерий в используемых для исследования объемах крови не достигает необходимого для роста колоний титра. Однако в этом случае стоило бы их поискать на структурах, способных агрегировать и тем самым концентрировать бактерий в естественных условиях. К подобным структурам относятся сама сосудистая стенка и любые образования в просвете сосуда — стенты, тромбы, противоэмболические фильтры и т. д. Поэтому следующий аргумент приверженцев «нестерильной» крови — это выделение бактерий из сосудистой стенки.
Давно известно, что в стенке кровеносных сосудов обнаруживается микробный генетический материал — причем здесь его заметили раньше, чем в самой крови. ДНК Chlamydia pneumoniae (вместе с ДНК цитомегаловируса и герпесвирусов 1-2 типов) из артериальной стенки даже успела подлить масла в вяло тлеющий огонь инфекционной теории атеросклероза [53, 54]. Подобные сообщения мало чем отличаются от аналогичных для крови, поэтому к ним применимы все аргументы, которые мы уже успели обсудить. Гораздо больший интерес представляют те работы, где микробные клетки визуализируются.
В первую очередь это позволяет электронная микроскопия — именно этот метод в дополнение к ПЦР используют Armingohar Z. et al. [55]. Данная работа примечательна тем, что результаты ПЦР демонстрируют большее количество более разнообразного бактериального генетического материала в стенке атеросклеротически измененных артерий у пациентов, страдавших пародонтитом, — это наблюдение довольно органично вписывается в контекст давней истории наблюдения бактериемии, связанной со стоматологическими процедурами [56]. К результатам сканирующей электронной микроскопии по-прежнему остаются применимы аргументы в пользу кристаллической или детритной природы демонстрируемых частиц, хотя по сравнению с предыдущими форма этих структур (особенно палочкоподобных) производит впечатление более постоянной. Но главное — авторам все еще не удается доказать, что обнаруженная бактериальная генетическая информация локализуется именно в этих структурах.
Показать, что такие внутрисосудистые бактериоподобные структуры содержат ДНК, удалось команде S. Fry [57]. В этой работе исследовались кровь, атероматозный детрит и противоэмболические фильтры с помощью специфической флюоресцентной окраски, выявляющей ДНК. Флюоресцентная микроскопия образцов показала наличие внеклеточной ДНК в крови, толще детрита и на поверхности фильтров, а также ДНК, локализованной в похожих на короткие палочки и кокки структурах. Параллельно из этих же образцов была выделена ДНК, ПЦР которой показала наличие нуклеиновых кислот представителей 11 видов прокариот и 3 родов эукариот. С учетом результатов ПЦР обнаруженные в ходе микроскопии структуры, содержащие локализованную ДНК, были интерпретированы авторами как клетки микроорганизмов. Внеклеточная ДНК в этом случае может быть как частью биопленки, так и частью внеклеточных ловушек нейтрофилов, погибших путем нетоза. Обсуждаемая работа выглядит весомым аргументом в пользу гипотезы «контаминированности» крови и сосудистой стенки, однако по-прежнему микробная принадлежность локализованной в этих структурах ДНК остается недоказанной.
Тем не менее, это уже подтвердили работы B. B. Lanter и D. G. Davies, которые с помощью флуоресцентной гибридизации in situ (FISH), позволяющей определить локализацию конкретной последовательности нуклеотидов, обнаружили бактериальные 16S rRNA-последовательности в толще атеросклеротически измененной стенки сонной артерии [58]. Содержащие эти последовательности структуры были определены авторами как биопленки. Более того, в дальнейшем исследовании авторы сообщают, что им удалось получить культуры 10 бактериальных видов, выделенных из атеросклеротически измененной стенки [59], что указывает на жизнеспособность содержащихся в ней микроорганизмов. Интересно, что в не пораженном атеросклерозом участке стенки артерий того же пациента авторам не удалось обнаружить бактериальный генетический материал.
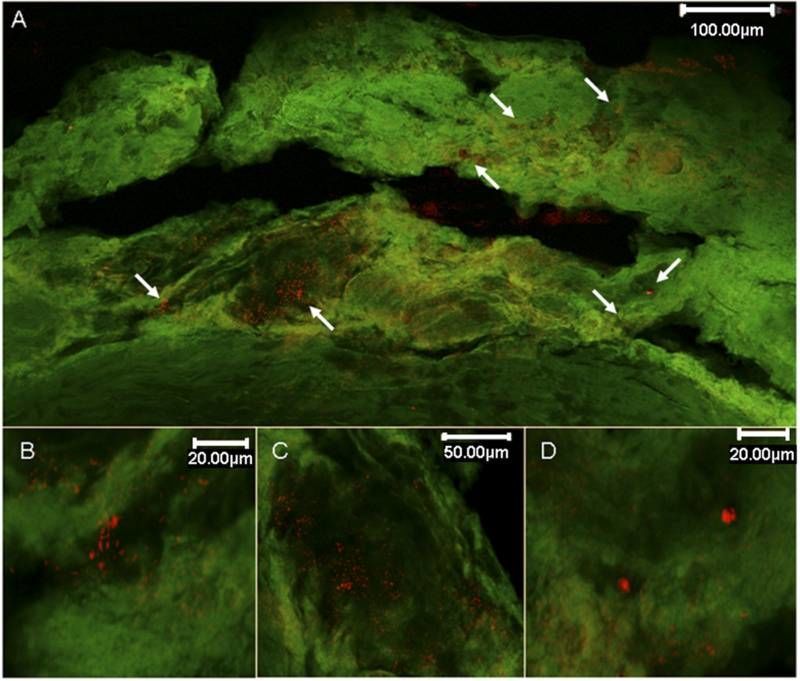
Рисунок 6 | Конфокальная микроскопия эубактериальной 16S рРНК, выявленной с помощью PNA-FISH в образце бляшки сонной артерии человека. (A) Общий вид места, где, по-видимому, произошел разрыв интимы, демонстрирующий поврежденную в результате тяжелого атеросклероза ткань, содержащую множественные флуоресцентные отложения. (B, C и D) Увеличенные изображения флуоресцентных отложений, показанных на панели A. Красная флуоресценция указывает на мишени зонда PNA-FISH эубактериального гена 16S рРНК; зеленая флуоресценция указывает на фон. Цит. по [58].
Хотя все авторы признают, что полностью исключить контаминацию практически невозможно, они отмечают, что обнаруженные бактерии не соответствуют типичным представителям вероятного загрязнения.
Если поврежденная сосудистая стенка, тромб или противоэмболический фильтр колонизируются гематогенным путем за счет «физиологической» бактериемии, логично предположить, что любые другие контактирующие с кровью импланты также должны подвергаться колонизации. Тем не менее, частота имплант-ассоциированных инфекций относительно невысока, а наличие микробной колонизации на поверхности имплантов, не демонстрирующих признаков инфицирования, не подвергалось систематическому изучению [60]. Кроме того, в большинстве случаев нельзя исключить возможность интраоперационной контаминации импланта, в первую очередь при контакте импланта с тканями пациента, где могут сохраняться жизнеспособные бактерии (например, в просвете рассеченных кожных желез). При этом многие авторы отмечают, что интраоперационной контаминации типичными представителями кожной микробиоты подвергаются около 50 % имплантов, которые, тем не менее, могут долгое время оставаться клинически «асептичными». При этом возможна длительная персистенция бактерий на поверхности импланта, которые со временем, медленно нарастив численность колонии, могут стать причиной отсроченных или поздних форм имплант-ассоциированных инфекций [61, 62]. Подобный механизм считается наиболее частым, однако он не исключает вклад гематогенной контаминации импланта. Обычно гематогенный механизм предполагается в случае поздних форм имплант-ассоциированных инфекций, когда ранее хорошо функционировавший имплант колонизируется микроорганизмами, источник диссеминации которых не всегда удается выявить, и тогда остается предполагать транзиторную бактериемию: спонтанную или связанную с медицинскими манипуляциями. Кроме того, гематогенная контаминация импланта пока что остается самой воспроизводимой экспериментальной моделью имплант-ассоциированных инфекций [63]. Обычно при этом модельным организмам с предварительно установленными имплантами вводят в кровоток небольшое количество бактерий, после чего наблюдают развитие той или иной формы имплант-ассоциированной инфекции (чаще всего остеомиелит). Интересно отметить, что не связанный с имплантами остеомиелит при этом развивается гораздо реже [64, 65]. По-видимому, это объясняется предпочтительной адгезией бактерий к поверхности импланта [66]. Хотя со временем имплант подвергается остеоинтеграции (обрастает костной тканью), могут сохраняться (или появляться в результате резорбции) области контакта с костным мозгом, а значит, и заполняющей его синусоиды кровью [67, 68]. По-видимому, как в случае экспериментальной модели, так и в случае поздних форм именно с адгезии к импланту принесенных с кровотоком бактерий начинается инфекционный процесс, который проявляется в виде перипротезного остеомиелита. Высокая частота последнего среди имплант-ассоциированных инфекций также может косвенно свидетельствовать в пользу гематогенного пути инфицирования. В свою очередь, гематогенное инфицирование в случае отсутствия патологического источника бактериемии может стать аргументом в пользу физиологической транзиторной бактериемии.
Таким образом, обнаружение бактериального генетического материала и бактериальных клеток с признаками жизнедеятельности в стенке кровеносных сосудов [58] и спонтанное гематогенное инфицирование имплантов [63] становятся наиболее убедительными, хотя и косвенными доказательствами физиологической бактериемии. Из-за крайне малого количества жизнеспособных клеток в объеме циркулирующей крови создается разведение с чрезвычайно маленькой концентрацией, практически исключающее возможность культивирования бактерий из крови здорового индивида [69] и вместе с тем контакта с клетками иммунитета, благодаря чему, вероятно, присутствие бактерий не начинает активный иммунный ответ, тогда как сосудистая стенка — комплекс тканей, наиболее тесно контактирующих с кровью и, соответственно, с ее микробиотой, — становится своего рода концентратором, где бактерии осаждаются. При этом следует отметить, что бактерии в значительно большей степени колонизируют атеросклеротические бляшки, чем интактный эндотелий; рискнем предположить, что это происходит благодаря созданию бляшкой ряда условий, благоприятствующих как адгезии, так и выживанию бактерий. Среди этих условий основными нам представляются гемодинамические (гемодинамический удар, способствующий «вбиванию» бактериальных клеток из кровотока в повреждения и неровности стенки бляшки, а также турбулентный ток крови, способствующий их осаждению на поврежденном эндотелии с дальнейшей адгезией и проникновением внутрь бляшки) и структурные (измененный эндотелий на поверхности, облегчающий проникновение внутрь за счет экспрессии адгезинов, и наличие тканевого детрита в бляшке, выступающего одновременно в качестве среды для адгезии, питательного субстрата и защиты, экранирующей бактериальные клетки от факторов немедленного ответа). Поэтому более вероятной представляется версия с колонизацией предсуществующих бляшек, чем их формирование в результате жизнедеятельности бактерий, однако вклад бактериальной колонизации в дальнейшее прогрессирование и дестабилизацию бляшки пока что остается неопределенным. Возможно, подобная аккумуляция становится достаточной для старта иммунного ответа, из-за чего вносит вклад в воспалительный механизм атерогенеза и объясняет наличие Т- и В-клеток в сосудистой стенке [70]. Таким образом, именно благодаря бляшке бактерии концентрируются в достаточных для культивирования количествах и становятся доступны для исследования, ведь на интактном эндотелии, как и в кровотоке, они быстро уничтожаются факторами немедленного ответа. По-видимому, аналогичным образом действуют любые другие выступающие в просвет сосуда структуры, такие как тромбы или противоэмболические фильтры. Если же на пути бактерии вместо бляшки или тромба попадается ортопедический имплант, то итог будет аналогичным, но развиваться он может по двум сценариям. Бактерии из кровотока попадают в соответствии с транспортом жидкости по компартментам внутренней среды в тканевую жидкость костного мозга или синовиальной оболочки — этот механизм обеспечивает относительная несостоятельность фильтра капиллярной стенки вследствие наличия и там, и там капилляров фенестрированного типа с фрагментированной базальной мембраной. С током тканевой жидкости в первом случае бактерии попадают сразу на поверхность импланта, а во втором — сначала в синовиальную жидкость и уже оттуда — на поверхность импланта. В этом случае синовиальная оболочка выступает в роли дополнительного тканевого фильтра, еще заметнее уменьшая количество бактериальных клеток; вероятно, это объясняет превалирование перипротезного остеомиелита над поражением полости искусственного сустава среди форм инфекции протезированного сустава (или начало этой инфекции с перипротезного остеомиелита). Затем бактерии адгезируются на поверхности импланта и колонизируют ее в виде биопленки. Вероятно, само наличие импланта создает условия для выживания и концентрации бактерий (в первую очередь благодаря высокой адгезивности и относительной безопасности от иммунных клеток, поскольку толща имплантата их не содержит и в ответ на колонизацию не выделяет медиаторов вроде DAMP) — точно так же, как это происходит в случае с атеросклеротической бляшкой [64].
Если в крови клинически здоровых людей могут обнаруживаться следы присутствия бактерий, то что насчет других микроорганизмов — эукариот и вирусов? В некоторых из обсуждаемых выше исследований отмечается присутствие чужеродного эукариотического генетического материала [57], к значению которого применимо абсолютно все, высказанное для прокариот. Что же касается вирусов и вирусного генетического материала, то здесь все не менее запутано. Вирусный генетический материал в виде герпесвирусной и цитомегаловирусной ДНК был обнаружен одним из первых [53] и до настоящего времени продолжает регулярно регистрироваться в многочисленных исследованиях. К настоящему времени из крови людей без симптомов болезни были выделены изоляты, классифицированные как принадлежащие вирусам семейства Anelloviridae (TTV, TTV-подобный вирус, SEN-вирус, TTV midi virus и TTV-подобный мини-вирус) [71], возможно, семейству Polyomaviridae [72], вирусу Эпштейна-Барр [73], вирусу гепатита С [74], а также семейству Marseilleviridae [75, 76, 77, 78], причем для части из них параллельно с ПЦР в образцах визуализированы вирионы с помощью электронной микроскопии. Наиболее крупное исследование [79] свидетельствует в пользу наличия у здоровых доноров герпесвирусов (герпесвирус 7 типа — в 20 %, вирус Эпштейна-Барр — в 14 % среди обследованных 8000 человек) и анелловирусов (9 %), в отношении остальных сохраняются весомые аргументы в пользу загрязнения [80].
Кроме вирусов эукариот, в крови обнаруживается генетический материал фагов отряда Caudovirales [81, 76]. Хотя для большей части бактериофагов имеются убедительные аргументы в пользу загрязнения [79], небольшая часть из них все же может быть малочисленной и редкой частью вирома крови. По-видимому, эти вирусы попадают в кровоток по механизму, аналогичному для бактерий — из бактериальной пленки, образованной бактериями-хозяевами этих вирусов при слущивании клеток и микротравмах эпителия [82].
Что же касается эукариотических вирусов, то кроме приобретения в течение жизни, вероятен вертикальный путь передачи этих вирусов с внутриутробным образованием вирома крови (к примеру, в пользу этого может говорить распространенность данных вирусов среди детей, которая достигает 77 % [75]); поддержание популяции вируса осуществляется за счет ограниченного, клинически незначимого размножения в клетках тропных тканей (в первую очередь гемопоэтических клеток, клеток крови и сосудистой стенки) с последующим выходом вирионов в кровоток. Также возможно, что некоторые из них остаются длительное время интегрированными в генетический аппарат клетки без формирования вирионов [79], и в этом случае нам приходится думать о «нормальном» вироме тканей. Святая святых организма — ткани его органов и частей тела — считаются в норме стерильными и лишенными микробиома, а все случаи обнаружения такового представляют собой латентные формы заболевания или носительство (как это происходит в случае токсоплазмоза, брюшного тифа, вирусных гепатитов и многих других заболеваний). Поэтому обнаружение постоянно интегрированного вирусного генетического материала стало неожиданностью. Этот материал довольно неоднороден и представлен мобильными генетическими элементами, псевдогенами и полноценными вирусными геномами [83]. Включение этого генетического материала в состав микробиома может быть в какой-то степени справедливо, пожалуй, только в отношении последних. Такие вирусные геномы, интегрированные в генетический материал клеток хозяина, по сути представляют собой провирусы, на тысячи и миллионы лет застывшие в этой стадии и, вероятно, уже не способные к спонтанной дезинтеграции и формированию свободных вирионов. Большая часть из них — это совершенно неактивные в патогенном отношении мутантные копии древних вирусов, интегрировавшиеся в человеческий геном сотни тысяч лет назад (HERVs) [84]. Их интеграция была настолько успешной, что некоторые из них не только утратили патогенность вместе со свободной формой (вирионом), но и обзавелись новыми функциями в пределах макроорганизма.Так, эффект экспрессии генетического материала ряда таких эндогенных ретровирусов (HERV-W, HERV-FRD) в организме млекопитающих нашел место в процессе формирования плаценты [83, 85]. Интересно заметить, что для некоторых более классических вирусов (например, парамиксовирусов, в частности, вируса кори) аналогичный феномен — образование синцития — известен в качестве цитопатического действия. Однако вероятно, что в некоторых случаях микробиота существует в тканях клинически здоровых носителей в классическом представлении: как вирусы, живущие среди тканей макроорганизма. Это те же герпесвирусы, обнаруживаемые в различных тканях (в первую очередь сосудистой стенки), а также цитомегаловирус, JC-вирус и вирус простого герпеса в ткани головного мозга [86, 87, 88, 89], что стало причиной роста популярности инфекционной гипотезы нейродегенеративных заболеваний [90]. В целом вопрос о том, отличается ли подобный виром от носительства в классическом представлении и, соответственно, является нормальным или патологическим, еще ждет окончательного разрешения.
Однако если в тканях могут присутствовать вирусы, не может ли подобное произойти с бактериями или другими микроорганизмами? Хотя имеются периодические сообщения об обнаружении бактериального генетического материала и даже бактериальных белков в тканях внутренних органов [89], резидентная бактериальная микробиота в тканях внутренних органов, как и в крови, в норме вероятнее всего отсутствует — если, конечно, не считать по аналогии с эндогенными ретровирусами за таковую митохондрии, которые (по крайней мере, с точки зрения клеток нашей иммунной системы) мало чем отличаются от бактерий [91]. Обнаруживаемый в образцах тканей некоторых внутренних органов бактериальный генетический материал, по-видимому, представляет собой следы микробиома крови. Различные виды Enterococcus, Staphylococcus, Streptococcus из костной ткани; Streptococcus sanguinis, обнаруженный в ткани сердца; Enterococcus faecalis из лимфатического узла; Fusobacterium necrophorum funduliforme из ткани печени — для них всех сходный генетический материал обнаруживается в образцах крови [34]. Таким образом, внутренние органы также содержат следы микроорганизмов и, вероятно, собственный микробиом. При этом микробиом крови и микробиом внутренних органов связаны теснейшим образом: остатки первого являются бактериомом внутренних органов (преимущественно транзиторный в норме и переходящий в резидентный при патологии, как мы это видели при атеросклерозе), а второй служит источником для большей части вирома крови. Более того, обнаружение жизнеспособных бактериальных клеток в стенках артерий и вирионов в крови позволяет говорить не только о микробиоме, но и о полноценной микробиоте внутренней среды. Вероятно, эта микробиота также не лишена внутренней структуры. Возможно, она организована по типу градиента: в тканях внутренней среды соответственно возрастающему градиенту защитных механизмов существует убывающий микробный градиент, по которому количество как микробных тел, так и микробного генетического материала во внутренней среде прогрессивно уменьшается — от жидкостей внутренней среды (кровь, лимфа) к стенке сосудов и от стенки к паренхиме внутренних органов. Данные «Human Microbiome Project» рисуют примерно такую же картину: если для крови известно 75 случаев регистрации чужеродного генетического материала, то для костной ткани — 27, для ткани сердца — 2, для лимфатических узлов и печени — по 1 случаю. В целом количество микробного материала во внутренней среде исчезающе мало и, по-видимому, не представляет клинического интереса, однако само предположение о его наличии замечательно подходит в качестве рабочей гипотезы для прежде необъяснимых казусов с обнаружением генетического материала или самих микробных тел в тканях внутренних органов без признаков инфекционно-воспалительного заболевания.
Если в крови и тканях обнаруживаются следы присутствия микроорганизмов, то в других жидкостях внутренней среды, производных от них, также должны быть подобные следы. Что касается лимфы, нам не удалось найти публикаций, посвященных ее возможному микробиому у здоровых людей. Но если экстраполировать на человека результаты, полученные на животном материале [92, 93, 94], то можно предположить, что лимфа и периферические лимфоидные органы (лимфатические узлы) также имеют собственный микробиом. Судя по общности предполагаемого источника микроорганизмов (бактерии и вирусы из подлежащих эпителию тканей — главным образом подслизистого слоя ЖКТ, а также вирионы из тканей паренхиматозных органов), микробиом лимфы должен быть практически идентичен микробиому плазмы крови. В пользу этой гипотезы говорит обнаружение сходного с микробиомом тканей микробиома жидкостей внутренней среды, продуцируемых аналогично лимфе, — спинномозговой жидкости с предсказуемым генетическим материалом герпесвирусов и менее ожидаемым бактериофагальным материалом [95, 96], синовиальной жидкости с протеобактериальным генетическим материалом [97, 98] и плевральной жидкости [99]. Вероятно, это также транзиторный микробиом, представленный бактериями и вирусами человека и бактерий. Отдельно следует сказать о возможном перитонеальном микробиоме, который у женщин может быть резидентным и более разнообразным благодаря сообщению брюшной полости с маточными трубами [100, 101, 102].
Лимфатические узлы представляют собой фильтр, аккумулирующий микробиологический материал лимфы, поэтому наибольшего богатства следует ожидать в поднижнечелюстных и мезентериальных лимфатических узлах — регионарных для лимфатических сосудов, дренирующих слизистые оболочки ротовой полости и кишечника, соответственно. Микробиом лимфатических узлов, вероятнее всего, представлен следами микробиома лимфы и крови. Однако если микроорганизмы или их молекулярные паттерны, включая ДНК, попадают в лимфоидную ткань, они должны вызвать иммунный ответ. С одной стороны, это не противоречит и даже способствует объяснению наличия IgA к микроорганизмам-комменсалам в физиологических условиях. С другой стороны, отсутствие непосредственного контакта микробиоты и тканей внутренней среды в норме (и появление такового в патологических условиях) могло бы объяснить патогенез некоторых заболеваний [103] — хотя, конечно, для этого есть и другие гипотезы и предполагаемые механизмы.
Получается, уже не осталось ни одного компартмента внутренней среды, где бы не было обнаружено следов микроорганизмов в физиологических условиях. Либо микроорганизмы действительно присутствуют в этих жидкостях, либо мы имеем дело с заблуждением, обусловленным методической ошибкой и неразрешимой с помощью используемых на данный момент методов исследования.
Путь к Океану
Однако если подобная «физиологическая бактериемия» возможна, как объяснить ее механизм?
Вероятно, такое объяснение есть. Все поверхности тела человека, так или иначе контактирующие с окружающей средой, покрыты бактериальной пленкой. Бактериальные клетки проникают сквозь эпителий при слущивании клеток и микротравмах, после чего попадают в межклеточные пространства подслизистого слоя. Наиболее вероятен такой транспорт бактерий сквозь однослойный эпителий. Косвенным подтверждением этого можно считать особенно частое обнаружение генетического материала Enterococcus faecalis и Enterococcus faecium (представители нормальной микробиоты кишечника, эпителиальная выстилка которого представлена однослойным эпителием) в образцах крови (из 75 случаев регистрации чужеродного генетического материала в крови выявлены в 15-ти и 20-ти случаях соответственно — по данным «Human Microbiome Project»). Затем бактериальные клетки по межклеточным пространствам достигают сосудов микроциркуляторного русла, через стенку которых и проникают в кровоток (вероятнее всего, такими сосудами становятся фенестрированные капилляры — и снова вспоминаем кишечник и энтерококков). При этом число клеток, попадающих в кровоток, критически мало; система тканей макроорганизма выступает в качестве многоуровневого фильтра, на каждый последующий уровень которого переходит меньшее количество бактерий: эпителий и его базальная мембрана, подслизистый слой с фагоцитами и лимфоидными клетками, стенка сосуда. Причем этот фильтр не просто механически препятствует продвижению микроорганизмов вглубь тканей, но и осуществляет лизис попавших в него микробов (за счет действия факторов немедленного ответа); и чем глубже уровень, тем более выражено это влияние, поэтому число микроорганизмов от уровня к уровню должно уменьшаться экспоненциально. Поскольку в ткани через кровоток поступает слишком мало бактериальных клеток, их невозможно выявить рутинными микробиологическими методами, и клинически выраженный иммунный ответ не развивается. Кроме того, попавшие в кровоток бактерии быстро элиминируются благодаря неспецифической бактерицидной активности плазмы (комплемент, β-лизин и т. д.) и форменных элементов (микро- и макрофагоциты), поэтому во внутренней среде в норме не возникает стабильной популяции микроорганизмов — вместо этого идут постоянный приток и постоянная элиминация бактерий. Вероятно, именно поэтому чаще обнаруживаются нуклеиновые кислоты бактерий (свидетельства свершившегося немедленного ответа), чем сами бактериальные клетки. Таким образом, микроорганизмы нормальной микробиоты в условиях здоровья хозяина могут проникать в кровоток, однако не способны жить и размножаться в данной среде и колонизировать внутренние органы. В этом случае кровь действительно не стерильна, а скорее «антисептична».
Из крови оставшийся микробный материал (вероятнее всего, нежизнеспособные бактериальные клетки, бактериофаги, микробный генетический материал) в соответствии с направлением тока жидкости в компартментах внутренней среды попадает в тканевую жидкость, где обогащается вирионами и вирусным генетическим материалом из клеток паренхимы или эндотелия, откуда затем переходит в лимфу. Однако в этом случае в течение всего пути на микроорганизмы продолжается действие комплемента и прочих противомикробных агентов этих жидкостей, а ткани сосудистой стенки, стромы или паренхимы выступают в качестве фильтра, поэтому количество микробной (в первую очередь бактериальной) генетической информации должно прогрессивно убывать вплоть до необнаружимых количеств. Тем не менее, в лимфе микробный генетический материал обнаруживается, и вероятно, что его дополнительно обогащают микроорганизмы, сквозь слизистые оболочки попадающие напрямую в тканевую жидкость в подслизистом слое и затем в дренирующие его лимфатические сосуды. С током лимфы микробный генетический материал попадает в ретикулоэндотелиальную систему регионарных лимфатических узлов, где может контактировать с антиген-представляющими клетками и, вероятно, участвовать в стимуляции иммуногенеза.
Более агрессивный микроорганизм за счет повреждения тканей вызовет более массивный иммунный ответ и потому будет уничтожен еще на этапе тканевой инвазии, до его проникновения в лимфо-/кровоток (подробнее см. соответствующий раздел).
Для механизма проникновения микроорганизмов во внутреннюю среду, не связанного с развитием воспаления, даже появился новый термин — транслокация. В первую очередь он призван разграничить патологическую инвазию, когда проникновение микроорганизма приводит к инфекционно-воспалительному процессу, и физиологическое путешествие низкопатогенного микроорганизма, не вызывающее воспаления. Однако и инвазия, и транслокация способны приводить к одинаковым патологическим процессам, хотя последняя только в случае присутствия отягощающего обстоятельства в виде острой кишечной непроходимости, ишемии кишечной стенки, асцита при циррозе или панкреонекроза.
Участие резидентной микробиоты кишечника в патогенезе инфекционно-воспалительных осложнений заболеваний, сопровождающихся снижением барьерных функций и неспецифической резистентности тканей, — хорошо известный факт, отчасти подтверждающий способность микроорганизмов к транслокации в условиях неповрежденной кишечной стенки. Особенно удачным является пример со спонтанным бактериальным перитонитом (СБП) при цирротическом асците, когда отсутствует повреждение кишки, и транслокация может быть объяснена только ростом сосудистой проницаемости в результате портальной гипертензии и в особенности снижением комплемента и других белков немедленного ответа в плазме. В пользу особой роли второго фактора может говорить редкость СБП при нецирротической портальной гипертензии [104]. Если транслокация возможна в условиях неповрежденной кишечной стенки, а перитонит развивается преимущественно в случае цирроза, то в нормальных физиологических условиях развитие инфекционного процесса лимитируют именно факторы немедленного ответа жидкостей внутренней среды, а не только барьерная функция эпителия. Возможность транслокации через неповрежденный эпителий, в свою очередь, создает патогенетический механизм для физиологической бактериемии.
Конкретные выводы
Присутствие микробного генетического материала в жидкостях внутренней среды выглядит правдоподобно [105]. Так, наличие микробного генетического материала в жидкостях и тканях внутренней среды в виде нуклеиновых кислот вирусов скорее доказано. Источник этого материала — микробиота слизистых оболочек и персистирующие вирусы тканей внутренней среды. Также вероятно присутствие жизнеспособных вирионов. Их источник — эндотелий, строма или паренхима обитаемых тканей; возможно, также микробиота для бактериофагов. Наличие бактериального генетического материала в крови здоровых доноров скорее вероятно, чем нет [37]. Его источники — митохондриальные нуклеиновые кислоты (ложноположительный результат), нуклеиновые кислоты из обитаемых тканей, из разрушаемых в крови бактериальных клеток или из живых клеток в крови. Таким образом, присутствие жизнеспособных бактерий в крови здоровых доноров также вероятно.
Конечно, всегда сохраняется вероятность того, что для каждого из приведенных аргументов найдется контраргумент, как это оказалось с амниотической жидкостью, выявление микробиоты в которой, вероятно, ошибочно [106], однако на данный момент больше аргументов в пользу наличия микробиома во внутренней среде.
На первый взгляд, обнаружение микробиоты внутренней среды ломает существующую парадигму вместе с клиническими корреляциями в диагностике и лечении. Однако принципиальное изменение клинической тактики вряд ли ожидаемо [107]. Микробное загрязнение внутренней среды в физиологических условиях настолько мало, что по-прежнему окажется за пределами разрешающих способностей любых клинических методов. Возможно, стоит его учитывать как возможный источник ложноположительных результатов только при использовании ПЦР в клинике для верификации бактериемии (и, вероятно, только в случае применения алгоритмов, сопоставимых по чувствительности с представленными в исследованиях данного обзора).
Отсутствие ожидаемых подтверждений колонизации новых биотопов бактериями, принесенными с током крови в физиологических условиях, также говорит в пользу практической незыблемости прежней парадигмы. К примеру, долгая дискуссия о фетоплацентарной колонизации кишечника плода бактериями ЖКТ матери пока что завершилась отсутствием убедительных доказательств в пользу этого механизма [106]. Дискуссия об энтеромаммарной миграции также пока что не предоставила достаточных доказательств существования этого явления [108], поскольку в силу очевидных причин результаты, полученные на иммунодефицитных мышах, не могут быть полноценно экстраполированы на иммунокомпетентных пациентов [109].
В то же время наличие подобного механизма в физиологических условиях и неизбежная интенсификация его в условиях патологии возвращают к дискуссии вопрос о необходимости антибиотикопрофилактики у пациентов в группах риска, для оценки эффективности которой в большинстве случаев недостаточно данных, вследствие чего требуются новые крупные исследования — источники для мета-анализов.
Из всех клинических исследований подобной тематики наибольший интерес могут представлять инфекционные осложнения интраваскулярных стентов. Хотя это редкие события, высокая клиническая значимость этих осложнений заставляет считать их профилактику оправданной. Давно известна роль микроорганизмов в индукции тромбоза [110]. Наличие стента с лекарственным покрытием, с одной стороны, предупреждает рестеноз, однако с другой — служит фактором аккумуляции микроорганизмов и последующей колонизации по аналогии с другими металлическими имплантами [111]. В случае физиологической бактериемии такой стент концентрирует микроорганизмы и создает среду для формирования биопленки. В это же время даже микроскопическая колония, наличие которой не сопровождается воспалением окружающих тканей, может запустить коагуляционный каскад. Таким образом, истинная доля тромбозов стентов, ассоциированных с колонизацией, может оказаться заниженной, как и роль антибиотикопрофилактики этого осложнения.
Однако наибольшей ревизии, по-видимому, потребуют гнотобионтические модели — для подтверждения их свободы, в том числе от такого остаточного микробного загрязнения или в случае сохранения последнего на отсутствие значимых эффектов, потенциально оказываемых микробиотой тканей на моделируемые процессы, например, старение, атерогенез или канцерогенез. Подобные работы проводились с калом гнотобионтных мышей, в результате чего остаточное микробное загрязнение скорее подтверждается, чем нет, хотя все еще с неясным результатом для жидкостей внутренней среды [112].
Абстрактные вопросы
Исследования, посвященные изучению таких «непризнанных» микробиомов, как микробиом крови или паренхиматозных органов, не слишком многочисленные и осторожные в плане формулировки выводов еще лет 10 назад, сегодня почти уверенно заявляют о микробиомах новых компартментов внутренней среды. Однако результаты многих из них не вписываются в традиционную клинико-микробиологическую парадигму, в соответствии с которой уже факт наличия микроорганизмов за пределами «сданных им в аренду» биотопов является признаком заболевания — острого или латентного (в зависимости от сопутствующей симптоматики). А если это инфекционное заболевание, то вне зависимости от наличия клинических проявлений оно требует лечения. С другой стороны, можно ли применять термины «заболевание» и «патология» к состоянию, обнаруженному у абсолютного большинства в любой выборке и клинически никак не проявляющегося? Да, многие из перечисленных микроорганизмов способны вызывать заболевания и потому более известны нам как патогенные (как, например, герпес-вирусы). Но при определенных обстоятельствах и давно признанная нормальной микрофлора может стать причиной заболевания и потому классифицируется как условно-патогенная. И если число заболевших составляет малую долю от числа инфицированных, не стоит ли данные микроорганизмы также отнести к условно-патогенным и, соответственно, представителям нормального микробиома? С другой стороны, многие животные в условиях естественной популяции столь же часто поражены гельминтозами, при этом клинические проявления инвазии могут быть минимальны или вовсе отсутствовать, хотя негативный эффект гельминтозов не подлежит сомнению. Неужели и гельминтов стоит причислить к нормальной микробиоте?
Ответов нет, есть парадигма. Для оценки этого особенно показательны заголовки статей — посмотрите, сколько из них сформулированы в качестве вопросов, что редкость для научной литературы. В первую очередь это случилось из-за сравнительно малого объема публикаций по теме и, соответственно, малой выборки для оценки (некоторая часть которой, кроме того, представлена пациентами с клинически скомпрометированной целевой системой органов, которые не могут считаться здоровыми), спорадического характера имеющихся исследований и отсутствия систематического подхода в разработке вопроса. Данные обсуждаемых в этом обзоре исследований тоже следует считать во многом предварительными и ориентировочными. Можно только сказать, что здесь начинается большой и трудный путь, который медицине ни за что не преодолеть без фундаментальных биологических дисциплин, в особенности экологии.
Между тем спор о том, что есть норма, а что — патология, применительно к микробиоте тела человека имеет гораздо более глубокий и принципиальный характер, чем очередная борьба теоретических концепций, поскольку именно на этом фундаментальном для практической медицины понятии покоится все здание рациональной терапии инфекционных заболеваний.
Выделение подобных «инфицированных» и «чистых» зон тела человека было во многом искусственно и слишком механистично. Очевидно, что те биологические барьеры, которые существуют между этими зонами, не являются для микроорганизмов непреодолимыми и не способны обеспечить их моментальную элиминацию. В то же время внутренняя среда человека, несмотря на всю агрессивность, остается очень перспективным для заселения биотопом — в первую очередь, благодаря стабильным и оптимальным для многих микроорганизмов условиям среды (температура, влажность, питательность и т. д.), что в совокупности с известной способностью микроорганизмов тем или иным способом приспосабливаться к практически любым условиям делает их обнаружение в ее пределах вполне ожидаемым.
Однако приспособление к жизни внутри макроорганизма вовсе не сводится к банальному приобретению резистентности к его гуморальным и клеточным защитным факторам. Как это ни удивительно, широкую распространенность среди популяции макроорганизма-хозяина скорее принесет не экспансивная стратегия (максимальная вирулентность с агрессивным течением инвазии, характеризующаяся максимумом воспроизведения микробных единиц за минимальное время), а латентная (минимум микробных единиц, однако более длительное время персистирования микробного агента в организме). Это объясняется двойным контролем микробной популяции (не только за счет МАМР, соответствующих количеству микробов, но и DАМР, показывающих степень повреждения клеток макроорганизма) — приверженцы первой всегда идут ва-банк, сразу вызывая массивный иммунный ответ, поэтому их время персистирования невелико и заканчивается либо гибелью, либо выздоровлением макроорганизма, тогда как вторые действуют осторожнее, и индуцированный ими иммунный ответ гораздо слабее, вследствие чего время персистирования оказывается дольше. При этом чем меньше агрессивность инфекционного процесса (а следовательно, и вирулентность патогена), тем больше время персистирования. Именно поэтому в эволюционном плане приспособление микроорганизмов к условиям среды-макроорганизма и достижение большей распространенности предполагает не только очевидный путь с непрестанным увеличением резистентности, но и снижение вирулентности. Именно поэтому среди обнаруженных во внутренней среде микроорганизмов исключительно условные патогены. С этой точки зрения микробиота внутренней среды, как и микробиота в целом — абсолютная персистирующая инфекция, агрессивность которой сведена к минимуму, но время персистирования растянуто на всю длину жизни хозяина. Оказывает ли это микробное давление на клетки долговременный патологический эффект, который окажется очередной каплей в чаше старения, атерогенеза, канцерогенеза?..
Источники:
- Ursell L. K. et al. Defining the human microbiome //Nutrition reviews. – 2012. doi: 10.1111/j.1753-4887.2012.00493.x
- Подвысоцкий В. В. Основы общей и экспериментальной патологии //СПБ. Изд. КЛ Риккера. – 1905.
- Микулинский С. Р. История биологии с древнейших времен до начала ХХ века. – М.: Наука, 1972.
- Ли И. А., Лазебник Л. Б. Изменения микробиоценоза кишечника и метаболизма липидов после гемиколэктомии //Экспериментальная и клиническая гастроэнтерология. – 2011.
- Мечников И. И. Этюды о природе человека. – Directmedia, 2015.; McFarland L. V. Normal flora: diversity and functions //Microbial ecology in health and disease. – 2009.
- Marchesi J.R., Ravel J. The vocabulary of microbiome research: a proposal // Microbiome. – 2015. doi: 10.1186/s40168-015-0094-5
- Handelsman J. et al. Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products //Chemistry & biology. – 1998. doi: 10.1016/S1074-5521(98)90108-9
- Fredericks D.N., Relman D. A. Sequence-based identification of microbial pathogens: are consideration of Koch's postulates //Clinical microbiology reviews. – 1996. doi: 10.1128/CMR.9.1.18
- Lederberg J., McCray A. T. Ome Sweet Omics – A Genealogical Treasury of Words //The Scientist. – 2001.
- Weinstock G. M. Genomic approaches to studying the human microbiota //Nature. – 2012. doi: 10.1038/nature11553
- Schommer N. N., Gallo R. L. Structure and function of the human skin microbiome //Trends in microbiology. – 2013. doi: 10.1016/j.tim.2013.10.001
- Rakoff-Nahoum S. et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis //Cell. – 2004. doi: 10.1016/j.cell.2004.07.002
- Otto M. Staphylococcus epidermidis—the 'accidental' pathogen //Nature Reviews Microbiology. – 2009. doi: 10.1038/nrmicro2182
- Achermann Y. et al. Propionibacterium acnes: from commensal to opportunistic biofilm-associated implant pathogen //Clinical microbiology reviews. – 2014. doi: 10.1128/CMR.00092-13
- Mayer, Gene (2006). Immunology — Chapter One: Innate (non-specific) Immunity. Microbiology and Immunology On-line.http://www.microbiologybook.or...
- Хаитов Р.М., Ярилин А.А., Пинегин Б.В. Иммунология: атлас.– М.: ГЭОТАР-Медиа, 2011.
- König J. et al. Human intestinal barrier function in health and disease //Clinical and translational gastroenterology. – 2016. doi: 10.1038/ctg.2016.54
- Cukrowska B. et al. Intestinal epithelium, intraepithelial lymphocytes and the gut microbiota-Key players in the pathogenesis of celiac disease //World journal of gastroenterology. – 2017. doi: 10.3748/wjg.v23.i42.7505
- Gewirtz A.T. etal. Cutting edge: bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression //The Journal of Immunology. – 2001. doi: 10.4049/jimmunol.167.4.1882
- Sansonetti P. Host–pathogen interactions: the seduction of molecular cross talk //Gut. – 2002. doi: 10.1136/gut.50.suppl_3.iii2
- Tamburini S. et al. The microbiome in early life: implications for health outcomes //Nature medicine. – 2016. doi: 10.1038/nm.4142
- Austin L. L., Dobbins III W. O. Intraepithelial leukocytes of the intestinal mucosa in normal man and in Whipple's disease //Digestive diseases and sciences. – 1982. doi: 10.1007/BF01296750
- Кораблёва Т. Р. Иммуноморфология интраэпителиальных лимфоцитов (обзор) //Наукові праці Південного філіалу Національного університету біоресурсів і природокористування України. – 2013.
- Jennifer L.Pechal, Tawni L. Crippen, M. Eric Benbow, Aaron M. Tarone, Scot Dowd, Jeffery K. Tomberlin. The potential use of bacterial community succession in forensics as described by high throughput metagenomics sequencing. International Journal of Legal Medicine. – 2014. doi: 10.1007/s00414-013-0872-1
- Marshall JC, Christou NV, Meakins JL. The gastrointestinal tract. The “undrained abscess” of multiple organ failure. Annals of Surgery. 1993. doi: 10.1097/00000658-199308000-00001
- Яковлев В. П., Яковлев С. В. Рациональная антимикробная фармакотерапия. – М. : Litterra, 2003.
- Christaki E, Giamarellos-Bourboulis EJ. The complex pathogenesis of bacteremia: from antimicrobial clearance mechanisms to the genetic background of the host. Virulence. 2014. doi:10.4161/viru.26514
- Lancashire J., Crowther M. Blood smear: fulminant pneumococcal bacteremia //Blood. – 2012. doi: 10.1182/blood-2012-07-444406
- Koch R. Untersuchungen über die Aetiologie der Wundinfectionskrankheiten. – FCW Vogel, 1878
- Bone, R. C., Balk, R. A., Cerra, F. B., Dellinger, R. P., Fein, A. M., Knaus, W. A., Schein, R. M., Sibbald, W. J.. Definitions for Sepsis and Organ Failure and Guidelines for the Use of
- Innovative Therapies in Sepsis. Chest. 1992. doi:10.1378/chest.101.6.1644
- Kalfin, E. Resident Microbial Flora in Human Erythrocytes. Journal of Culture Collections.1997–1998.
- Domingue, G.J. and Schlegel, J.U. Novel Bacterial Structures in Human Blood: Cultural Isolation. Infection & Immunity. 1977.
- Domingue, G.J. and Woody, H.B. Bacterial Persistence and Expression of Disease. Clinical Microbiology Reviews. 1997.
http://hmpdacc.org/catalog/ - Nikkari S. et al. Does blood of healthy subjects contain bacterial ribosomal DNA? //Journal of clinical microbiology. – 2001. doi: 10.1128/JCM.39.5.1956-1959.2001
- Moriyama K. et al. Polymerase chain reaction detection of bacterial 16S rRNA gene in human blood //Microbiology and immunology. – 2008. doi: 10.1111/j.1348-0421.2008.00048.x
- Whittle E. et al. Multi-Method Characterization of the Human Circulating Microbiome //Frontiers in microbiology. – 2018. doi: 10.3389/fmicb.2018.03266
- McLaughlin R. W. et al. Are there naturally occurring pleomorphic bacteria in the blood of healthy humans? //Journal of clinical microbiology. – 2002. doi: 10.1128/jcm.40.12.4771-4775.2002
- Markova N. L-form bacteria cohabitants in human blood: significance for health and diseases //Discovery medicine. – 2017.
- Panaiotov S. et al. Cultural isolation and characteristics of the blood microbiome of healthy individuals //Advances in Microbiology. – 2018. doi: 10.4236/aim.2018.85027
- Akerman K. K, Kuronen I, Kajander E. O. Scanning electron microscopy of nanobacteria-novel biofilm producing organisms in blood. //Scanning. – 1993.
- Rawal B. D., Pretorius A. M. “Nanobacterium sanguineum” – Is it a new life-form in search of human ailment or commensal: Overview of its transmissibility and chemical means ofi ntervention //Medical hypotheses. – 2005. doi: 10.1016/j.mehy.2005.06.024
- Kumar V, Farell G, Yu S; et al. Cell biology of pathologic renal calcification: contribution of crystal transcytosis, cell-mediated calcification, and nanoparticles. J. Investig. Med. 2006. doi: 10.2310/6650.2006.06021
- Kajander EO, Ciftçioglu N., Nanobacteria: an alternative mechanism for pathogenic intra- and extracellular calcification and stone formation, 1998. doi: 10.1073/pnas.95.14.8274
- John O. Cisar, De-Qi Xu, John Thompson, William Swaim, Lan Hu, and Dennis J. Kopecko. An alternative interpretation of nanobacteria-induced biomineralization // PNAS. — 2000. doi: 10.1073/pnas.97.21.11511
- Martel J., Young J.D.-E. Purported nanobacteria in human blood as calcium carbonate nanoparticles. PNAS. 2008. doi: 10.1073/pnas.0711744105
- Duda V. I. et al. Ultramicrobacteria: formation of the concept and contribution of ultramicrobacteria to biology //Microbiology. – 2012. doi: 10.1134/S0026261712040054
- Martel J. et al. Pleomorphic bacteria-like structures in human blood represent non-living membrane vesicles and protein particles //Scientific reports. – 2017. doi: 10.1038/s41598-017-10479-8
- Thrash J. C. et al. Phylogenomic evidence for a common ancestor of mitochondria and the SAR11 clade //Scientific reports. – 2011. doi: 10.1038/srep00013
- Gray M. W. Mitochondrial evolution //Cold Spring Harbor perspectives in biology. – 2012. doi: 10.1126/science.283.5407.1476
- Degli Esposti M. Bioenergetic evolution in proteobacteria and mitochondria //Genome biology and evolution. – 2014. doi: 10.1093/gbe/evu257
- Hotz M. J. et al. Red blood cells homeostatically bind mitochondrial DNA through TLR9 to maintain quiescence and to prevent lung injury //American journal of respiratory and critical care medicine. – 2018. doi: 10.1164/rccm.201706-1161OC
- Meijer A. et al. Detection of microorganisms in vessel wall specimens of the abdominal aorta: development of a PCR assay in the absence of a gold standard //Research in microbiology. – 1998. doi: 10.1016/S0923-2508(99)80005-9
- Dunne M. The evolving relationship between Chlamydia pneumoniae and atherosclerosis //Current Opinion in Infectious Diseases. – 2000. doi: 10.1097/00001432-200012000-00002
- Armingohar Z. et al. Bacteria and bacterial DNA in atherosclerotic plaque and aneurysmal wall biopsies from patients with and without periodontitis //Journal of oral microbiology. – 2014. doi: 10.3402/jom.v6.23408
- Lockhart P. B. et al. Bacteremia associated with tooth brushing and dental extraction //Circulation. – 2008. doi: 10.1161/CIRCULATIONAHA.107.758524
- Ellis J. E. et al. Evidence for polymicrobial communities in explanted vascular filters and atheroma debris //Molecular and cellular probes. – 2017. doi: 10.1016/j.mcp.2017.04.001
- Lanter B. B., Sauer K., Davies D. G. Bacteria present in carotid arterial plaques are found as biofilm deposits which may contribute to enhanced risk of plaque rupture //MBio. – 2014. doi: 10.1128/mBio.01206-14
- Lanter B. B., Davies D. G. Propionibacterium acnes recovered from atherosclerotic human carotid arteries undergoes biofilm dispersion and releases lipolytic and proteolytic enzymes in response to norepinephrine challenge in vitro //Infection and immunity. – 2015. doi: 10.1128/IAI.00510-15
- Nandakumar, V., Chittaranjan, S., Kurian, V. et al. Characteristics of bacterial biofilm associated with implant material in clinical practice. Polym J 45, 137–152 (2013). doi: 10.1038/pj.2012.130
- McGoldrick E, McElvany MD, Butler-Wu S, Pottinger PS, Matsen FA 3rd. Substantial cultures of Propionibacterium can be found in apparently aseptic shoulders revised three years or more after the index arthroplasty. J Shoulder Elbow Surg. 2015. doi: 10.1016/j.jse.2014.05.008
- Akgün D, Peters PM, Maziak N, Plachel F, Minkus M, Moroder P. High rate of unexpected positive cultures in presumed aseptic revision of stiff shoulders after proximal humerus osteosynthesis. BMC Musculoskelet Disord. 2020. doi: 10.1186/s12891-020-03430-y
- Jensen L. K., Johansen A. S. B., Jensen H. E. Porcine models of biofilm infections with focus on pathomorphology //Frontiers in microbiology. – 2017. doi: 10.3389/fmicb.2017.01961
- Shiono Y, Ishii K, Nagai S, et al. Delayed Propionibacterium acnes surgical site infections occur only in the presence of an implant. Sci Rep. 2016. doi: 10.1038/srep32758
- Wang Y, Cheng LI, Helfer DR, et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 2017. doi: 10.1073/pnas.1703427114
- Wagner, C., Aytac, S., & Hänsch, G. M. Biofilm Growth on Implants: Bacteria Prefer Plasma Coats. The International Journal of Artificial Organs. 2011. doi: 10.5301/ijao.5000061
- Zhang S. et al. In vitro and in vivo biocompatibility and osteogenesis of graphene-reinforced nanohydroxyapatite polyamide66 ternary biocomposite as orthopedic implant material //International Journal of Nanomedicine. – 2016. doi: 10.2147/IJN.S105794
- Kwon Y. S. et al. Effect of microthreads on removal torque and bone-to-implant contact: an experimental study in miniature pigs //Journal of Periodontal & Implant Science. – 2013. doi: 10.5051/jpis.2013.43.1.41
- Doern G. V. Detection of bacteremia: Blood cultures and other diagnostic tools. UpToDate. 2020.
- Wolf D., Ley K. Immunity and inflammation in atherosclerosis //Circulation research. – 2019. doi: 10.1161/CIRCRESAHA.118.313591
- Mokhtarzadeh A., Bouzari M. Detection of the frequency of the novel TT virus by PCR and its role in the induction of hepatic injuries in blood donors in West Azarbaijan, Iran //IJBC. – 2009.
- Egli A. et al. Prevalence of polyomavirus BK and JC infection and replication in 400 healthy blood donors //The Journal of infectious diseases. – 2009. doi: 10.1086/597126
- Smatti M. K. et al. Prevalence and molecular profiling of Epstein Barr virus (EBV) among healthy blood donors from different nationalities in Qatar //PLoS One. – 2017. doi: 10.1371/journal.pone.0189033
- Senevirathna D. et al. Hepatitis C virus in healthy blood donors in Sri Lanka //Asian journal of transfusion science. – 2011. doi: 10.4103/0973-6247.75976
- Simmonds P. et al. TT virus — part of the normal human flora? //Journal of Infectious Diseases. – 1999. doi: 10.1086/315103
- Breitbart M., Rohwer F. Method for discovering novel DNA viruses in blood using viral particle selection and shotgun sequencing //Biotechniques. – 2005. doi: 10.2144/000112019
- Bernardin F. et al. Transfusion transmission of highly prevalent commensal human viruses //Transfusion. – 2010. doi: 10.1111/j.1537-2995.2010.02699.x
- Popgeorgiev N. et al. Marseillevirus-like virus recovered from blood donated by asymptomatic humans //Journal of Infectious Diseases. – 2013. doi: 10.1093/infdis/jit292
- Moustafa A. et al. The blood DNA virome in 8,000 humans //PLoS pathogens. – 2017. doi: 10.1371/journal.ppat.1006292
- Sauvage V. et al. No evidence of Marseillevirus-like virus presence in blood donors and recipients of multiple blood transfusions //The Journal of infectious diseases. – 2014. doi: 10.1093/infdis/jiu443
- Abeles S. R., Pride D. T. Molecular bases and role of viruses in the human microbiome //Journal of molecular biology. – 2014. doi: 10.1016/j.jmb.2014.07.002
- Górski A. et al. Bacteriophage translocation //FEMS Immunology & Medical Microbiology. – 2006. doi: 10.1111/j.1574-695X.2006.00044.x
- Киселёв О. И. Эндогенные ретровирусы: структура и функции в геноме человека //Вопросы вирусологии. – 2013.
- Belshaw R. et al. Long-term reinfection of the human genome by endogenous retroviruses //Proceedings of the National Academy of Sciences of the United States of America. – 2004. doi: 10.1073/pnas.0307800101
- Knerr I, Beinder E, Rascher W. Syncytin, a novel human endogenous retroviral gene in human placenta: evidence for its dysregulation in preeclampsia and HELLP syndrome. Am J Obstet Gynecol. doi: 10.1067/mob.2002.119636
- Herndon R. M. Herpesviruses in multiple sclerosis //Archives of neurology. – 1996. doi: 10.1001/archneur.1996.00550020027011
- Fotheringham J., Jacobson S. Human herpesvirus 6 and multiple sclerosis: potential mechanisms for virus-induced disease //Brain. – 2005.
- Questions and Answers. Annals of the New York Academy of Sciences, Volume 939, NEUROPROTECTIVE AGENTS: FIFTH INTERNATIONAL CONFERENCE page 403, June 2001. doi:10.1111/j.1749-6632.2001.tb03649.x
- Branton WG, Ellestad KK, Maingat F, Wheatley BM, Rud E, Warren RL, et al. Brain Microbial Populations in HIV/AIDS: α-Proteobacteria Predominate Independent of Host Immune Status //PLoS ONE. – 2013. doi: 10.1371/journal.pone.0054673
- Li H. et al. Amyloid, tau, pathogen infection and antimicrobial protection in Alzheimer’s disease–conformist, nonconformist, and realistic prospects for AD pathogenesis //Translational neurodegeneration. – 2018. doi: 10.1186/s40035-018-0139-3
- Zhang Q. et al. Circulating mitochondrial DAMPs cause inflammatory responses to injury //Nature. – 2010. doi: 10.1038/nature08780
- Mann E. et al. Microbiomes of unreactive and pathologically altered ileocecal lymph nodes of slaughter pigs //Applied and environmental microbiology. – 2014. doi: 10.1128/AEM.03089-13
- Mann E. et al. The Metabolically Active Bacterial Microbiome of Tonsils and Mandibular Lymph Nodes of Slaughter Pigs //Frontiers in microbiology. – 2015. doi: 10.3389/fmicb.2015.01362
- Cuenca S. et al. Microbiome composition by pyrosequencing in mesenteric lymph nodes of rats with CCl4-induced cirrhosis //Journal of innate immunity. – 2013. doi: 10.1159/000356454
- Ghose C. et al. The virome of cerebrospinal fluid: viruses where we once thought there were none //Frontiers in microbiology. – 2019. doi: 10.3389/fmicb.2019.02061
- Perlejewski K. et al. Metagenomic analysis of cerebrospinal fluid from patients with multiple sclerosis //Pulmonary Infection and Inflammation. – Springer, Cham, 2016. doi: 10.1007/5584_2016_25
- Hammad D. B. M., Liyanapathirana V., Tonge D. P. Molecular characterisation of the synovial fluid microbiome in rheumatoid arthritis patients and healthy control subjects //Plos one. – 2019. doi: 10.1371/journal.pone.0225110
- Zhao Y. et al. Detection and characterization of bacterial nucleic acids in culture-negative synovial tissue and fluid samples from rheumatoid arthritis or osteoarthritis patients //Scientific reports. – 2018. doi: 10.1038/s41598-018-32675-w
- Shojaee S. et al. Microbiome profile associated with malignant pleural effusion //PloS one. – 2020. doi: 10.1371/journal.pone.0232181
- Wei W. et al. Microbiota composition and distribution along the female reproductive tract of women with endometriosis //Annals of Clinical Microbiology and Antimicrobials. – 2020. doi: 10.1186/s12941-020-00356-0
- Miao R. et al. Assessment of peritoneal microbial features and tumor marker levels as potential diagnostic tools for ovarian cancer //PloS one. – 2020. doi: 10.1371/journal.pone.0227707
- Chen C. et al. The microbiota continuum along the female reproductive tract and its relation to uterine-related diseases //Nature communications. – 2017. doi: 10.1038/s41467-017-00901-0
- Diehl G. E. et al. Microbiota restricts trafficking of bacteria to mesenteric lymph nodes by CX 3 CR1 hi cells //Nature. – 2013. doi: 10.1038/nature11809
- Zacharia G. S., Rangan K., Sunilkumar Kandiyil V. T. Spontaneous bacterial peritonitis in extrahepatic portal venous obstruction //Annals of Gastroenterology: Quarterly Publication of the Hellenic Society of Gastroenterology. – 2013.
- Castillo D. J. et al. The healthy human blood microbiome: fact or fiction? //Frontiers in Cellular and Infection Microbiology. – 2019. doi: 10.3389/fcimb.2019.00148
- Lim E. S., Rodriguez C., Holtz L. R. Amniotic fluid from healthy term pregnancies does not harbor a detectable microbial community //Microbiome. – 2018. doi: 10.1186/s40168-019-0642-5
- Sweeney T. E., Liesenfeld O., May L. Diagnosis of bacterial sepsis: why are tests for bacteremia not sufficient?. – 2019. doi: 10.1080/14737159.2019.1660644
- Moossavi S., Azad M. B. Origins of human milk microbiota: new evidence and arising questions //Gut Microbes. – 2020. doi: 10.1080/19490976.2019.1667722
- De Andrés J. et al. Physiological translocation of lactic acid bacteria during pregnancy contributes to the composition of the milk microbiota in mice //Nutrients. – 2018. doi: 10.3390/nu10010014
- Fitzgerald J. R., Foster T. J., Cox D. The interaction of bacterial pathogens with platelets //Nature Reviews Microbiology. – 2006. doi: 10.1038/nrmicro1425
- Bosman W. et al. Infections of intravascular bare metal stents: a case report and review of literature //European Journal of Vascular and Endovascular Surgery. – 2014. doi: 10.1016/j.ejvs.2013.10.006
- Fontaine C. A. et al. How free of germs is germ-free? Detection of bacterial contamination in a germ free mouse unit //Gut Microbes. – 2015. doi: 10.1080/19490976.2015.1054596
