Ноцицептивные нейроны мобилизуют стволовые клетки костного мозга
Ноцицептивные нейроны могут мобилизовать стволовые клетки крови у мышей, причем одним из стимулов служит компонент перца чили. Благодаря этому открытию ученые планируют усовершенствовать методики трансплантации стволовых клеток.
Ключевой особенностью стволовых клеток крови является их способность восстанавливать пул клеток крови и иммунной системы организма. Этот процесс известен как гемопоэз, а клетки — как гемопоэтические стволовые клетки (ГСК). В развивающихся эмбрионах ГСК с помощью системы кровообращения перемещаются по разным частям организма. После рождения эти клетки располагаются в специализированных нишах костного мозга, что поддерживает их покой и самообновление [1]. На протяжении всей жизни ГСК высвобождаются из костного мозга для пополнения клеточного пула крови в циркадном ритме, который контролируется вегетативной нервной системой [2]. Известно, что нервы, обеспечивающие болевую чувствительность, связаны с костным мозгом; но могут ли нейроны способствовать мобилизации ГСК? В своей статье в Nature Гао с соавт. [3] рассматривают этот вопрос и определяют неожиданную роль перца чили.
Данная работа имеет как биологическое, так и потенциальное клиническое значение. Для людей с такими видами злокачественных опухолей крови, как агрессивный лейкоз, лимфомы и множественная миелома, важной частью лечения после высокодозной химиотерапии является аутотрансплантация стволовых клеток (АТСТ) [4] — замена поврежденных ГСК на здоровые. Для того чтобы избежать возможных осложнений, в АТСТ используются собственные стволовые клетки человека, которые собираются из крови перед проведением химиотерапии, а затем повторно вводятся внутривенно для регенерации поврежденного костного мозга.
В ходе проведения этой процедуры необходимо «побудить» здоровые ГСК покинуть свою нишу в костном мозге и выйти в общий кровоток, чтобы их можно было собрать. Начиная с 1990-х годов наиболее часто используемым молекулярным стимулом являлся секретируемый организмом медиатор, известный как гранулоцитарный колониестимулирующий фактор (Г-КСФ). В 2003 г. появился еще один стимул — плериксафор — небольшая молекула, которая способствует вымыванию ГСК из костного мозга [4]. С тех пор все разработки ведутся в направлении усовершенствования различных способов комбинирования Г-КСФ с плериксафором и их введения. Но у части людей не происходит мобилизации ГСК в достаточной степени вследствие клинических факторов риска, таких как возраст, генетика и тип опухоли (у 25 % людей с лимфомой выявляется плохая мобилизация), а также повторных курсов химиотерапии [5]. Таким образом, существует острая необходимость в понимании молекулярных механизмов мобилизации ГСК [4].
Методика Гао с соавт.
Авторы начали с иммунофлуоресцентной визуализации нервных волокон костного мозга мышей, в ходе чего удалось обнаружить, что большинство из их — «ноцицептивные» нервы. Эти ноцицепторы представляют собой сенсорные нейроны, которые, вызывая боль в ответ на повреждение, защищают организмы от опасности. Ноцицепторы можно найти в любой области тела, которая воспринимает вредные раздражители [6]. Эти нейроны лучше всего исследованы в барьерных тканях, таких как кожа и кишечник. Биологическая роль ноцицепторов в небарьерных тканях, таких как костный мозг, остается малоизученной, за исключением аспекта восприятия боли.
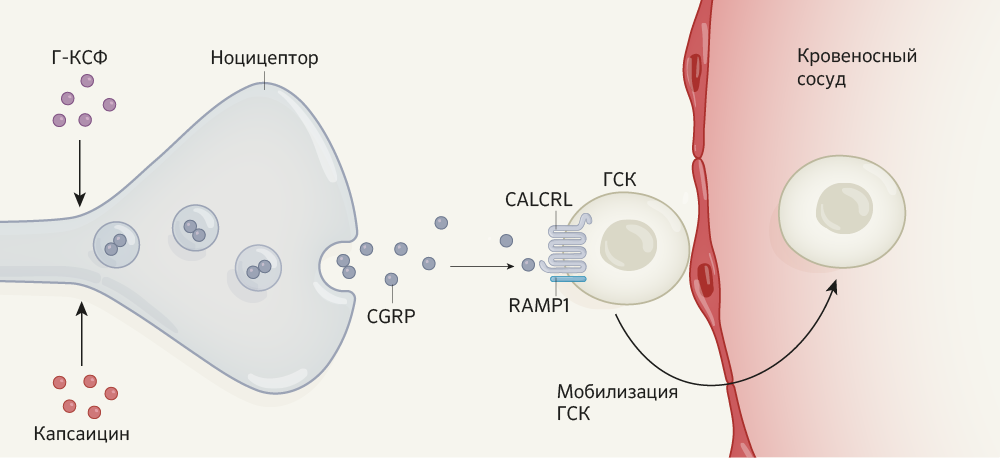
Для изучения потенциальной роли ноцицепторов в поддержании гемопоэза Гао с соавт. с помощью фармакологических и генетических методов удалили эти нейроны [из пространства гемопоэтической ткани]. Это не оказало влияния на поддержание функционирования ГСК в костном мозге, но привело к заметному снижению уровня вызванной Г-КСФ мобилизации ГСК в кровоток, на основании чего предполагается, что этот класс нейронов влияет на адгезию или миграцию ГСК.
Пептид CGRP (calcitonin-gene-related peptide) является основной молекулой-нейромедиатором, которая секретируется ноцицепторными нейронами [6]. Гао с соавт. обнаружили, что введение CGRP способствовало значительной мобилизации ГСК после применения Г-КСФ, плериксафора или их комбинации. Ученые также выявили, что CGRP напрямую влияет на ГСК (а не действует опосредованно через костный мозг), вызывая образование димерного рецептора, состоящего из белков CALCRL (calcitonin gene-related peptide type 1 receptor) и RAMP1 (receptor activity-modifying protein 1) на поверхности ГСК (Рис. 1). У генно-модифицированных мышей, у которых отсутствовал любой из этих белков в ГСК костного мозга, мобилизация ГСК нарушалась.
В клинических условиях непрерывные курсы химиотерапии часто приводят к ослаблению мобилизации ГСК. Такой дефицит был смоделирован Гао с соавт. с помощью введения мышам химиотерапевтического препарата цисплатина в течение пяти еженедельных циклов. Примечательно, что введение CGRP восстановило мобилизацию ГСК у этих животных. Это потенциально важный результат, благодаря которому можно значительно усовершенствовать протоколы взятия ГСК у людей с «плохой мобилизацией гемопоэтических клеток».
Определенные виды острой пищи могут вызывать активацию ноцицепторов, что привело Гао с соавт. к вопросу, может ли употребление таких продуктов вызвать мобилизацию ГСК. Чтобы проверить эту гипотезу, авторы добавляли в корм мышам капсаицин — активный компонент перца чили. Острая пища увеличивала уровни CGRP во внеклеточной жидкости в костном мозге и усиливала мобилизацию ГСК, индуцируемую CGRP. Эффект исчезал, когда ноцицепторы были фармакологически заблокированы, свидетельствуя о том, что эти нейроны опосредуют эффект диеты, богатой капсаицином.
Эта работа добавляет интересные детали к картине взаимосвязей между нервной системой, костным мозгом и развитием клеток крови. Ранние исследования с использованием микрофотографий нейронов в костном мозге показали, что он иннервируется нервными волокнами [7]. В течение последнего десятилетия хирургические, фармакологические и генетические модели денервации помогли установить роль нервной системы в регуляции ниши ГСК [8]. Но эти исследования в большей степени сосредоточены на изучении симпатических нервных волокон (вовлеченных в вегетативную регуляцию в организме) и показывают, что они служат для поддержания функциональной целостности ниши [костного мозга] [9]. В настоящей работе Гao с соавт. обнаружили, что адгезия ГСК к своей костномозговой нише и их способность мобилизоваться в периферический кровоток контролируются ноцицептивными нейронами, воздействующими напрямую на ГСК посредством выделения нейромедиатора CGRP.
Удивительно, но авторам не удалось обнаружить влияния нейронамиов на уровни CXCR4, CD44 и VLA4 — молекул, экспрессируемых на поверхности ГСК и связанных с миграцией этих клеток. В дальнейшем предстоит изучить точные механизмы, обеспечивающие мобилизацию ГСК после стимуляции белками CALCRL–RAMP1. Также неизвестно, влияет ли Г-КСФ на ноцицепторы прямо или опосредованно (с помощью иных типов клеток в костном мозге). Такие вопросы могут быть рассмотрены посредством направленного воздействия на гены, специфичные для определенного клеточного типа у животных. Более того, результаты, которые могут применимы для человека, должны пройти проверку в клинических испытаниях, так как биология человеческого организма не всегда четко соответствует мышиной.
Наконец, необходимо учитывать стрессовые реакции в костном мозге и их воздействие на нейроны: к примеру, лейкозы вызывают повреждение нервов в костном мозге [10]. Таким образом, изучение специфического влияния старения и разных типов злокачественных опухолей крови на ноцицепторы костного мозга представляется весьма ценным. Несмотря на существующие проблемы, в общих чертах понимание нейрональной регуляции гемопоэза уже начинает вырисовываться.
