Использование мотонейронов пациентов как способ лечения бокового амиотрофического склероза

Боковой амиотрофический склероз (БАС) — это тяжелое нейродегенеративное заболевание с летальным исходом, приводящее к гибели двигательных нейронов и произвольной мышечной активности. Хотя благодаря исследованиям на животных моделях (мыши) удалось выявить потенциальные методы лечения, значимой их эффективности в испытаниях на людях обнаружено не было. Исследователи из Детской больницы Бостона, сотрудничающие с Pfizer, сообщают об открытии высокоэффективной мишени для лекарственного воздействия, в основе которого лежит использование двигательных нейронов, полученных от пациентов с БАС. Благодаря данной платформе, удалось подтвердить цель (теоретически известную ранее) и определить класс лекарственных средств — агонистов дофаминового рецептора D2 — в качестве потенциальных новых средств терапии.
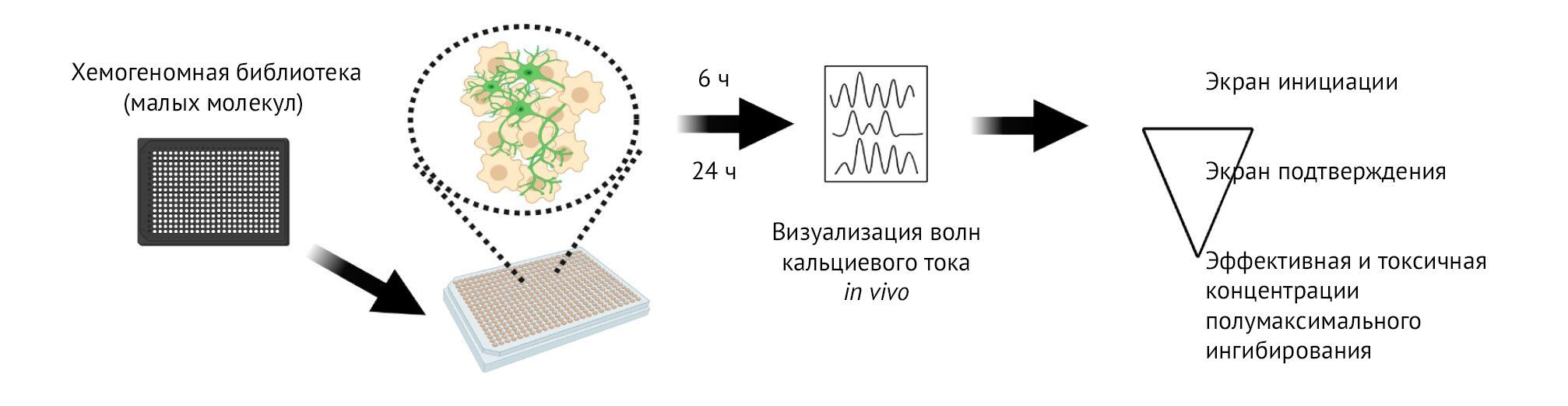
Эта высокоэффективная система скрининга предназначена для выявления соединений, снижающих повышенную возбудимость двигательных нейронов, что является отличительным признаком БАС. Мотонейроны, полученные от пациентов с БАС, культивируют в 384-луночных планшетах, и через 3–4 недели добавляют соединения из химических библиотек малых молекул против уже известных молекулярных мишеней. GCaMP-визуализация in vivo для обнаружения кальциевых волн, свидетельствующих о возбуждении нейронов, выполняется через 6 и 24 ч для определения возбудимости. Соединения, идентифицированные посредством первичного (инициального) скрининга, впоследствии проходят подтверждающий скрининг, а также производится тестирование эффективности и токсичности.
Исследователи во главе с Клиффордом Вульфом, доктором медицины, директором Центра нейробиологии Кирби в Детской больнице Бостона, а также первые авторы Сюань Хуанг (Ph.D.) и Каспер Рут (Ph.D.) из лаборатории Вульфа описали эту платформу и свои выводы в журнале «Cell Reports» от 8 июня.
Для создания двигательных нейронов, предназначенных для определения эффективности лекарственных средств, команда применила стимулированные плюрипотентные стволовые клетки, полученные в лаборатории Кевина Эггана в Гарвардском университете из образцов тканей пациентов с БАС, носителей мутации SOD1 (A4V). Лаборатория Вульфа также разработала высокочувствительную технологию визуализации живых клеток для измерения гипервозбудимости мотонейронов, т. н. тенденции к чрезмерному «возбуждению» до и после воздействия потенциальных лекарственных средств. Ранее Вульф с соавт. уже демонстрировали, что двигательные нейроны человека с мутациями, характерными для БАС, более возбудимы, чем нормальные двигательные нейроны.
По словам Вульфа, данная гипервозбудимость повышает восприимчивость мотонейронов к дегенерации, и это в конечном итоге приводит к их гибели. Данная визуализационная платформа позволяет быстро оценивать гиперактивность в 384-луночных планшетах с мотонейронами и проверять реакцию клеток на введение самых различных лекарственных средств.
Технология, получившая название GCaMP-визуализация, ранее массово не использовалась в диагностике или экспериментах по БАС. GCaMP — это индикатор уровня кальция в нейронах, сигнализирующий посредством флуоресценции о том, как часто в нейронах генерируются потенциалы действия.
В целом исследователи проверили около 2900 лекарств компании Pfizer с хорошо известными механизмами действиями. После трех этапов скрининга они обнаружили 67 соединений, не обладающих токсичными эффектами, которые способны были снижать гипервозбудимость мотонейронов.
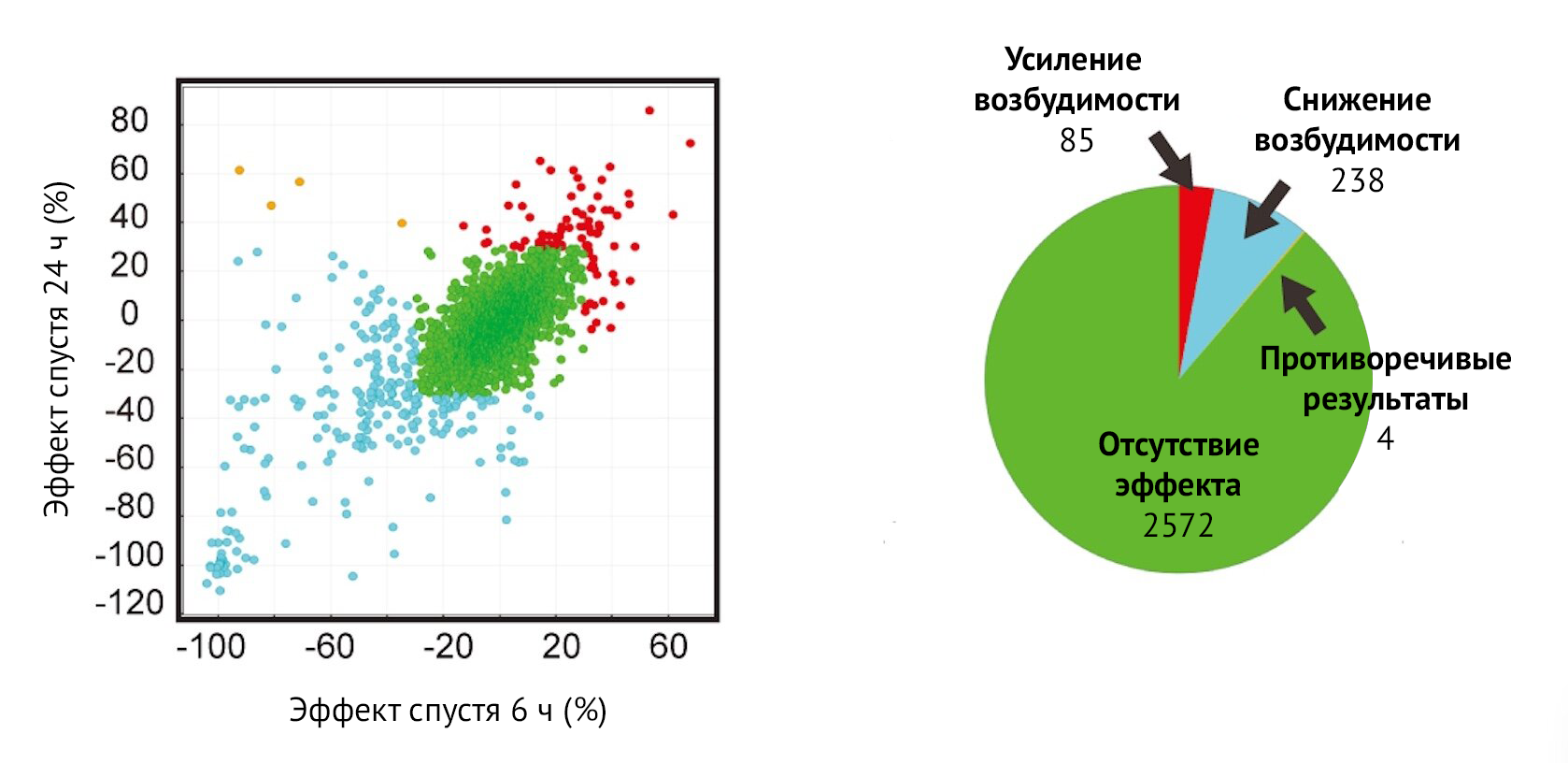
Точки на графике слева показывают средние эффекты различных соединений на возбудимость двигательных нейронов через 6 и 24 ч. Красные точки указывают на соединения, повышающие возбудимость; синие точки — на соединения, снижающие возбудимость; зеленые точки — химические соединения, эффекта которых засвидетельствовано не было. Несколько точек оранжевого цвета (вверху слева) указывают на противоречивые результаты через 6 и 24 ч. Круговая диаграмма справа дает количественную оценку результатов после инициального скрининга.
Как заявляет Вульф, проведя скрининг, целью которого был поиск измененного фенотипа мотонейронов при БАС, а именно гипервозбудимости, авторы смогли обнаружить новые цели воздействия и механизмы заболевания, а также подтвердить ранее существовавшие теории.
Ход дальнейших экспериментов был сосредоточен на 13 потенциальных лекарствах-мишенях с наибольшим эффектом, семь из которых принадлежали к двум классам (AMPA-рецепторы и Kv7-калиевые каналы), которые, как уже было известно, связаны с гипервозбудимостью мотонейронов при БАС. В ходе недавнего клинического исследования было обнаружено, что препараты, открывающие канал Kv7, снижают повышенную возбудимость двигательных нейронов при БАС. QurAlis, компания, сооснователями которой являются Вулф, Эгган и Роут, разрабатывает эти препараты для лечения БАС.
В ходе настоящего исследования был выявлен перспективный новый класс лекарств — агонисты D2-дофаминовых рецепторов (D2R). Ранее не признавалось участие этих рецепторов в формировании повышенной возбудимости мотонейронов. Некоторые агонисты D2R (бромокриптин, суманирол) доступны в коммерческом плане, что открывает возможность их использования у пациентов с БАС.
Результаты исследования авторов свидетельствуют о том, что нейрональная возбудимость — надежный способ выявления соответствующих мишеней, на которые можно воздействовать лекарственными средствами. Как заявляет Вульф, это можно использовать и в случае других неврологических заболеваний, которые связаны с возбудимостью нейронов, таких как эпилепсия и нейродегенеративные болезни (например, болезнь Альцгеймера).
Команда Вульфа использует платформы скрининга нейронов человека для выявления новых целей для лечения боли и нейропатии.
Ученый продолжает, что одной из самых сложных задач при открытии лекарств является определение ключевого механизма/механизмов в патогенезе заболевания. «Использование нейронов, полученных от пациентов, для моделирования патогенетического звена болезней и тестирования большого спектра химических соединений, фармакологические мишени которых известны, может стать движущей силой в разработке новых методов лечения».
