Миастения Гравис: атака против нейромышечного синапса

Миастения гравис (МГ) — аутоиммунное заболевание, обусловленное образованием аутоантител против рецепторов ацетилхолина (AChR), мышечно-специфической киназы (MuSK) или других связанных с ацетилхолиновыми рецепторами белков постсинаптической мембраны нервно-мышечного синапса.
Основным проявлением заболевания является локальная или генерализованная мышечная слабость.
Эпидемиология
- Распространенность МГ — 150–250 случаев на 1 млн человек, заболеваемость — 8–10 случаев на 1 млн населения.
- Возрастные рамки: нижняя граница — 30 лет, верхняя — 70–80 лет.
- Для ювенильной формы манифестация характерна в возрасте до 8 лет.
Патофизиология
МГ — заболевание, характеризующееся слабостью скелетной мускулатуры. Его причиной является нарушение нормального функционирования нейромышечного синапса вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна. Для лучшего понимания патогенеза следует рассмотреть работу нейромышечного синапса в норме (рис. 1) и в патологии (рис. 2) [1].
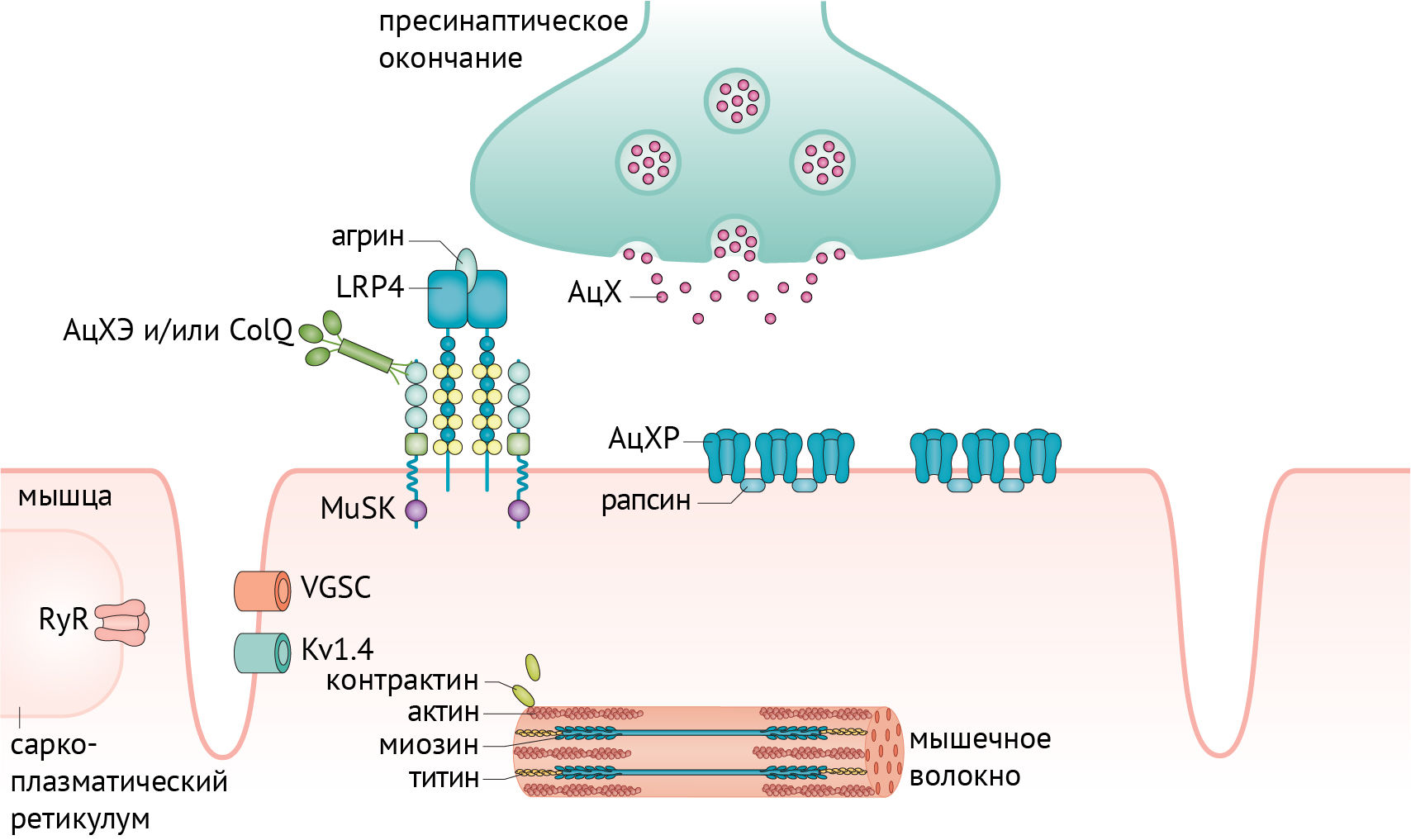
AChE — ацетилхолинэстераза; ColQ — коллаген Q; Kv1.4 — потенциал-зависимый калиевый канал; RyR — рианодиновый рецептор; VGSC — потенциал-зависимый натриевый канал.
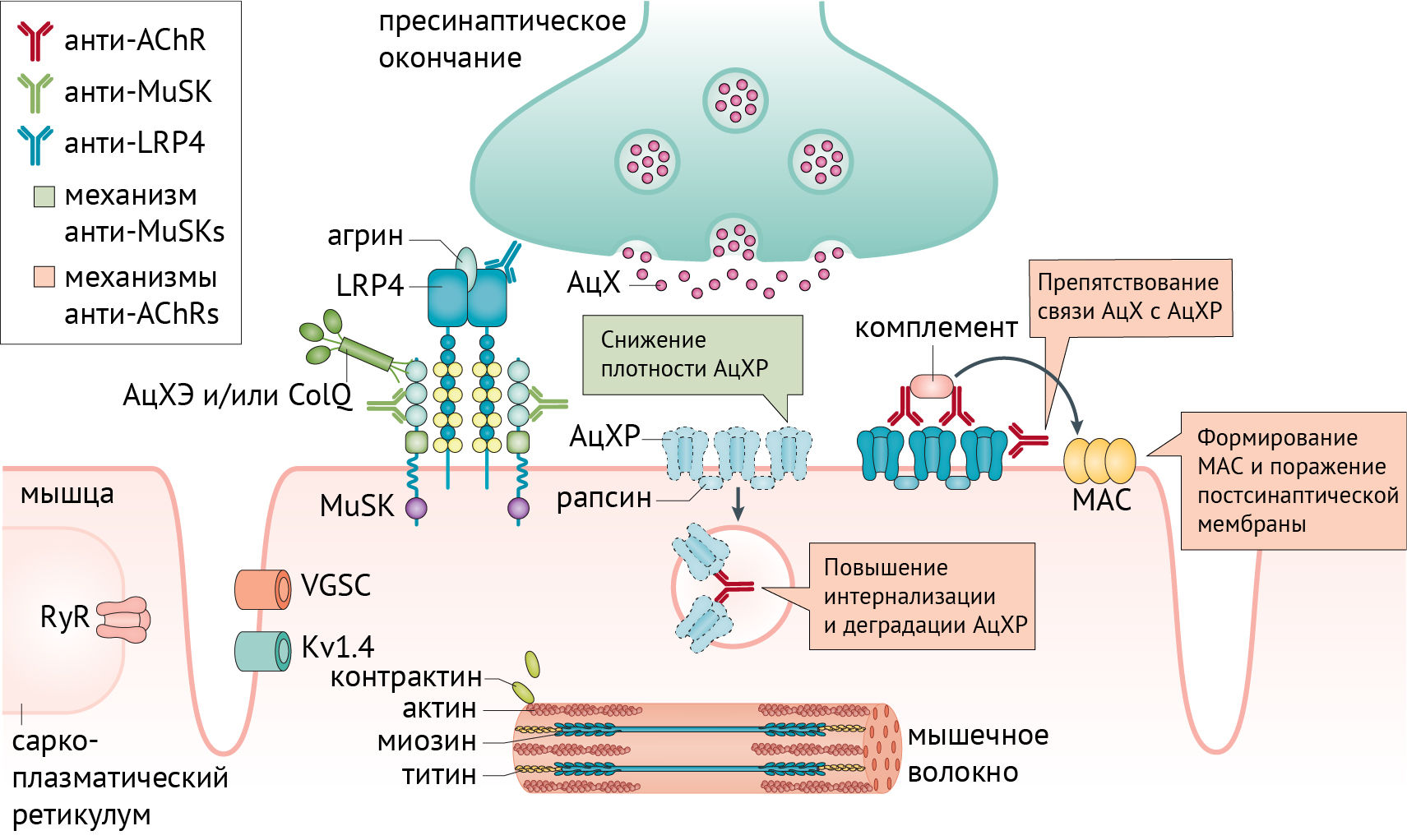
Аутоантитела, ассоциированные с МГ
Среди пациентов с МГ наиболее часто встречаются антитела к никотиновым ацетилхолиновым рецепторам (АцХР) мышечной ткани. Никотиновый АцХР является трансмембранным пентамерным гликопротеином массой 250 кД, состоящим из двух α1-, одной β1-, одной δ- и еще одной γ- (у эмбрионов) или ε- (у взрослых) субъединиц. Эти субъединицы формируют канал, который при связывании ацетилхолина с двумя α1-субъединицами открывает поток Na+, Ca2+ и K+ через клеточную мембрану.
Анти-АцХР антитела выявляются у 80 % пациентов с МГ. Эти антитела поликлональны, могут связываться с соответствующими рецепторами и блокировать их, приводя к интернализации и деградации рецепторных структур, а также активировать систему комплемента, формирующую мембрано-атакующий комплекс. Антитела формируются к определенным эпитопам связывания ацетилхолина. В случае аутоагрессии против α1-субъединиц, тяжесть заболевания будет куда более выраженной.
MuSK — трансмембранный белок, состоящий из одной субъединицы, функция которого заключается в структурировании АцХР и связывания его с рапсином — белком, служащим мостиком между рецептором и цитоскелетом. MuSK активируется после фосфорилирования, индуцированного LRP4-агриновым комплексом, после чего и происходит кластеризация АцХР.
Анти-MuSK антитела выявляются в 1–10 % случаев. В основном они связываются с иммуноглобулино-подобным доменом тирозинкиназы. Большинство этих антител относится к IgG4 субклассу, что делает невозможным активацию комплемента и антигенную модуляцию, так как анти-MuSK функционально моновалентны, а для антигенной модуляции необходимо связать 2 молекулы с антителом.
Так образом, негативное явление секреции этих антител проявляется перекрыванием сайта связывания MuSK, предотвращая его активацию через LRP4 и коллаген (ColQ). В результате происходит снижение плотности АцХР на постсинаптической поверхности и нарушение их расположения.
LRP4 — трансмембранный белок, состоящий из одной субъединицы с крупным внеклеточным доменом, содержащим множество повторов липопротеидов низкой плотности. Как уже было описано выше, связь LPR4 с агрином обуславливает активацию MuSK.
Анти-LPR4 антитела не являются строго специфичными для МГ. В 10–23 % случаев они также обнаруживаются у пациентов с боковым амиотрофическом склерозом.
Агрин связывается с белками мышечной мембраны, такими как LRP4, дистрогликан и ламинин, структурируя поддерживающий и способствующий регенерации нейромышечный синапс. Аутоантитела к агрину ингибируют фосфорилирование MuSK, вероятно, через подавление образования комплекса LRP4-агрин.
Коллаген Q (коллагеновый хвост ацетилхолинэстеразы, ColQ) концентрирует и удерживает ацетилхолинэстеразу, которая способствует деградации ацетилхолина, во внеклеточном матриксе нейромышечного синапса. Анти-ColQ антитела выявляются среди 3 % пациентов с МГ и у 2,3 % здоровых людей (не больных МГ). Мутации гена, кодирующего ColQ, также приводят к заболеваниям, одним из синдромов которых является миастения. Точный патофизиологический аспект развития МГ при секреции аутоантител к ColQ неизвестен.
Антитела к вольтаж-зависимым калиевым каналам скелетных мышц Kv1.4 выявлялись в японских и европейских группах больных с МГ в 10–20 % случаев. Также среди только японской группы проявлялись нарушения ритма сердца, ввиду наличия Kv1.4 в эндокарде.
Наличие антител к внутриклеточным белкам является отягчающим прогностическим фактором в отношении выраженности МГ и наличия тимомы. К таким внутриклеточным белкам относятся тинтин, кортактин и рианодиновые рецепторы.
Тинтин (Tintin) является обязательным компонентом мышечных сокращений. Анти-тинтиновые антитела выявляются среди 20–30 % пациентов с анти-АХР антителами, при часто сопутствующей тимоме либо при позднем дебюте МГ. Анти-тинтиновые антитела являются высоко чувствительными и специфичными маркерами тимомы.
Кортактин (Cortactin) связывается с актином в скелетных мышцах, способствуя его сборке, а также кластеризации АцХР. Антитела к кортактину в 20 % случаев встречаются среди дважды серонегативных пациентов с МГ и в 5–10 % случаев среди пациентов с антителами к АцХР. Однако эти антитела могут встречаться среди здоровых (5 %), а также больных другими аутоиммунными заболеваниями, включая полимиозит (20 %), что делает этот маркер малоспецифичным для выявления МГ.
Рианодиновые рецепторы (RyR) — это кальциевые каналы саркоплазматического ретикулума. Они открываются при деполяризации, обеспечивая мышечное сокращение путем предоставления кальция из сарколеммы в цитоплазму. Анти-риадиновые антитела выявляются у 70 % больных МГ с тимомой и среди 14 % пациентов с поздним началом МГ. Антитела к RyR можно также использовать как индикатор тимомы и тяжелой МГ.
МГ часто ассоциируется с тимомой. Вероятно, аутоиммунная агрессия связана с нарушением формирования периферической толерантности в результате патологии тимуса. Механизмы работы тимуса изображены на рисунке 3.
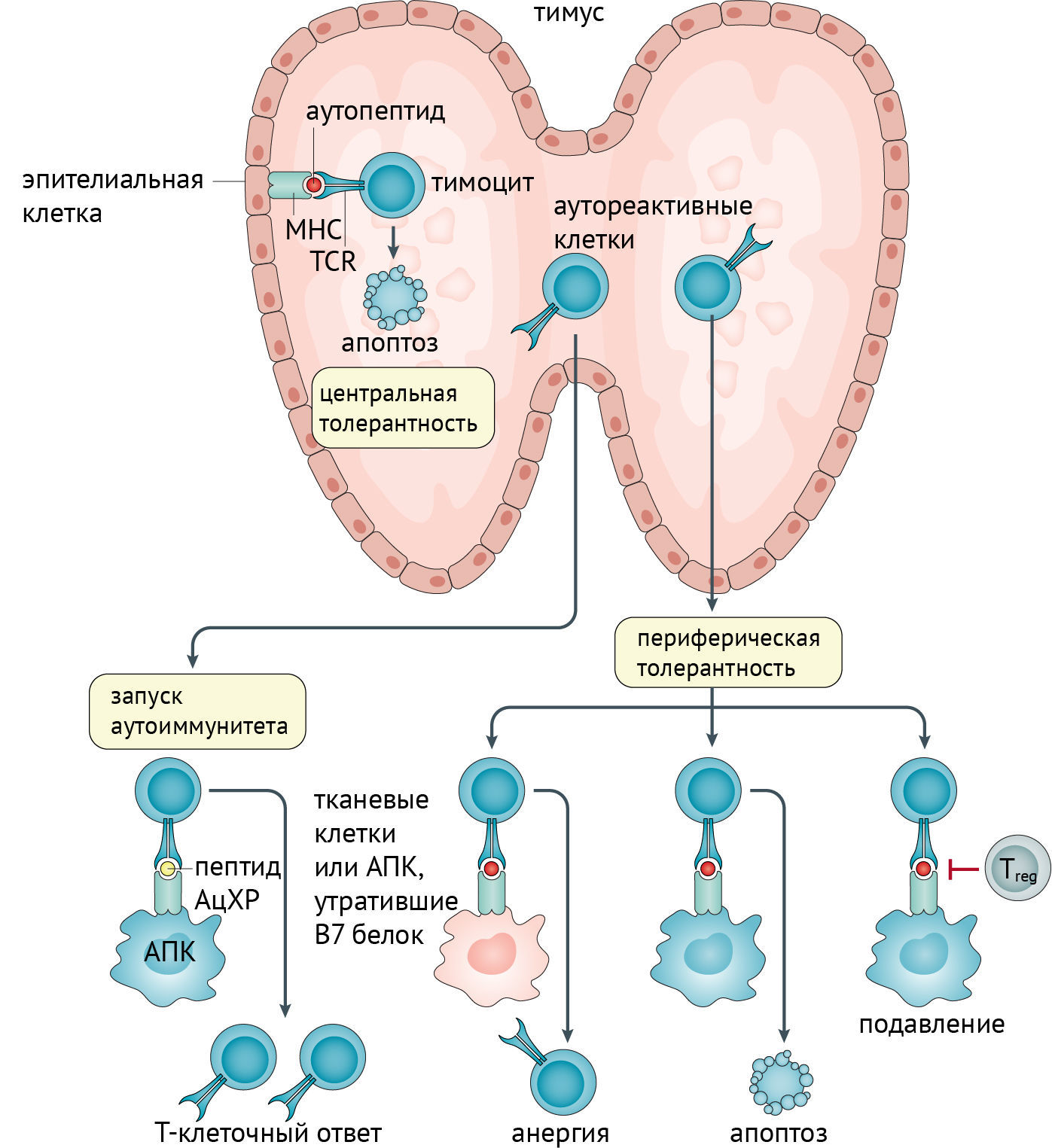
AChR — рецептор ацетилхолина; АПК — антигенпрезентирующая клетка; MHC — главный комплекс гистосовместимости; TCR — Т-клеточный рецептор; Treg — регуляторная Т-клетка.
Патогенез образования аутоантител
Механизмы, приводящие к избирательной продукции мышечных аутоантител при МГ, неясны. Тимус поражен у большинства пациентов с антителами к АцХР, с тимомой (10 % случаев) либо с фолликулярной гиперплазией тимуса (более чем в 80 % случаев с ранним началом МГ). Тимэктомия у пациентов с гиперплазией часто приводит к значительному клиническому улучшению. Гиперплазия характеризуется наличием большого количества зародышевых центров (участков развития и созревания В-клеток). В норме зародышевые центры находятся в органах, ответственных за продуцирование В-клеток, почти отсутствуют в нормальном тимусе и не наблюдаются в скелетных мышцах. Однако в рамках заболевания, наличие многих зародышевых центров с В-клетками в тимусе, продуцирующих анти-АцХР антитела, наводит на предположение о ключевом аспекте воспалительной патологии тимуса и потери иммунной толерантности. Эпителиальные клетки тимуса, миоидные клетки и профессиональные антигенпрезентирующие клетки вносят свой вклад в процесс иммунизации, что приводит к образованию зародышевых центров.
Тимус является органом созревания Т-клеток и отвечает за развитие центральной толерантности за счет делеции аутореактивных Т-клеток (рис. 3). Аутореактивные Т-клетки обычно контролируются регуляторными Т-клетками (Тreg-клетки, Treg cell) путем формирования периферической толерантности (рис. 3). Такие аутореактивные Т-клетки, направленные против мышечных антигенов, можно обнаружить во всех подгруппах пациентов с МГ, но также они наблюдаются и у здоровых людей. CD8+-лимфоциты представляют собой важные эффекторные клетки, необходимые для инициации МГ. Иммунорегуляторные дефекты, наблюдаемые у пациентов с антителами к АцХР и MuSK, обусловлены нарушением функционирования как Treg-клеток, так и обычных клеток. Дефекты работы Treg-клеток были продемонстрированы практически при всех аутоиммунных заболеваниях, включая МГ с гиперплазией тимуса. Стоит отметить, что для МГ на первый план выходит дисфункция Тreg-клеток, нежели подавление активация кластеров дифференцировки или других маркеров. Однако независимо от того, является ли дисфункция Treg-клеток причиной или следствием заболевания, дефектный противовоспалительный ответ очень важен для инициации и/или прогрессирования МГ. Тимус больных МГ обогащен подмножеством Т-клеток, экспрессирующих высокие уровни Fas (трансмембранные белки, относящиеся к семейству факторов некроза опухоли), участвующих в аутоагрессии к АцХР. На данный момент можно утверждать потерю центральной толерантности вследствие опухоли вилочковой железы. Отсутствие внутри опухоли миоидных клеток, Treg-лимфоцитов и экспрессии AIRE, вероятно, приведет к ненормальному отбору Т-клеток. Клинические проявления МГ наступают спустя долгое время после развития опухоли тимуса, что предполагает вовлечение других факторов регуляции, таких как цитокины, интерфероны и антигены класса II главного комплекса гистосовместимости (ГКГС). Неясна роль тимуса в случаях позднего дебюта миастении, а также секреции других аутоантител.
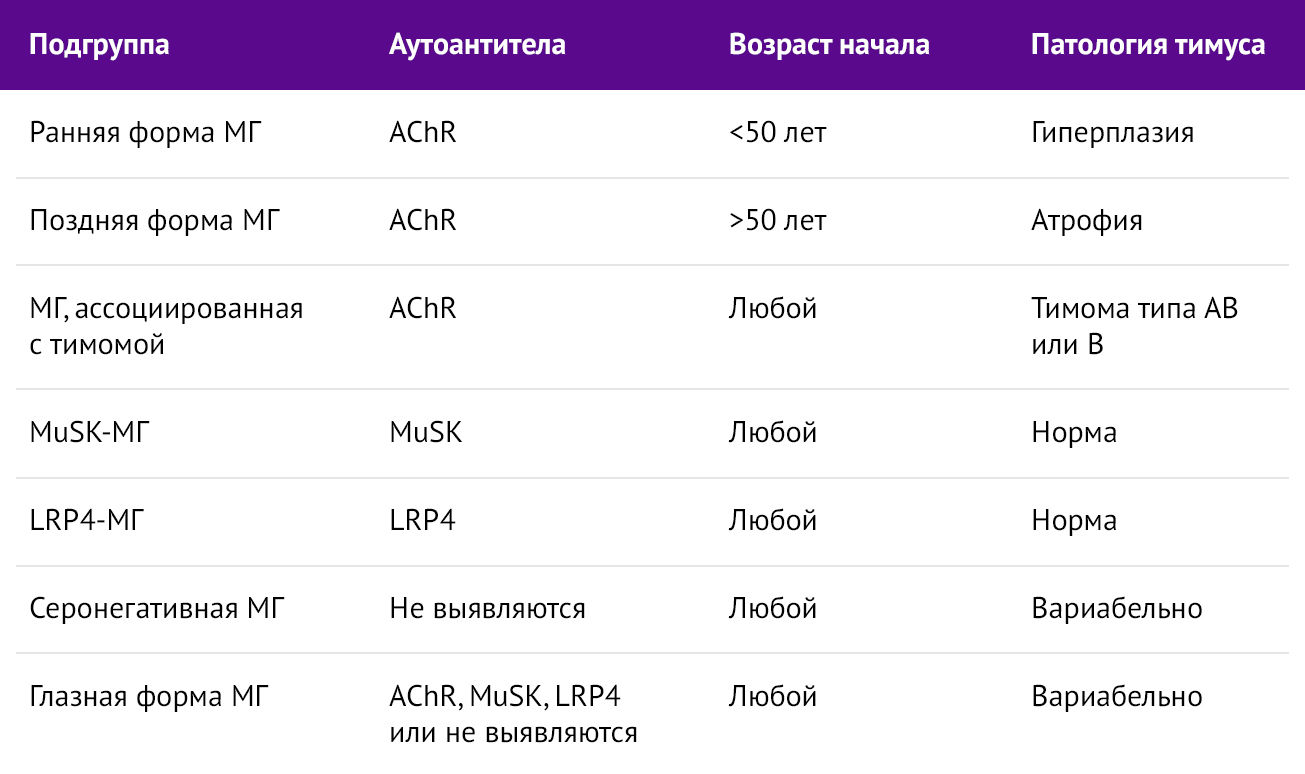
В зависимости от типа секреции аутоантител, возраста начала и наличия/отсутствия патологии тимуса, МГ дифференцируется на подгруппы. Ознакомиться с ними можно, рассмотрев таблицу 1.
Таблица 1 | Подгруппы миастении гравис
Определенные генетические факторы также вносят вклад в развитие заболевания, в частности, ассоциации таких HLA, как HLA-B8, DRw3, DQw2 с МГ и DR14, DQ5 для MuSK-позитивных пациентов. Кроме того, для этих пациентов характерна повышенная вероятность приобретения других аутоиммунных заболеваний, таких как аутоиммунный тиреоидит, ревматоидный артрит, системная красная волчанка, а также, в отличие от общей популяции, наличие в семейном анамнезе упоминаний об аутоиммунных заболеваниях среди родственников [2,3].
Клиника
Мышечная слабость усиливается при повторных мышечных сокращениях. Частое вовлечение глазодвигательных мышц обусловливает развитие диплопии и птоза, которые обычно асимметричные (рис. 4).
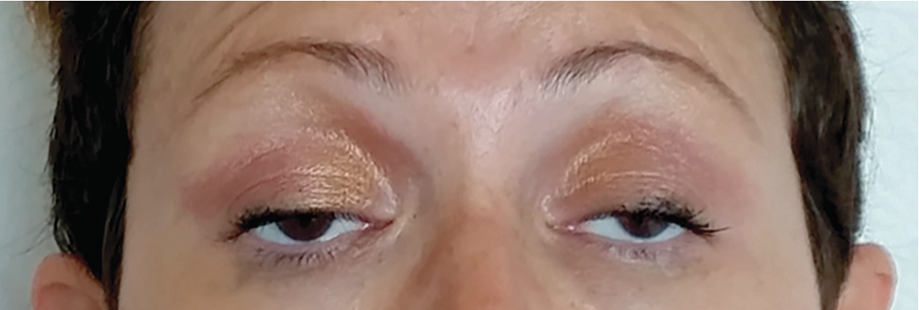
Рисунок 4 | Типичное проявление глазной формы МГ (либо генерализованной с вовлечением глазодвигательных мышц), проявляющееся в виде двустороннего асимметричного птоза
Лицо, шея, конечности и туловище также могут быть вовлечены при генерализованной форме заболевания; слабость чаще симметричная.
Слабость бульбарных и дыхательных мышц является жизнеугрожающим состоянием и требует интенсивной терапии.
Диагностика
Клиническая:
- Мышечные сокращения в течение 4-х минут или 20 сгибаний приводят к нарастанию мышечной слабости.
- Тест Когана — обращение взора книзу с возвращением в исходное положение взгляда сопровождается кратковременным резким подергивание века.
- Тест со льдом — прикладывание льда и охлаждение орбиты в течение 5 минут приводит к временному регрессу птоза более чем на 2 мм.
- Длительный взор вверх усиливает птоз.
Иммунологические исследования на выявления аутоантител к AChR, MuSK и LPR4.
Декремент-тест ЭНМГ — декремент амплитуды М-ответа более чем на 10 % от первого к четвертому ответу рассматривается как патология. Тест высоко специфичен, но его чувствительность варьируется от 80 до 50 % при анти-MuSK МГ.
Электромиография одиночных мышечных волокон (ЭМГ ОМВ) более чувствительна, чем декремент-тест, но менее специфична; положительна и для других неврологических заболеваний, в частности, для митохондриопатий и болезней мотонейрона. ЭМГ ОМВ разделяется на два теста: волевой и стимуляционный. Волевой состоит в измерении вариабельности скорости активации (измеряется в «джиттерах») между мышечными волокнами, иннервируемыми одним аксоном во время волевого мышечного сокращения, тогда как стимуляционный измеряет вариабельность стимуляции нерва и скорости мышечного ответа (джиттер).
Дифференциальная диагностика
Врожденный синдром миастении — редкая группа заболеваний, манифестирующих обычно во младенчестве, чаще наследственных. Однако встречаются формы дебюта в подростковом и раннем взрослом периодах, а в некоторых случаях и аутосомно-рецессивное наследование может мимикрировать под проявления МГ.
В отличие от наследственных миастений, при МГ отмечается наличие асимметричного птоза и глазодвигательных нарушений, отсутствие слабости тыльного сгибания стопы и положительный ответ на иммунотерапию.
Кроме того, симптом усиления слабости на фоне приема пиридостигмина примечателен для заболеваний медленных каналов, ColQ- или DOK7-синдромов.
Синдром Ламберта — Итона — паранеопластическое (приблизительно в 60 %) или аутоиммунное заболевание, характеризующееся секрецией антител против пресинаптических потенциал-зависимых кальциевых каналов (выявляются в > 90 % случаев) и проявляющееся мышечной слабостью. Слабость выражена в проксимальных отделах конечностей, сильнее в нижних конечностях; также наблюдается автономная дисфункция и гипо/арефлексия с ахилловых сухожилий. Мышечная слабость уменьшается после повторных мышечных напряжений, при ЭНМГ наблюдается обратный МГ паттерн.
Психиатрические, постинфекционные, аутоиммунные (полимиозит), а также эндокринные заболевания (гипотиреоз/гипертиреоз) могут вызывать мышечную слабость и имитировать МГ.
Кроме того, существует довольно-таки большой спектр различных препаратов, способных имитировать или усугубить течение МГ (таб. 2 и 3). Необходимо учитывать эти препараты при сборе анамнеза, дабы выявить возможную причину усугубления течения МГ у пациента либо предотвратить ятрогению.
Таблица 2 | Препараты, которые могут имитировать, либо усугубить МГ

Таблица 3 | Препараты, которые обычно хорошо переносятся, но могут быть ассоциированны с экзацербацией МГ*

* Это неполный список всех препаратов, которые у отдельных пациентов могут отрицательно влиять на нервно-мышечную передачу.
¶ Только при необходимости среди госпитализированных пациентов и с особой осторожностью при слабости дыхательных мышц.
Δ При внутривенном введении.
◊ Противопоказан при миастении.
§ Также используется как противорвотное средство.
¥ Хотя глюкокортикоиды являются средством лечения миастении, в высоких дозах они могут вызвать значительное обострение симптомов данного заболевания на ранних этапах лечения. По этой причине глюкокортикоиды следует назначать в высоких дозах только среди госпитализированных пациентов с возможностью получения плазмафереза или ВВИГ по поводу миастенического криза, а также перевода на ИВЛ.
В перечень препаратов, применение которых следует ограничить при МГ, следует также добавить депрессантов дыхательного центра (напр., барбитураты, бензодиазепины, опиоиды, седатики).
Диагностика МГ основывается на вышеописанных методах клинического, инструментального и лабораторного исследований. Для упрощения можно придерживаться алгоритма, представленного ниже (схема 1).
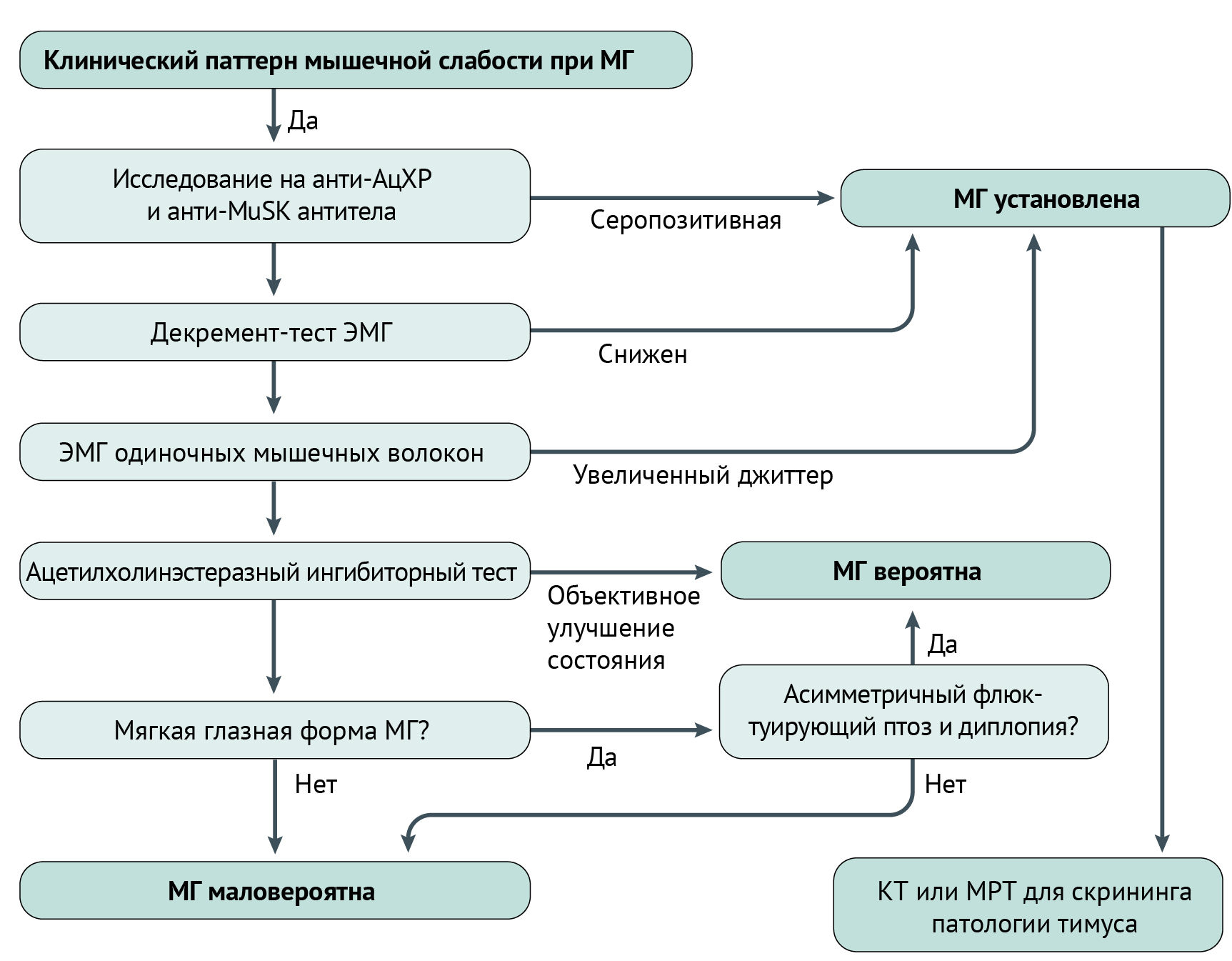
Схема 1 | Упрощенный алгоритм диагностики МГ
Градация тяжести основывается на сравнении выраженности мышечной слабости аксиальной и/или конечностей либо орофарингеальной и/или дыхательной областей (таблица 4).
Таблица 4 | Классификация Оссермана (MGFA)

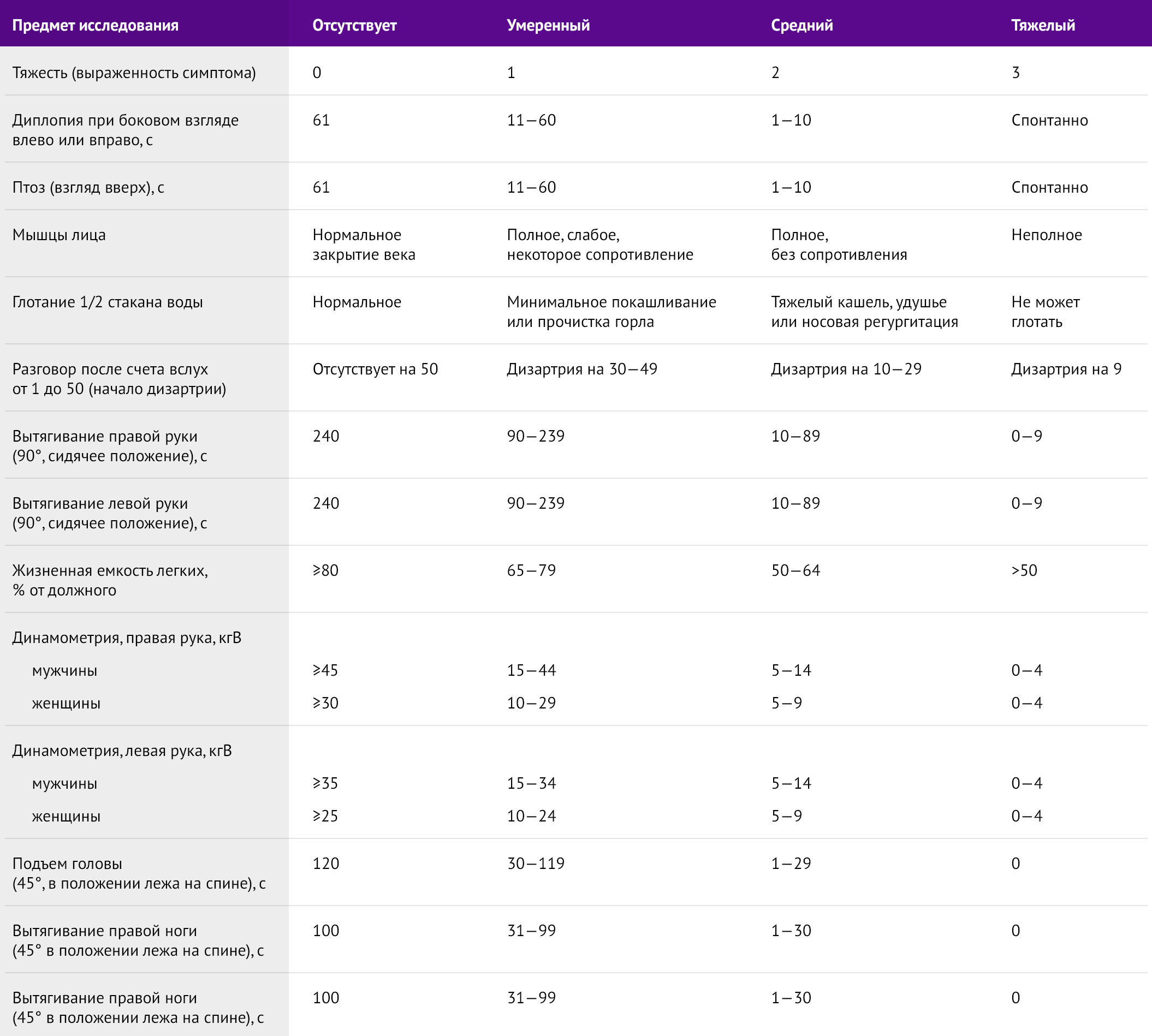
Шкала количественной оценки тяжести миастении (QMGS) полезна для достоверной оценки тяжести состояния пациентов с миастенией гравис, согласно классификации MGFA, а также позволяет оценить динамику клинических проявлений при проведении фармакологических проб с введением антихолинэстеразных препаратов (табл. 5) [4].
Таблица 5 | Шкала количественной оценки тяжести МГ
Терапия
Основные методы терапии МГ:
- Симптоматическое лечение (ингибиторы ацетилхолинэстеразы) — увеличение количества ацетилхолина (ACh) в нервно-мышечном соединении.
- Длительная иммуносупрессивная терапия (глюкокортикоиды и нестероидные иммунодепрессанты) для борьбы с иммунной дисрегуляцией.
- Быстрые, но кратковременные иммуномодуляторы (плазмаферез и внутривенное введение иммуноглобулина [ВВИГ]).
- Хирургическое лечение (тимэктомия).
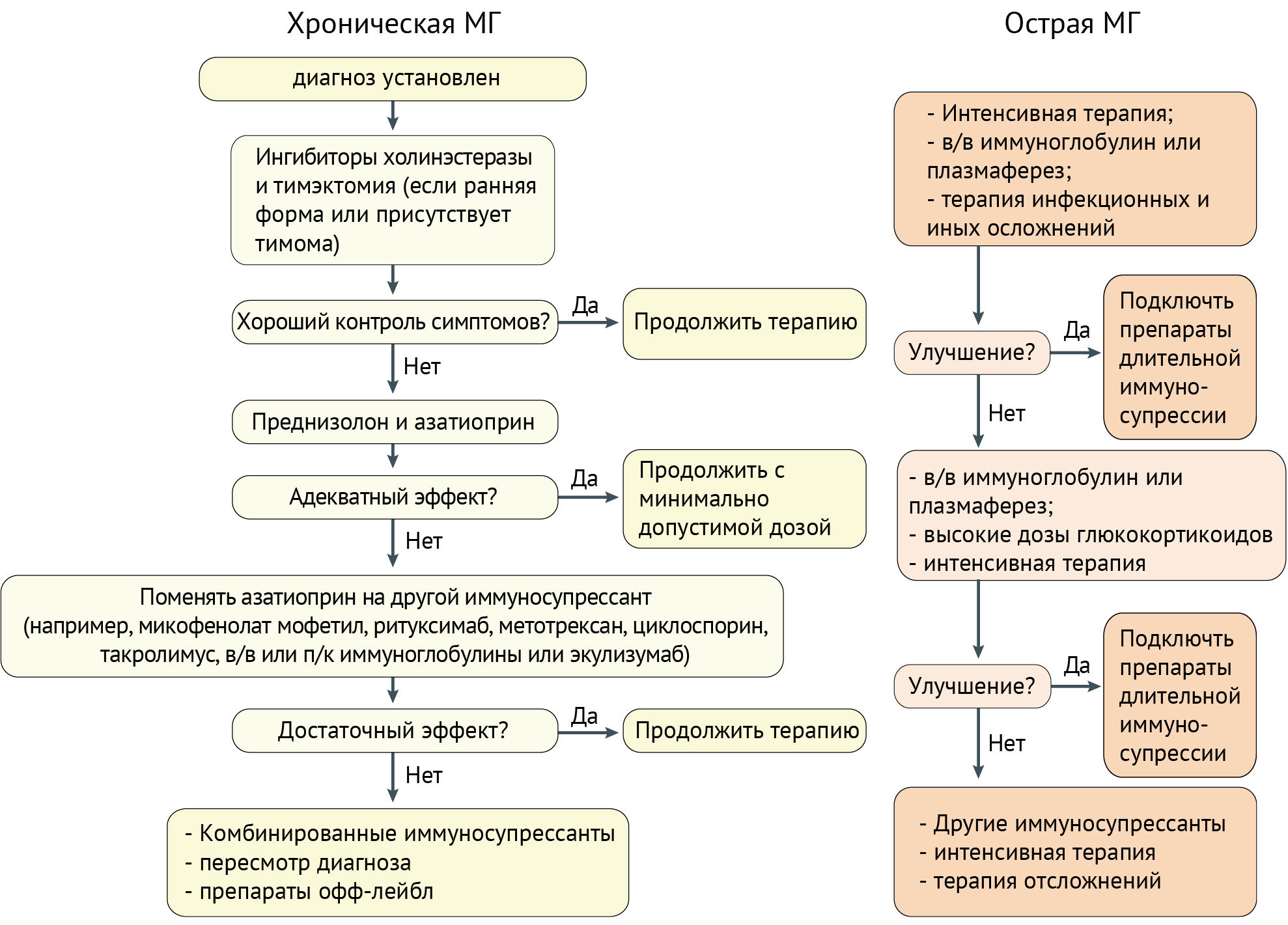
Схема 2 | Тактика назначения лекарственных средств при установленной миастении гравис
Симптоматическая терапия
Ингибитор ацетилхолинэстеразы пиридостигмин является наиболее предпочтительным препаратом в симптоматической терапии МГ, ответ на который проявляется среди большого количества пациентов, за исключением разве что больных с MuSK-позитивной МГ. Существуют как внутривенная, так и пероральная формы.
Пероральная форма препарата начинает действовать через 15–30 мин, достигая пиковой концентрации через 2 часа, продолжительность действия до 3–4 часов, иногда дольше [5].
Несмотря на малую продолжительность действия некоторым пациентам достаточно применять его каждые шесть или восемь часов в день. Другим необходима доза каждые три часа для поддержания эффекта.
Для взрослых и подростков старшего возраста обычной начальной дозой является прием 30 мг пиридостигмина трижды в день во время еды в течение 2–3 дней c целью определения холинергических побочных эффектов. При развитии чрезмерных побочных эффектов следует добавить M-холинолитики, чтобы уменьшить выраженность этих симптомов.
Тем, кто хорошо переносит пиридостигмин с антихолинергическими средствами или без них, стоит пошагово увеличивать дозу на 30 мг до хорошего терапевтического эффекта либо до развития выраженных побочных явлений. Максимальная доза обычно составляет 120 мг каждые четыре часа во время бодрствования. Иногда пациенту может потребоваться принимать его каждые три часа. Почти всем взрослым пациентам требуется общая суточная доза ≤960 мг, разделенная на 4–8 приемов.
Для детей и подростков начальная доза составляет от 0,5 до 1 мг/кг каждые 4–6 часов во время еды. Ее можно постепенно увеличивать в зависимости от терапевтического ответа и побочных эффектов. Максимальная суточная доза составляет 7 мг/кг в сутки, ее делят на 5–6 приемов.
Побочные явления приема антихолинэстеразных препаратов можно разделить на 2 типа: мускариновые и никотиновые. Среди мускариновых наиболее неприятные проявляются спазмами в животе и диареей. К другим относятся гиперсаливация, повышенное выделение бронхиального секрета, тошнота, гипергидроз и брадикардия. Также часты никотиновые побочные эффекты, включая фасцикуляции и мышечные спазмы. Однако они обычно менее обременительны, чем желудочно-кишечные проявления.
Мускариновые побочные эффекты можно контролировать, используя пероральные антихолинергические средства, оказывающие незначительное влияние на никотиновые рецепторы или не оказывающие такового (т. е. не вызывающие повышенной слабости).
К ним относятся следующие препараты:
- Гликопиррония бромид — 1 мг внутрь.
- Пропантелин — 15 мг внутрь.
- Гиосциамина сульфат — 0,125 мг внутрь.
Эти антихолинергические препараты можно принимать с профилактической целью три раза в день или вместе с пиридостигмином.
Выраженную диарею можно уменьшить путем использования лоперамида с другими антихолинергическими препаратами или без них.
Потенциальным основным побочным эффектом чрезмерного приема антихолинэстеразных препаратов является слабость, которую трудно отличить от ухудшения МГ. Холинергический криз настолько редок, что он не может быть предполагаемой причиной усиления слабости, если известно, что принятые дозы не превышают 120 мг каждые три часа или общую суточную дозу (960 мг).
В противном случае даже при наличии холинергических побочных эффектов следует предположить ухудшения основного заболевания и начать соответствующее лечение.
Патогенетическая терапия
У пациентов, слабость которых в значительной степени сохраняется в ответ на пиридостигмин, следует применять иммуносупрессивную терапию. Первоначально используются глюкокортикоиды, однако некоторым пациентам может потребоваться добавление к терапии нестероидных иммунодепрессантов (например, азатиоприна или микофенолата мофетила) с терапевтической целью и с целью профилактики побочных эффектов длительной терапии глюкокортикоидами.
Тактика ведения пациентов описана в схеме 2.
Терапия миастенического криза происходит в отделении интенсивной терапии, при необходимости подключают ИВЛ. Применяются иммуноглобулины (2–5 дней) в/в или плазмаферез (5 процедур 7–14 дней), либо пульс-терапия глюкокортикоидами в течение 1–2 дней, после чего может наступить транзиторное усиление мышечной слабости с последующим улучшением. Следует избегать одновременного назначения ИГ в/в или плазмафереза с использованием в/в метилпреднизолона, так как это может спровоцировать развитие миопатии критических состояний.
Терапию преднизолоном можно начать с 20 мг в день, затем увеличивать на 5 мг каждые 3–5 дней до целевой дозы 60 мг в день (или 1 мг/кг в день, максимум 80 мг в день). Часто это занимает от четырех до восьми недель. К этому времени обычно становится ясно, есть ли ответ на глюкокортикоиды. Снижение дозировки следует проводить примерно через месяц. При любом режиме суточная доза может снижаться на 5–10 мг каждый месяц до уровня не ниже 30 мг, а затем еще более медленно (например, 5 мг в месяц или менее). Кроме того, возможно использование терапии по типу “качелей”. Например, для снижения дозы с 80 мг сначала чередуется 80 мг и 60 мг в день, затем (через месяц) 80 мг и 40 мг в день, и в конечном итоге 80 мг и 0 мг в день. Затем идет сокращение высоких доз. Может потребоваться вернуться к более высокой дозе (как минимум на 10–20 мг), если симптомы возвращаются [6].
Тем не менее ежедневный прием предпочтителен в случае терапии детей и пациентов с сахарным диабетом.
Основные побочные эффекты приема глюкокортикоидов хорошо известны и зависят от дозы и длительности применения. К ним относят увеличение массы тела, кушингоидное лицо, стрии, асептический некроз головки плечевой или бедренной костей, стероидный диабет, артериальную гипертензию, остеопороз, желудочно-кишечное кровотечение и т. д.
С целью снижения выраженности побочных явлений следует проводить тщательный мониторинг, а также рекомендовать пациенту диету, прием витамина D и кальция, возможно, бисфосфонатов, проводить своевременную терапию АГ, использовать гастропротекторы.
Нестероидные иммунодепрессанты
В случае развития рефрактерной к стероидам МГ, а также развития осложнений и при наличии противопоказаний к терапии глюкокортикостероидами используются нестероидные иммунодепрессанты (табл. 6).
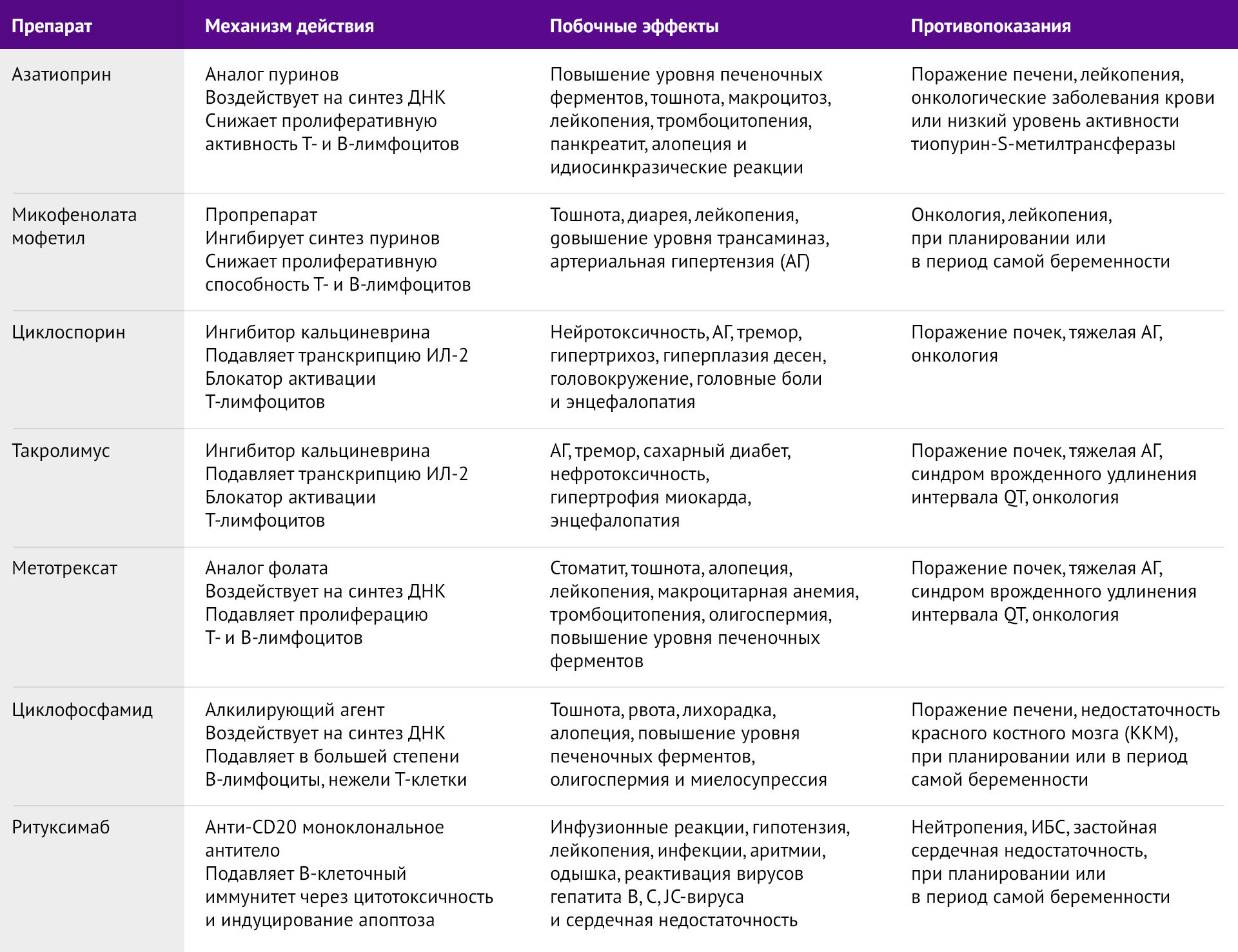
Таблица 6 | Характеристика основных иммунодепрессантов, использующихся при МГ
Параллельно с симптоматическим лечением пиридостигмином и иммунодепрессантами тимэктомия играет терапевтическую роль в зависимости от показаний:
- Пациенты с тимомой. Примерно 10–15 % пациентов с МГ, ассоциированной с тимомой, операция показана, если полная резекция считается выполнимой. Кроме того, лечение может включать иногда и химиотерапию, и лучевую терапию в случае потенциально операбельного или неоперабельного заболевания.
- Пациенты без тимомы. Тимэктомия при отсутствии тимомы рекомендуется пациентам с генерализованными формой МГ и наличием антител к рецепторам ацетилхолина в возрасте < 60 лет. Эффект от тимэктомии отсрочен и проявляется постепенно через несколько лет после операции. Роль тимэктомии среди других групп пациентов, таких как пациенты без антител к АХР, пожилые пациенты и пациенты с глазной формой МГ, противоречива, и требует индивидуального подхода.
Классификация тяжести МГ и ответа на терапию
- Полная стабильная ремиссия: никаких проявлений МГ в течение как минимум 1 года без терапии МГ. Допускается изолированный птоз.
- Фармакологическая ремиссия: критерии те же, что и при полной стабильной, однако пациент продолжает лекарственную терапию. Пациенты, принимающие блокаторы холинэстеразы, не включены.
- Минимальные проявления: никаких функциональных ограничений, кроме выявления некоторой мышечной слабости при исследовании.
- Улучшение: существенное улучшение симптоматики на фоне приема терапии либо значительное снижение дозировки/количества необходимой терапии.
- Без изменений: никаких выраженных изменений на фоне терапии и отсутствие изменений в приеме препаратов.
- Ухудшение: значительное ухудшение, по сравнению с периодом до начала терапии, или существенное увеличение дозировок/количества принимаемых препаратов
- Экзацербация: соответствует критериям полной стабильной или фармакологической ремиссии или минимальной манифестации, но впоследствии наступает рецидив с более выраженными клиническими проявлениями.
- Смерть: смерть вследствие МГ, осложнений терапии или в течение 30-ти дней после тимэктомии.
Ведение пациентов вне стационаров также включает в себя профилактику развития инфекционных осложнений при возможной экзацербации заболевания. Пациентам показана и пневмококковая вакцинация, и вакцинация против гриппа. Однако следует избегать использования живых вакцин, особенно среди пациентов, находящихся на иммуносупрессивной терапии.
Психиатрическая коморбидность
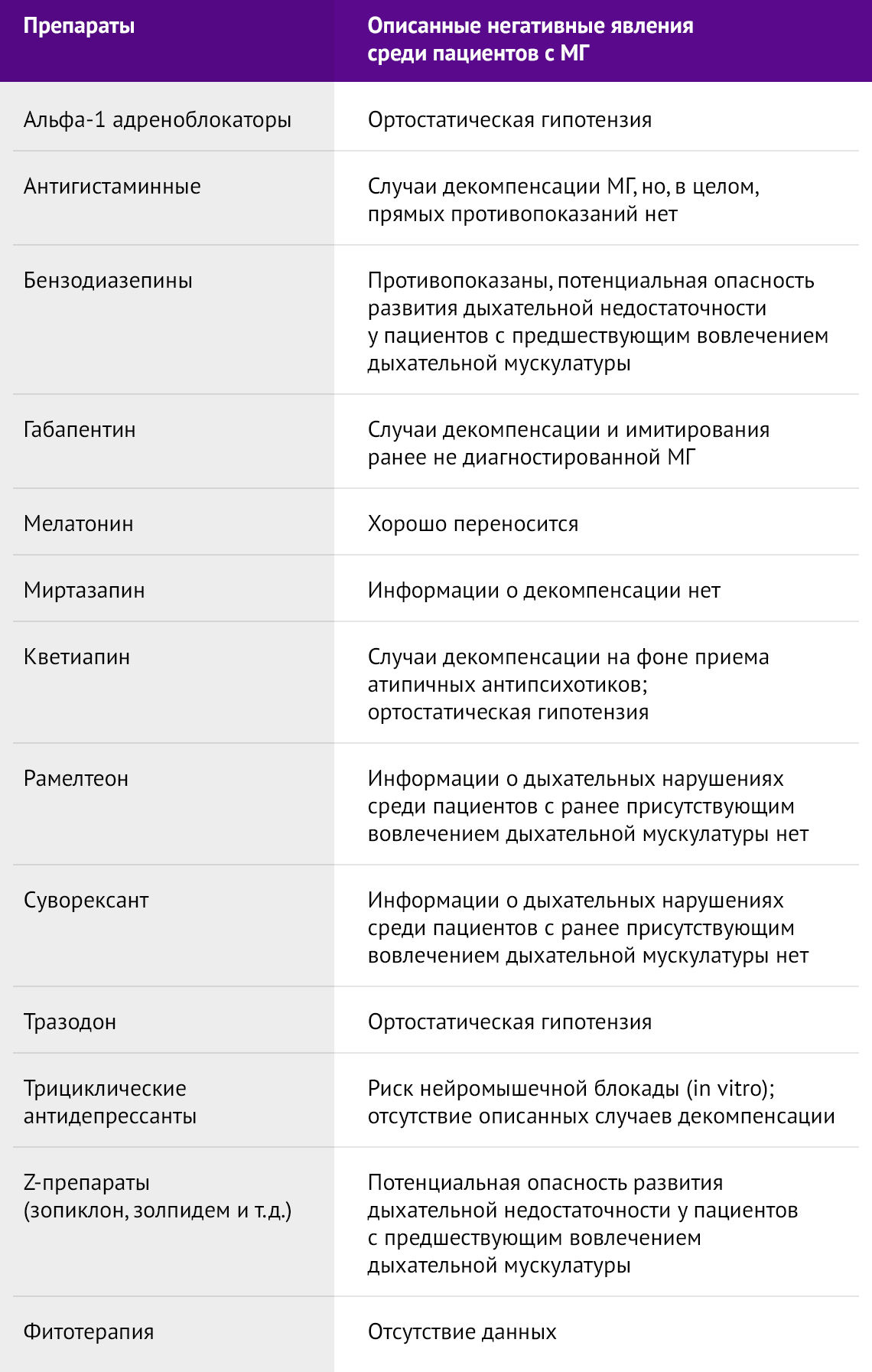
Среди пациентов с МГ аффективные расстройства и нарушения сна встречаются гораздо чаще, чем в общей популяции, по разным источникам, более чем на 40 % [7,8,9]. Данные расстройства могут усугублять течение заболевания, а в некоторых случаях при неправильном подходе к терапии привести к экзацербации может и само лечение. Препараты, побочные явления которых могут усугублять течение МГ, представлены в таблице 7.
Таблица 7 | Препараты, использующиеся при нарушениях сна и психических расстройствах, и их потенциальные негативные проявления среди пациентов с МГ [10]
Качество жизни пациентов, разумеется, страдает. Учитывая необходимость приема препаратов, развитие побочных явлений, коморбидность по аутоиммунным заболеваниям, аффективным расстройствам и нарушениям сна, следует проводить тщательное исследование качества жизни больных МГ. Для этих целей подойдут шкалы, состоящие из 15 или 60 параметров оценки качества жизни пациентов (MG-QoL15/60), индекс оценки нарушений при МГ (MGII), неспецифические опросники SF-36, шкалы оценки депрессии, тревоги, нарушений сна.
Миастения гравис — одно из немногих аутоиммунных заболеваний, для которых известны подробные сведения как об антигенах-мишенях, так и о влияющих факторах, включая патологию тимуса, генетическую предрасположенность и внешние причины, такие как беременность и роль некоторых лекарств.
Основной задачей, стоящей перед исследователями, является поиск новых чувствительных и специфических диагностических инструментов и биомаркеров для прогнозирования течения заболевания и реакции на терапию, а также определение основной причины заболевания и разработка специфической терапии, направленной на восстановление иммунной толерантности.
Источники:
- Gilhus, N.E., Tzartos, S., Evoli, A. et al. Myasthenia gravis. Nat Rev Dis Primers 5, 30 (2019).
- http://uptodate.searchbox.science/
- Tanovska N, Novotni G, Sazdova-Burneska S, et al. Myasthenia Gravis and Associated Diseases. Open Access Maced J Med Sci. 2018;6(3):472-478. Published 2018 Mar 5.
- S.I. DEDAYEV, A.G. SANADZE, D.V. SIDNEV. The use of the QMGS for quantitative assessment of the severity of movement disorders in patients with myasthenia. Zh Nevrol Psikhiatr im SS Korsakova 2012;112:7:32.
- http://uptodate.searchbox.science/
- http://uptodate.searchbox.science/
- Law C, Flaherty CV, Bandyopadhyay S. A Review of Psychiatric Comorbidity in Myasthenia Gravis. Cureus. 2020;12(7):e9184. Published 2020 Jul 14. doi:10.7759/cureus.9184
- Ybarra MI, Kummer A, Frota ER, Oliveira JT, Gomez RS, Teixeira AL. Psychiatric disorders in myasthenia gravis. Arq Neuropsiquiatr. 2011 Apr;69(2A):176-9.
- Qiu L, Feng HY, Huang X, et al. Study of incidence and correlation factors of depression, anxiety and insomnia in patients with myasthenia gravis. Zhonghua Yi Xue Za Zhi 2010; 90:3176–3179.
- Jordan H, Ortiz N. Management of Insomnia and Anxiety in Myasthenia Gravis. J Neuropsychiatry Clin Neurosci. 2019 Fall;31(4):386-391.
