Опасные связи — опухолевые клетки образуют синапсы с нейронами

В журнале Nature три группы ученых сообщают, что нейроны и раковые клетки головного мозга образуют возбуждающие синапсы, что благоприятно влияет на рост опухоли. Возбуждающий синапс — это структура, в которой два соседних нейрона — пресинаптический и постсинаптический взаимодействуют с помощью молекулы нейротрансмиттера, например, глутамата (рис. 1). Высвобождение глутамата пресинаптическим нейроном активирует рецепторы AMPA и NMDA на постсинаптическом нейроне. Это вызывает движение ионов через клеточную мембрану и деполяризацию, что приводит к возбуждению. Клетки глии окружают синапс и регулируют передачу сигнала, удаляя высвобожденный нейротрансмиттер. Другие типы глиальных клеток влияют на возбудимость нейронов, регулируя концетрацию внеклеточных ионов калия.
Глиома — опухоль головного мозга, образующаяся из глиальных клеток, является основной причиной смертности среди больных с внутричерепными новообразованиями. Для роста глиомам требуется активность соседних нейрональных клеток. Здоровые глиальные клетки образуют взаимосвязанные клеточные сети. Благодаря щелевым контактам на мембране глиальных клеток сигнальные молекулы, такие как ионы кальция, перемещаются в соседние глиальные клетки. Также клетки глиомы образуют щелевые соединения в опухолевых микротрубках — длинные тонкие выпячивания клеточной мембраны, которые простираются от этих клеток в окружающую ткань и индуцируют инфильтрацию и пролиферацию опухоли.
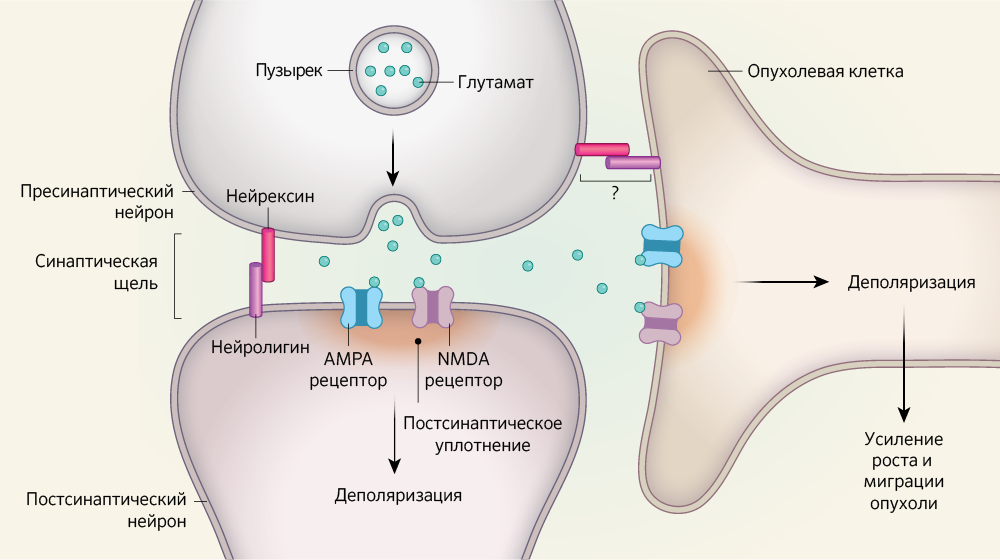
Ученые во главе с Венкатарамани трансплантировали опухолевые микротрубки глиом человека в мозг мыши и изучили их с помощью электронной микроскопии. В микротрубках найдены постсинаптические плотности, характерные для возбуждающих синапсов. Рядом с этими постсинаптическими плотностями в соседнем нейроне авторы отметили скопления пузырьков, содержащие молекулы нейротрансмиттера. Это для нейрональной пресинаптической зоны. Венкатеш и коллеги отметили аналогичные наблюдения.
Две группы ученых предоставляют доказательства того, что гены, кодирующие рецепторы глутамата и структурные компоненты постсинаптической области, экспрессируются в подмножестве клеток в глиомах человека. Это подтверждает, что клетки глиомы используют те же молекулярные механизмы, что и нейроны для создания синапсов.
Функционируют ли синапсы между опухолевыми клетками и нейронами также как и межнейрональные? Чтобы ответить на этот вопрос обе группы ученых трансплантировали клетки глиомы человека в мозг мыши. Стимуляция нейронов вблизи клеток глиомы вызывала быстрый деполяризующий ток, индуцированный рецепторами AMPA, в некоторых клетках глиомы. Это характерно для возбуждающих синапсов. Тип рецептора AMPA, экспрессируемый в этих клетках глиомы, имеет фармакологические свойства, отличные от рецепторов AMPA, экспрессируемых в нейронах. Это можно использовать для создания новых методов лечения. В некоторых других клетках глиомы наблюдался длительный деполяризующий ток, который усиливался и распространялся через щелевые соединения в сеть опухолевых клеток. Этот ток не имел синаптического происхождения — он связан с изменениями внеклеточной концентрации ионов калия.
Деполяризация клеток глиомы, вызванная нейрональной активностью, вызывала кратковременный рост количества ионов кальция в цитоплазме, которые затем распространяются через сеть клеток глиомы через их щелевые контакты. Большая частота кальциевых сигналов коррелирует с повышенной миграцией некоторых опухолевых клеток в сети. Это указывает на то, что образование синапсов в опухолевой клетке изменяет свойства других клеток в опухолевой сети и увеличивает их инвазивность.
Чтобы определить роль синапсов, образованных между клетками глиомы и нейронами в экспериментальных моделях, ученые блокировали рецепторы AMPA и тем самым предотвращали деполяризацию, вызванную синаптической активностью. Это привело к увеличению продолжительности жизни животных, которым имплантировали клетки глиомы человека, по сравнению с животными из контрольной группы, у которых рецепторы AMPA не блокировали.
Обе группы также создали клетки глиомы человека для экспрессии ионного канала, индуцированного светом. Это вызывает клеточную деполяризацию, подобную той, которая получается при синаптической опосредованной активации рецепторов глутамата. Такие клетки трансплантировали в мозг мышей. Когда свет использовался для деполяризации клеток глиомы, это привело к пролиферации опухоли.
Вместе доказательства ученых указывают на то, что некоторые клетки глиомы способны образовывать функциональные синапсы с нейронами их микроокружения. Клетки образуют электрически активную ткань, которая передает сигналы другим клеткам глиомы в сети опухолевых клеток, чтобы способствовать миграции и росту. Наличие функциональных синапсов между нейронами и раковыми клетками объясняет, почему глутамат-опосредованная нейротрансмиссия связана с усилением пролиферации, живучести и инвазивности клеток глиомы.
Цзэн и соавторы исследовали роль опосредованной глутаматом передачи сигналов в опухолях. В клетках рака молочной железы, которые часто мигрируют в мозг, отмечена повышенная экспрессия NMDA-рецептора по сравнению с другими типами изучаемых опухолей. Белковая субъединица NMDA-рецепторов под названием GluN2B, необходимая для образования синапсов и изменения силы синаптических связей также экспрессирована на высоких уровнях в клетках рака молочной железы человека и мыши. NMDA-рецепторы обеспечивают ток ионов кальция в клетки и участвуют в развитии некоторых видов рака у человека. Используя метод визуализации для отслеживания уровней кальция и электрофизиологических записей, Цзэн и его коллеги сообщают, что опосредованная NMDA-рецептором передача сигналов происходила в клетках рака молочной железы мыши.
Клетки рака молочной железы человека экспрессируют нейролигин — белок, способствующий адгезии клеток и образованию синаптических структур между нейронами. Клетки рака молочной железы человека устанавливают синаптические связи по тем же механизмам, что и нейроны. Когда авторы использовали методы микроскопии для изучения образцов ткани экспериментальных мышей, которым инъецировали клетки рака молочной железы человека в мозг, выяснилось, что белки, участвующие в упаковке глутамата в везикулы, находятся очень близко к NMDA-рецепторам и между синаптическими структурами образовались раковые клетки и нейроны. Пальцевидные клеточные отростки простирались от раковых клеток, достигая существующих мышиных синапсов между нейронами, занимая то же типичное положение вокруг синапса, что и глиальные клетки, которые удаляют глутамат из синаптической щели. Такое расположение оптимально для получения глутамата и последующей активации NMDA-рецепторов.
В случае, если мышам имплантировали клетки рака молочной железы со сниженной экспрессией GluN2B, отмечалось уменьшение опухоли головного мозга, и животные имели большую продолжительность жизни по сравнению с животными из контрольной группы. Эти результаты показывают, что передача сигналов, опосредованная NMDA-рецептором, способствует колонизации и росту раковых клеток в головном мозге.
Три исследования демонстрируют, что опухоли головного мозга образуют синаптические связи с нейронами. Подходы, нацеленные на разные типы рецепторов глутамата, процессы постсинаптической передачи сигналов и механизмы, необходимые для образования синапсов, могут помочь найти мишени для терапии опухолей.
