Клеточные метаболиты — новые мишени таргетной противоопухолевой терапии
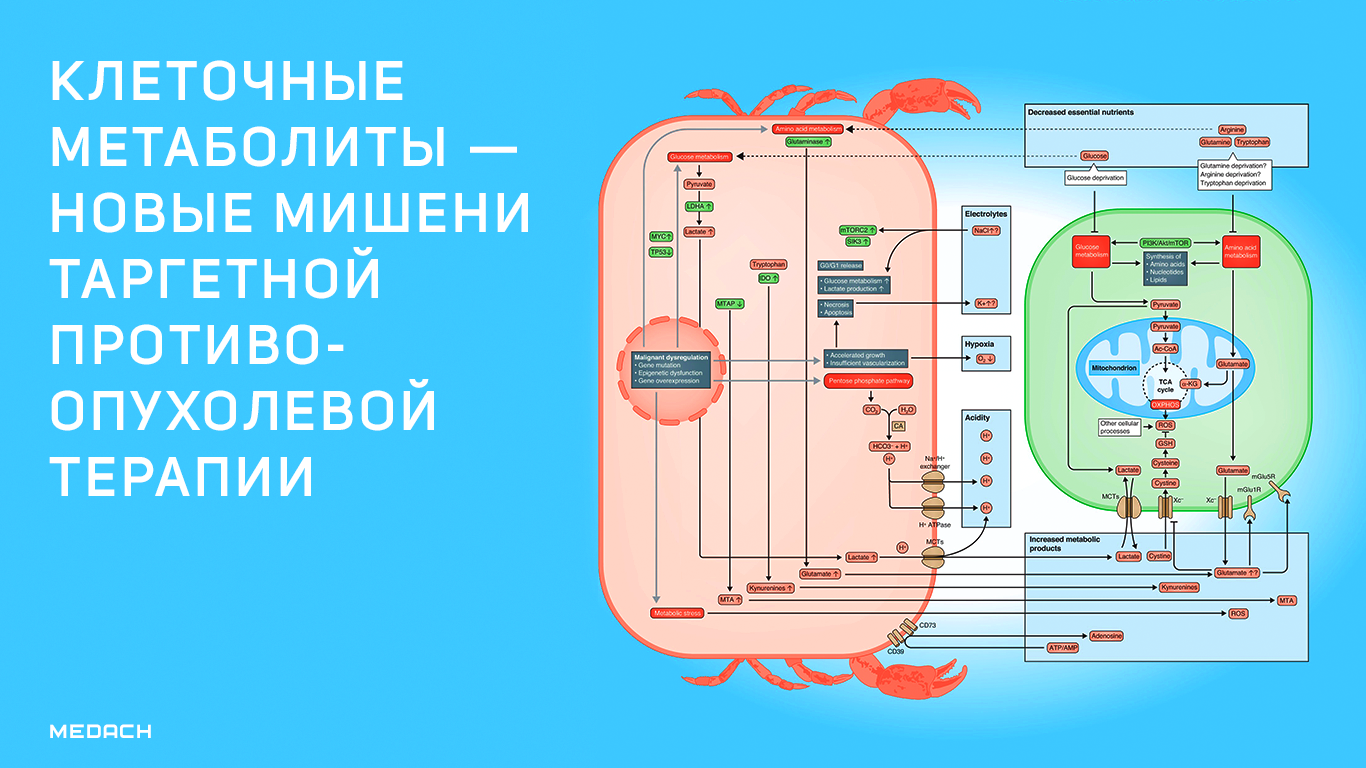
Для быстрого и агрессивного роста опухолям нужно много энергии. Поэтому раковые клетки потребляют большое количество глюкозы. В течение многих лет ученые пытались выявить и понять особенности клеточного метаболизма в надежде на создание новых методов лечения рака, которые работают, блокируя доступ к необходимым питательным веществам и тем самым убивая раковые клетки. В данной статье предлагается к прочтению анонс нескольких исследований в этой области.
Дефицит глюкозы
В исследовании, проводимом сингапурской командой под руководством Коджи Итахана вместе с командой ученых во главе с доктором Эгоном Огрисом из Лаборатории Макса Ф. Перуца в Австрии, ученые впервые продемонстрировали связь между низким уровнем сахара и гибелью раковых клеток.
Другая функция глюкозы
Долгое время считалось, что глюкоза служит одним из основных источников энергии для раковых клеток, но в некоторых раковых клетках очень низкие уровни глюкозы, которые не могли бы обеспечить выживание. Это означало, что помимо обеспечения энергией существует ранее неизвестная роль глюкозы в клетках рака. Впоследствии ученые обнаружили, что депривация глюкозы вызывает перепады напряжения на мембране опухолевых клеток, что приводит к притоку ионов кальция в клетки и последующей их гибели.
Новый подход к лечению
Исследователи предположили, что это свойство можно использовать для нового терапевтического подхода. Сочетая уменьшение потребления глюкозы и повышение уровня кальция в раковых клетках, им удалось убить раковые клетки, не повредив при этом здоровые. Такое комбинированное лечение для определенных типов раковых клеток может быть эффективным. Сейчас проводятся дополнительные исследования для разработки нового способа лечения рака в будущем.
Новая комбинированная терапия, основанная на этом выводе, находится в международной патентной заявке №. PCT/SG2017/050208 «Потенциальная комбинированная терапия с использованием ингибитора транспорта глюкозы и внутриклеточного индуктора кальция для нацеливания на метаболизм раковых клеток».
Недостаток цистина и устойчивый к лечению рак молочной железы
Ученые университета Дьюка обнаружили, что клетки рака молочной железы с тройным негативным фенотипом (устойчивая к лечению форма рака молочной железы) быстро отмирают, когда лишены ключевого питательного вещества — цистина. Изучив причину гибели клеток, они обнаружили, что эта «цистиновая зависимость» запускается механизмом, который используют многие виды опухолевых клеток, чтобы отделиться и мигрировать в новые места в организме. Блокирование поглощения цистина может быть эффективным способом лечения не только рака молочной железы с тройным негативным фенотипом, но и других агрессивных форм рака с похожим принципом метастазирования.
У пациентов с трижды негативным раком молочной железы, которые составляют примерно 10–20 % всех случаев рака молочной железы, немного вариантов лечения, кроме хирургического вмешательства и химиотерапии. Это связано с тем, что наиболее успешные методы лечения рака молочной железы нацелены на два из трех рецепторов, обычно обнаруживаемых в опухолевых клетках, — рецептор эстрогена, рецептор прогестерона или рецептор HER2/neu (human epidermal growth factor receptor 2, рецептор фактора роста эпидермиса 2) — но в клетках рака молочной железы с тройным негативным фенотипом отсутствуют все три.
Ученые провели с клетками рака молочной железы с тройным негативным фенотипом тест на депривацию питательных веществ: они наблюдали за растущими колониями клеток в различных питательных средах, в каждой из которых отсутствует только одна из 15 ключевых аминокислот.
В большинстве проб наблюдалась слабая реакция. Но при отсутствии доступа к цистину клетки быстро умерли. Клетки подвергли многим генетическим анализам, чтобы точно определить причину. Обнаружили, что цистиновая зависимость связана с процессом, называемым эпителиально-мезенхимальный переход. Клетки рака молочной железы с тройным негативным фенотипом, наряду с другими типами раковых клеток, задействуют этот процесс, чтобы отделиться от своих соседей и распространить метастазы по всему телу. Но похоже, что этот процесс также запускает клеточный сигнальный путь, который приводит к быстрой смерти, как только цистин становится недоступным.
С точки зрения терапии это может быть очень полезно, потому что есть соединения, которые блокируют этот процесс.
Также стало известно, что клетки агрессивной формы почечного рака зависимы от цистина. В настоящее время ученые продолжают исследовать молекулы, блокирующие доступ к цистину для опухолевых клеток и ищут биомаркеры, которые помогут определить, когда рак, вероятно, положительно отреагирует на это лечение.
Опухоль мозга и недостаток аминокислот
Некоторые опухоли также способны метаболизировать аминокислоту глютамин, важную для синтеза белков. Ключевым ферментом в процессе расщепления аминокислот является изоцитратдегидрогеназа (ИЦДГ). Несколько лет назад ученые обнаружили мутации в гене, кодирующем ИЦДГ, при многих типах злокачественных опухолей головного мозга. Такие опухоли, называемые первичными глиобластомами, несут интактный ген ИЦДГ, тогда как те, которые растут медленнее, обычно имеют дефектную форму.
«Изучение гена ИЦДГ в настоящее время является одним из наиболее важных диагностических критериев для дифференцирования глиобластом от других видов злокачественных опухолей мозга, которые растут медленнее», — говорит доктор Бернхард Радлвиммер из немецкого центра исследований рака. В сотрудничестве с учеными из других институтов, в том числе из университетской больницы Гейдельберга, доктор Мартье Тонес и доктор Себастьян Барбус сравнили профили генной активности нескольких сотен опухолей головного мозга. Они стремились выяснить, проявляют ли измененные или интактные ИЦДГ дальнейшие специфические генетические свойства, которые могут помочь объяснить агрессивность заболевания.
Исследователи обнаружили значительную разницу между двумя группами в сильно повышенной активности гена, кодирующего фермент BCAT1 (Branched Chain Amino Acid Transaminase 1 — аминотрансфераза для аминокислот с разветвленной цепью 1), который в нормальной ткани мозга отвечает за расщепление аминокислот с разветвленной цепью. Однако команда Радлвиммера обнаружила, что только те опухолевые клетки, у которых ген ИЦДГ не мутирован, продуцируют BCAT1. «Это неудивительно, потому что ИЦДГ при расщеплении аминокислот продуцирует кетоглутарат — молекулу, в которой нуждается BCAT1. Это объясняет, почему BCAT1 продуцируется только в опухолевых клетках, несущих интактную ИЦДГ».
Глиобластомы особенно опасны, потому что они агрессивно проникают в здоровую ткань мозга, которая их окружает. Когда исследователи с помощью препаратов блокировали эффекты BCAT1, опухолевые клетки теряли свою инвазивную способность. Кроме того, клетки выделяли меньше глутамата. Высокие концентрации глутамата — причина тяжелых неврологических симптомов, таких как эпилептические припадки. Клетки глиобластомы с блокированным геном BCAT1, подсаженные мышам, в опухоль не превращались.
«В целом, мы видим, что из-за повышенной экспрессии BCAT1 клетки глиобластомы более агрессивны», — говорит Радлвиммер. Исследование предполагает, что именно эти два фермента, BCAT1 и ИЦДГ, участвуют в разложении аминокислот с разветвленной цепью. Эти белковые строительные блоки, по-видимому, являются «источником пищи», который провоцирует агрессивность раковых клеток. Аминокислоты с разветвленной цепью также играют важную роль в метаболических заболеваниях, таких как диабет. Впервые ученые смогли показать роль этих аминокислот в росте злокачественных опухолей.
«Хорошая новость», — резюмирует Радлвиммер, — «это то, что мы нашли другую мишень для терапии в BCAT1. В сотрудничестве с Bayer Healthcare мы уже начали поиск средств, нацеленные на угнетение этого фермента». Исследователи также планируют выяснить, может ли экспрессия BCAT1 служить дополнительным маркером для диагностики злокачественной опухоли головного мозга.
Дефицит аминокислот и клетки лейкемии
Исследователи из университета Эмори нашли способ выборочно блокировать рост лейкозов. В качестве мишени использовался транспортный фермент, называемый ASCT2 (alanine serine cysteine transporter 2 — транспортный фермент 2 для аланина, серина и цистеина), который доставляет аминокислоты в клетки. Удаление гена, кодирующего этот фермент, продлевает выживаемость мышей с агрессивной формой лейкемии (ОМЛ — острый миелолейкоз): от 45 дней до более 300 дней.
В последние годы существует интерес к эффекту Варбурга: измененному метаболизму раковых клеток. Идея состоит в том, чтобы создать дефицит питательных веществ в опухолевых клетках, оставляя здоровые клетки в покое.
В клетках лейкемии потеря ASCT2 сильно влияет на клеточный метаболизм, нарушает поступление лейцина и передачу сигналов mTOR (mammalian target of rapamycin — мишень рапамицина млекопитающих), индуцирует апоптоз.
Ученые выяснили, что ген, кодирующий ASCT2, может быть удален у мышей без существенного нарушения развития клеток крови. Однако мышам действительно требуется больше времени для восстановления количества лейкоцитов после стресса от химиотерапевтических препаратов или облучения.
Ученым необходимо проявлять осторожность при комбинировании ингибиторов ASCT2 с химиотерапией в клинических испытаниях.
Ученые провели тестирование ингибирования ASCT2 у мышей, которым трансплантировали клетки острого миелолейкоза человека, и обнаружили значительный терапевтический эффект. Но пока лекарство недостаточно специфично для клинического применения.
Источники:
- Duke-NUS Medical School. "Starving cancer cells of sugar — does it work?." ScienceDaily. ScienceDaily, 26 January 2018. <www.sciencedaily.com/releases/2018/01/180126095312.htm>.
- Duke University. "Cellular starvation kills treatment-resistant breast cancer." ScienceDaily. ScienceDaily, 21 November 2016. <www.sciencedaily.com/releases/2016/11/161121162442.htm>.
- Helmholtz Association of German Research Centres. "Brain cancer: Hunger for amino acids makes it more aggressive." ScienceDaily. ScienceDaily, 24 June 2013. <www.sciencedaily.com/releases/2013/06/130624132800.htm>.
- Emory Health Sciences. "Starving leukemia cells by targeting amino acids: Altered metabolism in cancer cells." ScienceDaily. ScienceDaily, 12 March 2019. <www.sciencedaily.com/releases/2019/03/190312123803.htm>.
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- Telegram
