Противоопухолевый иммунный ответ: песнь льда и пламени

«Тогда огонь! Огонь, с которого все началось и которым мы все заканчиваем!»,
Михаил Афанасьевич Булгаков «Мастер и Маргарита».
Иммунологический фенотип микроокружения опухоли является важной детерминантой прогноза заболевания и терапевтического успеха. Стены этой цитадели — это опухолевое микроокружение, состоящее из «кирпичиков» — клеток. Среди них: сосудистые эндотелиальные клетки, опухоль-ассоциированные фибробласты, различные подгруппы резидентных или мигрирующих иммунных клеток (например, дендритные клетки, натуральные киллеры, Т-клетки). В зависимости от количественного и качественного состава определяется прочность преграды (рис. 1) [1]. Существуют так называемые «горячие» опухоли, которые инфильтрированы иммунными клетками (CD4+, CD8+, миелоидные клетки). Этот взвод иммунной армии не убивает опухоль, а, напротив, как затаившийся ниндзя, может мобилизоваться с мощным провоспалительным взрывом. «Горячие» опухоли часто имеют высокую мутационную нагрузку: в них накапливается множество поломок ДНК, что заставляет опухолевые клетки продуцировать специфичные молекулы — неоантигены — на своей клеточной поверхности. Эти неоантигены делают опухоль более уязвимой для распознавания иммунной системой и, таким образом, с большей вероятностью вызывают сильный иммунный ответ. Среди злокачественных опухолей считаются «горячими»: рак мочевого пузыря, головы и шеи, рак почки, рак печени, меланома и немелкоклеточный рак легкого, а также опухоли разных типов, которые имеют высокий показатель микросателлитной нестабильности [2]. Именно в таких типах опухолей эффективны ингибиторы иммунных контрольных точек. Длительная антигенная стимуляция обусловливает устойчивую экспрессию рецептора PD-1 на T-лимфоцитах и повышение экспрессии лиганда PD-L1 на злокачественно трансформированных клетках. Лиганд PD-L1, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность. Соответственно, анти-PD1 и анти-PD-L1 моноклональные антитела приводят к реактивации специфического противоопухолевого иммунного ответа [3].
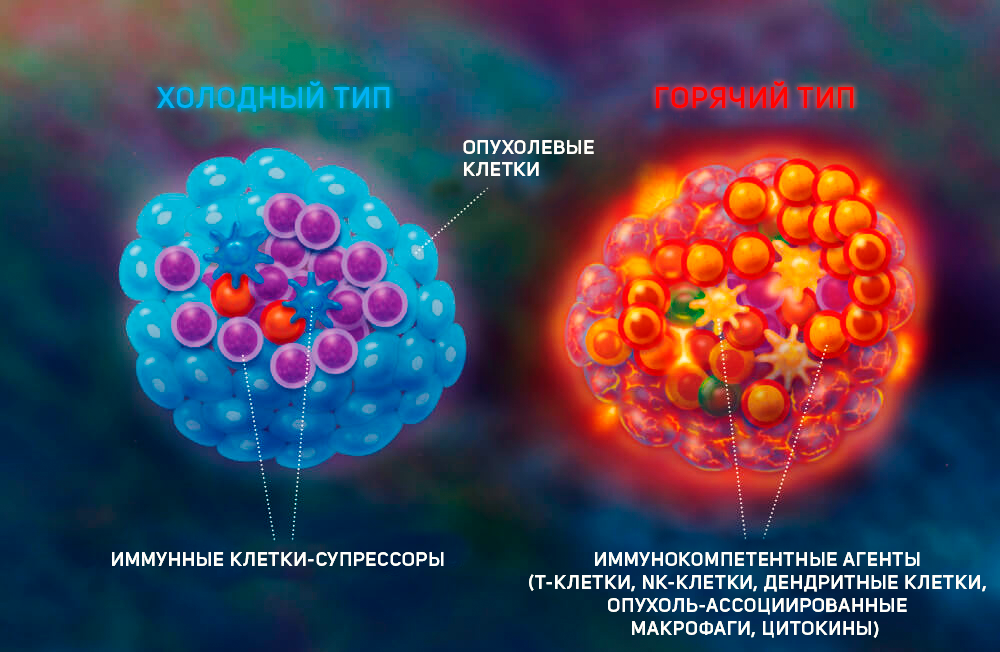
Рисунок 1 | Типы опухолей в зависимости от иммуногенности – холодная и горячая [1].
Также существуют «холодные» опухоли, напоминающие неприступную крепость, окруженную рвом. В их «стенах» мало Т-клеток, и мобилизовать иммунный ответ крайне сложно. Напротив, преобладают клетки, ассоциированные с иммуносупрессией, включая регуляторные Т-клетки, миелоидные клетки-супрессоры и макрофаги 2 типа. В топе «ледяных глыб»: глиобластома, рак яичников, предстательной железы и поджелудочной железы [4].
Одним из интересных методов «зажечь холодное сердце» не иммуноактивной опухоли является использование онколитических вирусов. За счет каких процессов это возможно? В процессе трансформации опухолевые клетки приобретают дефекты в многочисленных сигнальных путях, которые одновременно влияют на контроль клеточного роста и врожденные антивирусные защитные системы [5]. В результате такие опухоли становятся восприимчивы к ряду вирусов, встречающихся в природе или генетически модифицированных, которые избирательно реплицируются внутри опухолевых клеток и убивают их, не повреждая здоровые ткани, в которых противовирусные механизмы активно работают. Множество вирусов рассматриваются в роли потенциальных онколитических терапевтических векторов, среди них: аденовирусы, пикорнавирусы, реовирусы, полиовирусы, вирус простого герпеса, вирус коровьей оспы, вирус везикулярного стоматита, вирус болезни Ньюкасла, вирус кори, вирус эпидемического паротита. Основополагающими характеристиками идеального онколитического вируса являются специфичность, безопасность и эффективность. Специфичность означает тропность к злокачественным тканям при минимальном токсическом воздействии на неопухолевые клетки. Безопасность для организма хозяина подразумевает, что вирус не способен распространяться в популяции здоровых клеток и передаваться от человека к человеку. Важным фактором безопасности служит также генетическая стабильность. В вирусе не должно быть спонтанных рекомбинаций генома или активного мутагенеза, способных внезапно увеличить его патогенность. Одновременно с этим должна быть осуществима искусственно регулируемая модификация генома, что могло бы повысить эффективность онколизиса. Например, введение онконаправленных трансгенов (TRAIL, p53), иммуномодуляторов, колониестимулирующих факторов, цитокинов (INF-β, FAS-лиганд, IL-2, IL-12, IL-15, CD40-лиганд, TNF), антиангиогенных трансгенов (VEGFR-1-лиганд, эндостатин/ангиостатин). И, конечно, вирус должен проникнуть в клетки злокачественной паренхимы, реплицироваться с высоким индексом пролиферации и эффективно лизировать опухолевые клетки, несмотря на наличие противовирусного иммунного ответа [6].
Значительное внимание уделяют препарату талимоген лагерпарепвек (T-Vec, Imlygic®), который представляет собой генетически модифицированный вирус простого герпеса I типа, который в 2015 году был одобрен FDA и EMA для лечения неоперабельной меланомы [7]. Также изучается терапия препаратом на основе вируса коровьей оспы (пексастимоген девацирепвек/Pexa-Vec) в комбинации с сорафенибом у пациентов с гепатоцеллюлярной карциномой (фаза 3) [8]; сочетание вируса Мараба (MG1), экспрессирующего MAGE-A3 (MG1-MAGEA3) и аденовирусной вакцины, экспрессирующей MAGE-A3 (Ad-MAGEA3) в комбинации с пембролизумабом у пациентов с метастатическим немелкоклеточным раком легкого (которым проведен, по меньшей мере, 1 цикл химиотерапии препаратами платины и/или один курс таргетной терапии антителами к PD-1 или PD-L1) [9].
Но чем дальше изучается действие этих вирусных агентов, тем более узким кажется их определение как онколитических. Иммуногенная гибель пораженных вирусом опухолевых клеток является, безусловно, важным этапом данной терапии, но это лишь пусковой механизм, за которым следует каскад реакций, пробуждающих мощный противоопухолевый иммунный ответ (рис. 2). Выброс разнообразных молекулярных фрагментов, ассоциированных с повреждением, рекрутирует дендритные клетки. В свою очередь, стимулированные дендритные клетки начинают секретировать провоспалительные цитокины (IFN-α, IL-12, TNF-α и IL-6), чем «воспламеняют» опухоль [10].
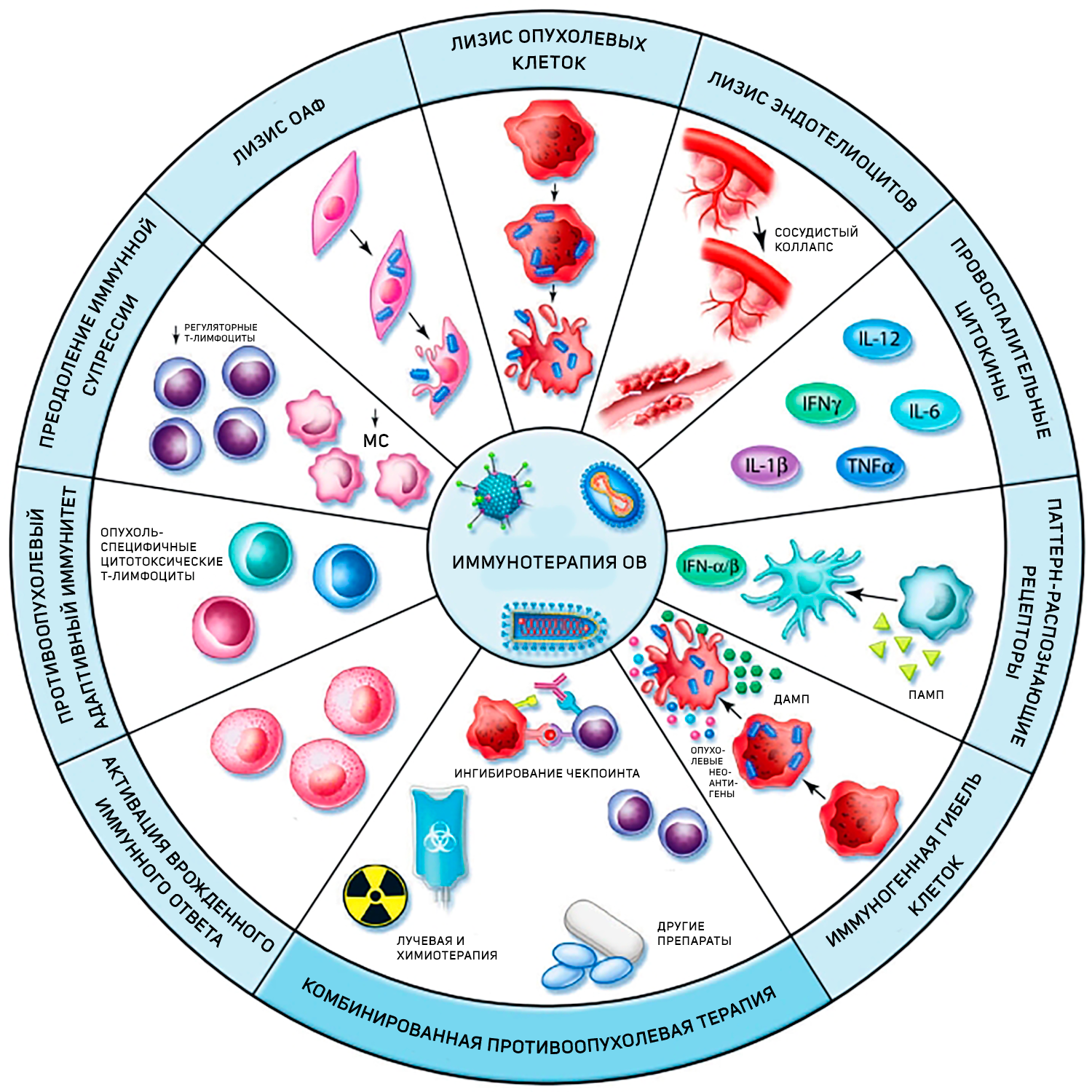
Рисунок 2 | «Десант» онколитических вирусов в микроокружении опухоли.
В дополнение к своей заявленной литической активности в отношении опухолевых клеток, онколитические вирусы (ОВ) могут нацеливаться и на другие компоненты опухолевого микроокружения, включая опухоль-ассоциированные фибробласты (ОАФ) и эндотелиоциты. Репликация этих вирусов вызывает высвобождение провоспалительных цитокинов, дистресс-ассоциированных молекулярных паттернов (ДАМП — отвечают за распознавание эндогенных факторов, возникающих в ответ на инфекцию, то есть обнаруживают «измененного своего»), патоген-ассоциированных молекулярных структур (ПАМС — ответственны за распознавание чужеродных молекулярных структур инфекционного происхождения). Также при разрушении опухолевых клеток высвобождается весь спектр опухолевых неоантигенов. Это приводит к рекрутированию и созреванию иммунных клеток, которые могут перекрестно представлять опухолевые неоантигены CD8+клеткам, генерируя таким образом, популяции специфичных онкоцитотоксических Т-лимфоцитов. Запуск противоопухолевого иммунного ответа противодействует иммунной супрессии, связанной с T-регуляторными клетками и миелоидными супрессорами (МС). Таким образом, вирусная инфекция вовлекает как врожденные, так и адаптивные звенья иммунной системы [10].
Такое плейотропное действие вирусных агентов еще раз доказывает, насколько сложной и многокомпонентной системой является опухоль.Терапия в онкологии — это как дирижирование огромным оркестром, где каждый фальшивый звук может стоить жизни. И хочется верить, что иммуногенные онкотропные (не будем ограничивать их роль лишь как убийц злокачественных клеток) вирусы станут одной из ведущих скрипок в нем.
Источники:
1. Enhancing Immunotherapy: The Race to Make «Cold» Tumors «Hot». June 6, 2018.
2. Niemann J.et al. Molecular retargeting of antibodies converts immune defense against oncolytic viruses into cancer immunotherapy. Nat Commun. 2019 Jul 19;10(1):3236.
3. Chen D.S., Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017 Jan 18;541(7637):321-330.
4. Pikor L.A., Bell J.C., Diallo J.S. Oncolytic viruses: exploiting Cancer's deal with the devil. Trends Cancer. 2015;1:266–277.
5. Russell S.J., Barber G.N. Oncolytic Viruses as Antigen-Agnostic Cancer Vaccines. Cancer Cell. 2018 Apr 9;33(4):599-605.
7. Guo Z.S., Liu Z., Kowalsky S., Feist M., Kalinski P., Lu B. Oncolytic immunotherapy: conceptual evolution, current strategies, and future perspectives. Front. Immunol. 2017;8:555.
6. de Graaf J.F., de Vor L., Fouchier R.A.M., van den Hoogen B.G. Armed oncolytic viruses: A kick-start for anti-tumor immunity. Cytokine & Growth Factor Reviews. 2018.41:28–39.
8. Hepatocellular Carcinoma Study Comparing Vaccinia Virus Based Immunotherapy Plus Sorafenib vs Sorafenib Alone. First posted: September 29, 2015. Last Update Posted : July 11, 2019.
9. Oncolytic MG1-MAGEA3 With Ad-MAGEA3 Vaccine in Combination With Pembrolizumab for Non-Small Cell Lung Cancer Patients. First Posted : August 26, 2016. Last Update Posted : April 11, 2019.
10. Achard C.et al. Lighting a Fire in the Tumor Microenvironment Using Oncolytic Immunotherapy. EBioMedicine. 2018;31:17–24.
