Клеточный цикл
От того, насколько своевременно и точно делятся клетки, зависит адекватная работа ткани, органа и всего организма. При нарушениях этого процесса возникают опухоли, аутоиммунные заболевания и иммунодефициты, дефекты регенерации тканей. Жизнь клетки представляет собой цикл, по которому так или иначе суждено пройти каждой, поэтому пришла пора осветить этот вопрос подробно. Бесспорно, людей, связанных с медициной, интересуют больше вопросы регуляции деления, но для начала вспомним об основах.
Клеточный цикл выглядит следующим образом.
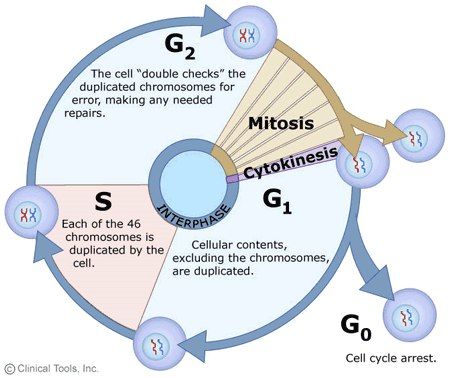
Непосредственно на деление (в нашем случае митоз) приходится меньшая часть времени, а большую часть занимает интерфаза, промежуток между делениями, во время которой клетка восстанавливается и готовится к следующему митозу... Или же не готовится: полностью дифференцированные клетки после последнего в своей жизни деления попадают в стадию G0, где и выполняют свои специфические функции. Надо сказать, для некоторых клеток это — еще не конец, и под действием каких-то внешних стимулов они могут вновь вернуться к делению, но, например, нейроны из этой стадии уже не выходят совсем.
Независимо от того, что делала клетка до интерфазы, чтобы перейти к делению, она должна пройти все ее периоды, т.е. G1, S и G2. Названия даны не случайно: в G- клетка растет, а в S -синтезирует ДНК, так, что общее количество ДНК удваивается. Забегая вперед, скажем, что переходы от одного этапа к другому управляются несколькими киназами, о чем мы скажем подробно позднее. Каждый этап проверяется — существуют "точки рестрикции", где деление останавливается, если результат конкретного периода не удовлетворяет требованиям.
Итак, в G1, сразу после митоза (или G0) клетка восстанавливает объем и массу и готовится к репликации, именно в этот период инициируется дупликация центриолей, которая сама, правда, случится позднее — в S-фазу. Если в среде присутствуют факторы роста, нет повреждений в ДНК, то клетка переходит в S-период, в который происходит репликация ДНК и дупликация центриолей. Что важно, клетка жестко следит за тем, чтоб дупликация центриолей произошла только один раз. Итак, если всё в порядке, ДНК реплицировалась удачно, то наступает G2-период, финишная прямая. Во время него опять проверяется качество ДНК, клетка увеличивает свою массу. И при условии, что все внешние и внутренние факторы способствуют переходу G2/M, наступает митоз.
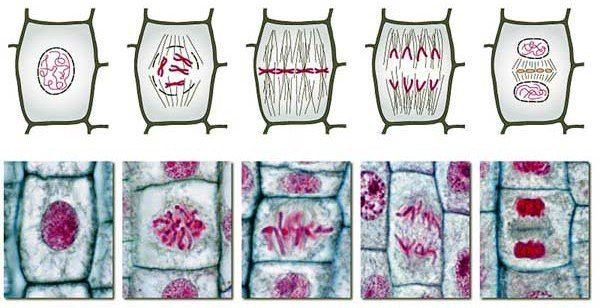
Для того, чтобы две дочерние клетки поровну получили генетический материал, организация процесса деления должна быть удобной и четкой. Хромосомы вне деления находятся в деконденсированном виде, т.е. представляют собой чрезвычайно длинные нити, рассредоточенные по всему ядру. Естественно, удобно разделить ДНК у каждой из них поровну просто не получится, поэтому первым делом хромосомы спирализуются и приобретают характерный вид, в это же время образуются абсолютно необходимые для деления органеллы — центросомы. Затем происходит разрушение ядерной оболочки, что знаменует начало следующей по списку стадии, прометафазы.
Микротрубочки, растущие из центросом, соединяются с хромосомами, образуется веретено деления и какое-то время совершается серия сложных движений, названных конгрессией — прикрепленные к микротрубочкам хромосомы движутся от и к полюсам, до тех пор, пока не выстроятся ровно на экваторе клетки, образуя метафазную пластинку. Когда все хромосомы примут это положение, начнется метафаза. Непосредственно в нее ничего не происходит, клетке нужна пауза, чтобы проверить, все ли хромосомы правильно прикрепились, читай чтобы каждый кинетохор был прикреплен к микротрубочкам своего полюса, а затем начинается анафаза.
Прежде чем идти дальше, поговорим о веретене деления. По сути, это уникальная структура, существующая только во время деления клетки, совершенно необходимая как для разделения хромосом, так и для разделения цитоплазмы дочерних клеток. Состоит она из центросом, состоящих из двух центриолей каждая, располагающихся в норме у человека на двух противоположных полюсах, микротрубочек, растущих от них в направлении к центру клетки — к хромосомам, астральных микротрубочек, идущих от центросом во всех направлениях, но не к хромосомам, белковых моторов, а также из самих хромосом.
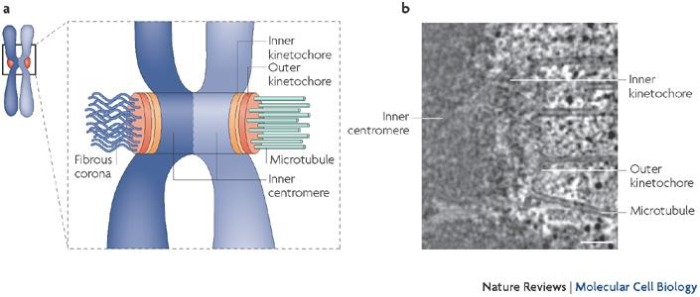
В делении задействован особый участок хромосомы — центромера, представляющая из себя комплекс из ДНК и хроматина, к которой прикрепляется кинетохор, сложная структура, служащая для связывания с микротрубочкам веретена. Центромера состоит из специфических участков, названных CEN, и с ними связываются соответствующие белки, CENP. Последние остаются с хромосомами до самого конца, но есть ещё и "хромосомные пассажиры", меняющие свою локализацию в ходе деления, к ним относят в первую очередь некоторые киназы. Кинетохоров у каждой хромосомы два, и они находятся на противоположных сторонах центромеры, повернуты друг от друга, и основная их функция — захват и стабилизация микротрубочек. Первое осуществляет наружная часть кинетохора, корона, имеющая вид щупалец, а второе — наружная пластинка.
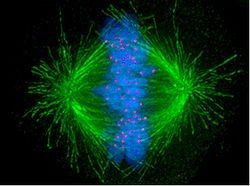
 Итак, как только ядро разрушилось, хромосомы вырываются на волю и норовят рассредоточиться по всей цитоплазме. В это же время центросомы начинают во всех направлениях сразу активно синтезировать микротрубочки, чтобы точно не промахнуться. Если микротрубочка не нашла свой кинетохор, она диссоциирует, если же нашла, то последний захватывает ее, и начинает перемещаться в направлении полюса, попутно связывая и другие, в результате чего образуется нить кинетохора. В какой-то момент кинетохор противоположной стороны также связывает какую-нибудь микротрубочку.
Итак, как только ядро разрушилось, хромосомы вырываются на волю и норовят рассредоточиться по всей цитоплазме. В это же время центросомы начинают во всех направлениях сразу активно синтезировать микротрубочки, чтобы точно не промахнуться. Если микротрубочка не нашла свой кинетохор, она диссоциирует, если же нашла, то последний захватывает ее, и начинает перемещаться в направлении полюса, попутно связывая и другие, в результате чего образуется нить кинетохора. В какой-то момент кинетохор противоположной стороны также связывает какую-нибудь микротрубочку.
А как же в итоге хромосомы выстраиваются точно на экваторе, если у одного кинетохора уже образовался целый пучок, а к другому присоединена какая-то жалкая пара микротрубочек? А хороший вопрос. Движение хромосом, вообще, очень сложный процесс, и даже на данный момент неизвестно точно, как это происходит, но есть несколько теорий, а также свеженькая (2017 года) статья, авторы которой предлагают объединить оба главных предположения в одно: гипотезу Остергрена, что кинетохор находится на конце микротрубочки, а моторы на полюсах подтягивают ее к себе, причем усилие прямо пропорционально длине микротрубочки — таким образом хромосомы стремятся к экватору, где будет наблюдаться равновесие сил; и модель "пакман", в которой основное усилие создают моторы на кинетохорах, а концы микротрубочек, связанные с ними, диссоциируют, т.е. кинетохор как бы "поедает" кинетохорную нить. Также в движении участвуют моторные белки, хромокинезины, находящиеся на плечах хромосом, а также отталкивающая сила микротрубочек, неприкреплённых к кинетохорам (таким образом, при движении хромосомы к полюсу, её плечи будут отталкиваться растущими навстречу микротрубочками). В принципе. найдено более ста белков, участвующих в конгрессии хромосом, но точная функция установлена лишь для немногих. Обзор в прикреплённом документе.
Когда все хромосомы выстроились на экваторе клетки, белки-пассажиры, (об анафазном промотором комплексе скажем в следующий раз), проверяют, достаточно ли микротрубочек прикрепилось к каждому кинетохору. И до тех пор, пока "достаточно" не станет, анафаза не не начнётся.
Анафазу условно делят на анафазу А и анафазу В. Но это не стадии этапа митоза, а скорее процессы, происходящие в неё. В анафазу А расходятся к полюсам хромосомы, в анафазу В — сами полюса. Но процессы эти идут практически одновременно. Первым делом хромосомы разделяются на две хроматиды, как раз в области центромеры, таким образом, что каждая хроматида обладает одним кинетохором. Те же силы, что управляют движением хромосом во время прометафазы, управляют движением и во время анафазы, но теперь ничто не мешает хроматиде спокойно двигаться к полюсу. В этом также участвуют многочисленные моторы, располагающиеся между микротрубочками, связанными с кинетохорами, между ними и микротрубочками, с ними не связанными, моторы полюсов.
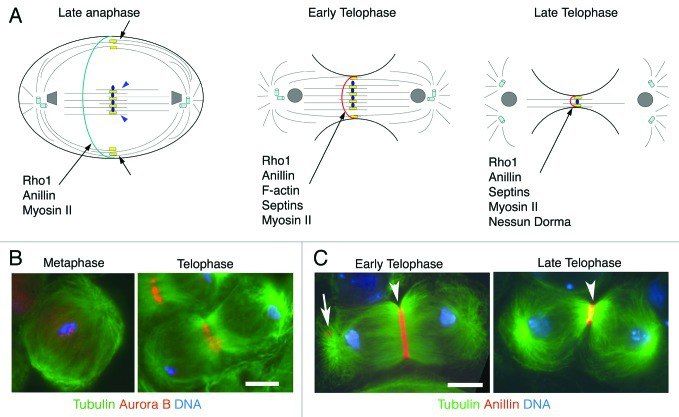
Во время анафазы В моторы, находящиеся на закрепленных у цитолеммы концах астральных микротрубочек, притягивают полюс к себе, а кинезиноподобные белки вроде Eg5, соединяясь с микротрубочками, идущими от противоположных полюсов, отталкивают микротрубочки от центра, и, таким образом, расходятся и сами полюса. В анафазу происходит и образование толстого пучка микротрубочек между расходящимися хромосомами, который после получит название остаточного тельца.
И затем наступает телофаза, в которую образуются две дочерние клетки. Процесс непосредственного разделения цитоплазмы на две части носит названия цитокинеза и является завершающим этапом митоза. Для него необходимо три элемента: веретено деления (оно никуда не делось после расхождения хромосом), остаточное тельце и сократимое кольцо. Последнее представляет собой пучок актиновых филаментов, связанных между собой миозинами, и находится оно прям под цитолеммой, образуя кольцо в области экватора. Веретено деления необходимо для образования в нужном месте остаточного тельца, а оно уже, в свою очередь, даёт клетке понять, где именно синтезировать сократимое кольцо.
Образовавшись, кольцо тут же начинает сокращение, благодаря взаимодействию актина и миозина II. Плазмалемма втягивается, образуется "бороздка деления". Интересен тот факт, что толщина сократимого кольца не увличивается при сокращениии, а остаётся неизменной до самого конца, что достигается за счёт постоянной диссоциации белков, его образующих. Итак, кольцо сжимается-сжимается, и в итоге дочерние клетки становятся связаны друг с другом лишь перемычкой — остаточным тельцем, которое может существовать ещё долгое время. В случае, если какой-то генетический материал не до конца разошёлся, а остался посреди клетки, бороздка деления пропадает, и образуется двухядерная клетка, если же всё пошло по плану, то перемычка разрушается, так или иначе, и деление тем самым завершается.
Регуляция клеточного цикла
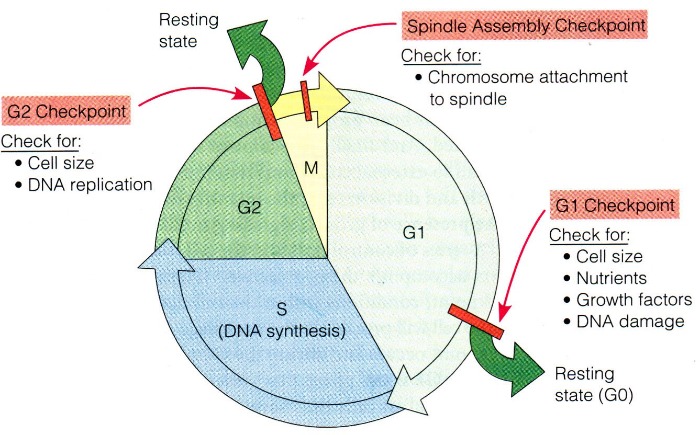
Такое ответственное дело, как деление, должно быть тщательно спланировано и отрегулировано, особенно в условиях многоклеточного организма. Клетки проходят по клеточному циклу не непрерывно, а могут долгое время находиться на одной из стадий, если внешних и внутренних стимулирующих сигналов недостаточно, или же преобладают ингибирующие сигналы. Контроль за соблюдением всех необходимых условий проходит в нескольких контрольных точках. Если все удовлетворяет требованиям, то клетка может совершить переход (transition) от одной фазы к другой.
Основные точки это: точка рестрикции, находящаяся в конце G1 фазы интерфазы, символизирующая начало деления, точка на границе G2/M (репликация ДНК прошла успешно) и точка выхода из митоза.
Регуляция в фазе G1
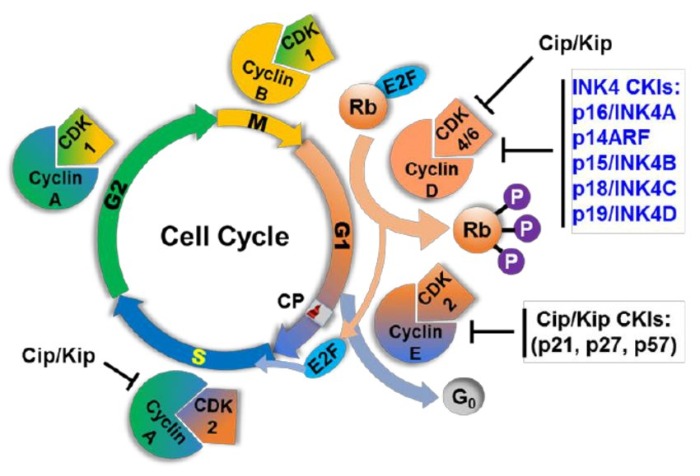
Основную регуляцию осуществляют комплексы из белков-представителей семейства циклинов и представителей семейства циклин-зависимых киназ (CDK). В организме млекопитающих эти киназы преимущественно специфичны по отношению к определенному периоду клеточного цикла. Так, например, CDK1 (совместно с циклином В) проявляет свою активность во время митоза, а CDK 2,4,6 — в интерфазе. Интересный момент, что каждый циклин не строго специфичен к какой-то определенной киназе, таким образом возникает огромное количество вариаций, позволяющих тонко регулировать транскрипцию и клеточное деление (для понимания масштабов, скажем, что циклинов в человеческой клетке 29, а CDK — 20).
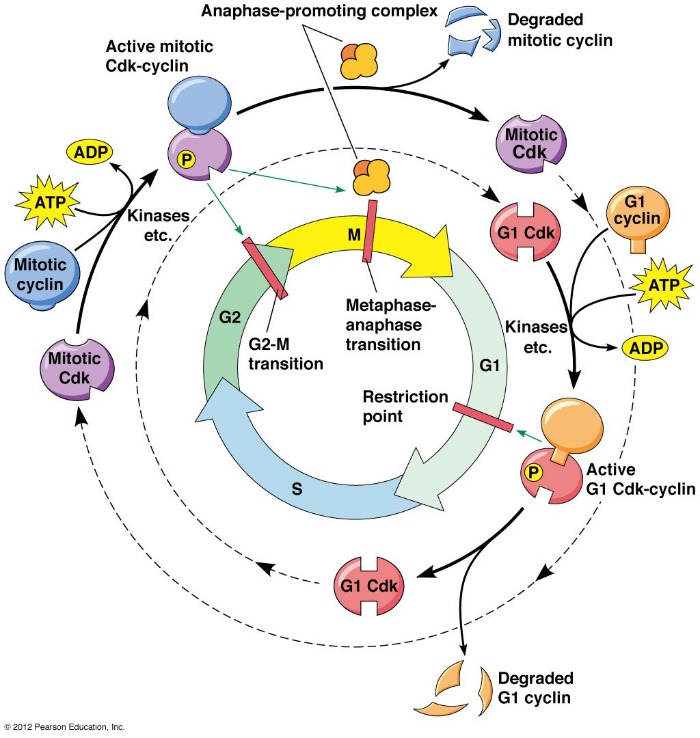
Активность комплексов циклин/CDK регулируется несколькими способами.
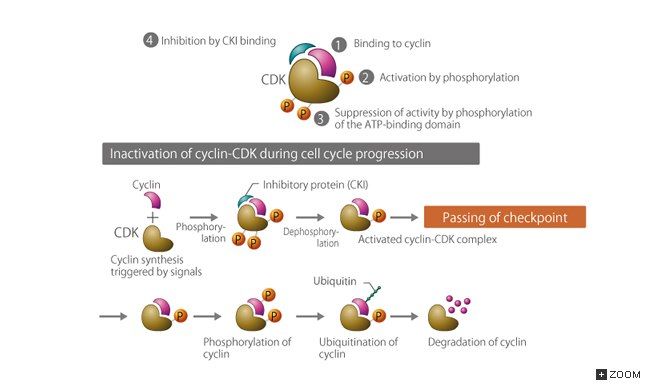
Во-первых, классика — фосфорилирование киназы. Но здесь все не так просто. Если для большинства ферментов фосфорилирование означает либо активацию, либо ингибирование, то в данном случае все зависит от того, что именно будет фосфорилировано. Если треонин в 167 положении, то киназа активируется, если же треонин в 14 и тирозин в 15, то наоборот.
Во-вторых, связывание с ингибитором (CKI), самым известным представителем которых является р27.
В-третьих, циклины в составе комплекса могут быть убиквитинированы и подвергнуты протеолизу.
А в-четвертых, основных участников можно просто не пускать в ядро. Так, циклин В1 в нефосфорилированном виде экранирует на поверхность сигнал ядерного экспорта (NES), а сигнал ядерной локализации (NLS) в это время спрятан, в силу чего этот белок не может попасть в ядро и осуществлять положенные ему функции.
Для помощи в принятии решения клетке, вступать ли в митоз, природой предусмотрено несколько механизмов.
Первый из них — связывание специфическими рецепторами различных факторов роста. Самый первый из открытых — тромбоцитарный фактор роста (PDGF). Две его молекулы связываются с двумя рецепторами, являющимися тирозиновыми киназами, после чего последние образуют димер, способный к аутофосфорилированию. Затем к этому фосфорилированному димеру присоединяются различные адапторные белки и ГТФ-азы Ras, образуя комплекс, а этот комплекс, в свою очередь, запускает активацию киназного каскада Ras/Raf/MEK/ERK, итогом чего служит фосфорилирование транскрипционных факторов с-Jun, c-Myc, c-Fos — их активация, а активированные белки далее либо сами по себе (с-Мус), или образуя димер, АР-1 (c-Fos + с-Jun) запускают транскрипцию генов раннего ответа (Jun, Myc, Fos), что активируют далее транскрипцию т. н. генов замедленного ответа, непосредственно участвующих в регуляции клеточного цикла, ярким примером которых служит циклин G1-фазы — циклин D.
Во-вторых, как уже было сказано, комплексы циклин/CDK могут быть связаны с ингибитором. Для удаления последнего существует специальная убиквитин-зависимая система протеолиза (UPC), состоящая из трех типов ферментов: E1 (убиквитин-активирующего), Е2 (убиквитин-связывающего) и Е3 (убиквитин-лигазы). Вообще, убиквитин очень широко используется в клетке: помеченный им (в большинстве случаев не одной, а несколькими молекулами) субстрат, как правило, подвергается протеолизу. В нашем случае, когда мы рассматриваем переход G1/S, субстратом являются ингибиторы циклин-зависимых киназ (CKI), а убиквитин-лигаза будет принадлежать к семейству куллин-содержащих лигаз под именем SCF, но отметим, что UPC работает на протяжении всего клеточного цикла и точкой рестрикции ее действие не ограничивается.
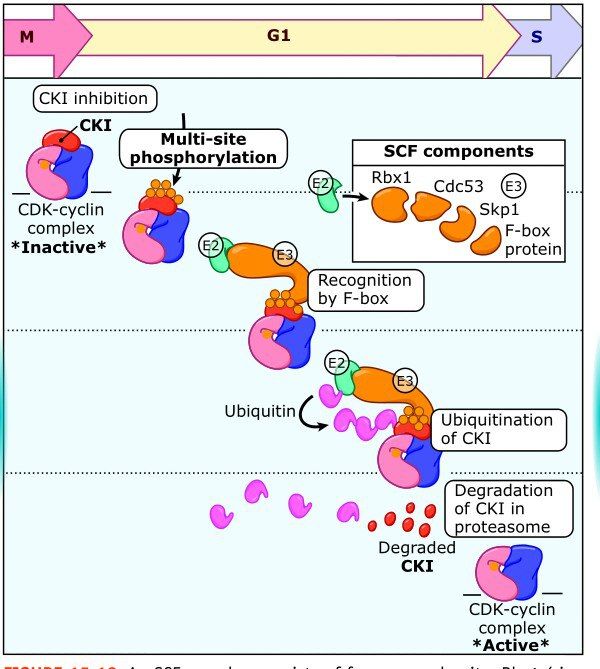
SCF является комплексом, состоящим из четырех компонентов: трех константных (Skp1, Rbx1, Cullin1) и одного вариабельного, белка F-бокса, которых на данный момент насчитывают около 70, и именно они отвечают за специфичность по отношению к конкретному субстрату. Причем белки F-бокса могут быть как активаторами деления (Skp2), так и супрессорами (FBW7), или быть и теми и другими в зависимости от обстоятельств (β-TrCP); нарушения их функционирования замечено в некоторых опухолях. Итак, при протеолизе ингибитора CDK комплекс циклин/CDK становится активен и может далее выполнять свою задачу.
Третьим же механизмом, благодаря которому клетка может преодолеть точку рестрикции, является система Rb/E2F. E2F — семейство факторов транскрипции, играющих важную роль в апоптозе и клеточном цикле. Ранее считалось, что его представители играют сугубо активирующую роль, запуская транскрипцию необходимых для прохождения клеточного цикла генов. Сейчас же стало известно, что не все так просто (в общем, как и всегда), и, к примеру, E2F1 может быть как онкогеном, так и онкосупрессором в зависимости от обстоятельств, но в целом E2F1-3 факторы являются активаторами транскрипции как самих себя, так и циклина Е. Современная модель выглядит следующим образом (схема): в G0 и в течение ранней G1 E2F связаны с промоторами и белком ретинобластомы (Rb). Под действием cycD/CDK4,6 Rb фосфорилируется и Rb отсоединяется от E2F, в результате запускается транскрипция как E2F, так и циклина Е, который совместно с циклином-2 по механизму положительной обратной связи тоже фосфорилирует Rb, за счет чего достигается амплификация данного циклина и переход в следующую фазу — фазу S.
Фаза S
Основное событие в S-фазе — репликация ДНК. Репликация должна происходить только в нужный период времени и лишь единожды за цикл. Намного легче управлять процессом, если репликация начинается не с любого конца молекулы ДНК, и множество ДНК-полимераз суетятся вокруг хромосомы, мешая друг другу и допуская ошибки, а если есть строго определенные точки начала репликации — ориджины, специфические последовательности, к которым присоединяются факторы, ответственные за начало матричного синтеза.
Сделаем ремарку: репликация всех хромосом не происходит одновременно. Так, инициация некоторых происходит в начале S-фазы, других же, например, инактивированной Х-хромосомы — под самый конец.
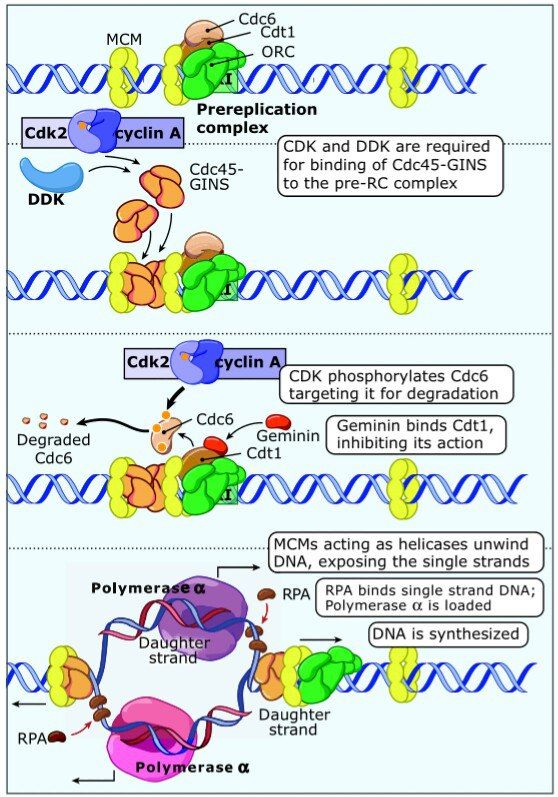
Как выяснилось, клетка готовится к делению уже тогда, когда еще даже не знает, суждено ли ей вообще в этой жизни будет поделиться. В конце предыдущего митоза на ориджине начинает формироваться пре-репликационный комплекс (pre-RC). Начинается все с присоединения к ориджину белкового комплекса с говорящим названием — origin-recognition complex, ORC, служащего платформой для других белков. В G1-фазу к нему присоединяются Cdc6 с АТФ-азной активностью и Cdt1, а затем к комплексу и к ДНК поблизости присоединяются белковые кольца, MCM (минихромосомный белковый комплекс). При повышенной активности циклин/CDK или киназы DDK, концентрация которых максимальна во время S-фазы, комплекс быстро диссоциирует (Cdc6 фосфорилируется, инактивируется, и МСМ не может быть более связан с ориджином), таким образом, пре-RC может существовать лишь в промежутке между концом M-фазы и началом S-фазы.
Что же активирует этот комплекс? Удивительно, но тоже Cyc/CDK, а именно — CycA/Cdk2. Для того, чтобы к комплексу могла присоединиться полимераза, должен присоединиться еще один белок, Сdc45 совместно с GINS, для чего и нужны эти киназы, которые не давали пре-RC образовываться в митозе. Cdc45 присоединяется, CycA/Cdk2 фосфорилирует Cdc6, еще один белок, геминин, не упомянутый нами, инактивирует Cdt1. В этот момент случается чудо, и MCM, ранее выполнявший функцию связующего фактора, теперь приобретает хеликазную активность, спираль ДНК раскручивается, и далее процесс идет как в учебнике: с одиночными цепями связываются белки RPA, что позволяет комплексу праймаза/ДНК-полимераза-альфа присоединиться в точке ориджина и запустить репликацию. МСМ и Cdc45 движутся вместе с репликативной вилкой, полимеразу-альфа замещает дельта. Когда же в данном участке репликация будет завершена, МСМ отсоединится, и пре-репликативный комплекс, по описанной нами логике, больше не сможет быть образован вплоть до окончания митоза.
Фаза G2
Как уже, возможно, стало ясно, нельзя описать происходящее в клетке как последовательность процессов, происходящих строго друг за другом. Каждый сигнальный путь действует одновременно и независимо от остальных, и тесно перекликается с ними. Таким образом, получается некая полифония, причем такая, в которой нет единственной солирующей мелодии, и это сохраняется до самого конца.
Итак, фаза S пройдена, начинается последняя часть прелюдии, Gap-фаза 2. Клетка в этот период растёт, ядерно-цитоплазматическое отношение уменьшается, а также исправляются ошибки, допущенные при репликации. Если никаких проблем с этим нет, то клетка может миновать точку транзиции G2/М и начать деление. В инициации деления участвует несколько киназ: уже знакомый нам комплекс Циклин В/Cdk1 (основной комплекс, но участвуют и другие), представители семейства NIMA-подобных киназ (NEK), киназы Aurora (А, В и С), а также Polo-подобные киназы (PLK).
За время интерфазы циклины аккумулируются в клетке и связываются со своими Cdk. Чтобы митоз не случился слишком рано, до достижения нормального объема клеткой, киназы Wee1 ингибируют активность целого комплекса, фосфорилируя циклин-зависимую киназу в участках Tyr15 и Thr14.
Название "Wee" дано не случайно: клетки с нокаутом по этим генам вступают в митоз слишком мелкими.
Итак, чтобы вновь активировать этот фермент, требуются фосфатазы, а именно — представители Cdc25. Эти ферменты активны в фосфорилированном виде, таким образом, для их активации необходимо участие других киназ. Запускают процесс PLK, а далее, как Cyc B/Cdk1 освобождается от фосфатов, он становится способен сам активировать Cdc25, а также ингибировать Wee1. Комплекс циклин B/Cdk1 является ключевым агентом для разрушения ядра в профазу, образования веретена и других процессов, таким образом, если не произойдёт его активация, клетка застрянет в G2.
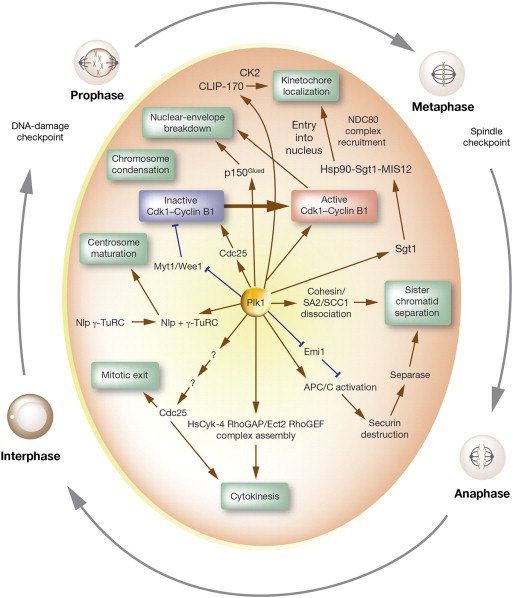
Polo-подобные киназы — семейство серин-треониновых киназ, имеющих один N-концевой киназный домен, консервативный, и один или несколько т.н. Polo-боксов — структур, необходимых для позиционирования киназ на сайтах связывания на центросомах, кинетохорах и митотическом веретене. На данный момент у человека нашли 5 PLK, которые принимают участие в определённых фазах клеточного цикла. Так, например, Plk1 играет большую роль в клеточном цикле, особенно в митозе, а также именно она фосфорилирует упомянутую Cdc25, обеспечивая переход G2/M, Plk2 участвует в дупликации центриолей, а Plk3 нужна для нормального прохождения цитокинеза. Plk активируются под действием киназ Aurora, а ингибируются преимущественно при активации каскада после обнаружения ошибок в ДНК, не давая клетке вступить в митоз до их исправления.
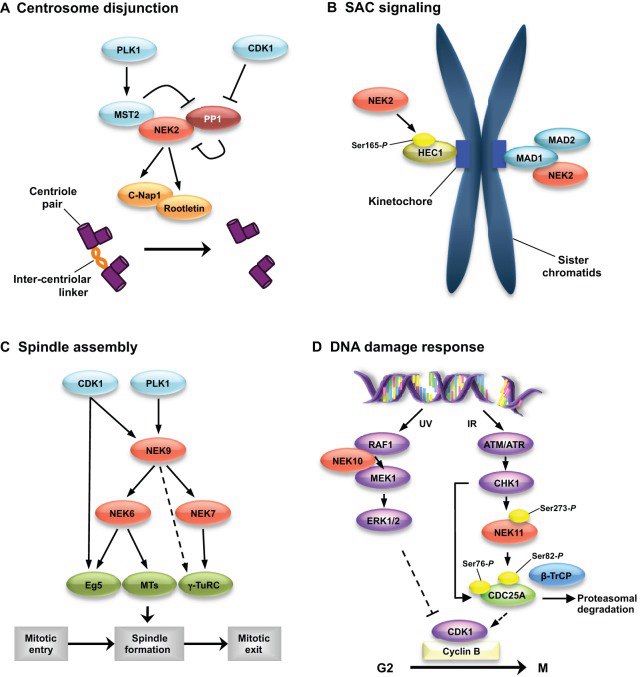
Семейство NEK, NIMA-подобных киназ, изучено в меньшей степени, чем остальные участники, и в отличии от остальных, при их дефектах не наблюдается нарушение во вступлении клетки в митоз. К слову, первоначально обнаруженная у гриба Aspergillus nidulans NIMA-киназа названа была так потому, что обладатели мутаций по гену, её кодирующему, не могли вступать в митоз (Never In Mitosis A), затем подобные белки были найдены у многих других эукариот. Судя по всему, в ходе эволюции, они перестали выполнять ключевую функцию регуляции транзиции G2/М (хотя и способствуют этому), зато стали играть огромную роль в регуляции стабильности генома, а также в образовании стабилизации веретена деления, конденсации и расхождении хромосом. У человека найдено одиннадцать представителей этого семейства, с NEK1 до NEK11, выполняющих разнообразные функции, в том числе и в неделящейся клетке.
Киназы Aurora, равно как и члены всех предыдущих семейств, являются серин-треониновыми киназами. Это семейство самое малочисленное: известно лишь три его представителя, Aurora A, B и C, причём киназы А и В очень похожи друг на друга как структурно, так и функционально, но тем не менее в клетке выполняют различные функции. Aurora A обеспечивает созревание центросом и расхождение их к полюсам, В — является хромосомным пассажиром и совместно с тремя белками, INCENP, Survivin и Borealin участвует в цитокинезе и способствует би-ориентации хромосом, в то время как Aurora С особенно ярко проявляет себя при мейозе, но и помогает двум предыдущим в ходе митоза. Активность этих киназ регулируется на нескольких уровнях: активация происходит засчёт аутосфосфорилирования, а также засчёт активации экспрессии их генов, пик чего приходит на конец G2 фазы, а очень строго регулируемая деградация происходит с помощью Е3-убиквитин-лигазы APC/C (Анафазного промоторного комплекса/циклосомы), которая обеспечивает убиквитин-опосредованный протеолиз.
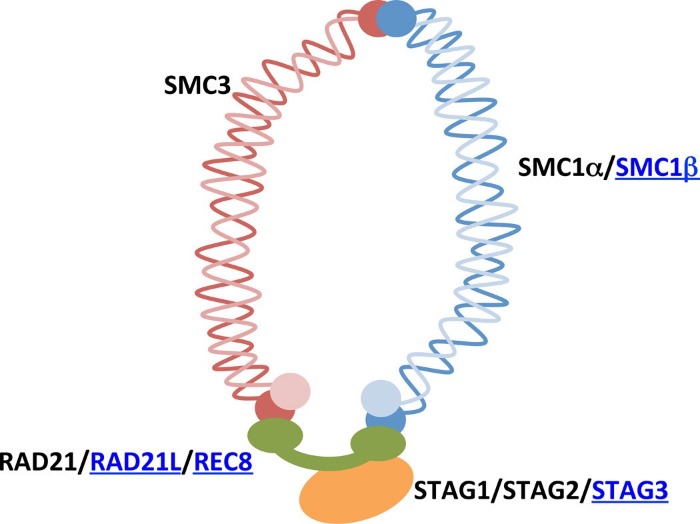
После репликации у каждой хроматиды появляется "сестра", с которой хроматида должна быть прочно связана вплоть до анафазы, когда каждая из них не разойдется в дочерние клетки. Очень важно, чтобы эта связь не разорвалась раньше, т.к. в противном случае клетки получат неравноценный генетический материал, что чревато нарушениями их жизнедеятельности. Связывание хроматид друг с другом обеспечивают когезиновые комплексы, состоящие из четырех основных субъединиц: SMC-белков 1 и 3 (Structural Maintenance of Chromosomes), обладающих АТФ-азной активностью, RAD21 (или REC8) и белков STAG (1/2/3). Белки образуют кольца, образующиеся уже с началом S-фазы, охватывающие хроматиды.
Диссоциация же когезиновых комплексов у позвоночных происходит по двум механизмам. Во время профазы "кольца" на плечах хромосом, а если точнее, белки STAG2/SA2 фосфорилируются и диссоциируют под действием Plk1 и киназы Aurora В, в то время как на центромерах когезиновые комплексы остаются нетронутыми. А когда все хромосомы ровно выстроятся на экваторе, будут "би-ориентированы" по отношению к полюсам, тогда станет возможен очередной переход — между метафазой и анафазой. При этом в диссоциации остатков когезина примет участие фермент сепараза, что вызовет деградацию белка RAD21.
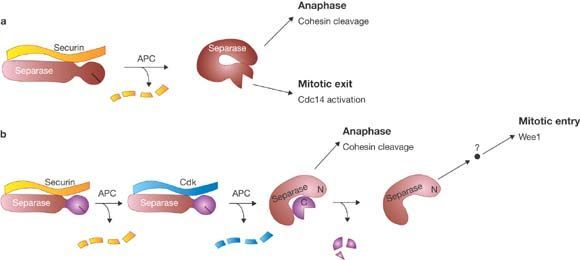
Сепараза до момента наступления анафазы находится в комплексе с секурином, который не даёт ей проявлять протеолитическую активность. Затем же, в конце метафазы, под действием APC (циклосомы) сепараза активируется. Активность же самого анафазного промоторного комплекса регулируется несколькими способами.
Во-первых, что именно будет убиквитинировать APC, решает адапторный белок, связанный с ним. Циклосома, связанная с Cdc20, будет как раз убиквитинировать секурин.
Во-вторых, АРС может быть активирован в результате фосфорилирования с помощью Plk1 или Cyc B/Cdk1. В-третьих, активность циклосомы регулируется сигнальным путём, реагирующим на правильное прикрепление хромосом к веретену деления — так называемой “сверочной точкой сборки веретена деления”, SAC.
А многоступенчатость регуляции требуется для того, чтобы можно было быть уверенным, что эта мощная машина протеолиза будет запущена только в нужный клетке момент, т.к. АРС ещё и вызывает деградацию циклина, и деградацию ключевых киназ (Plk, Aurora). Для этого и в течение всей G1 активность циклосомы поддерживается на достаточном уровне, во избежание преждевременного начала деления.
Совсем непросто дело обстоит и с выходом из митоза — несмотря на то, что один из основных путей это — убиквитин-зависимая деградация с помощью АРС, одного его недостаточно для перехода M/G1.
К сожалению, достаточно полно изучен этот процесс только у дрожжей, поэтому и говорить мы сейчас будем именно о них, несмотря на явные различия в протекании деления у них и у многоклеточных животных. Так, деление у них происходит без разрушения ядерной оболочки, а вместо центросом, находящихся на полюсах веретена у животной клетки, у них — полярные тельца веретена, находящиеся рядом с кариолеммой.
Рассмотрим совсем кратенько, что происходит.
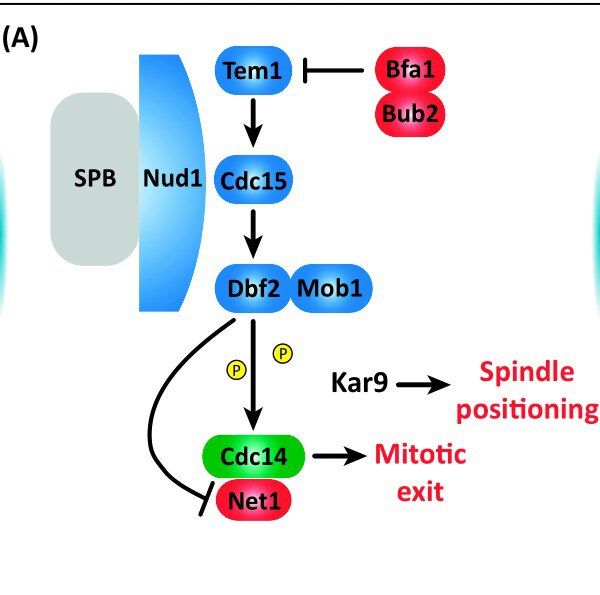
Основной фермент, необходимый для дефосфорилирования циклинов и белков, являющихся субстратами циклинов — фосфатаза Cdc14. На протяжении практически всего цикла этот белок находится в ядрышке в неактивном состоянии засчёт связывания со специфическим ингибитором, Net1. И основным путём его активации является MEN (Mitotic Exit Network), являющийся киназным каскадом, итогом которого служит фосфорилирование фосфатазы и выход её в ядро, где она уже дефосфорилирует непосредственно циклины, способствуя их разрушению, субстраты циклинов и потворствует аккумуляции их белков-антагонистов.
Активность свою MEN начинает проявлять тогда, когда концентрация циклинов, особенно комплекса Cyc B/Cdc1 становится достаточно низкой — а она начинает падать практически сразу после вступления клетки в митоз, таким образом, уже в начале анафазы начинается его активация, пика достигающая в конце телофазы.
Источники
- Plopper G., Sharp D., Sikorski E. Lewin's CELLS. – Jones & Bartlett Learning, 2013.
- Bochis O. V. et al. The importance of ubiquitin E3 ligases, SCF and APC/C, in human cancers //Clujul medical. – 2015. – Т. 88. – №. 1. – С. 9.3.
- Johnson J. et al. Targeting the RB-E2F pathway in breast cancer //Oncogene. – 2016. – Т. 35. – №. 37. – С. 4829-4835.
- Duronio R. J. Developing S-phase control //Genes & development. – 2012. – Т. 26. – №. 8. – С. 746-750.
- Lewin's cells — 3rd ed./ George Plopper, David Sharp, Eric Sikorski, Jones & Bartlett Learning, 2015.
- Sihem Zitouni, Catarina Nabais, Swadhin Chandra Jana, Adán Guerrero & Mónica Bettencourt-Dias; Polo-like kinases: structural variations lead to multiple functions, - NATURE REVIEWS MOLECULAR CELL BIOLOGY.
- AM Fry, L O'Regan, SR Sabir, R Bayliss; Cell cycle regulation by the NEK family of protein kinases, - J Cell Sci, 2012.
- B Goldenson, JD Crispino; The aurora kinases in cell cycle and leukemia- Oncogene, 2015.
- Amanda S. Brooker and Karen M. Berkowitz; The roles of cohesins in mitosis, meiosis, and human health and disease, Methods Mol Biol. 2014; 1170: 229–266.
- Hotz M, Barral Y; The Mitotic Exit Network: new turns on old pathways, Trends Cell Biol. 2014 Mar;24(3):145-52.
