Эпилептиформная активность и прогрессирование глиомы как результат нарушения работы калиевых каналов
Судорожный синдром является патофизиологическим признаком злокачественной глиомы и играет важную роль в опухолевой прогрессии. Используя панель функционализации in vivo «от человека к мыши», авторы обнаружили, что белок IGSF3 (белок 3 семейства иммуноглобулинов — от англ. immunoglobulin superfamily member 3) является регулятором опухолевой прогрессии глиомы и гиперактивности нервной сети мозга. Сопутствующее этому нарушение регуляции внутриклеточного обмена калия способствует гиперактивности сети, которую можно визуализировать in vivo на лидирующем крае опухоли.
▶ Читайте также: Опасные связи — опухолевые клетки образуют синапсы с нейронами
Ключевые тезисы
- У пациентов с глиомой, которые страдают от судорожных припадков, наблюдается активная экспрессия наборов генов синапсов.
- IGSF3 стимулирует опухолевую прогрессию глиомы посредством ремоделирования синапсов и усиления активности нейронной сети.
- IGSF3 связывается с Kir4.1 (калиевый канал внутреннего выпрямления 4.1), что приводит к нарушению клиренса калия при глиоме.
- Благодаря визуализации in vivo удалось соотнести происхождение гиперактивности глиомы и лидирующего края опухоли.
Кратко
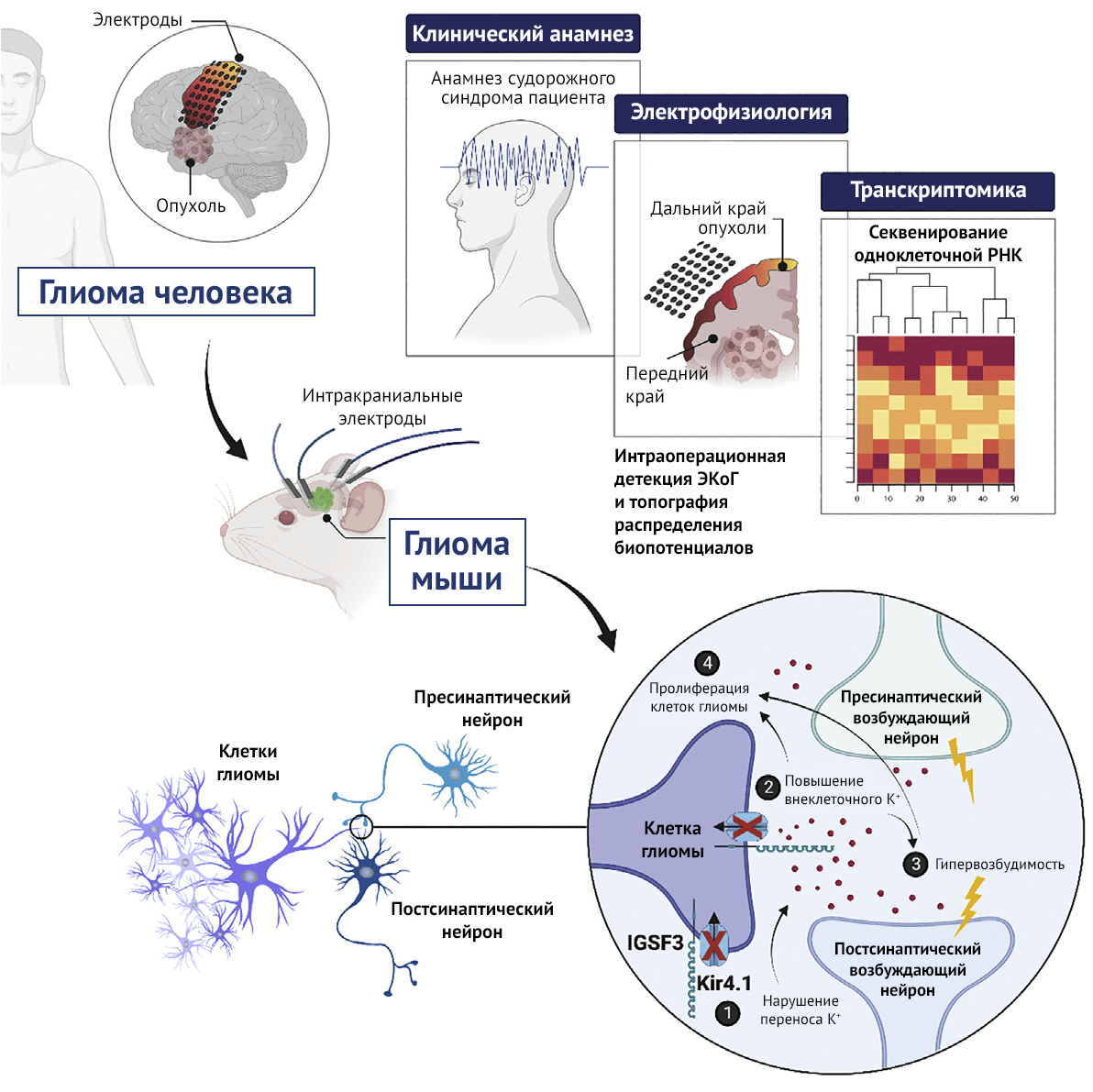
Судороги — частый патофизиологический признак злокачественной глиомы. Согласно результатам недавних исследований, нарушение регуляции перитуморальных синапсов — это движущая сила гиперактивности клеток мозга и опухолевой прогрессии; однако молекулярные механизмы, управляющие этими явлениями, по-прежнему не ясны. Используя метод секвенирования одноклеточной РНК (scRNA-seq) и записи интраоперационной ЭКоГ (электрокортикограммы) пациентов, авторы показывают, что опухоли у пациентов с судорогами изобилуют сигнатурами генов, регулирующих образование синапсов. Используя панель функционализации in vivo «от человека к мыши» для скрининга этих генов, авторы определили IGSF3 как медиатор опухолевой прогрессии глиомы и нарушения регуляции нейронных цепей, что проявляется в виде т.н. распространяющейся деполяризации (SD, от англ. spreading depolarization). Авторы обнаружили, что IGSF3 взаимодействует с Kir4.1, подавляя таким образом буферное действие калия, а также, что у пациентов с судорогами наблюдается пониженная экспрессия переносчиков калия в пролиферирующих опухолевых клетках. Согласно данным визуализации in vivo, нарушение регуляции активности синапсов исходит из взаимодействия опухоль-нейрон, что подтверждается у пациентов. А согласно исследованиям авторов, опухолевая прогрессия и судорожный синдром обусловлены нарушением ионного гомеостаза, а SD, фактически, главный патологический механизм развития заболевания.
Введение
В понятие «злокачественной глиомы» входит несколько подтипов этой опухоли высокой степени злокачественности, в том числе и наиболее летальный вариант, глиобластома (GBM), медиана выживаемости для которой составляет всего 12 месяцев. Среди множества патофизиологических фенотипов, влияющих на тяжесть заболевания, общей чертой проявления глиомы являются судороги. При этом до 50 % пациентов страдают от локализованных, интермиттирующих судорог, называемых «глиома-ассоциированные эпилептические судороги» (GRE, от англ. glioma-related epilepsy) [1,2]. Важно отметить, что частота развития приступов выше при мутантных глиомах IDH1, которые встречаются у 74 % пациентов (по сравнению с менее чем 35 % опухолей IDH1 дикого типа) [3]. Хотя различия в частоте развития GRE между этими подтипами глиом удалось документально подтвердить, происхождение таких судорог остается загадкой. По всей видимости, их возникновению способствует множество факторов, как например, масса опухолевой ткани, степень, локализация и гетерогенность пациентов. Благодаря недавним исследованиям удалось приблизиться к пониманию этиологии GRE, выяснив, что глиомы способны запускать ремоделирование нейронных синапсов в сторону гипервозбудимых состояний, что стимулирует пролиферацию и рост опухоли [4]. Тем не менее молекулярные процессы, связывающие воедино опухолевую прогрессию, GRE и патофизиологию мозга при глиомах по-прежнему во многом загадочны.
Крайне важным фактором малигнизации являются молекулярные связи между нейронами и опухолевой тканью в микроокружении головного мозга, где первые выделяют факторы роста, которые способствуют пролиферации клеток глиомы [5]. Более того, нейроны напрямую образуют синапсы с опухолевыми клетками, что также усиливает опухолевую экспансию [6]. Также в ходе исследований, посвященных влиянию опухолевых клеток на повышенную возбудимость, были обнаружены механизмы в глиоме, которые отражают связи между астроцитами и нейронами в ткани здорового головного мозга [7]. Фокус этих исследований был сосредоточен на нарушениях ключевых механизмов поддержки нейронов астроцитами (в число которых входят, например, формирование и поддержание синапсов, а также метаболизм глутамата). Соответственно, как было показано, клетки глиомы используют систему xCT (цистин-глутаматный транспортер) для выделения глутамата и усиления возбуждающей активности нейронов [8]. Кроме того, опухоли секретируют синаптогенные факторы, что приводит к ремоделированию нейронных синапсов в сторону гиперактивности [4]. В обоих случаях паракринная сигнализация начинается из клеток глиомы, действует на перитуморальные нейроны, результатом чего является GRE и опухолевая прогрессия. Несмотря на эти открытия, понимание механизмов, контролирующих паракринную коммуникацию между глиомой и нейронами и их влияния на развитие GRE, остается неясным.
Вышеупомянутые исследования подчеркивают важность синаптогенных процессов в патогенезе GRE, что соотносится с механизмами развития эпилепсии в мозге без опухолевого поражения. Другим провоцирующим фактором возникновения функциональной гиперактивности головного мозга и эпилептиформных очагов является нарушение регуляции обмена ионов, опосредованное мутацией или аномальной экспрессией белков ионных каналов [9,10]. Астроциты играют ключевую роль в буферном эффекте ионов калия после возбуждения нейронов: эта роль опосредуется через калиевый канал внутреннего выпрямления Kir4.1 [11]. Важно отметить, что нарушение регуляции или мутация в гене канала Kir4.1 способствует развитию гиперактивности и судорог в случае ряда эпилептиформных синдромов [12-16]. Подобные изменения в токе ионов калия связывают с нарушениями клеточного цикла и пролиферации в процессе эмбрионального развития мозга, что также было продемонстрировано на примере моделей рака. Это повышает вероятность того, что катионный дисбаланс может способствовать экспансии глиомы [17-20]. Однако неизвестно, приводит ли нарушение регуляции буферизации ионов калия в глиоме к изменению физиологии опухоли в сторону гипервозбудимости клеток и их усиленной пролиферации.
Благодаря исследованиям на пациентах с глиомой (и с диагностированными GRE) с использованием интраоперационной электрокортикографии (ЭКоГ) авторы выявили, что отличительным признаком наличия опухоли у пациентов с GRE является нарушение регуляции экспрессии синаптических и нейрональных сигнатур. Благодаря скринингу in vivo этих наборов генов, удалось определить, что IGSF3 — это регулятор опухолевой прогрессии, ремоделирования синапсов и дисфункции нейрональной сети головного мозга. IGSF3, который является специфичным для нейронов мембранным белком, регулирующим морфогенез нейронов в процессе эмбрионального развития [21], связан с Kir4.1, а также управляет током ионов калия, что способствует формированию судорожной активности посредством распространяющейся деполяризации (SD). Таким образом, исследования авторов позволяют по-новому взглянуть на механизмы, регулирующие поддержание ионного гомеостаза и состояние гиперактивности мозга, а также демонстрируют влияние этих процессов на онкогенез, в развитии которого свою роль играет и GRE.
В ряде недавних исследований была продемонстрирована прямая связь между активностью перитуморальных нейронов и развитием опухоли. Вследствие чего встает вопрос о том, как нарушение синаптической регуляции может способствовать пролиферации опухолевых клеток. Исследование авторов помогло описать транскрипционные и молекулярные пути, лежащие в основе механизма развития GRE. Это стало возможным благодаря мультимодальному анализу при создании моделей опухолей in vivo, проведении исследований электрофизиологии человека и мыши и биохимических исследований. Авторы подчеркивают сложное взаимодействие между нарушением регуляции тока калия, синаптической реорганизацией и пролиферацией раковых клеток, которое частично опосредуется IGSF3 — ключевым регулятором опухолевой прогрессии.
Механизмы ремоделирования синапсов и GRE
Благодаря изучению пациентов с глиомой удалось показать, что активность программ транскрипции, связанных с синаптической функцией и морфологией нейронов, значительно усилена у пациентов, страдающих от GRE. Скрининг in vivo показал, что IGSF3 — регулятор развития морфологии дендритов в ходе эмбриогенеза мозга [21] и один из факторов роста глиомы. Транскрипционный анализ опухолей мышей показал, что IGSF3 способствует усилению экспрессии программ возбуждающих синапсов, что согласуется с электрофизиологическими изменениями и снижением выживаемости. В соответствии с этими транскрипционными изменениями, результаты иЭЭГ (iEEG, от англ. intracranial electroencephalography — интракраниальная электроэнцефалография) показали, что IGSF3 способствует образованию опухолей с измененной нейрофизиологией, что, в свою очередь, усиливает их рост. Эти изменения возбудимости проявляются в виде SD, что проявляется в виде крупномасштабных приступов эпилепсии и, как заключают авторы, связано с нарушением регуляции калия и глутаматергическим влиянием [27–31].
Согласно более ранним исследованиям на мышах, синаптическое ремоделирование в глиомах выступает в качестве движущей силы гипервозбудимости и GRE [4, 6, 7, 32]. Работа авторов дополняет эти сведения: в ней делается акцент на том, что возникновение клеток глиомы, регулирующих образование синапсов, коррелирует с дебютом гиперактивности на клеточном уровне. Также опухоли выполняют астроцитоподобную функцию (на молекулярном уровне) по высвобождению факторов, способствующих образованию синапсов и развитию GRE [4,7]. Участие ремоделирования синапсов в качестве пускового фактора развития GRE также подчеркивает важность нейротрансмиттеров в этом явлении, поскольку в процесс поддержания опухолевой прогрессии глиом вовлечены и выделение глутамата и ГАМК [33-35]. Также ингибирование выделения глутамата из опухолей (фармакологическим путем) подавляет как гиперактивность мозговой ткани, так и опухолевый рост у мышей, что указывает на то, что глутамат, выделяющийся из опухоли, является активным модулятором GRE [36-38]. Результаты этих исследований согласуются с данными авторов, демонстрирующих увеличение поступления глутамата в постсинапсах, что происходит по причине избыточной экспрессии IGSF3. Соответственно, согласно анализу scRNA-seq опухолей с мутациями в гене IGSF3 с приобретением функций (IGSF3-GOF), в клетках глиомы наблюдается повышение экспрессии не NMDA-рецепторов, а AMPA-рецепторов, а также маркеров опухолевых микротрубочек (ОM). Действительно, в ходе предыдущих работ подтвердилось, что опухолевые клетки с этими микротрубочками и AMPA-рецепторами, являются ключевыми признаками нейроглиальных синапсов и способствуют прогрессированию глиомы и аберрантной электрофизиологической активности [6, 39]. Основываясь на данных сведениях, удалось создать модель, в которой функционирование глиом опирается на сочетание просинаптических глутаматергических программ, которые влияют на перитуморальные нейроны, стимулируя их активность, что, в свою очередь, способствует опухолевому росту.
IGSF3 как стартовая точка дисфункции нейрональной сети головного мозга
Согласно протеомному анализу, проведенному авторами, IGSF3 взаимодействует с калиевым каналом Kir4.1, что приводит к нарушению буферных свойств ионов калия в перитуморальном пространстве. В здоровом головном мозге, Kir4.1 экспрессируется в астроцитах, где его функцией является создание адекватной концентрации внеклеточного калия посредством пассивного поглощения этого катиона после возбуждения нейронов [40-42]. Нарушение функции канала Kir4.1 приводит к повышенному содержанию калия вне клетки, вследствие чего развивается возбудимость нейронов, результатом чего является судорожный приступ [26,43,44]. Несмотря на то, что данный механизм известен, исследования авторов — первые в своем роде — описывают роль канала Kir4.1 в патогенезе GRE. Исследователи решили сосредоточиться на роли генов, связанных с развитием GRE и прогрессированием глиомы. С этой целью в ходе недавних исследований удалось показать, что мутации генов сигнального пути PIK3CA играют значимую роль в развитии эпилепсии, онкогенезе глиомы и GRE [45-47]. Более того, было показано, что D-2-гидроксиглутарат (активный метаболит, образуемый мутантными глиомами IDH1) способствует эпилептогенезу посредством усиления экспрессии сигнальных путей mTOR [48]. В совокупности эти исследования подчеркивают сходство между патофизиологией эпилепсии и GRE, что представляет благодатную почву для изучения механизма последней, а также перспективных терапевтических разработок для лечения глиомы.
Исходя из факта взаимодействия между IGSF3 и Kir4.1, предполагается, что функция данного белка заключается в ремоделировании синапсов посредством множества механизмов. Исследования авторов по сокультивированию in vitro показали, что воздействие IGSF3 может способствовать образованию синапсов через внешние клеточные механизмы. Пока неизвестно, расщепляется ли IGSF3 для действия в синапсе или непосредственно взаимодействует со структурными белками нейронов — нужны дальнейшие изучения. К тому же, остается неясным, является ли усиленное образование синапсов, наблюдаемое на примере опухолей IGSF3-GOF, вторичным по отношению к повышенной возбудимости нейронов (что является следствием нарушения баланса концентрации ионов К из-за клеток глиомы). Важно отметить, что в ходе предыдущих исследований было показано повышение возбудимости нейронов из-за нарушения регуляции баланса K+, что, в свою очередь, усиливает образование синапсов [29,49,50]. Более того, нарушение регуляции K+ — ключевой фактор медленной деполяризации [51], которая наблюдается у пациентов с GRE, при SD [52– 54] и на примере опухолей IGSF3-GOF. Это ранее фиксировалось и на мышиных моделях и среди пациентов [36,55]. В будущем исследования должны разграничить непосредственное влияния IGSF3 на образование синапсов от косвенных эффектов, возникающих в результате нарушения баланса K+.
Нарушение регуляции калия как новый медиатор опухолевой прогрессии при GRE
При достижении сверхэкспрессии генов канала Kir4.1, было обнаружено восстановление выживаемости мышей с опухолями IGSF3-GOF до исходного уровня [здоровья]. Возник вопрос о том, как поддержание баланса калия влияет на пролиферацию клеток глиомы в контексте аномальной нейрофизиологии. Анализ scRNA-seq среди пациентов с глиомой,, проведенный авторами, а также — мышей с опухолями IGSF3-GOF со склонностью к развитию SD, показал, что экспрессия компонентов калиевых каналов в значительной степени подавлена среди циклирующих клеток-предшественников [опухоли], присутствующих у обоих видов. Исследования авторов по визуализации in vivo подчеркивают возможную взаимосвязь между пролиферацией клеток, расположенных по краям опухоли, и нарушением баланса калия, что дополнительно иллюстрирует сложное взаимодействие между активностью нейронов и пролиферацией клеток. В ходе предыдущих исследований по влиянию экспрессии калиевых каналов на пролиферацию клеток была продемонстрирована связь между функционированием калиевых каналов и клеточной пролиферацией [56]. Однако как это влияет на двунаправленность опухолевой прогрессии и развитие GRE, ранее не сообщалось, и исследования авторов позволяют по-новому взглянуть на это явление.
У пациентов с судорагами клетки перитуморального края опухоли характеризуются уникальными транскрипционными сигнатурами, которые могут влиять на нарушение баланса калия. Предполагается, что управлять синаптическим ремоделированием может популяция клеток-предшественников, расположенная на переднем крае опухоли. В ходе предыдущих исследований было показано, что нарушение баланса калия (что опосредуется дисфункцией каналов Kir4.1) снижает потенциал действия нейронов как напрямую [57], так и опосредованно за счет подавления активации нейронов после SD [58]. Результаты двухфотонной визуализации in vivo демонстрируют снижение потенциала действия в теле нейронов (что сочетается с повышенной возбудимостью нейропиля в дендритах). Это предполагает непосредственную связь между нарушением баланса калия, регуляцией функционирования нейронных сетей, повышенной синаптической возбудимостью в окружающем нейропиле и SD. Помимо этого, вышеперечисленное дополняется результатами интраоперационных ЭКоГ (полученных от нескольких пациентов с GRE), согласно которым регистрируется аберрантная электрофизиологическая активность, происходящая от переднего края опухоли. Дальнейшие исследования по определению того, предшествуют ли нарушения баланса калия возникновению GRE, помогут выяснить, возникает ли нарушение регуляции ионов калия вторично по отношению к гипервозбудимости, или наоборот оно предшествует нарушению регуляции нейронов. Клинически результаты этих исследований свидетельствуют о том, что нарушение буферных механизмов поддержания баланса калия способствует развитию судорог (при GRE). Соответственно, усиление захвата калия за счет целенаправленной активации его переносчиков или хелатирующих агентов может уменьшить как тяжесть течения судорожного синдрома, так и пролиферацию опухолевых клеток у пациентов с GRE. Эти методы заслуживают дальнейшего рассмотрения в качестве варианта терапии пациентов с глиомой и с судорожным синдромом.
