Преэклампсия

Аннотация
Преэклампсия — опасное для жизни заболевание беременных, уникальное для человека и служащее ведущей причиной материнской и неонатальной заболеваемости и смертности. У женщин, переживших преэклампсию, снижается ожидаемая продолжительность жизни, увеличивается риск инсульта, сердечно-сосудистых заболеваний и диабета, а у детей, родившихся в результате преэклампсии, повышается риск преждевременных родов, перинатальной смертности и нарушений развития нервной системы, а также сердечно-сосудистых и метаболических заболеваний в более позднем возрасте. Преэклампсия представляет собой сложное мультисистемное заболевание, диагностируемое по внезапно возникшей артериальной гипертензии (> 20 недель беременности) и как минимум еще одному сопутствующему осложнению, включая протеинурию, нарушение функции органов матери или маточно-плацентарную дисфункцию. Преэклампсия обнаруживается только тогда, когда плацента присутствует или недавно присутствовала, и классифицируется как преждевременная (роды < 37 недель беременности), доношенная (роды ≥ 37 недель беременности) или послеродовая. Синдром преэклампсии у матери обусловлен дисфункцией плаценты, которая выделяет в материнскую кровь факторы, вызывающие системное воспаление и обширное нарушение эндотелиальной функции у матери. Доступные методы лечения направлены на материнскую гипертонию и судороги, но единственным средством от преэклампсии является рождение ребенка, часто преждевременное, и выход дисфункциональной плаценты. Несмотря на десятилетия исследований, этиология преэклампсии, особенно доношенной и послеродовой, остается плохо изученной. Значительные успехи были достигнуты в прогнозировании и профилактике преждевременной преэклампсии, которая на ранних сроках беременности прогнозируется с помощью комбинированного скрининга и предотвращается ежедневным приемом низких доз аспирина, начиная с 16 недели беременности. Напротив, прогнозирование доношенной и послеродовой преэклампсии ограничено, а методы профилактики отсутствуют. Будущим исследователям предстоит изучить патогенез преэклампсии, в частности доношенной и послеродовой, и оценить новые прогностические тесты и методы лечения в клинических исследованиях с адекватной статистикой.
Введение
Преэклампсия — сложное мультисистемное заболевание, диагностируемое по внезапно возникшей артериальной гипертензии (> 20 недель беременности) и по меньшей мере еще одному сопутствующему осложнению, включая протеинурию, дисфункцию органов матери или маточно-плацентарную дисфункцию (например, задержку роста плода [ЗРП] или ангиогенный дисбаланс). Преэклампсия является одним из наиболее тяжелых осложнений беременности и ведущей причиной материнской и перинатальной заболеваемости и смертности [1]. По оценкам, во всем мире ежегодно преэклампсия (ранее называемая токсемией) диагностируется у четырех миллионов женщин, что приводит к смерти > 70 000 женщин и 500 000 детей [1, 2]. У женщин, переживших преэклампсию, уменьшается продолжительность жизни, повышается риск инсульта, сердечно-сосудистых заболеваний и диабета [1, 3, 4], в то время как дети, рожденные в результате беременности с преэклампсией, имеют повышенный риск преждевременных родов, перинатальной смертности, задержки нервного развития и сердечно-сосудистых и метаболических заболеваний в более позднем возрасте [1, 3]. По оценкам, во всем мире более 300 миллионов женщин и детей подвергаются повышенному риску хронических проблем со здоровьем из-за перенесенной преэклампсии [5].
Преэклампсию классифицируют в зависимости от гестационного возраста на момент клинической картины (Вставка 1). Международное общество по изучению гипертонии во время беременности (ISSHP) выделяет преждевременную (роды < 37 недель беременности), доношенную (роды ≥ 37 недель беременности) и послеродовую преэклампсию [2]. Также, особенно для механистических исследований, применяют классификацию, согласно которой различают преэклампсию с ранним началом (роды на сроке < 34 недель беременности) и преэклампсию с поздним началом (роды на сроке ≥ 34 недель беременности), хотя с клинической точки зрения она не являются предпочтительной, поскольку не отражает адекватно прогноз для матери и плода. В настоящей статье термины «недоношенность», «доношенность», «раннее начало» и «позднее начало» используются для точного отражения исследуемых популяций, из которых были получены данные. Считается, что время начала преэклампсии отражает лежащую в основе разницу в этиологии. Это подтверждается различиями в эффективности тестов прогнозирования преэклампсии на ранних сроках беременности [6] и профилактики аспирином, для которых показана польза при преждевременной, но не доношенной преэклампсии [7]. Тем не менее, также очевидно, что классификация, основанная на времени постановки диагноза, несет в себе неточность [8], в частности, связанную с различиями в прогрессировании заболевания и сроками обращения в больницу для постановки диагноза. Недавнее ретроспективное популяционное исследование показало, что классификация преэклампсии только по времени родов может привести к недооценке заболеваемости преэклампсией с ранним началом на 20% [9]. Хотя клиническое влияние такой недооценки может быть незначительным, правильная классификация на основе времени начала заболевания может улучшить разработку новых прогностических тестов и методов профилактики.
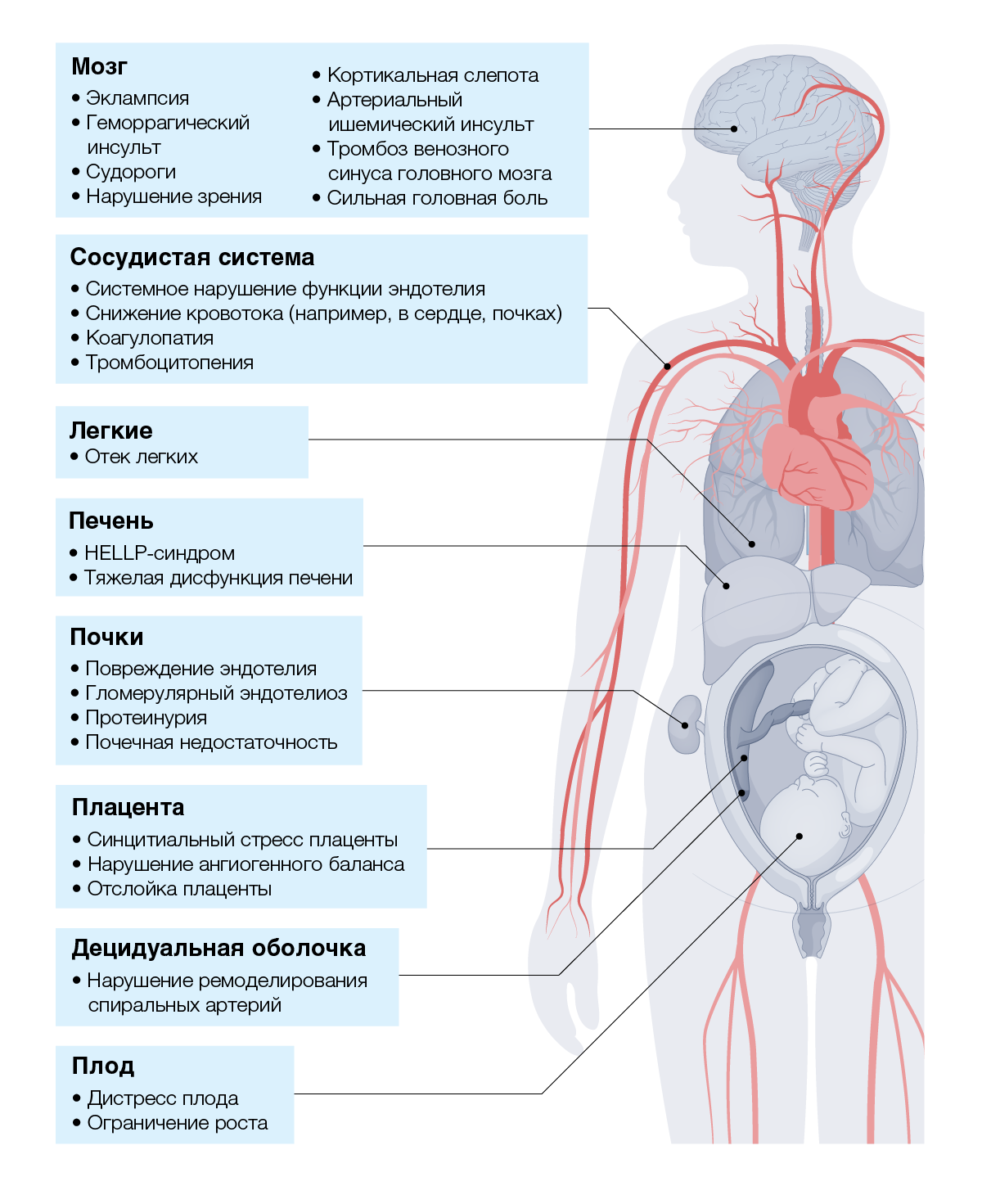
Можно ли классифицировать преэклампсию на основании симптомов, остается неясным. Преэклампсия связана с такими осложнениями, как эклампсия (судороги), геморрагический инсульт, гемолиз, синдром повышенного уровня печеночных ферментов и низкого количества тромбоцитов (HELLP), отслойка плаценты, почечная недостаточность и отек легких [10, 11] (рис. 1). Все женщины с преэклампсией подвергаются риску быстрого ухудшения состояния и тяжелого течения заболевания, независимо от времени начала заболевания [2, 8, 12]; таким образом, рекомендации ISSHP [2, 13] больше не поддерживают классификацию преэклампсии на «тяжелую» или «легкую» при продолжающейся беременности. HELLP-синдром (Вставка 1) или эклампсия могут быть тяжелыми подтипами преэклампсии с преимущественным поражением печени или нервной системы, соответственно [8].
В этой статье авторы суммируют современные знания об эпидемиологии, факторах риска, патофизиологии, клинической картине, диагностике, прогнозировании, ведении и исходах преэклампсии. Обсуждается также качество жизни пациентов и ключевые вопросы исследований, направленные на улучшение клинической практики и понимание этиологии преэклампсии.

Эпидемиология
Частота и смертность
Глобальная распространенность всех случаев преэклампсии в 2002–2010 годах оценивалась в 4,6% родов, но зарегистрированные региональные показатели варьировались от 1 до 5,6% [14]. Там, где есть соответствующие данные, распространенность преждевременной преэклампсии оценивается как < 1% [15–18]. Распространенность преэклампсии, как правило, ниже в странах с низким и средним уровнем дохода (СНСД) (за исключением стран Африки к югу от Сахары), чем в странах с высоким уровнем дохода (СВД) [19, 20]; однако вполне вероятно, что на данные о распространенности влияют различия в классификации, доступе к дородовой помощи и занижение данных в СНСД [20, 21]. Кроме того, большинство исследований преэклампсии проводится в СВД, что потенциально может привести к систематической ошибке и проблемам обобщения выборки населения и вопросов исследования.
Гипертонические расстройства беременных (включая преэклампсию) являются второй по распространенности причиной (после кровотечений) материнской смертности во всем мире (14% смертей, 95% ДИ 11,4–17,4), вызывая, согласно оценкам, 62 000–77 000 смертей в год [22, 23]. Материнская смертность выше при беременности с преэклампсией, чем при беременности без преэклампсии (скорректированное отношение шансов (сOШ) 3,73, 95% ДИ 2,15–6,47) [20]. Риск гибели плода при преэкламптической беременности выше, чем при непреэкламптической беременности (сОШ 3,12, 95% ДИ 2,77–3,51) [20], — в результате ЗРП и отслойки плаценты. Высокая частота преждевременных родов по медицинским показаниям также приводят к увеличению смертности новорожденных, которая в 2,7 раза выше (сОШ 2,7, 95% ДИ 2,28–3,21), чем при беременностях, закончившихся родами в срок [20].
Факторы риска
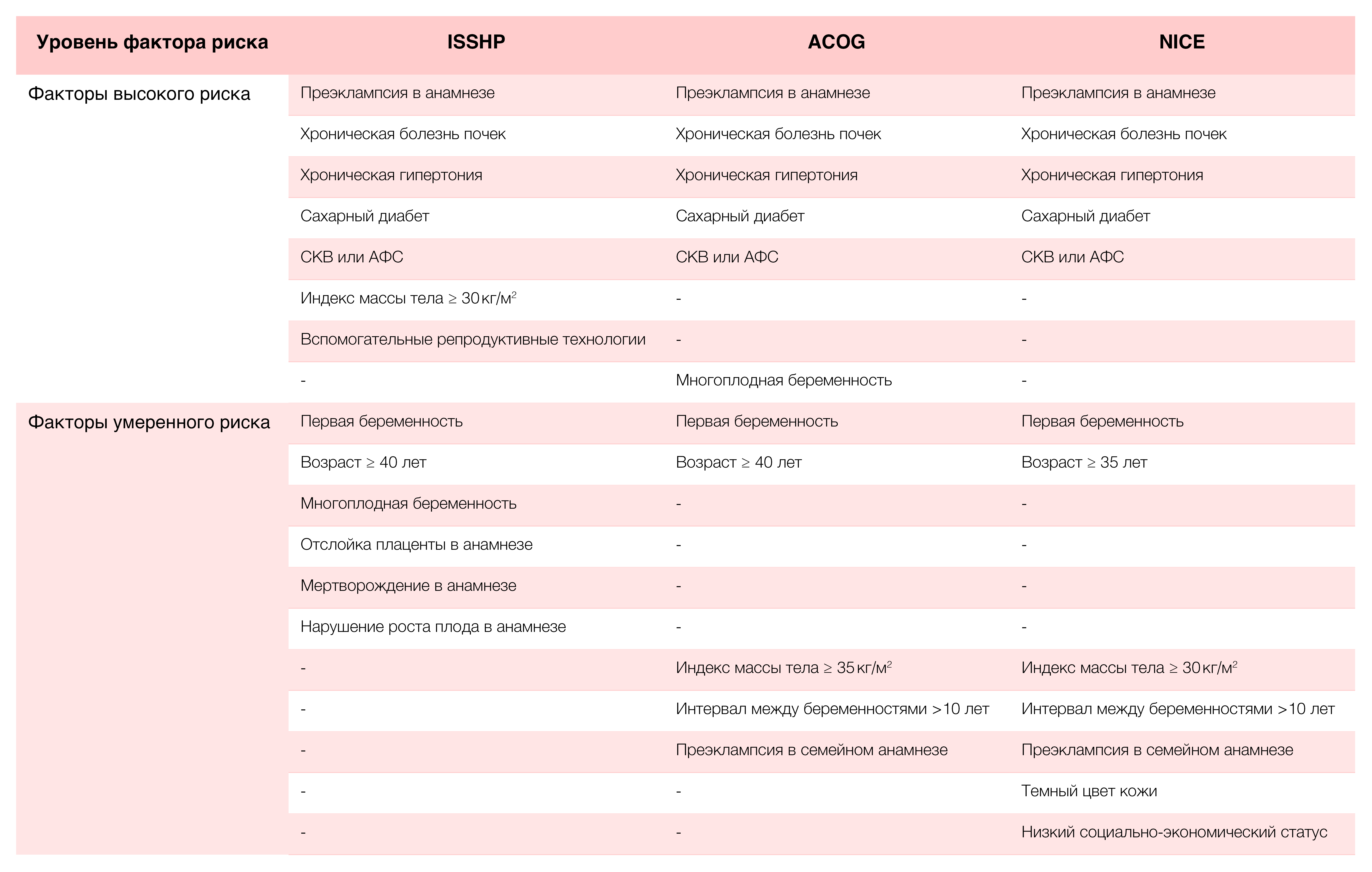
Существует множество факторов риска, связанных с преэклампсией (таблица 1); однако по отдельности ни один из них не обладает большой прогностической значимостью, и даже в сочетании их прогностическая сила невелика [24]. Признанные факторы высокого риска в целом схожи в рекомендациях ISSHP [2], Американской коллегии акушеров и гинекологов (ACOG) [25] и Национального института здравоохранения и совершенствования медицинской помощи (NICE) [26] и включают акушерский анамнез (например, предшествующую преэклампсию, многоплодную беременность [только ACOG]) и материнские факторы (например, хроническая болезнь почек, хроническая артериальная гипертензия, сахарный диабет, системная красная волчанка [СКВ], антифосфолипидный синдром). ИМТ >30 кг/м2 и вспомогательные репродуктивные технологии к факторам высокого риска относит только ISSHP. Недавнее сравнение руководств по клинической практике и данных, подтверждающих эти факторы риска, показало, что во многих руководствах четкое соответствие между факторами риска и подтверждающими данными отсутствует [24]. Более того, эти рекомендации в основном разрабатываются в СВД; таким образом, они не включают факторы, важные для СНСД, такие как доступ к поставщикам медицинских услуг / клиническому оборудованию для проведения тестов и характерные для СНСД факторы риска, в том числе подростковый возраст, малярию или анемию [24, 27]. Кроме того, лишь немногие модели проходят валидацию в условиях ограниченных ресурсов [24, 27].
Таблица 1 | Контрольные списки оценки рисков от ISSHP [2], ACOG [25] и NICE [26]
Генетические факторы риска
Тот факт, что эклампсия обычно встречается у матерей, сестер и дочерей, предполагает участие генетических факторов [28]; тем не менее, на сегодняшний день не выявлен ни один ген, связанный с высоким риском. Популяционные и большие когортные исследования подтверждают, что материнский семейный анамнез преэклампсии увеличивает риск этого заболевания в три-четыре раза [29–33]. Такая связь более выражена для преждевременной (отношение рисков (ОР) 2,15, 95% ДИ 1,69–2,73), чем для доношенной преэклампсии (ОР 1,49, 95% ДИ 1,4–1,58) [32]. Существует множество аллелей и мутаций генов матери и плода, связанных с преэклампсией [33–39], что, возможно, отражает синдромную природу этого заболевания. Многие из выявленных генов связаны с тромбофилическими [34–37] и ангиогенными факторами [33, 40] или иммунными реакциями [38, 39]. Фетальная трисомия по 13-й хромосоме также связана с повышенным риском преэклампсии, вероятно, из-за дополнительной копии FLT1 (кодирующей Fms-связанный рецептор тирозинкиназы 1; FLT1), которая расположена в 13-й хромосоме [41].
Женщины, у которых отсутствует активирующий рецептор KIR (иммуноглобулиноподобный рецептор киллерных клеток; генотип АА), имеют гораздо больший риск преэклампсии, когда плод экспрессирует генотип HLA-C2, фактор главного комплекса гистосовместимости I класса (MHCI), присутствующий на клеточной поверхности и обладающий диморфизмом в положении 80 [39]. Семейство KIR экспрессируется на естественных клетках-киллерах (NK) и взаимодействует с отцовским HLA-C, расположенным на поверхности клеток трофобласта, для контроля инвазии и кровоснабжения плода. У лиц с генотипом АА нет экспрессии активирующих рецепторов и, следовательно, у них трофобласт может плохо инвазировать в материнские маточные артерии, и развитие плаценты нарушается.
Полногеномный ассоциативный метаанализ европейских и центральноазиатских матерей и потомков [33] выявил три варианта последовательностей, связанных с преэклампсией: один в гене FLT1 у лиц, родившихся в результате преэкламптической беременности, и два в генах FTO (кодирующем α-кетоглутарат-зависимую диоксигеназу) и ZNF831 (кодирующем белок с цинковыми пальцами 831) у женщин с преэкламптической беременностью [33]. Растворимая форма FLT1 (sFLT1) представляет собой выделяемый плацентой антиангиогенный фактор, который используется в диагностических тестах на преэклампсию [42]. Варианты FTO и ZNF831 ранее связывали с артериальным давлением [43, 44], ожирением, ИМТ и диабетом второго типа [45]. Однако причинно-следственную связь этих ассоциаций и клиническую пользу обнаружения таких изменений еще предстоит изучить в более крупных исследованиях.
Расовые различия
Интерпретировать исследования, в которых изучается риск преэклампсии, связанный с расовой принадлежностью, необходимо с осторожностью, поскольку многие из них неправильно учитывают возможные медиаторы и искажающие результаты факторы, такие как различия в медицинском обслуживании и разные сердечно-сосудистые профили. Согласно эпидемиологическим исследованиям, чернокожие женщины и женщины южноазиатского происхождения имеют более высокий риск развития преэклампсии, чем белые женщины, даже с учетом социальной депривации [17, 46–48] и повышенного риска хронической гипертонии и сердечно-сосудистых заболеваний [49–51]. В крупном когортном исследовании с участием более 168 000 женщин с одноплодной беременностью в Великобритании риск развития преэклампсии на любой стадии беременности у чернокожих женщин был в два раза выше, чем у белых женщин [52]. Эта связь была наиболее сильной для ранней (в 3,5 раза) и преждевременной (в 2,5 раза) преэклампсии [52]. У женщин южноазиатского происхождения риск преждевременной преэклампсии был в 1,5 раза выше, чем у белых женщин, но при измерении всех видов преэклампсии связи обнаружено не было [52]. У женщин восточноазиатского происхождения не было существенной разницы в риске преэклампсии или гипертонических расстройств [52]. В этом исследовании были учтены медиаторы и искажающие факторы в характеристиках матери и истории болезни. Скрининг в первом триместре по алгоритму Фонда медицины плода улучшает перинатальные исходы среди небелого населения на 60% [53]; это позволяет предположить, что неравенства в состоянии здоровья можно избежать с помощью персонализированной оценки риска и правильного распределения маршрутов оказания помощи.
Возраст матери
Связь между риском преэклампсии и возрастом матери имеет вид J-образной кривой, причем риск повышен у подростков и женщин старше 35 лет [54–56]. Поздний возраст матери (≥35 лет) связан с повышенным риском предсуществующей кардиометаболической дисфункции и медицинских нарушений, многоплодной беременности и использования искусственных репродуктивных технологий, которые повышают риск преэклампсии. Сообщалось, что риск преэклампсии увеличивается с каждым дополнительным годом после 32 лет [56], даже после поправки на искажающие и последующие факторы и взаимодействия [55]. Матери младше 20 лет могут подвергаться повышенному риску из-за сочетания акушерских, иммунологических и социально-экономических факторов, включая первые роды и доступ к дородовой помощи. Возраст матери менее 20 лет в основном связан с преэклампсией с поздним началом (≥ 34 недель беременности) [57].
Предсуществующие заболевания матери
Предсуществующие заболевания могут увеличить риск развития гипертонической болезни во время беременности, в том числе преэклампсии. Многие из этих факторов риска можно выявить до или во время ранней беременности, что позволяет скорректировать риск развития более поздней преэклампсии.
Хроническая гипертония (или гипертония, диагностированная спустя < 20 недель беременности) связана с пятикратным увеличением риска преэклампсии по сравнению с нормотензией [58]. Лечение даже легкой хронической гипертонии противогипертоническими препаратами до беременности или на ранних ее сроках снижает риск развития преэклампсии на 18% (скорректированное ОР 0,82, 95% ДИ 0,74–0,92) [59].
ИМТ до беременности > 30 кг/м2 приводит к увеличению риска преэклампсии в 2–4 раза [30, 56, 60], а среди женщин с избыточным весом и ожирением наблюдается более высокая распространенность поздней преэклампсии [61–63]. Вероятно, это частично объясняется связью преэклампсии с ожирением и кардиометаболической дисфункцией [64]. Хотя потеря веса во время беременности не рекомендуется, для минимизации набора веса и снижения риска преэклампсии важно изменение образа жизни в дородовой период. Метаанализ показал, одни лишь физические упражнения во время беременности значительно снижают вероятность развития преэклампсии (ОШ 0,59, 95% ДИ 0,37–0,90) [65].
Риск развития преэклампсии у женщин с прегестационным сахарным диабетом более чем в три раза выше, чем у женщин без сахарного диабета [30, 66]. У таких женщин могут быть микрососудистые и макрососудистые осложнения диабета, включая заболевания почек, которые повышают риск. Диабет также может усиливать окислительный стресс, воспаление и эндотелиальную дисфункцию — путь в том числе и для развития преэклампсии [67].
У женщин с преэклампсией в три раза чаще встречается хроническая болезнь почек по сравнению с населением в целом [68], при этом имеются некоторые данные о том, что у женщин с хронической болезнью почек чаще развивается преэклампсия с поздним началом, чем с ранним началом [57]. С повышенным риском обычно связаны гломерулонефрит, диабетическая болезнь почек и поликистоз почек [68]. Тяжесть заболевания почек и степень протеинурии являются важными предикторами риска развития преэклампсии даже при отсутствии сопутствующей патологии, в том числе хронической гипертонии.
С повышенным риском преэклампсии связано нарушение функции щитовидной железы во время беременности и до нее [69]. Явный гипотиреоз и гипертиреоз без лечения связаны с высоким риском преэклампсии [70], который можно снизить с помощью заместительной терапии тироксином [71] или антитиреоидными препаратами, соответственно [72]. Терапия субклинического гипотиреоза спорна и не сопровождается уменьшением частоты преэклампсии [73], и сам по себе субклинический гипертиреоз с преэклампсией не связан [69].
Риск преэклампсии повышается при СКВ и антифосфолипидном синдроме, особенно в активной фазе заболевания, о чем свидетельствует наличие волчаночного нефрита при СКВ (ОШ 2,84, 95% ДИ 1,87–4,30), или волчаночного антикоагулянта (ОШ 2,45, 95% ДИ 1,18–4,64), или антител к кардиолипину (ОШ 1,52, 95% ДИ 1,05–2,20) при антифосфолипидном синдроме [2, 74–82]. Адекватное лечение и зачатие при отсутствии активного заболевания связаны со снижением риска преэклампсии.
У женщин с преэклампсией были выявлены нарушения профилей кишечной микробиоты, причем изменения сохранялись до шести недель после родов [83, 84]. Нарушение микробиоты кишечника также связано с другими заболеваниями, которые служат факторами риска преэклампсии, включая ожирение и метаболические нарушения [84].
Акушерский анамнез
Первые роды связаны с трехкратным увеличением вероятности развития преэклампсии [30]. Предполагается, что одним из механизмов ее возникновения является иммунная дезадаптация и материнская аллоиммунная реакция, вызванная отторжением отцовских антигенов на фетальном аллотрансплантате [85]. Этот ответ наиболее выражен при первой беременности; следовательно, у первородящих матерей более вероятно развитие преэклампсии [57], тогда как многократные роды имеют защитный эффект и снижают риск преэклампсии [86]. Эффект теряется, когда последующая беременность предполагает воздействие новых антигенов, унаследованных от отца [87]. Эпидемиологические исследования показали возрастание риска преэклампсии с увеличением интервала между беременностями, эквивалентного первым родам, когда он составляет > 10 лет [58, 88]. Эта гипотеза также согласуется с данными о том, что женщины, зачавшие с помощью экстракорпорального оплодотворения (ЭКО) или внутриматочного осеменения с использованием донорских гамет, подвергаются значительно более высокому риску, чем те, кто проходит ЭКО с аутологичной яйцеклеткой или спермой партнера [89, 90].
Многоплодная беременность связана со значительно более высокой частотой преэклампсии (ОШ 2,93, 95% ДИ 2,04–4,21), чем одноплодная беременность, причем частота увеличивается с увеличением количества плодов [30]. Ни хорионичность, ни зиготность не влияют на риск, хотя этот показатель может быть недооценен при монохориальной беременности, которая, скорее всего, будет выборочно преждевременно заканчиваться родами по показаниям со стороны плода, в отличие от дихориальной беременности, которая в большинстве случаев оканчивается в срок [91].
Предыдущая преэкламптическая беременность увеличивает риск рецидива при последующих беременностях в 7–10 раз [92–95]. Риск рецидива в большей степени связан с предыдущей беременностью, осложненной ранней преэклампсией, чем с предыдущей беременностью, осложненной поздней преэклампсией, при этом время беременности в момент рецидива часто приходится на несколько недель позже в последующих беременностях [57, 62]. Метаанализ, включающий данные 94 исследований, показал риск рецидива 13,8%, обратно пропорциональный гестационному возрасту на момент родов в предыдущей беременности, на которую повлияла преэклампсия [96, 97].
Предыдущие беременности, осложненные ЗРП, отслойкой плаценты и мертворождением, повышают риск преэклампсии, особенно если ранее они были связаны с ранней преэклампсией или признаками нарушения плацентарного кровотока [57]. Существуют ограниченные данные о связи преэклампсии с предыдущей внематочной беременностью; тем не менее, одно национальное когортное исследование в Шотландии (1981–2000 гг.) выявило более высокий риск развития преэклампсии у женщин с внематочной первой беременностью, чем у женщин, родивших живого ребенка [98]. Нет никаких данных о том, что предшествующий анамнез искусственного или естественного прерывания беременности на ранних сроках связан с преэклампсией [57, 60, 99, 100].
Зачатие с помощью ЭКО, внутрицитоплазматической инъекции спермы или донорства яйцеклеток увеличивает риск преэклампсии по сравнению с беременностями, возникшими естественным путем или посредством внутриматочного осеменения; риск еще выше при циклах переноса замороженных и размороженных эмбрионов, чем при циклах переноса свежих эмбрионов [101]. Это может быть связано с нарушением здоровья сосудов и материнской адаптации к беременности у женщин, у которых на момент зачатия отсутствует желтое тело [102–104]. Женщинам, которые сталкивались с переносом замороженных и размороженных эмбрионов, часто назначают гормональную терапию, которая подавляет ось гипофиз–яичники, что приводит к отсутствию желтых тел [102, 103]. Кроме того, различия в гормональной подготовке эндометрия перед циклом замораживания и размораживания могут оказывать неблагоприятное влияние на адаптацию матери к беременности [104], включая аномальную децидуализацию (формирование децидуальной оболочки) [105]. Перенос одного эмбриона также снижает риск многоплодной беременности, тем самым снижая риск преэклампсии.
После пандемии COVID-19 появились данные, позволяющие предположить связь между инфекцией SARS-CoV-2 во время беременности и повышенным риском развития преэклампсии. Некоторые систематические обзоры выявили увеличение риска при сопоставлении данных из разных когорт [106, 107]; однако другие исследования показали, что заражение COVID-19 во время беременности не увеличивает риск преэклампсии [108–110]. Преэклампсия с большей вероятностью связана с тяжелым течением COVID-19, хотя является ли одно из этих состояний причиной другого, окончательно не выяснено [107, 111]. И преэклампсия, и COVID-19 характеризуются увеличением циркулирующих провоспалительных цитокинов и нарушением функции эндотелия, что позволяет предположить общие механизмы [111]. С учетом того, что, по-видимому, существует взаимосвязь «доза-реакция» и сходство в активации множества одних и тех же молекулярных путей, таких как ангиогенез и эндотелиальная дисфункция, эти результаты требуют дальнейшего изучения.
Факторы окружающей среды
Проживание на большой высоте (> 2700 м) связано с повышенным риском преэклампсии (например, Колорадо, США, 33% беременностей; Перу, 22% беременностей; Боливия, 20% беременностей; распространенность во всем мире 4,6% беременностей) [14, 112–114]. Считается, что повышенная частота преэклампсии обусловлена гипоксией у матери, затрагивающей несколько физиологических систем, включая плаценту / децидуальную сосудистую систему [112]; сообщалось, что жители нескольких поколений, проживающие на больших высотах, могут быть более защищены от преэклампсии по сравнению с иммигрантами [113].
Качество воздуха и воздействие загрязняющих веществ из окружающей среды также являются факторами риска преэклампсии. Сообщалось о связи между воздействием твердых частиц из окружающей среды диаметром < 2,5 мкм (PM2,5) [115–117] и диоксида азота [116] во время беременности и увеличением числа случаев преэклампсии; при воздействии PM2,5 эта связь может быть более выраженной для преэклампсии с ЗРП [115].
Механизмы/патофизиология
Формирование здоровой беременности
Плацентация
При преэклампсии плацента играет центральную роль: преэклампсия обнаруживается только тогда, когда плацента присутствует или присутствовала недавно. Здоровая функция плаценты зависит от обширного ветвления ворсин плаценты и васкуляризации на ранних сроках беременности, при этом зрелая плацента в основном формируется к концу первого триместра [118].
Беременность наступает после имплантации компетентной бластоцисты в восприимчивый эндометрий [119]. Эндометрий транзиторно восприимчив к имплантации бластоцисты в середине лютеиновой фазы менструального цикла [119]. После имплантации плацента формируется из линий внеэмбриональных клеток бластоцисты: клетки трофэктодермы дифференцируются в цитотрофобласты-предшественники ворсинок, которые сливаются с образованием синцитиотрофобласта или дифференцируются в инвазивные вневорсинчатые трофобласты [120], а внеэмбриональная мезодерма образует стромальную ткань ядра ворсинок и кровеносные сосуды [120]. Плацентарная ворсинка выстлана двумя слоями трофобласта: многоядерным синцитиотрофобластом, который покрывает всю плаценту и находится в непосредственном контакте с материнской кровью, и цитотрофобластом, который формирует вневорсинчатый трофобласт и прикрепляет плацентарную ворсинку к материнской децидуальной ткани с помощью клеточных столбиков [120] (рис. 2a). Вневорсинчатые трофобласты проникают из клеточных столбиков в верхнюю треть миометрия, начиная с 14 дней после имплантации [120] и до 18 недель беременности, когда плацентация в основном завершена [121]. Факторы, выделяемые вневорсинчатыми трофобластами (включая прогестерон), усиливают децидуализацию [122, 123], создавая полупостоянную децидуальную ткань, сохраняющуюся на протяжении всей беременности.
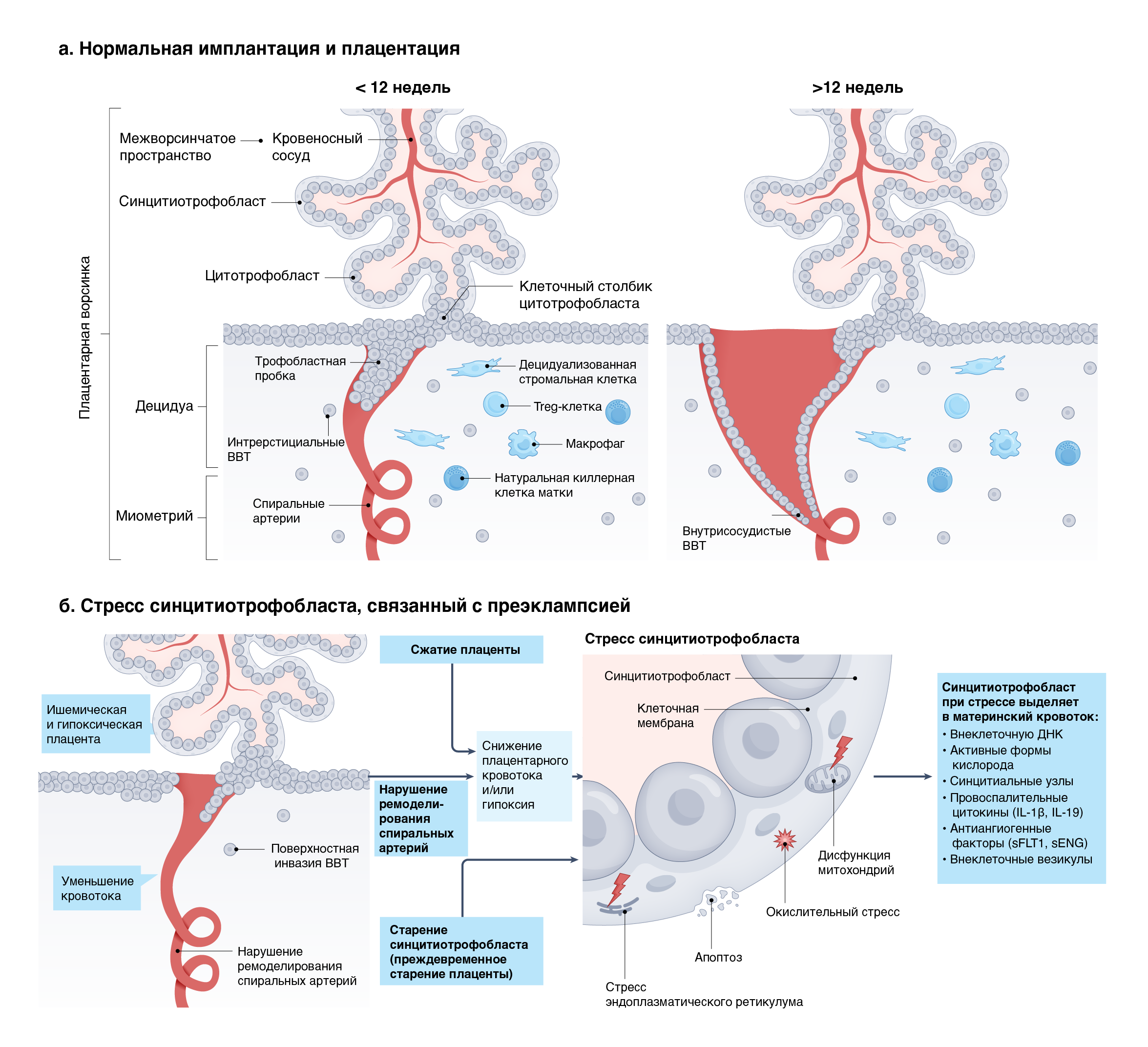
б) Существует несколько предполагаемых причин стресса синцитиотрофобласта, связанного с преэклампсией. Предполагается, что нарушение ремоделирования спиральных артерий, которое связано с поверхностной инвазией ВВТ, приводит к стрессу синцитиотрофобласта, что вызывает ишемическое кровоснабжение плаценты. По-видимому, теснота и сжатие ворсин плаценты вызывают снижение плацентарного кровотока и гипоксию плаценты, что приводит к стрессу синцитиотрофобласта. Старение синцитиотрофобластов в результате преждевременного старения плаценты также может приводить к стрессу синцитиотрофобласта. Стресс синцитиотрофобласта проявляется в виде стресса эндоплазматического ретикулума, нарушения функции митохондрий, окислительного стресса и апоптоза и приводит к аномальному выделению в материнский кровоток факторов, среди которых внеклеточная ДНК, активные формы кислорода, синцитиальные узлы, экзосомы/микровезикулы, провоспалительные цитокины и антиангиогенные вещества.
рЭнг — растворимый эндоглин; sFLT1 — soluble Fms-related receptor tyrosine kinase 1 (растворимая рецепторная тирозинкиназа 1, родственная Fms).
Адаптировано из ссылки. 349, Springer Nature Limited
Плацентарные ворсинки, омываемые материнской кровью, облегчают обмен питательных веществ и газов, необходимый для поддержания плода во время беременности. Сосуды внутри ядра ворсинок транспортируют питательные вещества и газы к плоду и от него через пупочные кровеносные сосуды. В течение первого триместра спиральные артерии матки перестраиваются, превращаясь в сосуды с большим диаметром, сильным потоком и низким сопротивлением [124], способные удовлетворить повышенные потребности плацентарного кровотока на более поздних стадиях беременности. Ремоделирование запускается резидентными клетками врожденного иммунитета в матке, в том числе маточными NK-клетками и Т-регуляторными (Treg) клетками, которые вызывают потерю гладких миоцитов сосудов, окружающих спиральные артерии, и регулируют инвазию вневорсинчатого трофобласта через децидуальную оболочку посредством секреции ангиогенных факторов роста и цитокинов [125]. Внутрисосудистые вневорсинчатые трофобласты проникают в артерии, замещая сосудистые эндотелиальные клетки и временно закупоривая материнские артерии, блокируя приток крови к развивающейся плаценте и приводя к развитию эмбриона в условиях низкого содержания кислорода. Примерно на 10–12 неделе беременности внутрисосудистые трофобластные пробки смещаются [126, 127], что позволяет увеличить объемы поступления материнской крови в межворсинчатое пространство и тем самым усилить снабжение плаценты и плода кислородом.
Адаптация сосудов во время беременности
При здоровой беременности сердечно-сосудистая система матери подвергается значительному расширению, включая увеличение объема плазмы и сердечного выброса уже на 3–4 неделе — в первую очередь, за счет факторов, выделяемых плацентой [128]. Возникающее в результате повышение артериального давления предотвращается сопутствующим снижением системного сосудистого периферического сопротивления, увеличением растяжимости артерий, расширением периферических сосудов, ослаблением сократимости, усилением выделения эндотелием сосудорасширяющих факторов и активацией ренин-ангиотензин-альдостероновой системы почек [129–132]. Данных о том, что вегетативная регуляция приводит к изменениям в сердечно-сосудистой системе во время беременности, мало: первичные адаптации являются эндотелиальными и миогенными [128]. Эндотелий представляет собой связующее звено между кровью и гладкими мышцами сосудов и очень чувствителен к гуморальным факторам и физическим силам [128].
Патофизиология преэклампсии
Что лежит в основе этиологии преэклампсии, как преждевременной, так и доношенной, остается неясным. Вполне вероятно, что в ней участвуют материнские и плацентарные факторы и что в патогенезе преждевременной и доношенной преэклампсии есть общие черты [133], но в исследованиях по определению патогенеза доношенной преэклампсии, которая более распространена и часто связана с материнскими осложнениями [134], присутствует значительный пробел.
Двухэтапная модель преэклампсии предполагает, что это состояние возникает в результате нарушения функции плаценты, вызывающей стресс синцитиотрофобласта (стадия 1), что приводит к клиническим проявлениям преэклампсии у матери (стадия 2) [135, 136]. Предполагается, что причина и время плацентарного инсульта различаются при преждевременной и доношенной преэклампсии [136]. Стресс синцитиотрофобласта (стадия 1) проявляется как окислительный стресс, стресс эндоплазматического ретикулума, повреждение митохондрий, нарушение регуляции метаболизма и апоптоз [137, 138]. Синцитиотрофобласт в состоянии стресса аномально выделяет провоспалительные цитокины, активные формы кислорода, внеклеточные везикулы, антиангиогенные агенты (например, растворимый FLT1 [sFLT1] и бесклеточную ДНК плода) в кровоток матери [135, 139–141]. Эти факторы способствуют развитию эндотелиальной дисфункции у матери и системной полиорганной недостаточности, которая включает снижение вазодилатации, системное воспаление и тромбоз [142–144] (стадия 2). Среди эффектов можно назвать гипертонию, нарушение функции печени и почек, тромбоцитопению и коагулопатию.
Нарушение функции плаценты при преждевременной преэклампсии
Считается, что стресс синцитиотрофобласта при преждевременной преэклампсии возникает из-за аномальной плацентации на ранних сроках беременности, характеризующейся неадекватной инвазией вневорсинчатого трофобласта и ремоделированием спиральных артерий [145, 146] (рис. 2b). Это уменьшает приток крови к плаценте, что приводит к плацентарной гипоксии и повреждению, связанному с ишемией-реперфузией, вызывая стресс синцитиотрофобласта. Неадекватная инвазия трофобласта в спиральные артерии и связанная с ней плацентарная гипоперфузия также напрямую способствуют развитию ЗРП, который часто сопровождает преждевременную преэклампсию.
Нарушение функции плаценты при доношенной преэклампсии
Аномальные гистопатологические изменения плаценты, часто встречающиеся при преждевременной преэклампсии, относительно редки при доношенной форме заболевания [147, 148]. Предполагается, что развитие плаценты при доношенной преэклампсии происходит нормально и что стресс синцитиотрофобласта начинается на более поздних сроках беременности. Предложено два механизма, посредством которых стресс синцитиотрофобласта возникает при доношенной преэклампсии: сдавление хронической ворсинки, в результате которого более крупной плаценте на поздних сроках беременности оказывается недостаточно места, и старение синцитиотрофобласта, связанное с преждевременным старением плаценты [135, 149] (рис. 2b). Стресс синцитиотрофобласта усиливается по мере течения беременности, даже если она протекает без осложнений, что обусловлено растущим несоответствием между нормальным материнским кровотоком в плаценте и метаболическими потребностями плаценты и плода [135]; это позволяет предполагать, что преэклампсия неизбежна, если превышаются возможности плаценты [125].
Предполагается, что на ранних сроках беременности, которая позже осложняется доношенной преэклампсией, стресс синцитиотрофобласта отсутствует [149], что объясняет, почему ранние модели прогнозирования преэклампсии, которые часто включают факторы риска и биомаркеры аномальной плацентации, демонстрируют высокую точность в прогнозировании преждевременной преэклампсии (уровень выявления 75–90%), но менее эффективны в прогнозировании доношенной преэклампсии (уровень выявления ниже 50%) [150]. Однако эти гипотезы трудно проверить экспериментально из-за проблемы получения плаценты на ранних сроках текущих беременностей.
Нарушение функции иммунной системы
Иммунологические проблемы у матери связаны с аномалиями в области взаимодействия плода и матери. Иммунологическая толерантность к плоду и плаценте, половина генов которых являются отцовскими, частично обеспечивается снижением плацентарной экспрессии MHC (системы человеческого лейкоцитарного антигена [HLA]); этот механизм направлен на попытку избежать врожденного отторжения полуаллогенных клеток плода [151]. NK-клетки и Т-лимфоциты матки расположены в децидуальной оболочке и играют решающую роль в обеспечении иммунной толерантности матери к плоду. В частности, Treg-клетки осуществляют функции иммунной толерантности посредством таких механизмов, как презентация антигена, секреция ингибирующих цитокинов и лизис клеток-мишеней [152, 153]. При преэклампсии обнаруживается аномальное выделение факторов Treg-клеток, включая цитокины и микроРНК [154]. Эпидемиологические исследования подтверждают экспериментальные данные о том, что материнский иммунный ответ на антигены отцовского происхождения в трофобласте [155] уменьшается после предыдущего воздействия семенной жидкости [156]: более высокая частота преэклампсии обнаруживается у первородящих женщин при беременностях от нового отца, после длительного интервала между беременностями (> 10 лет), при беременности, наступившей вскоре после первого полового акта, а также беременности в результате использования донорской яйцеклетки [157] и спермы [90]. В сыворотке женщин с преэклампсией повышено содержание аутоантител к рецептору ангиотензина II типа 1 (АТ1-АА) [158]. АТ1-АК способствуют продолжительному сужению сосудов и могут вызывать повреждение эндотелиальных клеток [158].
Метаболическое и сердечно-сосудистое здоровье матери
Накапливаются данные, свидетельствующие о том, что преэклампсия связана с нарушением метаболизма и сердечно-сосудистой функции матери, что приводит к неадекватной адаптации к нуждам беременности [159–163]. Предполагается, что изменение метаболической и сердечно-сосудистой функции способствует преэклампсии, вызывая подавление перестройки спиральных артерий при преждевременной преэклампсии и изменение метаболической функции плаценты как при преждевременной, так и при доношенной преэклампсии [163]. Метаболомные исследования сыворотки крови женщин на сроке 11–13 недель беременности, у которых позднее развилась поздняя преэклампсия, выявили, что на поздних стадиях беременности присутствуют инсулинорезистентность и метаболический синдром, митохондриальная дисфункция, нарушение энергетического обмена, окислительный стресс и липидная дисфункция [164]; это позволяет предположить, что нарушения можно выявить на ранних стадиях заболевания.
Нарушение регуляции экспрессии плацентарных генов
Два небольших исследования с использованием образцов ворсин хориона (ОВХ), взятых у беременных, у которых впоследствии развилась преэклампсия с ранним началом (< 34 недель беременности), выявили нарушение регуляции экспрессии генов в плаценте и децидуальной оболочке в конце первого триместра [165–167]. В ткани плаценты наблюдалось нарушение регуляции экспрессии генов, связанных с ангиогенезом и окислительным стрессом [165], а в децидуальной ткани оказалась изменена экспрессия генов, связанных с воспалением/иммунорегуляцией, подвижностью клеток, децидуализацией и функцией NK-клеток [166, 167]. Многие из этих результатов затем подтвердились при преждевременной преэклампсии, включая изменение экспрессии фактора комплемента H и протромбина [35–37, 168]. На сегодняшний день ни в одном исследовании не изучалась экспрессия генов ОВХ, полученных от беременных женщин, у которых впоследствии развиваются поздние преждевременные роды (35–36 недель беременности) или доношенная преэклампсия (≥ 37 недель беременности).
Метаанализ образцов плаценты, собранных при родах, выявил нарушение регуляции генов, участвующих в использовании углеводов и энергии, иммунном ответе и процессах развития/беременности, при всех формах преэклампсии [169]. В более мелких исследованиях, в которых различали преэклампсию с ранним и поздним началом, выявили, что в образцах плаценты при преэклампсии с ранним началом повышалась экспрессия генов, участвующих в метаболических процессах, а в образцах плаценты при преэклампсии с поздним началом была повышена экспрессия генов, участвующих в иммунных процессах [170, 171]. Эти данные также позволяют предположить, что механизмы, участвующие в трех формах преэклампсии, различаются.
Нарушение регуляции выделения плацентарных факторов
В крови матери до развития преэклампсии было выявлено нарушение секреции плацентой факторов, включая ангиогенные белки, провоспалительные цитокины и небольшие внеклеточные везикулы [139, 172–176].
Ангиогенные факторы, выделяемые плацентой, включая sFLT1 и плацентарный фактор роста (PGF), участвуют в развитии преэклампсии [177–179]. Примерно за пять недель до начала преэклампсии в сыворотке наблюдается резкое повышение уровня sFLT1 и снижение уровня PGF [178]. Таким образом, соотношение sFLT1 и PGF используется в качестве полезного инструмента при диагностике плацентарной дисфункции при преэклампсии, при этом более высокая чувствительность и специфичность достигаются при преэклампсии с ранним началом [177, 178]. Еще одним заметным антиангиогенным фактором, высвобождаемым преэкламптической плацентой, с картиной в сыворотке, аналогичной sFLT1, служит растворимый эндоглин [177, 180]. Считается, что повышение уровня расщепленной растворимой формы эндоглина в сыворотке крови матери приводит к нарушению ангиогенеза и сужению сосудов, что вызывает симптомы преэклампсии [180]. Результаты недавнего метаанализа позволяют предположить, что растворимый эндоглин в материнской сыворотке может быть полезен в качестве прогностического биомаркера преэклампсии, но он не позволяет различать заболевание с ранним и поздним началом [181].
При преэклампсии усиливается активация инфламмасом и связанный с ними провоспалительный каскад [182, 183]. Инфламмасомы — это рецепторы и сенсоры врожденной иммунной системы, состоящие из мультимерных белков, которые регулируют активацию каспазы 1 и вызывают воспаление в ответ на инфекционные микробы и молекулы, полученные из белков хозяина (так называемое стерильное воспаление) [184]. В крови женщин с преэклампсией повышено содержание белков NLRP3 (NACHT, LRR and PYD domains-containing protein 3) и NLRP7 и ассоциированного с ними адапторного белка PYCARD [182, 183]. Разрабатывается несколько стратегий ингибирования активации инфламмасом [185], которые могут быть полезны для воздействия на связанные с воспалением пути при преэклампсии.
У женщин, у которых впоследствии развивается преэклампсия, на ранних сроках беременности повышается содержание IL-11 в кровотоке [186]. Тем не менее, важно определить, нарушается ли регуляция уровня IL-11 в плаценте при ее развитии — это может иметь решающее значение для патогенеза преэклампсии.
Галектины представляют собой семейство β-галактозидсвязывающих лектинов, играющих важную роль в развитии преэклампсии [187]. Галектины 1, 2, 3, 7, 9, 13 и 14 участвуют в патогенезе преэклампсии [187] — вероятно, из-за их функции повышения толерантности матери к плоду [169, 187] или вызываемых ими изменений в ренин-ангиотензин-альдостероновой системе и окислительного стресса [188, 189]. При преждевременной преэклампсии была обнаружена корреляция между экспрессией галектина 7 в ОВХ и его уровнем в крови матери.
При преэклампсии выявляется усиленное выделение синцитиотрофобластом внеклеточных везикул (рис. 2б) в материнский кровоток [191–193]. Эти везикулы обогащены антиангиогенными факторами, лигандами, индуцирующими апоптоз, и активной каспазой 3, особенно при преэклампсии с ранним началом [192, 193]. Новые данные говорят о том, что внеклеточные везикулы, выделяемые синцитиотрофобластом, интернализуются эндотелиальными клетками, в которых они высвобождают эти факторы и вызывают нарушение функции материнского эндотелия и воспаление, наблюдаемые при преэклампсии [176, 194–196].
Системные последствия начала преэклампсии
Повреждение сосудов
Считается, что материнский эндотелий служит важной мишенью для факторов, которые выделяются плацентой и предположительно вызывают преэклампсию [197]. Обширная эндотелиальная дисфункция также может объяснить системное поражение органов у женщин с преэклампсией [198]. Эндотелий контролирует тонус гладких мышц, выработку и выделение сосудосуживающих и сосудорасширяющих факторов (включая оксид азота), а также регулирует антикоагулянтную, антитромбоцитарную и фибринолитическую функции [197]. Нарушение функции эндотелия может привести к снижению притока крови к таким органам, как сердце и почки [133], а также к снижению оттока венозной крови и связанному с этим венозному застою. Это способствует нарушению работы органов и может вызывать рефлекторное сужение артерий [199]. В целом предполагается, что дисфункция эндотелия под действием выделяемых плацентой факторов инициирует и стимулирует гипертонию при преэклампсии.
Аномальные результаты допплерографии маточных артерий (сосудистый кровоток) чаще встречаются при преэклампсии с ранним началом, чем при преэклампсии с поздним началом [62], что подтверждает затруднение тока крови, связанное с недостаточностью физиологического ремоделирования спиральных артерий и, как следствие, плохим кровотоком в плаценте, гипоксией и реперфузионным повреждением при преэклампсии с ранним началом [133, 134]. Напротив, преэклампсия с поздним началом часто связана с дисфункцией эндотелиальных клеток матери [200] и, как полагают, зависит от предсуществующих заболеваний матери, которые могут повлиять на целостность эндотелия [131]. Тем не менее, подходы с применением машинного обучения, в которых используются биохимические данные, полученные из электронных медицинских записей (например, систолическое артериальное давление, азот мочевины сыворотки крови, калий, кальций и креатинин, количество тромбоцитов и лейкоцитов, а также белок в моче) у 11 006 женщин в со сроком беременности от 14–17 до 34 недель, позволяют предсказывать позднюю преэклампсию в начале второго триместра [92]; это дает основания предположить, что повреждение сосудов плаценты на ранних сроках беременности также встречается при поздней преэклампсии.
Отек легких
Отек легких, характеризующийся чрезмерным накоплением в легких жидкости, представляет собой редкое (у 0,6–5% женщин с преэклампсией) острое, опасное для жизни состояние, главным образом связанное с тяжелой преэклампсией [201, 202]. Отек легких является второй наиболее распространенной причиной смерти при беременности, осложненной гипертонией [203]. Существует множество причин отека легких, включая снижение онкотического давления, повышение проницаемости капилляров, повышение гидростатического давления и диастолическую дисфункцию. Факторами риска отека легких служат противогипертонические препараты и чрезмерное потребление жидкости [204]. Отек легких наиболее распространен (39%) после родов [204], когда жидкость, секвестрированная во внесосудистом пространстве, мобилизуется в сосуды, увеличивая давление заклинивания в центральных венах и легочных капиллярах.
Повреждение почек
Почки являются органом, наиболее подверженным поражению эндотелия при преэклампсии [198]. Биопсия почек у женщин с преэклампсией показывает гломерулярный эндотелиоз (набухание эндотелиальных клеток, облитерацию фенестраций и инвазию капиллярного пространства), который, по-видимому, лежит в основе снижения скорости клубочковой фильтрации, отмечаемой при преэклампсии [205]. Характерная для преэклампсии протеинурия вызывается высокими концентрациями sFLT1, ингибирующими экспрессию белков щелевой диафрагмы подоцитов, таких как синаптоподин и нефрин [206], что увеличивает разделение подоцитов. В свою очередь, отсутствие фактора роста эндотелия сосудов (VEGF) и наличие PGF в эндотелии клубочков стимулирует экспрессию эндотелина 1, что способствует отслоению подоцитов [207].
Поражение печени
Поражение печени при преэклампсии характеризуется перипортальным воспалением и повреждением гепатоцитов (проявляющимся болью в правом верхнем квадранте или эпигастрии и повышением активности трансаминаз), субкапсулярной гематомой и, в редких случаях, печеночной недостаточностью или разрывом печени [208]. Обширная микроангиопатия вызывает спазм печеночных синусоидов и способствует отложению фибрина в микроциркуляторном русле [209], что приводит к ишемии. Эндотелиальные клетки печени сильно зависят от VEGF, и его антагонизм по отношению к sFLT1 значительно влияет на их функцию на фоне снижения доступности оксида азота [210]. Возникающая в результате ишемия вызывает окислительный стресс и воспаление, которые поражают печеночные дольки, повышая концентрацию печеночных ферментов в крови и способствуя возникновению HELLP-синдрома.
HELLP-синдром включает микроангиопатический гемолиз, повышение активности печеночных ферментов и тромбоцитопению. Наиболее распространенными симптомами у больных являются боль в правом подреберье, эпигастралгия, тошнота и рвота, головная боль и изменения зрения. При гипербилирубинемии преобладает непрямой билирубин; таким образом, только в запущенных случаях у пациента может наблюдаться клиническая желтуха [211]. Развитие в тяжелых случаях синдрома диссеминированного внутрисосудистого свертывания крови подтверждает ухудшение состояния и диагностируется по снижению уровней фибриногена, антитромбина и увеличению протромбинового времени и содержания фибрина [212].
Неврологическое поражение
Неврологические симптомы считались признаками высокого риска эклампсии на протяжении столетий[213]. Неврологические осложнения являются непосредственной причиной многих случаев материнской смертности вследствие преэклампсии, особенно в СНСД, и включают эклампсию (судороги), зрительную скотому, кортикальную слепоту, артериальный ишемический инсульт, тромбоз церебральных венозных синусов, субарахноидальные и внутримозговые кровоизлияния, синдром обратимой церебральной вазоконстрикции и синдром обратимой задней энцефалопатии [213, 214]. Тромбоз церебральных венозных синусов, синдром обратимой церебральной вазоконстрикции и синдром задней обратимой энцефалопатии чаще всего возникают в послеродовом периоде и часто практически без предупреждения [215]. Выявляются механизмы, приводящие к неврологическим осложнениям; сосудистая система головного мозга матери очень чувствительна к преэклампсии [215]. Нейроваскулярная дисфункция очевидна при преэклампсии, при этом исследования показывают повышение симпатической активности вегетативной нервной системы [213, 216] (артериальная ригидность и нарушение функции эндотелия частично находятся под симпатическим контролем [216]), нарушение церебральной ауторегуляции (что предотвращает гиперперфузионное повреждение мозга [213, 217]), повышенная проницаемость гематоэнцефалического барьера [132] и вазогенный отек, при этом в преэкламптической спинномозговой жидкости, сыворотке и плазме нарушается содержание церебральных маркеров, включая легкую цепь нейрофиламентов [218].
Задержка роста плода
ЗРП возникает главным образом из-за дисфункции плаценты и, таким образом, тесно связана с преждевременной преэклампсией [219–222]. Нарушения инвазии трофобласта на ранних сроках беременности приводят к неадекватному ремоделированию спиральных артерий матки и могут вызывать гипоксию и дефицит питательных веществ, что в конечном итоге приводит к ЗРП [220]. Преэклампсия с поздним началом, осложненная ЗРП, обычно сопровождается меньшей массой плаценты и большим количеством аномалий сосудов и ворсин по сравнению с преэклампсией с поздним началом без такого осложнения [223]. При любой беременности с подозрением на ЗРП ISSHP рекомендует с помощью УЗИ оценивать скорость роста плода, объем околоплодных вод и проводить допплерографию пупочной артерии каждые две недели, хотя польза допплерографии пупочной артерии вблизи срока родов может быть ограничена [2]. В условиях ограниченных ресурсов ISSHP рекомендует отслеживать частоту сердечных сокращений плода, проводить кардиотокографию каждые шесть часов, а материнские показатели плюс протеинурию можно использовать для оценки перинатального риска на сроке беременности ≥ 32 недель, поскольку до этого низкий гестационный возраст создает наибольший риск [2].
Диагностика, скрининг и профилактика
Диагностика
В руководствах ISSHP [2, 13] указано, что преэклампсия может быть диагностирована после 20 недель беременности по впервые возникшей артериальной гипертензии (систолическое артериальное давление ≥ 140 мм рт. ст. и/или диастолическое артериальное давление ≥ 90 мм рт. ст.; среднее значение двух измерений) у пациентки, ранее имевшей нормальное артериальное давление, в совокупности с еще одним симптом или признаком, связанным с преэклампсией. Это может быть протеинурия (белок/креатинин ≥ 30 мг/ммоль в разовом образце мочи или ≥ 300 мг/ммоль при > 0,3 г/день), острое повреждение почек (креатинин ≥ 90 мкмоль/л), поражение печени (повышение активности трансаминаз, например, АЛТ или АСТ > 40 МЕ/л), неврологические симптомы (эклампсия, изменение психического статуса, слепота, инсульт, клонус, сильные головные боли, постоянные зрительные скотомы), гематологические нарушения (тромбоцитопения [количество тромбоцитов ниже 150 000/мкл], диссеминированная внутрисосудистое свертывание крови, гемолиз), кардиореспираторные осложнения (отек легких, ишемия или инфаркт миокарда, сатурация крови < 90%, ≥ 50% вдыхаемого кислорода в течение более одного часа, интубация, кроме кесарева сечения) или маточно-плацентарная дисфункция (ЗРП, ангиогенный дисбаланс, отслойка плаценты). Этот новый набор диагностических критериев, опубликованный в 2014 г. и пересмотренный в 2018 и 2021 гг., значительно отличается по от предыдущих рекомендаций, опубликованных в 2001 г. [224], которые требовали наличия протеинурии и впервые возникшей артериальной гипертензии у пациента с предшествующей нормотензией. Использование новых руководств ISSHP увеличивает число случаев диагностики преэклампсии, более эффективно выявляя женщин и новорожденных с риском неблагоприятных исходов [225], хотя у большинства женщин с диагностированной таким образом преэклампсией заболевание протекает в легкой форме, и риск неблагоприятных исходов низок [226]. ACOG25 и NICE26 обновили свои рекомендации по диагностике преэклампсии в 2019 году, чтобы они в целом были аналогичны рекомендациям ISSHP [227].
При подозрении на преэклампсию ISSHP рекомендует оценивать ангиогенный дисбаланс как маркер маточно-плацентарной дисфункции, тогда как нормальный ангиогенный баланс подтвердит диагноз гестационной гипертензии [2]. Рекомендации NICE и метаанализ поддерживают измерение PGF отдельно или в сочетании с sFLT1 для исключения подозрения на преэклампсию в течение 14 дней после измерения [26, 42, 228–234]. Кластерное исследование с дизайном «ступенчатого клина» продемонстрировало, что измерение PGF у женщин с подозрением на преэклампсию сокращает время до клинического подтверждения и может снизить частоту неблагоприятных исходов для матери [235]. Сходным образом, соотношение sFLT1 и PGF ниже определенного порогового значения (обычно < 38) может надежно исключить преэклампсию у женщин с подозрением на это заболевание [42].
Небольшие ретроспективные исследования выявили увеличение общего количества тиолов при преэклампсии с поздним началом [236], и агрегатов сывороточных белков, измеренных с помощью ADT-ProteoStat [237], и подокаликсина [238] при преэклампсии как с ранним, так и с поздним началом. Результаты этих небольших исследований требуют проверки на более крупных когортах.
Прогрессирование заболевания
Все женщины с преэклампсией подвергаются риску быстрого прогрессирования и тяжелого течения заболевания, независимо от времени его начала [8, 12], при этом до 18% HELLP-синдрома и 55% эклампсии возникают во время доношенной (≥ 37 недель беременности) преэклампсии [239, 240]. Хроническая гипертония в анамнезе и повышенное систолическое артериальное давление или креатинин сыворотки при госпитализации могут быть связаны с повышенным риском прогрессирования тяжелого заболевания при поздней преждевременной (34–36 [+6 дней] недель беременности) [241] или доношенной преэклампсии [12]. Однако наиболее эффективная модель для прогнозирования риска тяжелых исходов при преэклампсии с ранним началом (гестационный возраст, боль в груди или одышка, насыщение кислородом, количество тромбоцитов и концентрации креатинина и аспартатаминотрансферазы) не включает хроническую гипертонию или артериальное давление при госпитализации [242], что, возможно, отражает различия в этиологии заболевания. Для подтверждения этого необходимы более крупные многоцентровые исследования [243, 244].
Для прогнозирования неблагоприятных исходов беременности исследовали соотношение sFLT1 и PGF. В исследовании, проведенном в Азии, величина отношения sFLT1 к PGF ≤ 38 имела отрицательную прогностическую ценность 98,9% (95% ДИ 97,6–99,6 %), а > 38 — положительную прогностическую ценность 53,5% (95% ДИ 45,0) для совокупности неблагоприятных исходов для матери (включая смерть, отек легких, острую почечную недостаточность, кровоизлияние в мозг, тромбоз головного мозга и диссеминированное внутрисосудистое свертывание крови) [245]. Недавнее исследование показало, что соотношение sFLT1 и PGF лучше подходит для прогнозирования перинатальных неблагоприятных исходов (площадь под рабочей характеристической кривой [AUROC] 0,87, 95% ДИ 0,81–0,93), чем для прогнозирования исходов, неблагоприятных для матери (AUROC 0,69, 95% ДИ 0,59–0,78) [246]. И наоборот, многовариантные прогностические модели, такие как FullPIERS, по-видимому, достаточно хорошо предсказывают неблагоприятные для матери исходы (AUROC 0,88, 95% ДИ 0,84–0,92) как при ранней, так и при поздней преэклампсии [242, 247].
Скрининг
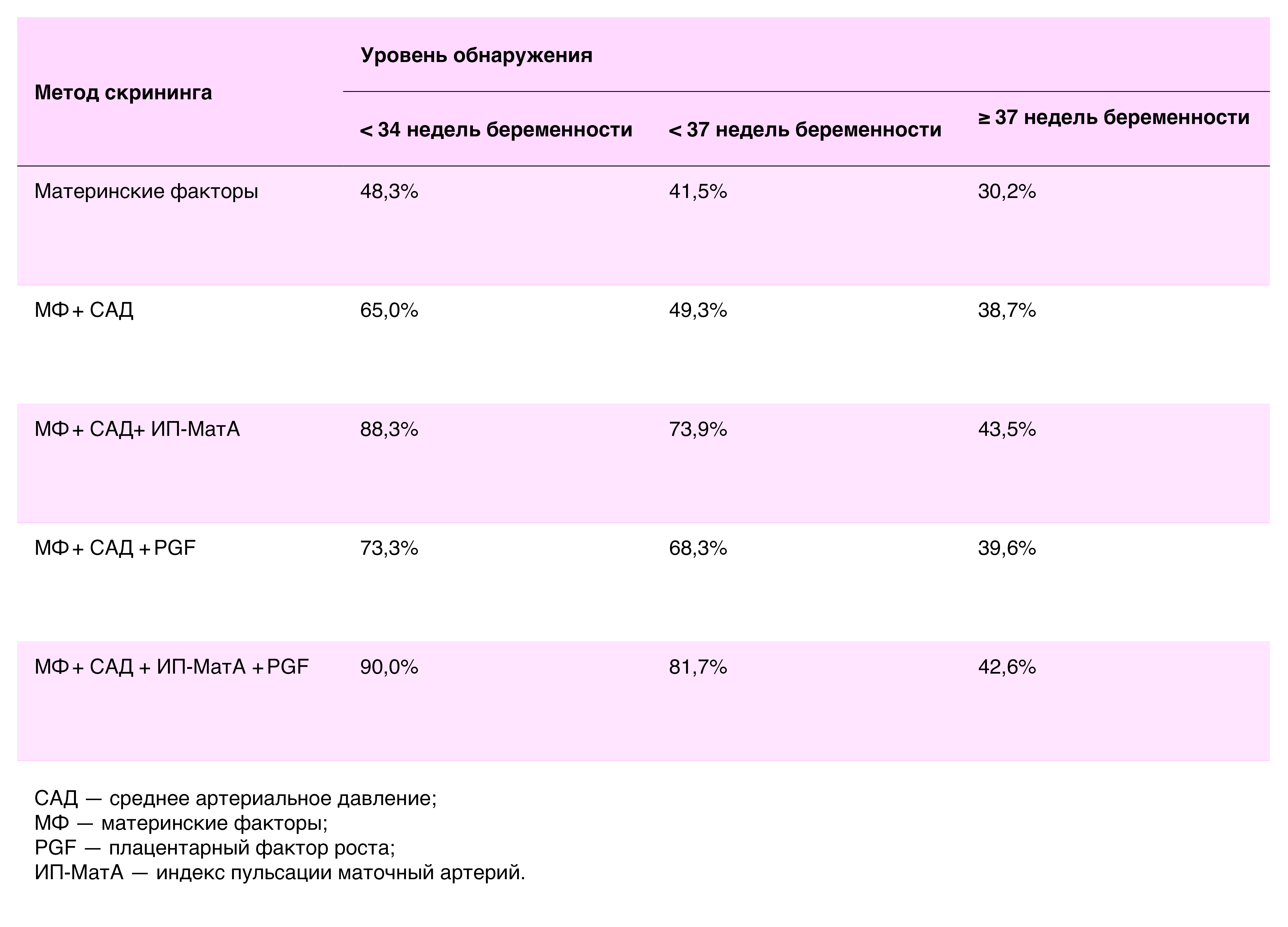
NICE и ACOG опубликовали рекомендации по оценке риска, основанные на характеристиках матери и истории болезни, например, хронической гипертонии в анамнезе (таблица 1). Модель конкурирующих рисков Фонда медицины плода (FMF) [248, 249] для оценки индивидуального риска развития преэклампсии включает возраст матери, этническую принадлежность, вес и рост, медицинский и акушерский анамнез, среднее артериальное давление, индекс пульсации маточной артерии при УЗИ и уровень PGF в материнском кровотоке на сроке 11–13 недель беременности. Эти два подхода к скринингу оценивались в исследовании Программы скрининга преэклампсии Национальной службы здравоохранения Великобритании (SPREE), в котором приняли участие 16 747 пациентов[14]. При уровне положительных результатов скрининга 10% (где 10% исследуемой популяции считались подверженными высокому риску, согласно критериям NICE) уровень выявления преждевременной преэклампсии составил 41% при использовании системы оценки риска, рекомендованной NICE, в то время как при скрининге на основе модели конкурирующих рисков FMF величина достигала 82% [15]. Скрининг FMF особенно эффективен при преждевременной преэклампсии: он позволяет выявлять ~ 90% женщин, у которых преэклампсия разовьется на сроке < 34 недель беременности, и ~ 80% женщин, у которых это произойдет на сроке < 37 недель беременности [250]; но удается выявить только 44% женщин, у которых преэклампсия разовьется на сроке беременности ≥ 37 недель [15]. ISSHP и Международная федерация гинекологии и акушерства (FIGO) теперь рекомендуют, где это возможно, комбинированный скрининг с алгоритмом FMF [251]; однако во многих странах мира УЗИ маточных артерий и анализы PGF рутинно не проводятся. Было обнаружено, что протокол поэтапного скрининга с первоначальным скринингом материнских факторов риска (характеристики матери, история болезни и артериальное давление) с последующим УЗИ маточной артерии или анализом PGF только у женщин с положительным риском дает аналогичный уровень выявления [250] (Таблица 2).
Таблица 2 | Сравнение показателей выявления преэклампсии при скрининге в первом триместре с фиксированным уровнем ложноположительных результатов 10% [15]
Инструмент скрининга преждевременной преэклампсии FMF в первом триместре прошел обширную проверку в нескольких различных сообществах по всему миру. Исследования по его внедрению показали значительное снижение частоты преждевременной преэклампсии и улучшение материнских и перинатальных исходов в Великобритании [15] и Австралии [252], а подход «скрининг и лечение», основанный на алгоритме FMF, кажется весьма экономически эффективным [253], и в настоящее время он рекомендуется различными учреждениями [13, 251, 254].
Разрабатываемые скрининговые тесты
Скрининг с помощью аналогичного прогностического подхода, опубликованного FMF, на сроке 19–24 недель беременности женщин, у которых в первом триместре был низкий риск или которые пропустили скрининг в первом триместре, позволяет выявить почти всех женщин, у которых преэклампсия разовьется к 32 неделям, и до 90% женщин, у которых это произойдет между 32 и 35 (+6 дня) неделями беременности [255, 256]. Это можно использовать для стратификации женщин, нуждающихся в интенсивном наблюдении на сроке 24–31 (+ 6 дней) недели беременности, и женщин, которым требуется повторная оценка на сроке 35–37 недель беременности [255] (рис. 3).
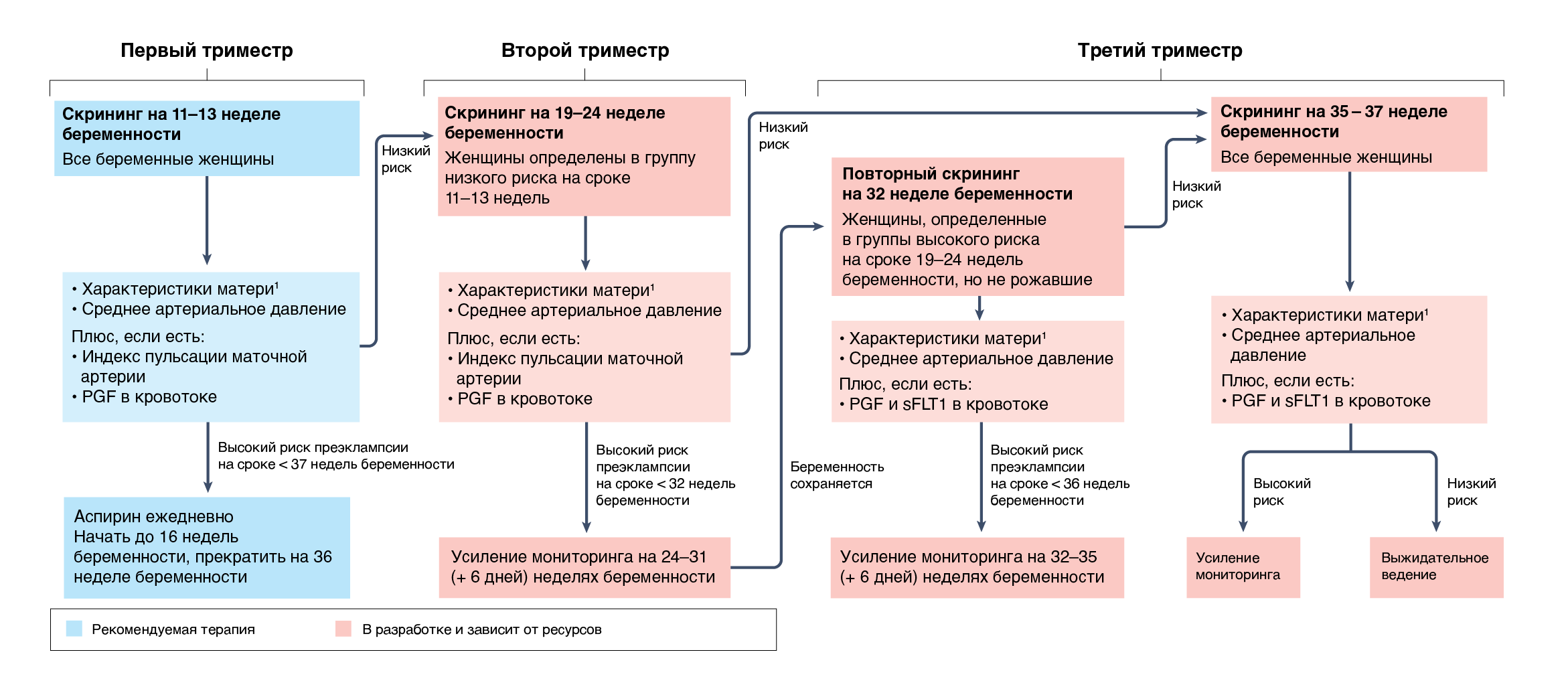
1 — Характеристики матери: возраст, ИМТ, курение, преэклампсия в анамнезе матери беременной, способ зачатия, сопутствующие заболевания (например, хроническая гипертензия, диабет первого или второго типов, системная красная волчанка, антифосфолипидный синдром) и акушерский анамнез. PGF — плацентарный фактор роста; sFLT1 — soluble Fms-related receptor tyrosine kinase 1 (растворимая рецепторная тирозинкиназа 1, родственная Fms).
Прогнозирование доношенной преэклампсии на сроке 35–37 недель беременности (рис. 3) позволяет выявить до 85% всех женщин, у которых преэклампсия разовьется на сроке > 36 недель [250, 257]. Когда в алгоритм прогнозирования была включена этническая принадлежность, скрининг имел более высокую прогностическую силу для афро-карибских женщин (88%), чем для белых женщин (66%) в Лондоне [258]. Скрининг на 35–37 неделе беременности включает sFLT1 в кровотоке матери, но не содержит индекс пульсации маточных артерий, поскольку он бесполезен для выявления женщин с высоким риском развития преэклампсии на сроке > 36 недель беременности [258].
Поскольку прогнозирование преждевременной преэклампсии достаточно эффективно, в настоящее время срочно необходимы новые методы прогнозирования риска доношенной преэклампсии. Небольшое исследование с использованием машинного обучения для агрегирования характеристик материнского организма и лабораторных показателей второго и третьего триместров выявило 77,1% случаев преэклампсии с поздним началом (частота ложноположительных результатов 0,9%) [92]. Наиболее влиятельными переменными были систолическое артериальное давление, мочевина в сыворотке, азот, калий, кальций и креатинин, количество тромбоцитов и лейкоцитов, а также белок в моче [92]. Однако это результаты этого исследования не подтверждены в других когортах. Другие потенциальные факторы, которые могут улучшить прогнозирование преэклампсии с поздним началом, но требующие проверки в больших когортах или метаанализах, включают HtrA3 в кровотоке во втором триместре [259], бесклеточную РНК [260, 261] и ELABELA [262] и програгулин [263] в кровотоке в третьем триместре.
Профилактика
Связанные с преэклампсией серьезные краткосрочные и пожизненные риски для здоровья как матери, так и ребенка подчеркивают необходимость поиска новых методов профилактики преэклампсии. Для выявления групп пациентов, которым могут быть полезны различные разрабатываемые профилактические методы лечения, необходимы многоцентровые исследования с адекватной статистикой.
Профилактическая терапия с хорошей доказательной базой
Еще давно для предотвращения преэклампсии предлагали использовать аспирин. Несмотря на опубликованное в 1985 г. рандомизированное исследование, показавшее, что профилактический прием аспирина приводит к значительному снижению частоты преэклампсии, ЗРП и мертворождения у женщин из группы высокого риска [264], дальнейшие исследования были весьма неоднородными в отношении дозы аспирина, времени начала курса и, что важно, метода, используемого для отбора женщин из группы повышенного риска [265–267]. Метаанализ данных отдельных участников позволил заключить, что аспирин обеспечивает статистически значимое, но клинически умеренное снижение риска преэклампсии на 10% [268]. Более поздний метаанализ показал, что аспирин очень эффективен в предотвращении преждевременной преэклампсии, если его назначать женщинам из группы высокого риска, начиная с срока беременности до 16 недель [268] (рис. 3). Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование «Аспирин для профилактики преэклампсии» (ASPRE) с участием 1776 женщин из группы высокого риска, выявленного с помощью комбинированного скрининга с алгоритмом FMF, предоставило дополнительные убедительные данные о том, что ежедневный прием аспирина с первого триместра снижает риск преждевременной преэклампсии на 62% (95% ДИ 20–80%) без существенного влияния на частоту доношенной преэклампсии [7].
Метаанализ 30 исследований показал, что низкие дозы кальция в виде пищевых добавок вдвое снижают риск преэклампсии (как с ранним, так и с поздним началом) у женщин с высоким риском развития преэклампсии и с низким потреблением кальция с пищей [269], и поэтому такие добавки рекомендуются, согласно руководствам ISSHP.
Кроме того, для снижения вероятности гестационной гипертензии и преэклампсии руководства ISSHP рекомендуют физические упражнения [2]. Метаанализ 27 исследований показал, что упражнения продолжительностью не менее 260 метаболических эквивалентов минут задания в неделю снижают вероятность развития преэклампсии на 25% [65].
Разрабатываемые методы профилактики
Многоцентровое исследование с участием 6000 нерожавших женщин с низким риском, рандомизированных для индукции родов на 39 неделе беременности или для выжидательного наблюдения, показало, что индукция родов снижает риски неблагоприятных исходов, включая гипертензивные расстройства во время беременности [270]. Необходимы дальнейшие исследования, чтобы определить, снижает ли рутинная индукция заболеваемость самой преэклампсией и уменьшает ли она отдаленные неблагоприятные исходы для матери и ребенка.
Правастатин — это пероральный статин, применяемый для снижения уровня холестерина ЛПНП и триглицеридов, который также обладает противовоспалительным действием. Исследование с участием 173 женщин с высоким риском развития преэклампсии показало, что ежедневный прием правастатина со второго триместра (14–20 недель беременности) до родов значительно снижает частоту преждевременной преэклампсии (13,8% по сравнению с 26,7% в контрольной группе). и преждевременных родов [271]. Правастатин может быть неэффективен для предотвращения доношенной преэклампсии: не наблюдалось снижения частоты доношенной преэклампсии ни в этом [271], ни в другом исследовании с участием 1120 женщин с высоким риском развития доношенной преэклампсии, принимавших правастатин ежедневно с 35–37 недель беременности до родов [272].
Метформин представляет собой пероральный инсулино-сенсибилизирующий и сахароснижающий препарат, широко назначаемый во время беременности при гестационном сахарном диабете. Метаанализ, в котором использовались данные исследований, в которых метформин назначался при других заболеваниях и участницы которых забеременели, выявил снижение вероятности преэклампсии [273]. В рандомизированном контрольном исследовании одноплодной беременности, в котором женщины с ИМТ > 35 кг/м2 получали метформин ежедневно в течение 12–18 недель до родов, наблюдалось значительное снижение частоты преэклампсии (ОШ 0,25, 95% ДИ 0,1–0,61) и сообщалось о значительном уменьшении прибавки веса во время беременности [274].
Метаанализ с участием 313 женщин из трех рандомизированных контролируемых исследований показал, что ежедневный прием добавок витамина D значительно снижает риск преэклампсии (ОР 0,29, 95% ДИ 0,09–0,95) [275]. Другой метаанализ с участием 2464 женщин из 13 исследований выявил значительное снижение частоты преэклампсии при профилактическом применении низкомолекулярного гепарина, начатом до 16 недель беременности [276]; однако руководства ISSHP в настоящее время не рекомендуют гепарин [2].
Ведение беременности
При беременности, осложненной преэклампсией, интересы матери и плода конкурируют. Для матери выход плаценты облегчит симптомы (вставка 2); однако это может вызвать преждевременные роды и связанные с этим осложнения недоношенности у новорожденного. Ведение преэклампсии до срока родов (рис. 4) требует терапии повышенного кровяного давления у матери с целью предотвращения тяжелых исходов у матери и продления беременности с наблюдением за здоровьем плода и сроками родов, чтобы обеспечить наилучший исход как для матери, так и для новорожденного.

АПФ — ангиотензинпревращающий фермент; БРА — блокатор рецепторов ангиотензина II; IV — внутривенно.

Общая терапия для всех подтипов заболевания
Гипертония служит преобладающим диагностическим признаком преэклампсии и обычно усугубляется с увеличением срока беременности. Тяжелая гипертензия (≥ 160/110 мм рт. ст.) может привести к внутримозговому кровоизлиянию, эклампсии и отслойке плаценты, и ее следует лечить при любых обстоятельствах [277]. Целью терапии является снижение артериального давления до целевого диапазона 140–155/90–105 мм рт. ст. [277].
Пероральные противогипертонические препараты
Хотя в острой ситуации могут быть показаны внутривенные антигипертензивные препараты, для лечения гипертонии во время беременности широко применяются пероральные препараты, которые обычно включают метилдопу, лабеталол и нифедипин. Эти агенты, как правило, доступны даже в условиях ограниченных ресурсов. В недавнем многоцентровом открытом рандомизированном контролируемом испытании в параллельных группах сравнение этих трех препаратов (почасовые дозы нифедипина или лабеталола или суточная доза метилдопы) показало, что, хотя в монотерапии нифедипин приводил к более высокой частоте контроля артериального давления (систолическое давление 120–150 мм рт. ст. и диастолическое давление 70–100 мм рт. ст.) в течение шести часов, все три препарата являются потенциально целесообразными первоначальными вариантами для терапии тяжелой гипертонии во время беременности [278].
Нифедипин представляет собой антагонист кальциевых каналов и вызывает расширение периферических сосудов. Он начинает действовать быстро [279], и женщины могут жаловаться на сильные головные боли (особенно в первые 24 часа), головокружение, приливы крови к лицу, сердцебиение и нарастающий отек лодыжек. Первоначально для быстрой коррекции тяжелой гипертонии во время беременности поддерживалось сублингвальное введение препарата, но у небеременных взрослых наблюдались значительные побочные эффекты, также возможен острый дистресс плода из-за снижения плацентарного перфузионного давления [280].
Лабеталол блокирует β1-, β2- и α1-адренергические рецепторы и снижает периферическое сосудистое сопротивление [281]. Это отрицательный инотроп, который может способствовать отеку легких и сердечной недостаточности. Он может вызвать бронхоспазм, и лабеталола следует избегать женщинам с астмой в анамнезе. Женщины могут жаловаться на головные боли и тошноту, особенно в течение первых 24 часов применения. Пиковые дозы в плазме достигаются в течение двух часов после перорального приема, а максимальный эффект проявляется в течение 48 часов.
Метилдопа — симпатомиметик центрального действия, действующий как агонист α2-адренергических рецепторов. Женщины обычно сообщают о чувстве вялости и сонливости, особенно в течение первых 72 часов приема; кроме того, метилдопа может усугубить депрессию [282]. Пиковые дозы в плазме достигаются через шесть часов после перорального приема, а максимальный эффект достигается через 72 часа, что при острых проявлениях потенциально делает более полезными другие терапевтические стратегии. Резкое прекращение приема (после длительного применения) может вызвать рикошетную гипертонию.
Процедуры при легкой гипертонии
Ранее высказывались опасения, что агрессивное лечение легкой гипертонии во время беременности (определяемой в большинстве юрисдикций как артериальное давление ≥ 140/90 мм рт. ст.) может повлиять на плацентарный кровоток, что приведет к увеличению распространенности неблагоприятных перинатальных исходов. Два рандомизированных контролируемых испытания, посвященных этим проблемам, продемонстрировали, что это не так и что поддержание артериального давления < 140/90 мм рт. ст. улучшает исход для матери и потенциально для ребенка [59, 283] (таблица 3). Испытания по контролю гипертонии во время беременности CHIPS (The Control of Hypertension In Pregnancy Study; включавшее женщин с хронической и гестационной гипертонией) и CHAP (Control of Hypertension And Pregnancy; включавшее женщин с хронической гипертонией) имели некоторые различия, но пришли к схожим выводам. В исследование CHIPS преимущественно набирались женщины с артериальной гипертонией > 140/90 мм рт. ст. на сроке 14–33 недель беременности (75% с хронической гипертонией; 25% с гестационной гипертонией) [283]. Вмешательство включало распределение женщин в две разные целевые группы по диастолическому артериальному давлению (<85 мм рт. ст. и <100 мм рт. ст.) для определения влияния более высокого диастолического артериального давления на исходы беременности. Первичным показателем результата была совокупность перинатальной смертности и значительной госпитализации новорожденных, без существенных различий между группами. Основным результатом было снижение частоты тяжелой гипертонии в группе с < 85 мм рт. ст., что подтверждает вывод об отсутствии очевидной пользы от более мягкого контроля, учитывая известную связь между тяжелой гипертонией и тяжелой материнской заболеваемостью и смертностью.
Таблица 3 | Сравнение результатов исследований CHIPS [283] и CHAP [59]
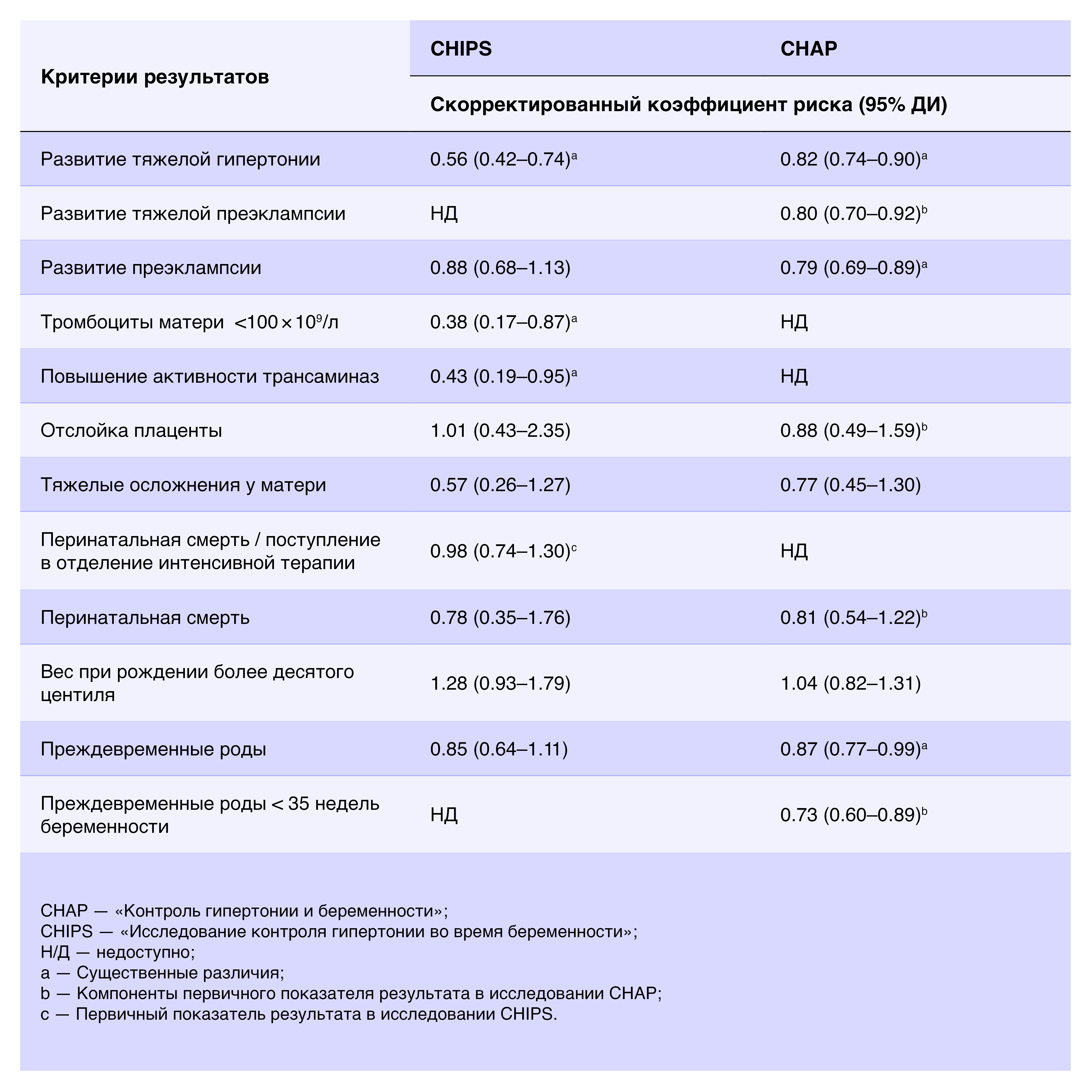
Напротив, исследование CHAP было ограничено женщинами с хронической гипертонией, у которых манифестация была на сроке менее 23 недель беременности [59]. Вмешательство включало лечение гипертонии >140/90 мм рт. ст. в отличие от контрольной группы, которая получала противогипертонические препараты только в том случае, если их артериальное давление было ≥160/105 мм рт. ст. Частота событий, связанных с первичными исходами (малая масса тела при рождении для гестационного возраста, серьезные материнские осложнения, тяжелые неонатальные осложнения, преэклампсия и преждевременные роды), была значительно ниже в группе активного лечения, чем в контрольной группе.
Результаты этих двух исследований дополняют друг друга и предполагают, что агрессивный подход к лечению легкой гипертонии во время беременности приводит к снижению морбидности у матерей, не влияя на безопасность плода. Потенциальное уменьшение частоты преждевременных родов на самом деле может быть полезным для плода. Описанные испытания подтверждают метаанализ, в котором рассматривалось использование противогипертонических препаратов во время беременности [284]. Из этого метаанализаа также следует вывод, что у женщин с легкой и умеренной гипертонией во время беременности лабеталол или нифедипин могут быть предпочтительнее по сравнению с метилдопой [284].
Плановые роды
Клиническое испытание HYPITAT-I (The Hypertension and Preeclampsia Intervention Trial At Near Term-I) показало значительное снижение неблагоприятных материнских исходов при активном ведении (индукции родов) по сравнению с выжидательным наблюдением за женщинами с гестационной гипертонией или легкой преэклампсией на сроке > 36 недель беременности. Из него был сделан вывод, что таким женщинам следует рекомендовать индукцию родов [243]. Однако исследование HYPITAT-II показало значительное увеличение риска неонатального респираторного дистресс-синдрома при немедленных родах (индукция родов или кесарево сечение в течение 24 часов после рандомизации в группы исследования) по сравнению с подходом выжидательного наблюдения (продление беременности до 37 недель) у женщин с нетяжелой преэклампсией на сроке 34–37 недель беременности. В результате получен вывод, что целом безопасно и полезно продлевать беременность до 37 недель [244]. Напротив, исследование PHOENIX (Planned early delivery or expectant monitoring for late preterm pre-eclampsia, «Планируемые ранние роды или выжидательный мониторинг поздней преждевременной преэклампсии») [285] показало значительно меньшую частоту сопутствующих первичных материнских исходов, составляющих материнскую морбидность или зарегистрированное систолическое артериальное давление > 160 мм рт. ст., и достоверно более высокую частоту сопутствующих первичных перинатальных исходов (сочетание перинатальной смертности или госпитализации новорожденных) в группе плановых родов, по сравнению с группой выжидательного наблюдения из женщин с поздней преждевременной преэклампсией на сроке 34–37 недель беременности. Авторы рекомендовали обсудить этот компромисс между материнским и неонатальным прогнозом с пациентками, чтобы обеспечить возможность совместного принятия решений о сроках родов [285, 286].
Терапия для особых групп пациентов
Некоторые признаки и симптомы преэклампсии заслуживают особого внимания, включая несколько эпизодов постоянных или периодических головных болей, зрительные скотомы (слепые пятна), тошноту/рвоту, боль в эпигастрии и тяжелую гипертонию, а также изменения лабораторных показателей, такие как повышение креатинина или печеночных трансаминаз, тромбоцитопению, а также изменения в тестах на рост плода и его состояние. Все это признаки и симптомы проявляются при особых состояниях, возникающих при преэклампсии, таких как эклампсия и HELLP-синдром. Если у женщины до беременности было хроническое заболевание, особенно гипертония, во время беременности часто возникают проблемы, требующие тщательного контроля артериального давления, начиная с ранних сроков беременности, включая смену лекарств.
Хроническая гипертония
Такие факторы, как увеличение возраста матери и ожирение, связаны с хронической гипертонией, от которой страдают примерно 2% беременных женщин [59]. Профилактика преэклампсии аспирином у этих женщин может быть менее эффективной; у них имеется значительный риск ряда неблагоприятных материнских и перинатальных исходов, включая более высокую распространенность «наложенной» преэклампсии (преэклампсия, осложняющая гипертонию, возникшую по другой причине), ЗРП и отслойку плаценты [287].
Ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина обычно используются для лечения гипертонии у небеременных женщин, но их применение связано с неблагоприятными исходами, включая ЗРП, маловодие, почечную недостаточность плода и мертворождение [288]. Ингибиторы ангиотензинпревращающего фермента также могут быть тератогенными и приводить к увеличению частоты сердечных аномалий, хотя неясно, зависит ли это от других факторов риска (таких как диабет). В идеале женщин, принимающих эти препараты, до беременности или к 12 неделе беременности следует перевести на пероральные противогипертонические средства с признанным профилем безопасности, такие как метилдопа, лабеталол и нифедипин [2].
Эклампсия
Первоначальное ведение пациенток с эклампсией должно заключаться в применении мер клинической стабилизации женщин в критическом состоянии (голодание, оксигенация, защита языка канюлей Геделя, венозный доступ, кровать с приподнятыми поручнями и в полусидячем положении). Пациентку желательно содержать в спокойной обстановке, но под тщательным наблюдением. Во всем мире в качестве средства для остановки и предотвращения судорог используется MgSO4 [289]; однако из-за повышенного риска кесарева сечения и побочных эффектов для матери требуется интенсивный клинический мониторинг. Поэтому разумно ограничить применение MgSO4 пациентками с эклампсией или «тяжелой» преэклампсией, как это определено в исследовании Magpie (160/110 мм рт. ст., 3+ протеинурия) или с несколько более низким порогом (150/100 мм рт. ст., 2 + протеинурия), если последняя сопровождается двумя и более признаками неминуемой эклампсии (головная боль, зрительные симптомы, клонус) [2, 290]. Необходимо контролировать график приема препарата и клинические признаки интоксикации магнием. Родоразрешение обычно показано при наличии эклампсии, особенно если срок беременности выше жизнеспособного в данных клинических условиях [291]. Если жизнеспособность беременности еще не достигнута, в похожих случаях можно использовать выжидательный мониторинг при условии строгого наблюдения [291]
HELLP-синдром
Случаи HELLP-синдрома очень серьезны, и обычно показано родоразрешение. У пациенток с неконтролируемым артериальным давлением и без предварительной терапии можно попытаться оптимизировать лечение; возможна ранняя повторная оценка лабораторных тестов (максимум в течение шести часов после поступления) и при наличии лабораторного и клинического улучшения — выжидательный мониторинг [291].
Послеродовое ведение
Американская кардиологическая ассоциация (AHA) [292] считает преэклампсию значимым фактором риска будущих сердечно-сосудистых заболеваний. Сеть по взаимодействию пациентов и поставщиков медицинских услуг по вопросам здоровья после преэклампсии (HAPPEN) дает рекомендации по информационным кампаниям (для пациентов и врачей первичной медико-санитарной помощи), а также по ежегодным физическим осмотрам и лабораторным исследованиям для всех женщин, перенесших преэклампсию [293], включая мониторинг артериального давления, расчет ИМТ и уровня глюкозы натощак или гемоглобина A1C для оценки риска непереносимости глюкозы и диабета. Эти рекомендации в целом соответствуют рекомендациям AHA и ACOG [25, 292]. Рандомизированное контрольное исследование с участием женщин с гестационной гипертонией или преэклампсией показало, что самостоятельное измерение артериального давления в течение шести месяцев после родов значительно снижает 24-часовое диастолическое артериальное давление через шесть месяцев (–4,5 мм рт. ст., 95% ДИ от –8,1 до –0,8) [294] и 3,6 года после родов (–7,4 мм рт. ст., 95% ДИ от –10,7 до –4,2) [295].
Качество жизни
Долгосрочные последствия для здоровья
Эффекты у женщин с преэкламптической беременностью
Хорошо известно, что преэклампсия служит фактором риска долгосрочных неблагоприятных сердечно-сосудистых, почечных и цереброваскулярных событий. Как следствие, женщины с преэклампсией с ранним и поздним началом в анамнезе имеют повышенный риск смерти от сердечно-сосудистых заболеваний в 5 и 1,65 раза, соответственно, по сравнению с женщинами, не имевшими в анамнезе преэклампсии [296]. Женщины, перенесшие преэклампсию с ранним началом, подвергаются более высокому риску сердечно-сосудистых и цереброваскулярных заболеваний, чем женщины, перенесшие преэклампсию с поздним началом [133, 297]. Чтобы улучшить эту ситуацию, в Бригамской женской больнице (Бостон, Массачусетс, США) недавно была разработана клиническая программа «Здоровье сердца для мам» с целью повышения осведомленности о профилактике сердечно-сосудистых заболеваний в будущем [293, 298]. Наблюдательные исследования также зафиксировали у женщин с преэклампсией в анамнезе 5–12-кратное увеличение риска развития терминальной стадии почечной недостаточности [299, 300]. В группах с преэклампсией женщины, у которых была преэклампсия с ранним началом, имеют более высокое бремя заболеваний почек, чем женщины с преэклампсией с поздним началом [297]. Преэклампсия также приводит к длительному нарушению когнитивных функций [301, 302] и неврологическим осложнениям, включая инсульт [303], поражение белого вещества головного мозга [304, 305] и синдром задней обратимой энцефалопатии [306]. Некоторые неврологические симптомы чаще встречаются при преэклампсии с ранним началом, чем в случае преэклампсии с поздним началом [304]. В отношении когнитивных нарушений остается неясным, существует ли разница между преэклампсией с ранним и поздним началом [302]. Недавно было выявлено влияние преэклампсии на злокачественные новообразования [307]. В метаанализе более пяти миллионов женщин преэклампсия в анамнезе была связана с более низким риском рака молочной железы (ОР 0,88, 95% ДИ 0,83–0,93) и повышенным риском рака яичников (ОР 1,82, 95% ДИ 1,16–2,85) [307].
Влияние преэкламптической беременности на ребенка
Долгосрочное влияние преэклампсии на здоровье ребенка в основном обусловлено ЗРП и преждевременными родами по медицинским показаниям [308]; таким образом, эти эффекты чаще всего связаны с преждевременной преэклампсией [309]. Было показано, что дети, которые на стадии плода пережили раннюю преэклампсию, более подвержены нарушениям функции сердечно-сосудистой системы [310] и гипертонии [311]. Кроме того, дети, рожденные после тяжелой преэкламптической беременности с ранним началом, подвергаются более высокому риску нарушения когнитивных способностей и нервно-психического развития [312].
Психосоциальные эффекты
Преэклампсия оказывает серьезное негативное воздействие на психосоциальный профиль женщин. Подобные эффекты связаны с тяжестью преэклампсии, сроками диагностики и исходами беременности. Результаты независимых наблюдательных исследований указывают на то, что диагноз тяжелой преэклампсии оказывает более негативное влияние на психическое здоровье и качество жизни, чем диагноз легкой преэклампсии [313–317]. В этом случае в группе пациенток с преждевременной преэклампсией диагноз тяжелой преэклампсии на сроке до 30 недель имеет худшие психосоциальные последствия, чем диагноз на 30–34 неделе беременности [315]. В трех независимых временных исследованиях изучали психологические эффекты, включая депрессию и посттравматическое стрессовое расстройство (ПТСР), в период от 6 до 12 недель после родов, и было зафиксировано общее снижение эффекта с течением времени [316–318]; однако психосоциальные последствия преэклампсии могут быть длительными. У женщин с ранней преэклампсией и преждевременными родами симптомы ПТСР регистрировались спустя семь лет после беременности [319]. Психосоциальные последствия преэклампсии также тесно связаны с исходами беременности. Неблагоприятные исходы, такие как перинатальная смерть и госпитализация в отделение интенсивной терапии новорожденных, оказывают значительное влияние на психологическое благополучие матерей [315, 316].
Перспективы
Остается еще много нерешенных вопросов и возможностей для улучшения профилактики и лечения преэклампсии, особенно доношенного варианта заболевания. Основным препятствием в этой области служит выявление плацентарной дисфункции задолго до постановки диагноза, что позволило бы разработать профилактические стратегии по ее устранению. Прогностические биомаркеры и лежащие в основе преэклампсии пути, запускаемые аномальным развитием/функцией плаценты, вероятно, формируются до постановки диагноза, и на сегодняшний день их трудно определить, даже несмотря на то, что были предприняты некоторые шаги для прогнозирования и предотвращения преждевременной преэклампсии. Одной из основных проблем служит то, что подтипы преэклампсии, особенно преждевременная и доношенная преэклампсия, скорее всего, имеют разную патофизиологию, однако многие исследования их не различают. Действительно, является ли аномальное развитие и функция плаценты причиной преэклампсии, еще предстоит экспериментально доказать. Исследование специфичных для плаценты продуктов, таких как микрочастицы, внеклеточная некодирующая РНК и внеклеточная ДНК, в материнской крови напрямую через ОВХ или косвенно через жидкие биопсии, может дать представление о нарушении функции плаценты, которая способна возникать при доношенной преэклампсии.
Для существенного прогресса в знаниях о патогенезе этого заболевания необходима разработка новых систем in vitro и in vivo для моделирования преэклампсии.
Животные модели
Не существует идеальной животной модели in vivo, которая могла бы полностью охватить все патофизиологические изменения, зарегистрированные при преэклампсии [320, 321], хотя доступны модели, имитирующие подтипы преждевременной и доношенной преэклампсии [321]. Эти модели служат полезными стратегиями для выявления механистической основы подтипов преэклампсии и тестирования новых методов терапии. Существующие модели включают спонтанные генетические модели (например, мыши BPH/5), трансгенных животных, включая плацентарноспецифичных трансгенных грызунов (например, sFLT1 [323], человеческий ренин/ангиотензин [324, 325], человеческий STOX1 [326], C1q –/– [327]), хирургически индуцированные животные модели (например, снижение перфузионного давления матки у грызунов [328] и перевязка маточных артерий у павиана [329]), фармакологически индуцированные животные модели (например, метиловый эфир Nω-нитро-L-аргинина (L -NAME) [330], липополисахарид [331]), животные модели с преэкламптической сывороткой человека или внеклеточными везикулами человека [332, 333] или животные модели, индуцированные экзогенным введением факторов, выделяемых плацентой (например, sFLT1 [179]). Примечательно, что изменение временных рамок воздействия позволяет фармакологически индуцированной модели преэклампсии L-NAME имитировать как недоношенную (воздействие с 4–8-го дня беременности), так и доношенную (воздействие с 8–14-го дня беременности) преэклампсию [334]. Эта модель использовалась для определения эффектов цитрата силденафила [335, 336], гидросульфида натрия [337], L-аргинина [338], омега-3 жирных кислот и витамина Е [339].
Человеческие модели ex vivo
Несмотря на значительный прогресс в разработке новых технологий, проблемы с определением подходящих терапевтических методов сохраняются. Гипертония и протеинурия у матери, наблюдаемые при преэклампсии, вызваны повышением тонуса и сопротивления сосудов [340]. Для исследования сосудистой реактивности и проверки потенциальных терапевтических вариантов [341], включая сульфорафан [342], в качестве подхода ex vivo используется проволочная миография артерий пациенток с преэклампсией или без нее. Двойная перфузия плаценты — еще один подход ex vivo, обычно применяемый для исследования преэклампсии в плацентарной ткани [343]. Как правило, собирают доношенные плаценты, и кровообращение плода и матери восстанавливают с помощью канюль, при этом уровень кислорода контролируют посредством подключения к газообменным устройствам [344, 345]. Изменение уровня кислорода позволяет исследовать преэклампсию как в условиях нормоксии, так и при гипоксии. Перфузионную среду также можно модифицировать — например, добавив гемоглобин для создания повреждений, подобных тех, что встречаются при преэклампсии, и вводя потенциальные реагенты для проверки терапевтического потенциала [345]. Кроме того, двойная плацентарная перфузия также позволяет собирать материнские перфузаты, которые можно использовать для определения выделяемых факторов и их участия в преэклампсии [346, 347]. Такие технологии позволят исследовать повреждение сосудов, которое приводит к преэклампсии.
Будущие направления
Секвенирование отдельных клеток — прекрасная возможность изучить гетерогенность клеточных реакций во время развития плаценты. Однако в настоящее время непонятно, как интерпретировать данные секвенирования РНК отдельных клеток плаценты, поскольку в ее состав входит синцитий — многоядерная единичная клетка, которая покрывает всю плаценту. Молекулярные взаимодействия во время развития плаценты помогут лучше определить сочетание секвенирования одиночных клеток с пространственной транскриптомикой и/или протеомикой. Благодаря разработке новых биоинформатических подходов для выявления молекулярных путей и клеточных взаимодействий, которые имеют решающее значение для развития как плаценты, так и преэклампсии, теперь также возможен мультиомный анализ. Тем не менее, остается необходимость в возможности пространственно картировать нарушение функции плаценты, которое способствует развитию заболевания. Одним из способов обойти эту проблему может быть использование недавно разработанных плацентарных органоидов [348]. Органоиды могут позволить моделировать болезненные состояния и могут быть полезны при определении реакций на потенциальные терапевтические средства, воздействующих на плаценту. Модели органоидов можно дополнительно расширить, включая в них клетки сосудов и иммунные клетки. Такие модели уже разрабатываются для других патологий, таких как злокачественные новообразования.
Хотя в понимании этиологии и патогенеза преэклампсии были достигнуты ощутимые успехи, в знаниях все еще существует множество пробелов, преодоление которых требуют совместных усилий ученых по всему миру. Частью подхода к борьбе с преэклампсией и ее значительными пожизненными последствиями как для матери, так и для ребенка должна стать профилактика. В частности, для оказания существенного влияния на профилактику и лечение преэклампсии необходимы обмен хорошо охарактеризованными клиническими образцами и проведение надежных крупных многоцентровых клинических исследований по изучению потенциальных терапевтических средств.
