Созревание нейронов: клеточные механизмы и видовые различия
Аннотация
Замедленное и продолжительное постмитотическое созревание нейронов человека по сравнению с нейронами других видов может способствовать развитию специфических для человека когнитивных способностей и неврологических расстройств. В этой статье авторы описывают механизмы созревания нейронов, данные о которых получены на основе модельных систем, чтобы понять особенности длительного созревания коры человека и видовые различия. Авторы рассматривают клеточные аспекты созревания нейронов, включая транскрипционные, эпигенетические и метаболические механизмы, а также внеклеточные аспекты, такие как роль активности и синапсов, действия глиальных клеток и вклад внеклеточного матрикса. В обзоре обсуждаются данные о видовых различиях в скорости биохимических реакций, существование предполагаемых эпигенетических часов созревания и участие как общих, так и модульных механизмов в видоспецифичных сроках созревания. Наконец, авторы предлагают подходы к измерению, улучшению и ускорению созревания человеческих нейронов в культуре, изучают взаимодействия между различными аспектами созревания и предлагают концептуальные модели для будущих направлений исследований.
Глоссарий
Бивалентные промоторы — промоторы, у которых окружающие гистоны несут как активирующие метки H3K4me2/3 (ди- или триметилирование лизина 4 в молекуле гистона 3), так и репрессивные метки H3K27me3 (триметилирование лизина 27 в молекуле гистона 3), которые, как полагают, подготавливают экспрессию генов, которые включаются на более поздних стадиях развития.
Внеклеточные факторы — факторы, берущие начало за пределами клетки (компоненты окружающей среды) и влияющие на свойства или реакции клетки.
Внутриклеточные факторы — факторы, которые возникают внутри клетки и сохраняются даже тогда, когда клетку удаляют из ее естественной среды.
Гены, регулируемые активностью, — гены, уровень экспрессии которых регулируется уровнем или паттернов активности нейронов. К ним относятся первая волна генов раннего ответа (также известная как гены немедленного раннего ответа) и вторая волна генов позднего ответа.
Гетерохрония — эволюционные изменения в сроках развития.
Гликолиз — метаболический путь, происходящий в цитоплазме, в котором клетки производят АТФ и лактат/пируват, способные в дальнейшем вступать на путь окислительного фосфорилирования. Этот путь менее эффективен для производства АТФ, чем окислительное фосфорилирование.
Кортикальная пластинка — термин для формирующихся слоев II–VI коры во время эмбрионального развития до того, как слоистая цитоархитектоника становится отчетливой.
Модификации гистонов — химические изменения (включая ацетилирование и метилирование) аминокислот в белках-гистонах, которые регулируют экспрессию генов и конденсацию хроматина.
Мультимодальные методы — методы характеристики клеток, сочетающие в себе два или более метода из разных категорий (например, молекулярный, структурный, функциональный и метаболический).
Неотенический — демонстрирующий сохранение ювенильных характеристик у половозрелого взрослого организма.
Нуклеосомы — белковые комплексы, каждый из которых состоит из восьми гистонов, вокруг которых обернута ДНК.
Окислительное фосфорилирование (ОФ) — метаболический путь, происходящий в митохондриях, при котором клетки используют продукты обмена глюкозы и кислорода для производства энергии в форме АТФ.
Созревание нейронов — процесс, в ходе которого постмитотические нейроны претерпевают молекулярные, метаболические, морфологические и функциональные изменения, участвуют в клеточных взаимодействиях (включая установление синаптических связей и миелинизацию) и достигают устойчивого фенотипа во взрослом мозге.
Субпластинка — переходный слой нейронов, расположенный между пролиферативной зоной и кортикальной пластинкой. Субпластинка обычно исчезает еще до рождения из-за миграции клеток и апоптоза, а оставшиеся клетки становятся нейронами слоя VIb.
Топологически ассоциированные домены (TAД) — единицы организации генома, внутри которых уровень взаимодействия хроматина более высокий, чем снаружи от них, что определяет границы петлевых взаимодействий между энхансерами и промоторами.
Трансрегуляторные механизмы — механизмы, в которых трансрегуляторные факторы координируют активность больших наборов генов.
Факторы транскрипции — белки, которые связываются с ДНК посредством энхансеров и/или промоторов для регулирования экспрессии генов; пример трансрегуляции.
Хроматин — комплекс, присутствующий в ядре клетки и содержащий ДНК и связанные с ней белки, которые организуют, упаковывают и регулируют репликацию ДНК и экспрессию генов.
Цисрегуляторные механизмы — механизмы, в которых цисрегуляторные элементы контролируют экспрессию отдельных близлежащих генов на хромосоме.
Энхансеры — геномные элементы, дистальные по отношению к промоторам генов, которые регулируют уровень и/или вероятность экспрессии генов; пример цисрегуляторных элементов.
Введение
Последние шесть миллионов лет эволюции человека как вида кардинально изменили размер и сроки развития человеческого мозга. Одновременно с этим у людей развились расширенные способности к поведенческой гибкости, долгосрочному планированию и общению. Исследования людей с ранним повреждением головного мозга, врожденным отсутствием определенных областей мозга или людей с врожденной карликовостью, имеющих нормальные когнитивные способности [1, 2], подчеркивают, что сам по себе размер мозга не может объяснить когнитивные преимущества человека. По этой причине понимание того, как протекает длительное (по сравнению с другими приматами) развитие мозга у человека, может иметь решающее значение для выявления его уникальных преимуществ и уязвимостей.
Более продолжительный период развития мозга у человека включает в себя не только более длительный нейрогенез [3–8], но и долгий период постмитотического созревания нейронов, который продолжается в детстве, подростковом возрасте и юности. Авторы настоящего обзора определяют созревание нейронов как процесс, посредством которого постмитотические нейроны претерпевают молекулярные, метаболические, морфологические и функциональные изменения; участвуют в межклеточных взаимодействиях (включая установление синаптических связей и миелинизацию) и достигают устойчивого фенотипа во взрослом мозге.
Хотя такое неотеническое созревание может быть вторичным или плейотропным последствием отбора на больший размер мозга [9], оно могло возникнуть вследствие того, что социальное и культурное развитие человека благоприятствует более длительному периоду повышенной пластичности мозга и обучения [10]. Однако наряду с этими предлагаемыми адаптивными преимуществами, медленное созревание нейронов может делать людей уязвимыми перед рядом уникальных опасных состояний, примером которых служат нарушения нервного развития, которые проявляются в раннем детстве (например, расстройства аутистического спектра) или подростковом возрасте (например, шизофрения). Таким образом, характеристика молекулярных и клеточных механизмов созревания нейронов может иметь решающее значение для понимания эволюционной специализации человеческого мозга и разработки методов лечения неврологических расстройств.
По мере развития человека темп созревания нейронов снижается. Во время раннего эмбриогенеза человека самые ранние морфологические этапы растягиваются примерно в 2–3 раза по сравнению с таковыми у мышей [11], тогда как кортикальный нейрогенез продлевается примерно в 10 раз [12], а некоторые аспекты постмитотического созревания нейронов (миелинизация и синаптический прунинг) в префронтальной коре (ПФК) у людей длятся более чем в 100 раз дольше [13–15], чем у мышей. Для сравнения процессов развития у разных видов те или иные этапы можно согласовать с фазами жизненного цикла [16] (рис. 1), конкретными событиями в развитии нервной системы [17, 18] или картиной экспрессии генов [19, 20].
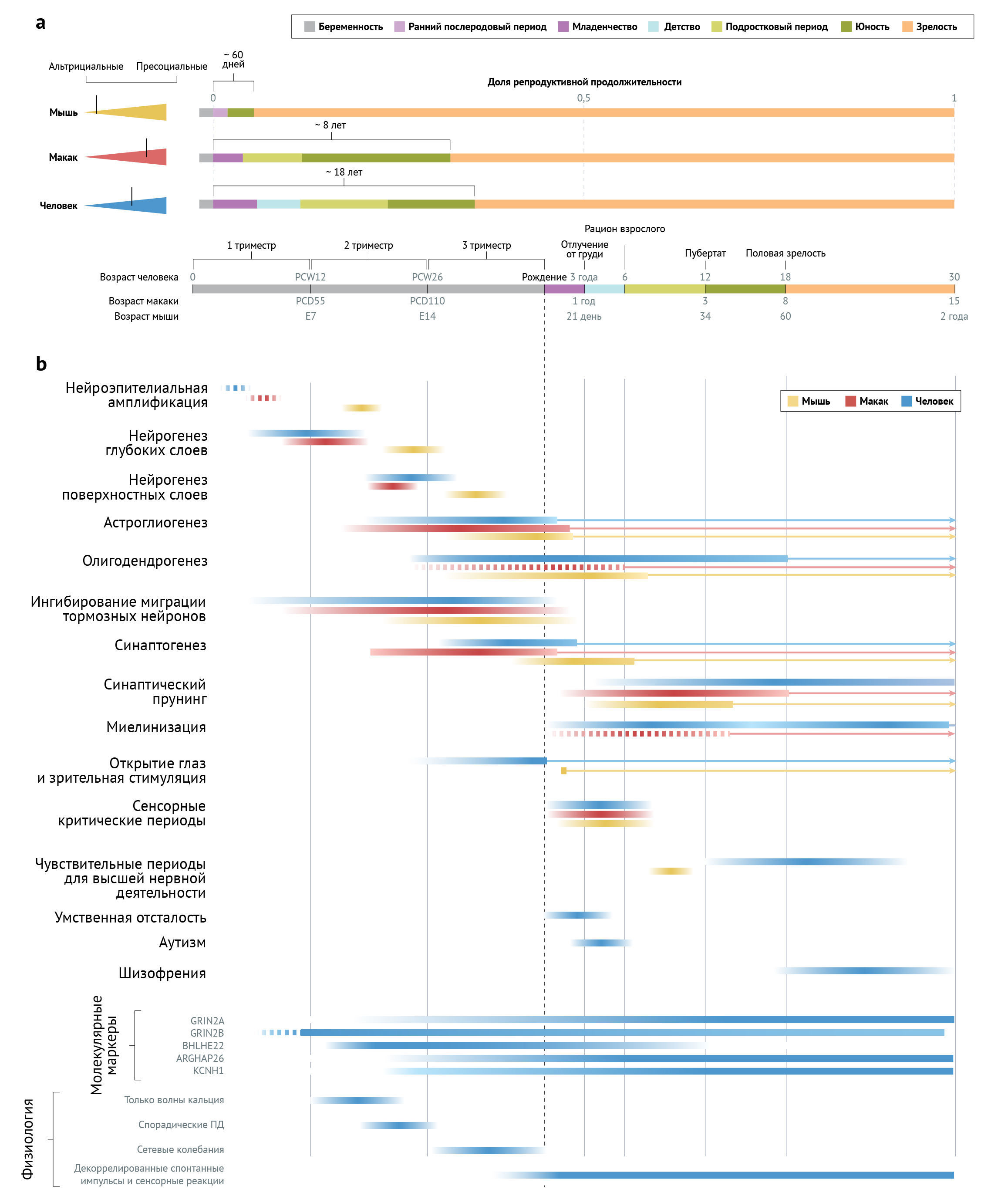
b. Сроки ключевых процессов развития мозга у мышей, макак-резусов и человека представлены цветными полосами, которые соответствуют стадиям жизненного цикла, указанным на верхней временной шкале [16, 205, 232] (абсолютные возрасты, соответствующие этим стадиям для каждого вида, показаны выше и ниже шкалы времени). Длина полос указывает на относительную долю определенной стадии жизни, необходимую для завершения каждого процесса. Таким образом, выравнивание подчеркивает особенности созревания, которые избирательно задерживаются и/или удлиняются у людей. Заштрихованные столбцы показывают степень и пик каждого процесса, а стрелки указывают на процессы развития, которые продолжаются на протяжении всей жизни. Обратите внимание, что мыши рождаются более альтрициальными, чем приматы, и поэтому ключевые пренатальные события у мышей происходят позже относительно рождения, несмотря на более высокую абсолютную скорость созревания. Сроки нейроэпителиальной амплификации у человека и макака-резуса приблизительно соответствует моменту закрытия нервной трубки [17, 18]. Сроки экспансии нейроэпителия у мышей и коркового нейрогенеза у всех видов указаны в [12, 233]. Сроки астроглиогенеза указаны в [234–236]. Сроки олигодендрогенеза у человека указаны в [22, 178] и у мышей — в [179]. Сроки олигодендрогенеза у макак-резусов неизвестны, но были интерполированы на основе сроков астроглиогенеза и миелинизации. Сроки миграции тормозных нейронов указаны в [30, 237, 238] и синаптогенеза (в лобной коре) — в [239–241]. Сроки синаптического прунинга в зрительной и префронтальной коре указаны в [15, 234, 242, 243]. У человека миелинизация протекает в две преобладающие фазы: от 0 до 8 лет и от 20 до 28+ лет [14]. График миелинизации у макак-резусов экстраполируется на основе данных, показывающих, что у шимпанзе 90% миелинизации завершается к моменту полового созревания [14], и что характер экспрессии генов указывает на плато миелинизации у макак-резусов по завершении детства [19]. Другие показанные события включают открытие глаз и начало зрительной стимуляции [244], сенсорные критические периоды для бинокулярного зрения и распознавания тонов [245–247] и чувствительные периоды когнитивного развития [248–250]. Показан типичный возраст при диагностике умственной отсталости, расстройств аутистического спектра и шизофрении у людей [234]. Также указано время экспрессии молекулярных маркеров созревания у человека [22, 44]. Наконец, проиллюстрированы физиологические показатели созревания нервных цепей [107, 251].
ПД — потенциал действия; Э — эмбриональные; ДПЗ — день после зачатия; НПЗ — неделя после зачатия.
В этом обзоре центральное внимание уделяется коре головного мозга, поскольку она особенно увеличилась в ходе эволюции, отличается по паттернам транскрипции [6, 21] от подкорковых областей мозга и медленно созревает по сравнению с ними. Важно отметить, что существуют общие, региональные и специфичные для каждого типа клеток механизмы, влияющие на скорость созревания. В пределах коры некоторые области созревают медленнее, чем другие (например, ПФК созревает гораздо медленнее, чем затылочная кора), а для некоторых подтипов нейронов характерно особенно длительное созревание (например, возбуждающие нейроны верхнего слоя коры (CExN, cortical excitatory neurons) созревают медленнее, чем CExN глубокого слоя [22, 23]; кортикальные тормозные нейроны, экспрессирующие парвальбумин (CInN, cortical inhibitory neurons), — медленнее, чем CInN, экспрессирующие вазоактивный интестинальный полипептид [22, 24]. Большинство данных, приводимых в обзоре, были получены в результате исследований CExN человека (hCExN) и CExN мыши (mCExN), но у CInN человека сходным образом увеличены сроки развития [25, 26].
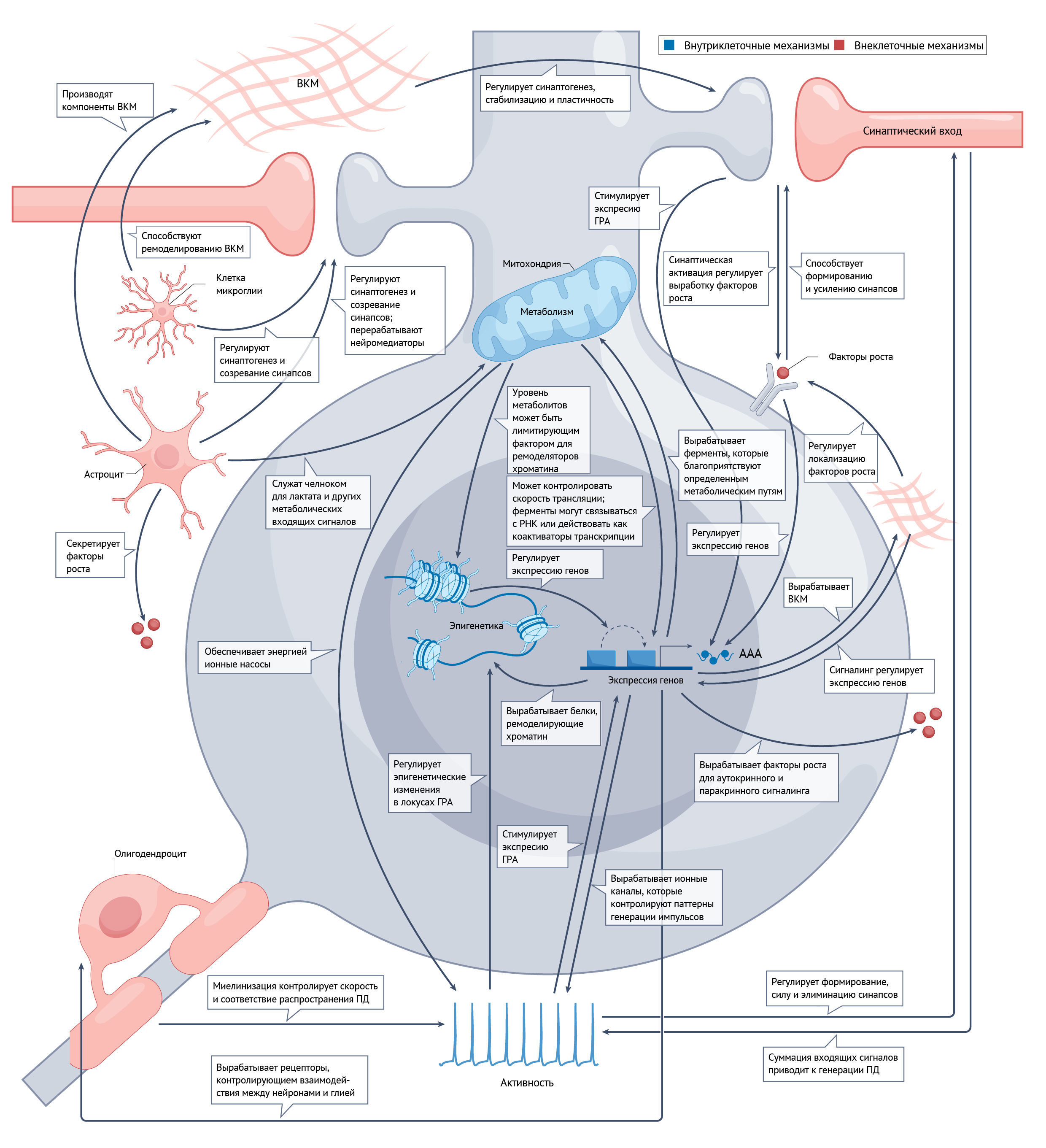
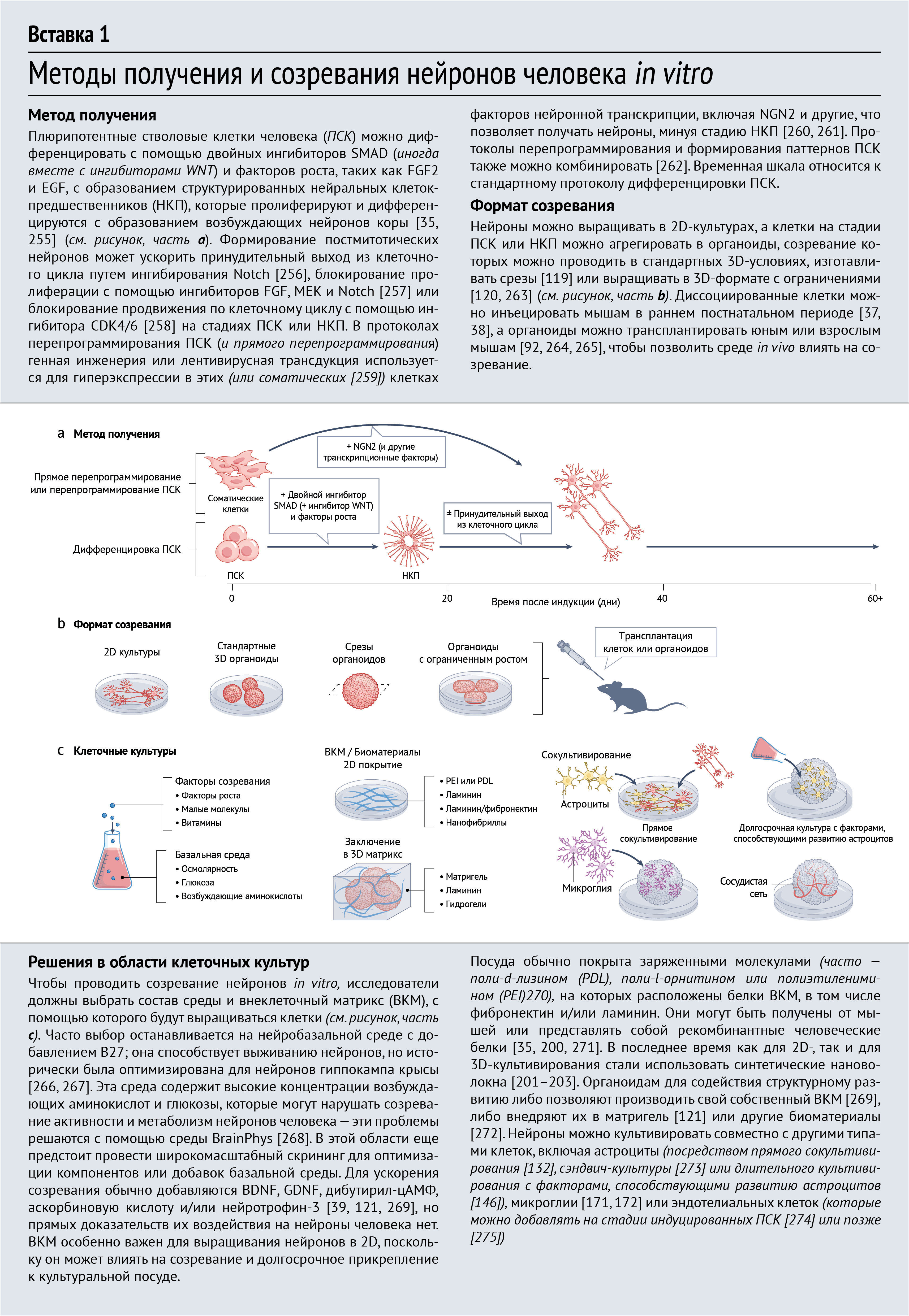
Поскольку понимание того, что каждый нейрон человека обладает отличительными транскрипционными [27–31] и физиологическими [32–34] характеристиками, растет, нейроны человека необходимо изучать, чтобы расшифровать механизмы, лежащие в основе их длительного созревания. Так или иначе, современные методы дифференцировки in vitro отражают те же медленные сроки развития, как и те, что характерны для организма человека in vivo [35–37] (Вставка 1). Таким образом, по практическим соображениям современные знания о биологическом процессе созревания нейронов во многом основаны на данных, полученных на модельных организмах. В настоящем обзоре объединены данные по моделям млекопитающих с фокусировкой на аспектах созревания, связанных с нейронами человека и/или явно изучаемых в них. Обсуждение различных компонентов созревания разделено в зависимости от преобладающего источника каждого механизма на разделы, посвященные внутриклеточным и внеклеточным факторам; при этом авторы отмечают, что многие аспекты могут включать компоненты обеих категорий, и существуют обширные взаимодействия (рис. 2). В ходе обсуждения подчеркивается механистическая основа новых методов для улучшения и/или ускорения созревания нейронов человека in vitro, что позволит изучать развитие человека на протяжении всей жизни и совершенствовать моделирование неврологических заболеваний. В обзоре рассматривается несколько фундаментальных вопросов: какие комбинации внутренних и внешних факторов формируют процесс созревания на каждой стадии развития, как на них влияют видовые различия и возможно ли этот процесс отклонить, ускорить или обойти?
Внутриклеточные аспекты созревания
Различные внутриклеточные механизмы, включая регуляцию генов и метаболизм, могут контролировать общий темп созревания и лежат в основе способности нейронов человека воспроизводить характерные черты длительного созревания in vitro и на моделях ксенотрансплантации [25, 36–39].
Транскрипция
Созревание нейронов включает в себя последовательность транскрипционных изменений, во время которых дочерняя клетка выключает гены пролиферации, вступает в фазу G0 клеточного цикла и начинает экспрессировать гены, кодирующие белки, необходимые для функции зрелого нейрона. Например, нейроны должны производить достаточный уровень потенциалзависимых натриевых и калиевых каналов, необходимых для инициации и поддержания реакций потенциала действия в ответ на стимуляцию, а также других ионных каналов, которые формируют кинетику потенциала действия [40]. Развитие синапсов, которое происходит в тандеме с таким изменением электрофизиологических свойств [41–43], включает в себя экспрессию различных субъединиц рецепторов нейромедиаторов на определенных стадиях развития [44] для контроля проницаемости синаптических рецепторов для кальция и кинетики синаптических ответов. Наконец, по мере созревания нейронов постепенно увеличиваются размеры перикариона (клеточного тела) и дендритного дерева, что приводит к необходимости экспрессии белков цитоскелета. Факторы транскрипции, специфичные для клеточного типа, вместе со специфичными для класса нейронов и паннейрональными факторами транскрипции координируют экспрессию специфических наборов белков, которые контролируют уникальную структуру, активность и профили сигнальных ответов различных типов нейронов [45].
Методы секвенирования РНК (RNA-seq) позволили создать атласы транскрипции с тканевым [19, 46, 47] и клеточным разрешением для областей мозга на различных стадиях эмбрионального и постнатального развития у грызунов и приматов, в том числе человека [19, 22, 23, 30, 31, 45, 48]. Эти атласы показывают, что многие транскрипционные различия между близкородственными типами клеток становятся заметными только после того, как нейроны становятся постмитотическими [30, 45, 48–50]. Экспрессия генов, участвующих в транспорте ионов, постепенно увеличивается от стадии плода до взрослой стадии в различных типах нейронов, тогда как гены, участвующие в развитии проекций нейронов и организации синапсов, имеют более специфичные для типа клеток паттерны экспрессии, достигая пика в CExN глубокого слоя раньше, чем в CExN верхнего слоя [22]. Важно отметить, что некоторые типы клеток могут различаться по паттернам транскрипции только на определенных стадиях развития [51] или в определенных субклеточных компартментах (таких как конус роста аксонов [52]). Таким образом, для отслеживания трансформации необходимы дальнейшие усовершенствования мультимодального анализа, включая интеграцию секвенирования РНК отдельных клеток, метод полногеномного оценивания степени открытости хроматина (ATAC-seq), пространственной транскриптомики и/или отслеживания линий. Они позволят отслеживать трансформацию и разветвленный переход исходных классов клеток в терминальные классы клеток, при этом повышая временное разрешение и учитывая индивидуальную изменчивость.
Сравнительные транскриптомные и протеомные исследования выявили различия в сроках молекулярных изменений у человека и других приматов, которые отражают различия в темпах созревания. К ним относятся задержка начала и продолжительная экспрессия синаптических генов [19, 53, 54] и генов, участвующих в миелинизации [19]. Полную последовательность клеточно-специфических транскрипционных изменений, происходящих в нейронах с эмбрионального возраста до зрелости, и их причинно-следственную связь с физиологией нейронов, структурным развитием и проекционными паттернами еще предстоит выяснить и связать со специфическими для человека генетическими и фенотипическими различиями.
Эпигенетика
Наряду с крупными изменениями в экспрессии генов в процессе развития меняются и эпигенетические механизмы, которые управляют локальной и глобальной структурой хроматина. Эти механизмы включают химические модификации ДНК, изменение упаковки ДНК в нуклеосомах (гистоны в которых могут быть химически модифицированы таким образом, что влияют на компактизацию хроматина), петлевые взаимодействия между энхансерами и промоторами, крупномасштабную организацию областей генома в топологически ассоциированные домены (ТАД) и физическое расположение ДНК внутри ядра в компартментах A («активном») или B («неактивном»), содержащих эухроматин и гетерохроматин, соответственно [55]. Относительная важность и причинные последствия этих уровней регуляции, а также взаимодействие между ними представляют собой направления активных исследований.
Переход от стволовой клетки к предшественнику и к постмитотическому нейрону сопровождают существенные перестройки структуры хроматина, включая консолидацию гетерохроматина в компартменте B и усиление взаимодействий внутри TAД, содержащих нейрональные гены [56]. По сравнению с генами, специфически экспрессируемыми в других типах клеток, нейрональные гены обычно располагаются в TAД, в которых плотность генов ниже, а некодирующие области длиннее [57]. Хотя значение организации TAД для регуляции экспрессии генов до сих пор неясно [58], присутствие внутри TAД большего количества энхансеров, приходящихся на один ген, потенциально может обеспечить более сложную регуляцию сроков и клеточной специфичности экспрессии генов [57]. Большая длина петель между энхансерами и промоторами нейрональных генов, важных для более поздних стадий созревания, также сильнее связана с экструзией петель, опосредованной когезинами [59]. Изменения в организации ТАД ассоциированы с изменениями экспрессии генов в эволюции человека [60].
В отдельных локусах взаимодействуют несколько эпигенетических механизмов, контролируя экспрессию генов во время созревания нейронов. Ландшафт глобально менее конденсированного хроматина в стволовых клетках во время дифференцировки постепенно переходит к специфичным для клеточного типа паттернам более плотно упакованного хроматина [61]. Факторы транскрипции способствуют конденсации или деконденсации хроматина, а некоторые из них могут даже иметь противоположные функции в разных локусах. Например, у человека FOXP2 подавляет экспрессию прогениторных генов в CExN субпластинки и глубокого слоя, но при взаимодействии с кофакторами NFI деконденсирует хроматин в генах, связанных с созреванием [62]. Было показано, что метилирование ДНК по цитозину в CpG-островках канонично подавляет экспрессию генов посредством привлечения к промоторам репрессивных факторов транскрипции, таких как MeCP2 [63]. Общий уровень метилирования CpG-островков устанавливается при рождении, но характер метилирования в определенных участках быстро меняется в младенчестве и детстве, а затем с идет с постоянной скоростью на протяжении всей взрослой жизни [64, 65]. Кроме того, в нейронах (в отличие от других типов клеток) после рождения усиливается не-CpG-метилирование (метилирование последовательностей CpA, CpT или CpC), которое в конечном итоге становится доминирующей формой метилирования [66]. Метилирование по CpA накапливается в телах генов, экспрессируемых на низких уровнях в раннем возрасте, и привлекает MeCP2 для точной настройки уровня экспрессии генов на протяжении всего последующего созревания нейронов, обеспечивая эпигенетический механизм, с помощью которого ранняя нейронная активность может иметь долгосрочные эффекты [67].
Модификации гистонов могут связывать эпигенетические изменения в отдельных локусах с изменениями в более масштабных взаимодействиях хроматина в процессе созревания. Различные обратимые модификации гистонов, такие как метилирование и ацетилирование, связаны с репрессией или активацией экспрессии генов в отдельных локусах. Большинство модификаций гистонов связаны как с записывающими ферментами (теми, которые их откладывают), так и со стирающими (ферментами, которые удаляют), с различной кинетической эффективностью. На уровне отдельных клеток есть данные, что определенные модификации гистонов подавляют экспрессию генов, контролируя разворачивание и компактизацию хроматина, и что скорость исчезновения этих модификаций контролирует начало экспрессии генов [68, 69]. Устранение модификаций гистонов может быть вызвано пассивным распадом в ходе множественных делений клеток или — в более короткие сроки — активностью «ластиков» [69] и обновлением нуклеосом [70] в постмитотических клетках. Таким образом, временное удаление репрессирующих модификаций гистонов может координировать экспрессию генных модулей, участвующих в созревании нейронов. В соответствии с этими предположениями в двух опубликованных исследованиях и одном препринте недавно сообщалось, что химическое ингибирование или CRISPR-опосредованный нокдаун некоторых репрессивных модификаторов хроматина ускоряет созревание ранних постмитотических CExN человека, полученных из плюрипотентных стволовых клеток (ПСК) (hPSC-CЕxNs) [71, 72] и нейронов мозжечка мыши [73].
Хотя модификации гистонов могут стабильно изменять экспрессию некоторых участвующих в развитии генов, другие гены (особенно те, которые имеют динамические паттерны экспрессии) контролируются отталкиванием и притяжением конкурирующих модификаций гистонов. Такие гены имеют бивалентные промоторы с сигнатурами хроматина, состоящими как из активирущих меток H3K4me2/3, так и из репрессирущих меток H3K27me374. И у мышей, и у людей количество генов с бивалентными промоторами велико в нервных клетках-предшественниках (НКП) и уменьшается в ходе развития нервной ткани [71, 73, 74]. Модификации двухвалентного состояния могут облегчить взаимодействие между внутриклеточными эпигенетическими механизмами и влияниями на развитие со стороны внеклеточных факторов. В частности, активность нейронов может стимулировать перестройки хроматина, включая изменения в метилировании ДНК [75] и открытие хроматина [76] для регуляции экспрессии генов. Во время развития mCExN многие гены раннего ответа (ERG) (подмножество генов, регулируемых активностью нейронов) демонстрируют двунаправленное переключение между уравновешенным двухвалентным состоянием и отчетливым «двусторонним» состоянием [77]. В последнем состоянии имеется дополнительная активная метка H3K27ac и больше открытых промоторных областей, при этом репрессивные метки все еще препятствуют активной элонгации мРНК. Это позволяет быстро активировать ERG в ответ на низкий уровень стимуляции, что может иметь решающее значение для усиления влияния активности нейронов на экспрессию генов на ранних этапах [77]. ERG в основном возвращаются в бивалентное состояние на более позднем этапе развития с более высокими порогами активации. Таким образом, эпигенетические механизмы могут объединить внутриклеточные и внеклеточные факторы и контролировать экспрессию генов во временной шкале, соответствующей медленным темпам созревания нейронов человека, а также быстрым временным масштабам пластичности, индуцированной активностью нейронов.
Эпигенетический контроль созревания важен для исследователей, выбирающих работу с человеческими клетками in vitro. Репрограммирование в индуцированных ПСК (иПСК) возвращает к исходному уровню многие аспекты эпигенетического состояния клетки независимо от возраста донора, тогда как прямое перепрограммирование из соматических клеток сохраняет эпигенетические метки, связанные со старением и заболеваниями [61, 78, 79], которые могут влиять на созревание нейронов in vitro [80]. В будущем предстоит выяснить, в какой степени старение представляет собой продолжение механизмов созревания и какие эпигенетические факторы являются причинами, а не последствиями обоих процессов.
Метаболизм
В ходе дифференцировки и созревания клетки должны перенастроить свой метаболизм для удовлетворения меняющейся потребности в энергии и биомолекулах. В целом клетки могут производить энергию непосредственно с помощью гликолиза или путем дальнейшей переработки продуктов гликолиза (лактата или пирувата) посредством окислительного фосфорилирования (ОФ) в митохондриях. Предполагалось, что в классическом случае при наличии кислорода клетки выбирают путь ОФ с более высоким коэффициентом полезного действия. Однако некоторые быстро делящиеся типы клеток, включая НКП, вместо этого преимущественно используют аэробный гликолиз для производства АТФ и побочных продуктов метаболизма, участвующих в синтезе ДНК и производстве макромолекул, — механизм, который, как считается, поддерживает продолжающуюся пролиферацию [81]. Постмитотические нейроны постепенно уменьшают свою зависимость от гликолиза, переключаясь на путь ОФ [82], который дает более высокий выход АТФ, необходимый для создания энергоемкого процесса — потенциала действия. В ходе развития изменяется количественное содержание почти 80% метаболитов головного мозга [83]; это позволяет предположить, что в процессе такого переключения задействуется множество метаболических путей. Например, набор крупных нейтральных аминокислот обеспечивает необходимые энергетические затраты для питания нейронов ОФ в mCExNs [83], прежде чем нейроны получают полную метаболическую поддержку от астроцитов. Мутации в транспортере этих аминокислот вызывают дефекты активности и постнатальный апоптоз нейронов слоев 2/3 у мышей и связаны с расстройствами аутистического спектра и микроцефалией у людей [83].
Морфология митохондрий во время дифференцировки и созревания нейронов также претерпевает радикальные изменения. Динамика митохондрий в течение первых нескольких часов после клеточного деления предсказывает идентичность дочерней клетки: усиленное слияние способствует самообновлению, тогда как деление или фрагментация митохондрий говорит о том, что клетка перейдет в постмитотическое состояние [84, 85]. Впоследствии длина, объем и сложность структуры митохондрий увеличиваются в тандеме с активностью ОФ и созреванием как mCExNs, так и hPSC-CexNs нейронов [86]. Созревающие нейроны регулируют экспрессию генов, участвующих в митохондриальном метаболизме, в зависимости от их потребностей в энергии и биомолекулах на тех или иных стадиях [82, 87].
Поскольку развивающиеся нейроны должны выполнять энергоемкие функции, такие как рост длинных нейритов и генерация потенциалов действия, неудивительно, что клеточный метаболизм может быть механизмом, контролирующим созревание нейронов. Баланс между субъединицами A и B лактатдегидрогеназы (ЛДГ) контролирует равновесие между лактатом (конечным продуктом гликолиза) и пируватом (который может дополнительно перерабатываться в OФ). Гиперэкспрессия ЛДГA предотвращает дифференцировку mCExNs [82], тогда как ингибирование ЛДГА ускоряет некоторые аспекты созревания hPSC-CexN [86].
Метаболизм также служит связующим звеном взаимодействия между внутриклеточными аспектами созревания и внешними факторами, такими как доступность питательных веществ, — это древняя связь, которая позволяет организмам координировать рост с условиями окружающей среды. Помимо своей классической биоэнергетической роли, ферменты и продукты метаболизма выполняют важную сигнальную функцию [81]. Например, некоторые гликолитические ферменты могут связываться с РНК или действовать как коактиваторы транскрипции [81]. Уровень нутриентов из пищи влияет на концентрацию промежуточных продуктов метаболизма S-аденозилметионина и ацетил-КоА, которые служат молекулярными донорами метильных и ацетильных групп и лимитирующими реагентами для ферментативных модификаций гистонов [88, 89]. Другие метаболиты могут действовать как кофакторы или ингибиторы ферментов, модифицирующих гистоны [90]. Большинство исследований метаболической регуляции эпигенетики и экспрессии генов были сосредоточены на модельных организмах или опухолевых клетках, оставляя неясной их роль в длительном взрослении человека. Учитывая эволюционные изменения в питании и метаболизме человека [91], это представляет собой интересную область будущих исследований.
Взаимодействие между метаболизмом и экспрессией генов развития имеет практическое значение для моделирования созревания нейронов in vitro. Исследования с применением RNA-seq показали, что метаболические гены по-разному экспрессируются в органоидах коры головного мозга человека и первичных hCExN, выращенных in vitro, по сравнению с типами клеток in vivo [92, 93]. На метаболизм может влиять состав среды; например, mCExN, выращенные в среде Brainphys с физиологическими концентрациями глюкозы, обладают более высокой активностью OФ, чем те, которые выращены в гипергликемической нейробазальной среде, которая может нарушать митохондриальный гомеостаз [94]. Смесь нескольких типов клеток, присутствующая в различных моделях in vitro, также может влиять на метаболизм нейронов, поскольку нейроны поглощают лактат, секретируемый астроцитами [81]. Интересно, что, как показало недавнее исследование, набор факторов, которые ускоряют созревание hPSC-CExNs in vitro, усиливает экспрессию генов, связанных как с гликолизом, так и с метаболизмом ОФ [72]. Чтобы интерпретировать этот результат и в дальнейшем оптимизировать созревание in vitro, необходимо больше узнать о метаболических путях, используемых нейронами человека в различных условиях и на разных стадиях развития.
Внеклеточные аспекты созревания
Хотя основные сроки и самые ранние этапы созревания, по-видимому, управляются внутренними факторами клетки, по мере того, как усиливается синаптическая связь между нейронами и дифференцируются глиальные клетки, все большее значение приобретают внеклеточные факторы.
Активность и синапсы
Активность (повышение уровня кальция, электрическая деполяризация и потенциалы действия) представляет собой внутреннюю реакцию нейрона на внешние стимулы. Поскольку созревающие нейроны обладают динамическими функциями входа-выхода (благодаря регулируемой в процессе развития экспрессии ионных каналов и морфологии), одни и те же входные сигналы на разных стадиях могут иметь различные эффекты. В процессе раннего развития активность нейрона регулирует его дифференцировку, выживание, миграцию, экспрессию генов и образование синапсов. Со временем активность постепенно начинает выполнять свою основную роль в обработке информации, сохраняя при этом роль в регуляции экспрессии генов и синаптической пластичности.
Способность генерировать спонтанное повышение уровня кальция, независимое от потенциала действия, демонстрируют уже постмитотические нейроны в процессе миграции [95]. Эта активность, вместе с внешними направляющими сигналами, контролирует темп миграции и окончательное расположение различных типов нейронов [96–98]. В раннем повышении уровня кальция участвуют сигнальные пути рецепторов γ-аминомасляной кислоты (GABAR), глициновых рецепторов и рецепторов N-метил-d-аспартата (NMDAR) [95], многие из которых могут быть внесинаптическими. Небольшой размер, высокое входное сопротивление и деполяризованный мембранный потенциал новых постмитотических нейронов позволяют этим сигналам оказывать существенный деполяризующий эффект, который дополнительно усиливается за счет входа кальция через потенциалзависимые кальциевые каналы L-типа (VGCC) [95]. Нейроны обладают множеством механизмов контроля пространственно-временных паттернов повышения уровня кальция и, таким образом, нижележащих сигнальных каскадов, включая селективную экспрессию, локализацию и привязку белков кальциевого сигналинга, а также расположение органелл, таких как митохондрии и эндоплазматический ретикулум, которые могут поглощать или выбрасывать кальций из внутренних запасов [95]. Эти механизмы, вероятно, контролируются в процессе развития [99], хотя детали этих процессов у млекопитающих все еще предстоит выяснить.
Важная роль ранней активности развивающегося мозга заключается в обеспечении идентичности терминального типа клеток. Факторы транскрипции, зависящие от активности нейронов, могут оказывать значимое влияние на усиление различий между близкородственными типами клеток [22, 100], поскольку они интегрируют пространственно-временные паттерны активности, передачу сигналов факторов роста и другие внешние факторы [101] с эффектами транскрипционных факторов, специфичных для конкретного типа клеток, и предсуществующим эпигенетическим ландшафтом. Этот процесс может происходить на стадиях развития, специфичных для конкретного типа клеток. Например, у мышей подтипы CExN слоя 5/6 формируются до открытия глаз, но для уточнения этого процесса в нейронах слоя 2/3 необходима зрительная активность (по крайней мере, частично посредством зависимой от активности экспрессии молекул синаптической адгезии) [23].
Переключение между спонтанной и сенсорной активностью в процессе развития было тщательно изучено в коре головного мозга, в которой этот процесс координируют переходные нервные цепи. Наиболее заметные из них обнаруживаются в субпластинке — временном слое рано возникающих, преимущественно возбуждающих, нейронов, расположенном под кортикальной пластинкой. У нейронов субпластинки раньше, чем у других нейронов коры, созревает способность запускать потенциал действия [102]. На ранних стадиях (17–23 недели после зачатия у людей) их спонтанная активность является редкой и асинхронной, обусловленной окружающими нейромедиаторами и спонтанным открытием полуканалов коннексонов [103], которые вызывают прямую деполяризацию, позволяя ионам перемещаться между внеклеточным пространством и цитоплазмой. На сопоставимых стадиях у грызунов CExNs напрямую связаны щелевыми соединениями (парные полуканалы, примыкающие друг к другу между двумя нейронами) [104, 105], хотя роль щелевых контактов у людей неясна [103]. По мере развития активность CExN становится более синхронизированной. В основном она состоит из всплесков потенциалов действия в субпластинке (наряду с ранними рекуррентными связями между CExN слоя 5, по крайней мере, у мышей [106]), которые помогают управлять кальциевыми волнами в кортикальной пластинке. Впоследствии субпластинку иннервируют таламические аксоны, а нейроны субпластинки образуют синапсы на CExN слоя 4. На более поздних стадиях аксоны нейронов субпластинки направляют аксоны таламуса непосредственно на иннервацию слоя 4, и двухступенчатая система переключения постепенно подвергается прунингу [107]. После рождения субпластинка исчезает вследствие программируемой гибели клеток, миграции и перехода нейронов субпластинки в глубокие слои CExNs [108], при этом у приматов ее остатки сохраняются и становятся интерстициальными нейронами белого вещества [109].
Исследования на мышиных моделях показали, что активность, обусловленная таламусом, важна для точного определения размера области коры [110], стабилизации и развития кортикальной пластинки [111] и содействия определению судьбы постмитотических нейронов в раннем постнатальном периоде у грызунов (у человека — третий триместр), особенно в поверхностных слоях коры [23, 112]. Внутри колонок неокортекса и между областями коры активность становится все более синхронизированной, поскольку между нейронами в кортикальной пластинке улучшаются синаптических связи, и они приобретают более зрелый набор ионных каналов, что обеспечивает регулярные потенциалы действия. Такая скоординированная активность создает отличительные электрофизиологические особенности, которые можно измерить у недоношенных детей [113] и которые в совокупности называются транзиторными явлениями спонтанной активности (SAT). SAT могут запускаться входными сигналами из таламуса или других областей коры. Паттерны активности на этой стадии контролируют выживаемость CExN и CInN в культуре [114] и in vivo [115, 116]. После рождения в паттернах активности младенцев постепенно начинает преобладать редкая, десинхронизированная активность во время продолжающейся обработки сенсорной информации, с менее частыми колебаниями, ограничивающимися определенными поведенческими состояниями. Соотношение возбуждения и торможения в развивающихся нервных цепях (контролируется скоростью миграции вставочных нейронов, синаптогенеза и созревания) определяет детали временных паттернов активности и может иметь решающее значение для регуляции критических периодов развития [117].
На более поздних стадиях развития зависимая от активности экспрессия генов важна для контроля разнообразных процессов созревания, включая наведение аксонов, развитие дендритов, синаптогенез и прунинг. Есть интригующие данные, указывающие на то, что изменения в регуляции генов, зависящих от активности, могут способствовать длительному созреванию нейронов у приматов. Например, ген OSTN экспрессируется в костной и мышечной тканях мышей, но у приматов приобретает энхансеры, зависящие от активности нейронов, и работает на ограничение роста дендритов в нейронах приматов [118].
Решающая роль активности в определении экспрессии генов, специфичных для конкретного типа клеток, судьбы клеток и синаптических связей представляет собой проблему для моделирования созревания нейронов человека in vitro. Паттерны активности устанавливаются внутриклеточными факторами, такими как экспрессия ионных каналов, но активность также влияет на синаптические связи и наоборот. Большинство современных культуральных систем не подразумевают стимуляцию, поэтому активность оказывается либо спонтанной, либо является результатом повторяющейся стимуляции в сети. Кроме того, отсутствие истинной многослойной структуры в большинстве органоидных протоколов (за исключением протоколов, которые ограничивают рост в 3D [119–121]), вероятно, ухудшает синаптическую специфичность [122]. Если соответствующие синаптические партнеры отсутствуют, нейроны образуют синапсы с другими доступными нейронами, в том числе сами с собой, формируя аутапсы (синапсы нейрона с самим собой — прим. перев.) [123]. Таким образом, хотя органоиды, созревающие в культуре в течение многих месяцев, могут проявлять некоторые паттерны активности, наблюдаемые у новорожденных младенцев [124, 125], это, вероятно, отражает особенности клеточного созревания, а не сходство сетевой структуры с развивающейся корой головного мозга. К счастью, существует множество способов усилить зависящую от активности передачу сигналов в культуральных системах человека. Недавнее исследование показало, что агонист VGCC, который стимулирует зависимую от активности экспрессию генов, ускоряет созревание hPSC-CExNs [72]. Связанные ассемблоиды (получаемые in vitro структуры более высокого уровня организации, чем органоиды — прим. перев.), содержащие нейроны, сходные с нейронами из подкорковых областей мозга [126], могут обеспечивать входные сигналы и постсинаптические мишени для нейронов коры, а физиологические паттерны стимуляции могут доставляться либо с помощью оптогенетики, либо через третий слой фоторецепторов, происходящих из ПСК, или входных сигналов сетчатки [127]. Такие усовершенствования на уровне цепей могут позволить более детально изучить взаимодействия между внутриклеточными и внеклеточными механизмами созревания, а также происхождение видовых различий.
Участие глии
Глиальные клетки оказывают важное внешнее влияние на развитие нейронов посредством секретируемых факторов и межклеточных взаимодействий. Согласно некоторым оценкам, экспрессия генов в клетках глии более специфична для человека, чем таковая у нейронов [21, 128] и, таким образом, она может быть важным внешним фактором, обусловливающим межвидовые различия в созревании нейронов.
Астроциты
Астроциты коры образуются после нейронов и созревают вместе с ними, играя роль в выживании нейронов, формировании синапсов и метаболической поддержке [129]. Давно известно, что астроциты in vitro секретируют факторы, которые способствуют выживанию нейронов [130] и синаптогенезу [131, 132]. Совсем недавно были идентифицированы специфические факторы, участвующие в синаптогенной активности астроцитов, в том числе несколько членов семейства секретируемых белков внеклеточного матрикса (ВКМ) тромбоспондинов [133, 134], которые опосредуют взаимодействия между нейронами и ВКМ. Другой белок, секретируемый астроцитами, SPARCL1, связывает нейрексины и нейролигины в синапсах [134] и участвует в формировании последних [135]. Астроцитарный нейролигин имеет решающее значение для образования возбуждающих синапсов [136]; также в недавнем препринте сообщается, что С-концевой фрагмент расщепленного нейрокана, выделяемый астроцитами, специфически способствует синаптогенезу соматостатин-положительных тормозных синапсов [137]. Эксперименты с культивируемыми mCExNs показывают, что прямой контакт с астроцитами способствует синаптогенезу более эффективно, чем кондиционированная астроцитами среда, что подразумевает взаимодействия между астроцитарным эфрином A3 и нейрональным EphA4 [138] и интегриновым сигналингом [139]. Помимо содействия образованию синапсов, астроциты также участвуют в их прунинге [140].
Большинство этих результатов получены на моделях грызунов, но астроциты человека имеют более сложную морфологию, отличную от грызунов экспрессию генов и измененные функциональные свойства [141], поэтому важно определить, какие из этих механизмов консервативны. Исследования коры головного мозга взрослых млекопитающих выявили по крайней мере три типа астроцитов [29, 142]: протоплазматические астроциты с радиальной морфологией, межламинарные астроциты (МЛА) с отростками, распространяющимися по всем колонкам неокортекса, и фиброзные астроциты в белом веществе. Морфология МЛA особенно различается у разных видов млекопитающих и наиболее сложна у приматов [142]. Один из подтипов МЛА — астроциты варикозной проекции — обнаруживаются только у людей и шимпанзе, хотя неясно, представляют ли они отдельный тип или переходное состояние [143]. Также неизвестно, как типы взрослых астроцитов связаны с подтипами, которые описаны во время развития [144], и какова их роль в регуляции различных аспектов и стадий созревания.
В недавних исследованиях изучали роль астроцитов человека в созревании нейронов. Совместное культивирование hPSC-CexN с астроцитами мыши способствует синаптогенезу и активности [132], но достичь таких результатов с астроцитами, полученных из hPSC, оказалось труднее [145]. Протоколы долгосрочного культивирования позволяли получить функциональные человеческие астроциты, которые благоприятствовали синаптогенезу, были способны к фагоцитозу, экспрессия генов у них лучше коррелировала с таковой у взрослых астроцитов, чем у фетальных [146]; также эти клетки демонстрировали функциональный кальциевый сигналинг и захват глутамата [147]. Поскольку созревание астроцитов также регулируется сигналами нейронов и их активностью [148], важно разработать системы культивирования с физиологической смесью типов клеток для изучения их взаимодействий. Например, в недавнем исследовании с использованием высокопроизводительного скрининга было обнаружено, что белки семейства BET (bromodomain и extra-terminal domain) увеличивают синаптическую плотность только в NGN2-индуцированных нейронах, сокультивируемых с первичными астроцитами человека [149]. Наконец, многообещающими для исследования специализированных функций астроцитов человека могут быть модели с применением трансплантации, в которых предшественники астроцитов человека пересаживают мышам [150, 151].
Микроглия
Микроглия — резидентные иммунные клетки головного мозга — начинает мигрировать в передний мозг человека на четвертой неделе после зачатия, проходя через циклы пролиферации и апоптоза во время развития плода [152]. Отростки у микроглиоцитов меньше и менее многочисленны, чем у астроцитов, но находятся в постоянном движении, обследуя паренхиму мозга и синапсы и воздействуя на определенные подмножества синапсов тем или иным способом, зависящим от их морфологии и активности [153–155]. Как и астроциты, микроглия регулирует количество синапсов с помощью множества механизмов [156, 157]. У мышей в критические периоды развития они регулируют зависимую от активности синаптическую конкуренцию, ремоделирование и прунинг посредством каскада комплемента [158–160] и главного комплекса гистосовместимости (MHC) класса I [161]. Синаптический прунинг — один из наиболее отсроченных и продолжительных процессов созревания в человеческом мозге [53]. Хотя степень вклада микроглии в этот фенотип неизвестна, исследования связали вариации в генах человека, кодирующих иммунные факторы MHC [162], компонент комплемента 4 [163] и ингибитор комплемента CSMD1 [164, 165], с риском развития шизофрении (расстройства, которое включает в себя избыточный прунинг в коре головного мозга). Отсюда возникла гипотеза, что эти пути опосредуют взаимодействия микроглии с нейронами, участвующие как в длительном созревании, так и в риске развития заболевания [166]. Микроглия также участвует в развитии филоподий [167], усилении синапсов и формировании соотношения АМРА и NMDAR с участием фракталкинового сигналинга [168, 169], а также в стимуляции роста шипиков и пластичности за счет ремоделирования локального ВКМ [170], опосредованного IL-33. Полный набор сигналов, с помощью которых микроглия способствует различным формам синаптического ремоделирования на разных стадиях развития, цепях и типах клеток, еще предстоит выяснить.
В двух недавних исследованиях изучали, присутствуют ли микроглиальные механизмы, обнаруженные на мышиных моделях, при созревании нейронов человека. В одном из них было показано, что органоиды коры, содержащие трансплантированную первичную микроглию человека, обладают повышенными синхронизированными всплесками активности, но при этом имеют меньшее количество синапсов [171]. Сходным образом, в исследовании со включением микроглии, полученной из ПСК, в органоиды среднего мозга человека, обнаружилось снижение окислительного стресса и гибели клеток, более высокая возбудимость нейронов и более низкий уровень синаптических белков [172], что указывает на участие микроглии в оптимизации синапсов в органоидах.
Поскольку микроглия представляет собой относительно редкий тип клеток с исключительной чувствительностью к окружению, их трудно изучать с помощью секвенирования РНК из-за опасений по поводу артефактных состояний транскрипции, которые могут быть вызваны трудностями обработки и очистки тканей [173]. Тем не менее, в недавних исследованиях использовались оптимизированные протоколы для характеристики транскрипционного разнообразия микроглии на протяжении всего развития [174, 175] и у разных видов [176], что создает основу для будущей работы по выяснению того, какие микроглиальные механизмы действуют на те или иные типы нейронов человека и стадии их созревания.
Олигодендроциты
Во время развития олигодендроциты (OДЦ) формируются в несколько временных волн из клеток-предшественников олигодендроцитов (КПО), которые у людей начинают активно размножаться в конце второго триместра [177, 178]. Среди всех типов клеток в мозге млекопитающих линия OДЦ имеет наиболее длительный процесс дифференцировки, при этом многие КПО сохраняются на протяжении всей жизни и способны к пролиферативным симметричным делениям или прямой дифференцировке в ОДЦ. В мозге человека этот процесс еще более затягивается: у мышей количество КПО достигает пика в первую постнатальную неделю [179], тогда как в человеческой ПФК пик количества КПО не достигается до выхода из младенческого возраста, а пик ОДЦ достигается к взрослому возрасту [22]. Это соответствует очень поздней миелинизации у людей: у младенцев миелинизация составляет менее 2%, а у подростков — около 60% от максимального уровня у взрослых. При этом уровень миелинизации у шимпанзе составляет 20% в младенчестве и 96% — к подростковому возрасту [14].
Миелинизация обычно коррелирует с прогрессом созревания различных нервных цепей головного мозга: кортикоспинальный тракт миелинизируется при рождении, сенсорные области — в младенчестве и детстве, а ассоциативные волокна — только в подростковом и взрослом возрасте [180, 181]. Миелинизация может способствовать регуляции сроков критического периода: миелинизация аксонов интернейронов, экспрессирующих парвальбумин, коррелирует с началом критического периода у мышей [182], а после закрытия критического периода миелин ограничивает пластичность, образуя структурный барьер и с помощью экспрессии NoGo-A, который через нейрональные рецепторы передает сигнал об ограничении возбуждающей синаптической пластичности [178]. Миелинизация отдельных аксонов и нервных цепей пластична на протяжении всей жизни [183], а исследования с участием людей и применением магнитно-резонансной томографии подтвердили, что общий принцип пожизненных изменений миелинизации в ответ на обучение консервативен [184]. Однако человеческие ОДЦ претерпели значительные эволюционные изменения в экспрессии генов [128], поэтому важно разработать системы для изучения и манипулирования ОДЦ человека.
Изучать миелинизацию человека in vitro было сложно из-за длительных сроков проведения экспериментов, но протоколы получения ОДЦ из ПСК человека с помощью формирования паттерна [185] и гиперэкспрессии транскрипционных факторов [186] позволяют получить ОДЦ, которые миелинизуют аксоны на мышиных моделях. Детальные исследования влияния миелинизации на созревание нейронов в человеческих системах отсутствуют, но несколько протоколов, подтверждающих принцип, позволяют получить человеческие органоиды, содержащие OДЦ, и показывают примеры миелинизации аксонов на ранних стадиях [187, 188].
Внеклеточный матрикс
Многие глиальные факторы, которые способствуют созреванию синапсов, действуют совместно с ВКM. ВКМ критически важен на нескольких стадиях развития нейронов, включая пролиферацию, миграцию, образование извилин и борозд коры и развитие синапсов. Нейроны и глия производят компоненты ВКМ, причем разные компоненты преимущественно производятся теми или иными типами клеток [189, 190].
Если говорить о механизмах, то ВКМ может передавать сигналы через рецепторы нейронов, а также путем прямых физических взаимодействий между белками клеточной мембраны и белками ВКМ. Во время синаптогенеза у нейронов молекулы адгезии на дендритных шипиках стабилизируют их структуру посредством механических взаимодействий с белками ВКМ [191]. Многие синаптогенные факторы, секретируемые астроцитами, такие как тромбоспондины, классифицируются как матриклеточные белки и интегрируют сигналы от белков ВКМ и белков синаптической адгезии, таких как нейролигин 1 [192]. В mCExN сигнальные пути с участием рецепторов интегрина (опосредованные ламинином, коллагенами и фибронектином) регулируют локализацию AMPAR во время гомеостатической пластичности, индукцию долговременной потенциации через NMDAR и ингибирование через глициновые рецепторы [192]. Сигнальные пути с участием гиалуроновой кислоты поддерживают активность VGCC L-типа [192]. Деградация ВКM, осуществляемая зависимыми от активности матриксными металлопротеиназами и нейротрипсинами, участвует в синаптическом ремоделировании при пластичности [192]. Таким образом, ВКM критически важен для поддержания баланса между синаптической стабилизацией и пластичностью во время созревания нейронов. Хотя многие факторы, которые модулируют взаимодействие с ВКМ, имеют глиальную природу, этом процессе могут также участвовать и другие типы клеток. Например, эндотелиоциты секретируют SPARC и серпин E1, которые способствуют росту дендритов у hPSC-CInN [193].
ВКМ может также регулировать распределение и локализацию факторов роста [194], таких как нейротрофический фактор головного мозга (BDNF) и нейротрофический фактор глиального происхождения (GDNF), которые важны для созревания нейронов [195, 196].
Вследствие сложности воспроизведения ВКМ in vitro в большинстве механистических исследований функций ВКМ использовались мышиные модели. Однако во время эмбрионального развития человека компоненты ВКМ экспрессируются на более высоких уровнях, чем у грызунов [197]. Наиболее распространенными компонентами внеклеточного матрикса плода человека являются гиалуронан, хондроитинсульфат-протеогликаны (CSPG), коллагены, фибриллин 1, ламинин и фибронектин [191, 198, 199], причем некоторые компоненты, такие как ламинин, способствуют развитию нейритов [200], а другие (например, CSPG, выделяемый реактивными астроцитами [198]) ингибируют их рост [199]. В этой области были бы полезны исследования, определяющие вклад каждого компонента в различные стадии развития нейронов, оптимальный состав для стимуляции созревания нейронов in vitro и роль экспрессии компонентов ВКM, специфичных для человека. Несколько исследований уже показали, что усиление ВКM in vitro может улучшить созревание нейронов человека. Например, 3D-гидрогели (функционализированные белками ВКМ), c эластичностью, близкой к эластичности мозга, улучшают миграцию, синаптическое и электрофизиологическое созревание hPSC-CexN по сравнению с более жесткими гидрогелями или 2D-системами [201, 202]. Кроме того, гидрогель с более высокой молекулярной подвижностью (функционализированный сигнальным пептидом ламинина) улучшал выживаемость, миграцию и созревание hPSC-CexN, обеспечивая при этом более прочный каркас для созревания in vitro, чем традиционное покрытие из ламинина [203].
На пути к комплексному подходу
Выше обсуждалось множество примеров взаимодействия между различными аспектами созревания, но неизвестно, в какой степени они независимы (вставка 2). Текущие данные, полученные в результате попыток наиболее качественно воссоздать созревание нейронов in vitro и моделей заболеваний [83], указывают на модульность различных признаков созревания. Тем не менее, до сих пор неясно, какие аспекты на каких стадиях являются вышестоящими по отношению к другим, какие из них причинные, а какие — разрешающие, и насколько много между ними взаимодействий и цепей обратной связи. Ключевое значение для решения этих вопросов имеет интеграция молекулярных, структурных и функциональных подходов в мультимодальные методы (вставка 3); она дает основу для понимания значительных различий во времени созревания нейронов у разных видов животных.


Механизмы видоспецифических сроков созревания
Чтобы понять, почему созревание нейронов человека стало таким длительным, авторы рассмотрели как общие, так и специфические механизмы, уделяя особое внимание тем, которые лучше всего подтверждены экспериментально. В настоящем обзоре общие механизмы определяются как те, которые могут широко влиять на клеточные процессы и стадии развития, тогда как специфические механизмы являются модульными и могут применяться только к определенным аспектам или стадиям созревания (рис. 3). Общие механизмы предлагают привлекательное и экономное эволюционное объяснение огромных межвидовых различий в сроках созревания нейронов. Тем не менее, существуют явные свидетельства дифференциальной гетерохронии в процессах развития у разных видов (рис. 1). Сравнение различных представителей приматов позволяет предположить, что только часть модулей и процессов экспрессии генов участвует в длительном созревании нейронов человека [46, 53, 54, 204]. Наибольшее межвидовое расхождение в экспрессии генов происходит в позднем внутриутробном и раннем подростковом периодах, при этом эти закономерности определяются разными генами [19]; это позволяет предположить, что видовые различия на разных стадиях жизни формируются под действием несопоставимых молекулярных механизмов. Действительно, раннее детство — этап жизни, на котором быстрый рост мозга опережает рост тела и в течение которого дети отнимаются от груди, но еще не могут питаться взрослой пищей, — по-видимому, является уникальной для людей стадией [205] и может требовать специальной адаптации. Наконец, разнообразие скоростей созревания разных типов клеток говорит о наличии специфичных для каждого типа клеток механизмов, которые могут накладываться на более общие различия между областями мозга и разными видами.
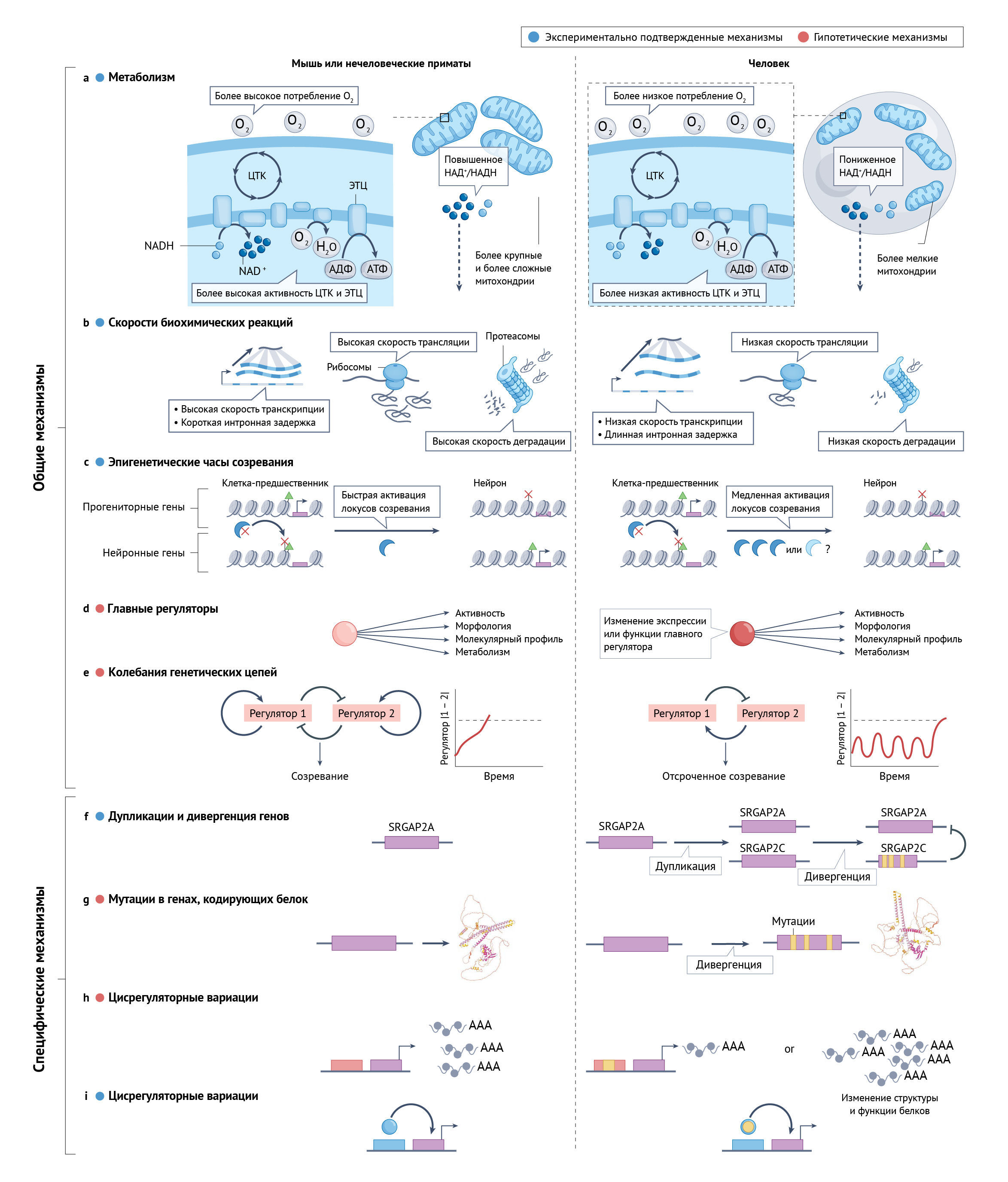
Общие механизмы
В нескольких недавних исследованиях изучались межвидовые различия по срокам с применением моделей раннего развития in vitro. Используя пресомитную мезодерму, полученную из ПСК (ПСM — эмбриональная ткань, которая последовательно производит сомиты во время сегментации тела), две группы исследователей показали, что клетки человека и мыши in vitro сохраняют присущие им сроки развития (которое у мышей на данном этапе происходит в 2–3 раза быстрее) [206, 207]. Одно исследование также показало, что разницу в сроках может объяснить более позднее начало транскрипции и трансляции ключевого гена сегментации и скорость деградации белка, который он кодирует [207]. Третье исследование обнаружило аналогичные результаты при дифференцировке НКП в мотонейроны спинного мозга, при этом различия в скорости деградации белка коррелируют с разницей в сроках созревания между человеком и мышью [208].
Что вызывает замедление биохимических реакций в клетках человека? Значимым кандидатом может быть метаболизм, скорость которого у млекопитающих обратно пропорциональна размеру тела [209, 210]. У hCExN скорость обмена веществ ниже, чем у mCExN, а усиление митохондриального метаболизма в hPSC-CexN за счет ингибирования ЛДГA или добавления свободных жирных кислот ускоряет синаптическое и морфологическое созревание нейронов [86]. Повышенный уровень также выявляется в ПСМ мышей, что приводит к более высокому содержанию в цитозоле НАД+ по отношению к ее восстановленной форме НАДН. Соотношение НАД+/НАДН в контроле сроков формирования ПСМ действует раньше, чем уровень трансляции, и манипулирование этим соотношением в клетках человека влияет на скорость сегментации [211]. Ситуация усложняется тем, что в другом исследовании с оценкой сроков образования ПСМ из ПСК у четырех других видов млекопитающих воспроизводятся метаболические различия между человеком и мышью и расширяется связь между более поздним началом транскрипции, скоростью деградации белка и развитием ПСМ, но не удалось найти корреляцию с видоспецифичными скоростями метаболизма [212]. Гены, участвующие в катаболизме белков и процессинге РНК, тесно коррелировали со сроками развития, что потенциально позволяет предположить, что они могут действовать как главные регуляторы таких сроков [212]. Эти данные свидетельствуют о том, что метаболизм влияет на скорость созревания нейронов, особенно внутри вида, но не может быть единственным фактором межвидовых различий. Будущие исследования должны выяснить вклад экспрессии генов, метаболизма и скорости биохимических реакций в различия между видами, а также общность этих механизмов для разных типов клеток и стадий онтогенеза.
Еще один механизм, который следует учитывать, — это возможность существования эпигенетических часов. Паттерны метилирования ДНК в тканях человека могут предсказать возраст от стадии плода до взрослого [64, 65]. Однако причинно-следственная связь между изменениями метилирования, созреванием и старением остается неясной. Между тем, как отмечалось выше, в одном недавнем исследовании и препринте сообщалось, что нокдаун регуляторов хроматина в ранних постмитотических hPSC-CexNs [71], зернистых клетках мозжечка мыши [73] или НКП человека [71] ускоряет созревание нейронов; это позволяет предположить, что действие модификаторов гистонов может поддерживать эпигенетические часы, которые медленно выключают гены пролиферации и включают гены созревания нейронов. Важно отметить, что манипулирование модификаторами хроматина с целью удаления репрессивных меток гистонов и подавления генной экспрессии (предположительно нейрональных генов) ускоряет созревание, но увеличение числа репрессивных меток гистонов к такому эффекту не приводит [71]. С механистической точки зрения это может указывать на то, что ландшафт хроматина сбалансированных бивалентных генов развития у предшественников особенно чувствителен к удалению репрессивных модификаций гистонов и переходу в состояние, разрешающее экспрессию нейрональных генов; модули нейрональных генов также могут быть важны для подавления модулей-предшественников [213]. Тем не менее, в ряде других исследований обнаружено увеличение количества маркерных генов альтернативных путей дифференцировки клеток и дерегуляция генов созревания после ингибирования одних и тех же репрессивных модификаторов хроматина [214, 215]; это указывает на то, что для понимания роли модификаторов хроматина в судьбе и созревании клеток необходимы дополнительные исследования. Тем не менее, упомянутая предварительная работа [71] указывает на интригующую возможность того, что механизмы, влияющие на длительную пролиферацию предшественников и нейрогенез [216–218], могут оказывать плейотропное воздействие на скорость постмитотического созревания.
Дальнейшее подтверждение существования механизма эпигенетического созревания по принципу часов получено в иммунологическом исследовании, показывающем, что в Т-клетках активация гена, определяющего дифференцировку, контролируется противоположными действиями метилтрансферазы гистонов PRC2 и деметилазы гистонов KDM6A/B, которые регулируют длительность временной задержки перед активацией гена с помощью вероятностного переключения состояния хроматина вне зависимости от номера клеточного цикла [69]. Серия математических моделей, созданных той же научной группой, предполагает, что эпигенетические сети переключения могут быть общим механизмом, контролирующим скорость развития, и что эволюционные изменения в регуляторах хроматина способны гибко регулировать сроки [213]. Параллельно недавнее исследование показало, что ингибирование метилтрансферазы гистонов соединением DOT1L ускоряет созревание hPSC-CexN [72]. DOT1L может контролировать доступность хроматина для других модификаторов, и для нее неизвестен деметилаза; это позволяет предположить, что ее деградация может контролироваться обновлением нуклеосом [70] и что DOT1L может быть главным хронометристом созревания нейронов. Если они подтвердятся у разных видов, эти результаты могут объединить метаболические и эпигенетические механизмы межвидовых различий в сроках созревания нейронов. Хотя скорость метаболизма может контролировать выработку и обновление ключевых транскрипционных факторов, которые обеспечивают раннюю дифференцировку, метаболическая модуляция обновления эпигенетических модификаторов и/или самих модифицированных нуклеосом может определять скорость постмитотического созревания нейронов. Однако направление причинно-следственной связи неясно, и эволюционные изменения в эпигенетических механизмах могут также регулировать скорость возникновения метаболических изменений, таких как переключение на ОФ, который затем может контролировать другие факторы созревания. Для выяснения взаимодействия между этими механизмами необходимы дальнейшие сравнительные исследования различных видов животных и причинно-следственными манипуляции с эпигенетическими и метаболическими факторами.
Специфические механизмы
На определенных стадиях и/или аспектах созревания могут действовать более специфические механизмы. Наиболее известным примером служит человеческий ген SRGAP2C, частично дуплицированный паралог предкового гена SRGAP2A [219, 220]. Димеризуясь с SRGAP2A и вызывая его деградацию [221], SRGAP2C ингибирует наследственные функции SRGAP2A, которые включают взаимодействия, способствующие накоплению рецепторов AMPA и GABAA [222]. В двух недавних препринтах сообщается, что SRGAP2C также увеличивает содержание в синапсах ключевого постсинаптического регуляторного белка SYNGAP1 [223, 224] в hPSC-CexN, что замедляет темпы возбуждающего и тормозного синаптогенеза [222]. Эти механизмы способствуют синаптической неотении человека в ходе онтогенеза, в конечном итоге увеличивая количество корково-кортикальных связей во взрослом мозге [225].
Недавние результаты, полученные на моделях стволовых клеток и с помощью сравнительной транскриптомики, открывают потенциал для выявления не только дуплицированных генов, но и других специфичных для человека различий в генной экспрессии во время созревания нейронов. Например, GATA3 был описан как фактор транскрипции, который у человека на ранних стадиях созревания активируется в большей степени, чем в CExN нечеловеческих приматов. Нокдаун GATA3 вызывал более быстрое возникновение потенциала действия и активацию нейронной сети в культурах нейронов человека [226], что позволяет предположить, что этот ген способствует более позднему созреванию внутренней возбудимости и/или развитию синапсов, хотя точные механизмы до сих пор неясны. Таким образом, хотя исследования были сосредоточены на роли дупликации генов и цисрегуляторных механизмов в контроле изменчивости между близкородственными видами [227, 228], на многие нижестоящие гены может влиять небольшое количество изменений в экспрессии и/или времени действия факторов, опосредующих механизмы трансрегуляции.
Нерешенные вопросы
Вокруг процесса созревания, который можно рассматривать как текущий, подобно реке, от истока в НКП по извилистому руслу через морфологическое и метаболическое развитие, молекулярную спецификацию и приобретение функциональных свойств и, наконец, достигающий своей конечной точки в виде нейрона взрослого организма, остается много важных вопросов (рис. 4). Во-первых, как изменения в источнике — в НКП — влияют на последующее постмитотическое созревание? В недавнем препринте есть интригующие данные о том, что временные эпигенетические манипуляции в клетках-предшественниках могут влиять на темпы созревания нейронов [71], а математическая модель поддерживает идею о том, что сходные сети эпигенетического переключения могут контролировать сроки как дифференцировки, так и постмитотического созревания [213]. С эволюционной точки зрения было бы интересно исследовать, продлевают ли созревание генетические изменения, которые увеличивают количество делений клеток-предшественников, и действует ли метаболизм в этом контексте раньше эпигенетики.
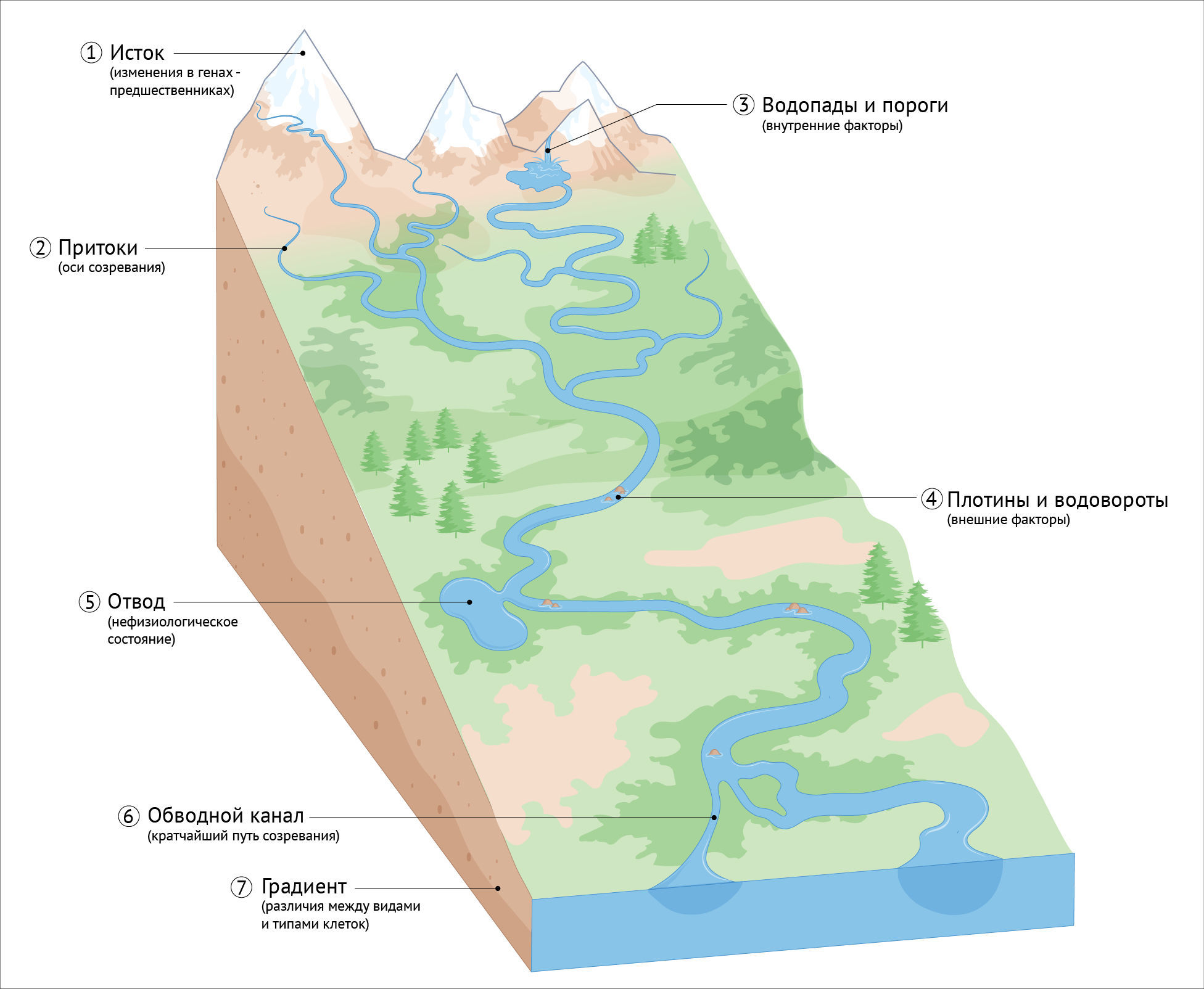
Следующий вопрос — переплетены ли различные аспекты созревания — молекулярные, морфологические, метаболические и функциональные — полностью, или они могут протекать с разной скоростью [71] (вставка 2)?
Насколько на феноменологическом уровне созревание нейронов напоминает прямой поток к стабильному бассейну-аттрактору, а не извилистую реку с заводями, плотинами и водоворотами, где прогресс можно остановить? Возможно ли изменить курс на альтернативное, нефизиологическое направление? Хотя темп ранних стадий созревания контролируется изнутри, неясно, какие внешние факторы и на каких этапах необходимы для продвижения процесса вперед или препятствования дальнейшему прогрессу. Простые в использовании модели in vitro — ключ к решению этой проблемы, и соответствующие вопросы касаются того, как количество и тип синапсов влияют на экспрессию генов, регулирующих активность, и терминальную молекулярную идентичность, а также как состав питательных веществ облегчает или предотвращает метаболические переходы.
Если говорить о различиях между видами животных и типами клеток, то существует вопрос, какие механистические изменения корректируют общую топографию на протяжении всего процесса созревания и изменения градиента на определенных участках? Взятые за основу первоначальные исследования, полные сравнительные мультиомные атласы развития отдельных клеток, включающие индивидуальные вариации, могут выявить общие и специфичные для того или иного типа клеток регуляторные изменения генов, связанные с различиями в скорости созревания. Какие механизмы являются специфичными для каждого типа клеток, а какие — общими для нейронов или даже для других типов клеток? Интересно, что, как показало недавнее исследование, модуляторы эпигенетических и кальциевых сигнальных механизмов, которые ускоряют созревание hPSC-CexN, также улучшают созревание мотонейронов спинного мозга, полученных из ПСК, и некоторых типов клеток, не являющихся нейронами, таких как меланоциты и β-клетки поджелудочной железы [72]. Хотя большая часть работ in vitro сосредоточена на CExN, в настоящее время доступны протоколы для получения из ПСК широкого спектра различных типов клеток, что делает возможным механистическое исследование потенциальных генетических, эпигенетических и метаболических факторов, влияющих на созревание различных типов клеток у разных биологических видов.
Наконец, важнейшим соображением для исследователей, желающих изучить более поздние стадии взросления, во время которых начинают проявляться как уникальные человеческие способности, так и неврологические заболевания, будет вопрос о том, можно ли сократить физиологический процесс созревания, искусственно увеличить скорость его протекания и/или полностью изменить направление, приходя при этом в ту же конечную точку. Получается благотворный цикл, в котором лучшее понимание биологического процесса созревания нейронов может привести к усовершенствованию методов созревания нейронов человека in vitro, что может подтолкнуть дальнейшее изучение механизмов межвидовых различий. На данный момент исследовано лишь небольшое количество химических модуляторов созревания, но технология количественного высокопроизводительного скрининга [229] делает возможными дальнейшие открытия. Механистические исследования межвидовых различий уже предоставили благодатную почву для идей о способах ускорения созревания нейронов человека, и, как ожидают авторы обзора, эта тенденция сохранится. Между тем, лучшее понимание генетических регуляторных сетей может привести к появлению возможности регуляции путей созревания с помощью гиперэкспрессии или нокдауна ключевых факторов транскрипции и модификаторов хроматина; хотя к этим методам следует отнестись с осторожностью, учитывая их способность полностью изменить ход созревания. Здесь могут оказаться актуальными исследования старения [230], поскольку некоторые эпигенетические механизмы могут быть общими как для развития, так и для старения [64, 79]; конечной целью будет создание нейронов in vitro, на которых можно будет моделировать любой этап человеческой жизни [64, 79]. Для разработки и характеристики этих подходов потребуется комбинаторная проверка новых и существующих идей по ускорению созревания, а также мультимодальные оценки стадий созревания и соответствия условиям in vivo.
Заключение
По мере изучения процесса созревания нейронов человека становится заметен значительный прогресс как в понимании этого процесса, так и в его воспроизведении в лаборатории. Системы in vitro позволяют манипулировать механизмами созревания, а методы ускорения и/или улучшения созревания нейронов человека идут рука об руку с фундаментальными биологическими открытиями. Прошло менее 50 лет с тех пор, как культивирование нейронов мыши в лаборатории стало обычным делом, и менее двух десятилетий с тех пор, как технология ПСК дала возможность получать нейроны человека in vitro. С помощью современных методов теперь возможно производить человеческие нейроны и доводить их до состояния, приближающегося к позднему эмбриональному или раннему постнатальному этапу. Благодаря недавним достижениям в области биологии стволовых клеток, пространственной геномики и геномики отдельных клеток, сравнительной генетики и нейробиологии, сейчас настало время для сближения этих методов, чтобы исследовать полную траекторию созревания нейронов, картировать — и даже манипулировать — его необычно извилистым течением, характерным для нашего вида.
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- Telegram
