Ототоксичность, связанная с аминогликозидами: механизмы, факторы риска и профилактика у детей

Аннотация
Аминогликозиды — это антибиотики широкого спектра действия, активно применяемые для лечения детей, но они обладают потенциальными токсическими побочными эффектами, в том числе ототоксичностью. Ототоксичность аминогликозидов постоянна и является следствием их действия на клетки внутреннего уха посредством множества механизмов. В патогенезе обусловленной аминогликозидами ототоксичности участвуют как неконтролируемые, так и контролируемые факторы риска, и из-за ее необратимости важным мероприятием по предотвращению ототоксичности является ответственный подход к использованию антибиотиков и ограничение применения аминогликозидов. Аминогликозиды играют основополагающую роль в лечении многочисленных инфекционных заболеваний у новорожденных и детей. Нормальная слуховая функция в детстве обеспечивает адекватное нейрокогнитивное и социальное развитие. Таким образом, повреждение слуха вследствие приема аминогликозидов может сильно повлиять на нормальный рост ребенка. В настоящем обзоре описаны молекулярные механизмы ототоксичности, связанной с аминогликозидами, и проанализированы факторы риска и потенциальные отопротекторные стратегии у детей.
1. Введение
Аминогликозиды — антибиотики широкого спектра действия, используемые при лечении многочисленных инфекций у всех возрастных групп пациентов [1].
Они применяются при лечении тяжелых инфекций в раннем детском возрасте, но имеют различные побочные эффекты, включая ототоксичность с потерей слуха. Нормальная функция слуха в детстве имеет фундаментальное значение для нормального развития когнитивных способностей и речи. Таким образом, знание о механизмах, лежащих в основе повреждения слуха аминогликозидами, а также о возможных профилактических стратегиях может помочь предотвратить появление этого необратимого побочного эффекта.
В настоящем обзоре авторы проанализировали патогенетические механизмы, лежащие в основе потери слуха у детей вследствие приема аминогликозидов, факторы риска и доступные защитные стратегии.
Методы исследования
Целью исследования было создать описательный обзор, обобщающий имеющиеся в настоящее время знания о патогенезе и профилактике ототоксичности аминогликозидов у детей. Для ее достижения авторы с 20 января 2023 г. по 30 июня 2023 г. искали в базе Pubmed статьи, посвященные этой теме, используя поисковые термины «аминогликозиды» и «ототоксичность», в соответствии со словом «дети». После первоначального поиска авторы применили фильтры для отбора статей на английском языке и статей с доступными полными текстами. В ходе этого исследования была получена 391 статья. Два оператора выставили 391 статью по соответствию заголовка и аннотации теме. В результате поиска в общей сложности была получена и включена в обзор 161 статья.
2. Фармакокинетика и фармакодинамика аминогликозидов
2.1. Структура аминогликозидов
Аминогликозидные противомикробные препараты были открыты в 1940-х годах. Первый, стрептомицин, был выделен из грамположительных бактерий Streptomyces griseus и применялся для лечения туберкулеза. С тех пор из видов Streptomyces были получены другие аминогликозиды (неомицин, тобрамицин, канамицин, паромомицин и спектиномицин). Ряд аминогликозидов был выделен из видов Micromonospora (гентамицин и сисомицин) или из уже известных молекул аминогликозидов посредством химических модификаций (нетилмицин, амикацин, плазомицин, арбекацин) [2].
Структуры аминогликозидов образованы гексозой (аминоциклитом), связанной с одним или несколькими аминосахарами с помощью гликозидных связей. Стрептомицин состоит из гуанидинилированного стрептамина, связанного в четвертом положении с дисахаридом. В трех других классах аминогликозидов аминоциклитол представляет собой 2-дезоксистрептамин; он может быть 4,5-замещенным (неомицин, неамин, паромомицин, рибостамицин), 4,6-замещенным (амикацин, арбекацин, канамицин, тобрамицин, гентамицин, сисомицин, нетилмицин, плазомицин) или монозамещенным (апрамицин, неамин).
По спектру действия выделены четыре поколения аминогликозидов в соответствии со способностью уклоняться от механизмов бактериальной резистентности: I поколения (стрептомицин, неомицин, канамицин, мономицин), II (гентамицин), III (тобрамицин, амикацин, нетилмицин, сисомицин) и IV (изепамицин), а также нового поколения (плазмомицин) [3].
2.2. Всасывание и распределение аминогликозидов
Аминогликозиды представляют собой гидрофобные поликатионные молекулы, их катионная природа обусловлена преобладанием в их химической структуре основных ионизируемых аминогрупп. Их бактерицидная активность обусловлена нарушением бактериального синтеза белка [2].
Вследствие своей катионной природы аминогликозиды не липофильны и, следовательно, очень плохо всасываются в желудочно-кишечном тракте; поэтому пероральный прием аминогликозидов не рекомендуется. Таким образом, их необходимо вводить внутримышечно или — как делают чаще — внутривенно. Для аминогликозидов характерна удивительно схожая кинетика. Они демонстрируют низкое связывание с белками плазмы (< 10%) [1].
После парентерального введения объем распределения аминогликозидов приближается примерно к общему объему тела, с хорошим распределением во всех тканях и преимущественным накоплением во внеклеточной среде из-за их гидрофильной природы. Их кажущийся объем распределения (Vd) уменьшается с увеличением возраста: Vd гентамицина варьирует от 0,5–0,7 л/кг у недоношенных детей до 0,25 л/кг у молодых людей из-за более высокой доли общей воды в организме у новорожденных [4]. Они хорошо проникают в некоторые жидкости организма, включая синовиальную, перитонеальную, асцитную и плевральную жидкости, но плохо проходят в центральную нервную систему и стекловидное тело. Аминогликозиды довольно медленно распределяются в желчи, кале, предстательной железе и околоплодных водах. Vd повышается при таких состояниях, как сепсис, тяжелые ожоги и фебрильная нейтропения, застойная сердечная недостаточность, перитонит, в ближайшем послеродовом периоде и при парентеральном питании [1].
Аминогликозиды проникают в клетку путем электростатического связывания своих положительно заряженных молекул с отрицательно заряженными компонентами поверхности бактериальной клетки (липополисахаридами и фосфолипидами наружной мембраны грамотрицательных бактерий, а также фосфолипидами и тейхоевой кислотой грамположительных бактерий). Такое связывание обеспечивает доступ к периплазматическому пространству. Анаэробные бактерии обычно невосприимчивы к аминогликозидам из-за отсутствия мембранного потенциала и механизмов транспорта электронов, необходимых для захвата препарата. Из периплазматического пространства небольшое количество аминогликозидов попадает в цитоплазму, пересекая внутреннюю мембрану [5]. В цитоплазме они влияют на синтез белка, ингибируя инициацию трансляции, блокируя элонгацию или способствуя неправильному считыванию кодонов; этот процесс приводит к образованию неправильно синтезированных белков, которые вызывают повреждение внутренней мембраны [6]. Это событие облегчает поглощение других аминогликозидов, которые накапливаются внутри клетки и ускоряют процесс неправильной трансляции, что приводит к дозозависимому уничтожению бактерий аминогликозидами [7].
2.3. Механизм действия аминогликозидов
Аминогликозиды связываются с 16S-рРНК (А-сайт) 30S-субъединицы рибосомы, вызывая конформационные изменения рРНК в декодирующей области, что приводит к неправильному считыванию информации с мРНК и ошибкам в синтезе белка. Они также ингибируют транслокацию рибосом путем иммобилизации пептидил-тРНК в А-сайте [8].
Некоторые аминогликозиды (канамицин, неомицин В и гентамицин) способны связываться с аллостерическим сайтом 23S-рРНК 50S-субъединицы рибосомы [9]. В отличие от других, сайт связывания стрептомицина, по-видимому, находится в непосредственной близости от декодирующего центра рибосомы, что препятствует первоначальному отбору тРНК [7]. Кроме того, было показано, что он нарушает образование инициирующего комплекса 70S, ингибируя стадию терминации синтеза белка [10].
Гибель бактериальных клеток после поглощения аминогликозидов, по-видимому, происходит из-за встраивания дефектно синтезированных белков во внутреннюю мембрану, что приводит к дестабилизации клетки; кроме того, массовое поступление аминогликозидов приводит к ингибированию активности рибосом и блокированию синтеза белка [11, 12].
2.4. Выведение аминогликозидов
Аминогликозиды выводятся почками в виде интактных соединений путем клубочковой фильтрации; их клиренс аналогичен клиренсу креатинина и снижается при ухудшении функции почек. Таким образом, клиренс также снижается у пожилых людей и новорожденных [13]. Концентрация аминогликозидов в моче составляет 70% введенной дозы или более; таким образом, они идеально подходят для лечения инфекций мочевыводящих путей [14]. Период полувыведения составляет примерно 2–3 часа у взрослых, но удлиняется у маленьких детей, особенно новорожденных, из-за не до конца сформированной функции почек, а также при терминальной стадии заболевания почек [1].
2.5. Фармакокинетика аминогликозидов у детей
У детей фармакокинетика (ФК) и фармакодинамика аминогликозидов отличается от таковых у взрослых и меняется с возрастом по мере изменения количества внеклеточной жидкости и функции почек. У новорожденных и младенцев количество внеклеточной жидкости на килограмм выше, чем у детей и взрослых, и это влияет на объем распределения водорастворимых препаратов, таких как аминогликозиды, что приводит к более высокому объему распределения, который с возрастом уменьшается [15]. Выведение препаратов почками также зависит от возраста; у недоношенных новорожденных функция почек нарушена, и скорость клубочковой фильтрации увеличивается с возрастом и в детстве превышает значения, характерные для взрослых, а в подростковом возрасте приближается к ним [15]. Помимо этих двух факторов, на фармакокинетику аминогликозидов у детей может влиять и ряд других, таких как ожирение, воспаление, органная недостаточность, критические заболевания и сопутствующая терапия; таким образом, традиционные режимы дозирования, основанные на возрасте или весе, не представляются оптимальными. Неадекватная дозировка может привести к неэффективности лечения или, наоборот, обострению связанных с ним побочных эффектов. С целью предотвращения ущерба от неадекватной дозировки как для аминогликозидов, так и для других лекарственных средств, в последние годы разработано популяционное моделирование ФК (ПопФК), которое в сочетании с терапевтическим лекарственным мониторингом позволяет адаптировать дозу к пациенту [16]. В настоящее время для детей доступны ПопФК для гентамицина, амикацина и нетилмицина, и в них подчеркивается, что основными переменными, влияющими на ФК аминогликозидов у педиатрических пациентов, являются объем распределения и функция почек [17, 18, 19]. Более того, на сегодняшний день доступны модели, которые анализируют взаимодействие между фармакокинетическими и фармакодинамическими (ФК/ФД) параметрами. Например, в недавнем исследовании, проведенном Зазо с соавт., с помощью модели ФК/ФД было обнаружено, что наиболее часто используемая доза гентамицина может оказаться недостаточной для новорожденных, которым может потребоваться введение через более длительные промежутки времени с последующим снижением токсических эффектов [20]. Кроме того, Донг с соавт. применили модель ФК для оценки переменных, которые больше всего влияют на нарушение слуха, и заметили, что у пациентов с муковисцидозом, проходящих терапию тобрамицином, основными детерминантами являются повторные циклы и пожилой возраст (из-за повторения лечения с течением времени) [21]. Как указывают авторы, для подтверждения результатов данного исследования необходима валидация на более крупной проспективной выборке. Для разработки улучшенных физиологических моделей ФК (ФФК) и прогнозирования концентрации препарата во внутреннем ухе необходимы проспективные исследования [21]. Создание моделей ФФК представляет собой тип фармакокинетического моделирования на основе компартментов и потоков, в котором каждый компартмент представляет собой физиологически дискретный объект, такой как орган или ткань, в сочетании с входящими и выходящими потоками крови. Распределение лекарственного препарата в органе будет зависеть от притока и оттока крови, концентрации в крови и коэффициента распределения. Теоретически, если бы модель ФФК содержала отсек для каждого органа тела, это могло бы облегчить одновременное описание изменений концентрации лекарства в каждом органе с течением времени. Отсеки не ограничиваются целыми органами, и часто модели ФФК содержат вложенные отсеки, которые представляют разные типы клеток внутри органа и даже разные органеллы внутри клетки. Такая степень иерархической сложности позволяет моделировать события на молекулярном уровне, такие как механизмы повреждения конкретных метаболических путей. С помощью конкретной модели внутреннего уха можно более точно оценить концентрацию препарата в этом органе и лучше понять, коррелирует ли дозировка со степенью потери слуха. Авторы обзора сообщают, что в настоящее время им неизвестно о конкретных данных на основе модели ФФК о повреждении слуха у детей в связи с приемом аминогликозидов.
3. Клинические показания к применению аминогликозидов
Аминогликозиды представляют собой антибиотики широкого спектра действия, активные как против грамотрицательных, так и против грамположительных бактерий. Среди первых можно назвать семейство Enterobacteriacea, в том числе Escherichia coli, Klebsiella pneumoniae и Klebsiella oxytoca, Enterobacter cloacae и Enterobacter aerogenes, Providencia spp., Proteus spp., Morganella spp., Serratia spp., Yersinia pestis, и Francisella tularensis [22]. Среди грамотрицательных бактерий аминогликозиды хорошо действуют против Staphylococcus aureus, включая метициллин-резистентные, промежуточные и ванкомицин-резистентные изоляты, Pseudomonas aeruginosa и — в меньшей степени — Acinetobacter baumannii [23, 24].
Активность аминогликозидов усиливается за счет синергизма с другими классами противомикробных препаратов, такими как бета-лактамы, которые действуют на клеточные стенки грамотрицательных и грамположительных бактерий, включая изоляты дикого типа и изоляты с множественной лекарственной устойчивостью [25]. По этой причине аминогликозиды часто используются в сочетании с бета-лактамами для эмпирического лечения тяжелого сепсиса или внутрибольничной инфекции у пациентов с высоким риском смертности или в случаях, когда предполагаемый возбудитель может быть устойчив к часто используемым препаратам [26]. Можно рассмотреть их применение у пациентов, инфицированных бактериями с множественной лекарственной устойчивостью, такими как устойчивые к карбапенемам Enterobacteriaceae. Аминогликозиды также важны для лечения туберкулеза с множественной лекарственной устойчивостью.
Аминогликозиды часто применяют для детей с септическим шоком. Эти препараты рекомендуют для эмпирической терапии широкого спектра действия в условиях, когда среди грамотрицательных бактерий распространена резистентность к цефтриаксону. У детей с ослабленным иммунитетом их можно использовать в дополнение к бета-лактамам или цефалоспоринам второго/третьего поколения, когда возникает проблема устойчивости к антибиотикам. Такое применение также следует рассматривать для эмпирической терапии у пациентов с сепсисом с высоким риском резистентных грамотрицательных инфекций в дополнение к бета-лактаму с ингибитором бета-лактамаз [27].
Аминогликозиды могут применяться для лечения детей с лихорадкой и нейтропенией, детей с зависимостью от антипсевдомонадных бета-лактамов, цефалоспоринов четвертого поколения или карбапенемов, у пациентов с клинически нестабильным состоянием или в центрах с высоким уровнем резистентных возбудителей [28].
Использование гентамицина рекомендуется для эмпирического лечения новорожденных с подозрением на ранний сепсис при зависимости от ампициллина. Дозировка гентамицина составляет 4 мг/кг на дозу, вводимую внутривенно каждые 24 часа [29, 30].
Этот режим также подходит для лечения неонатального сепсиса с поздним началом у новорожденных, поступивших из внебольничных учреждений и, следовательно, с низким риском заражения, вызываемого возбудителем с множественной лекарственной устойчивостью. В этом режиме доза гентамицина составляет 5 мг/кг внутривенно каждые 24 часа [31].
Аминогликозиды (например, гентамицин в дозе 7,5 мг/кг/день, вводимый внутривенно и разделенный на три дозы) являются подходящими парентеральными препаратами первой линии для эмпирического лечения инфекций мочевыводящих путей у детей, которым требуется внутривенное введение препарата [32]. Ряд исследований показал, что парентеральное введение гентамицина (или цефтриаксона) один раз в день в дневном стационаре безопасно, эффективно и недорого [33, 34].
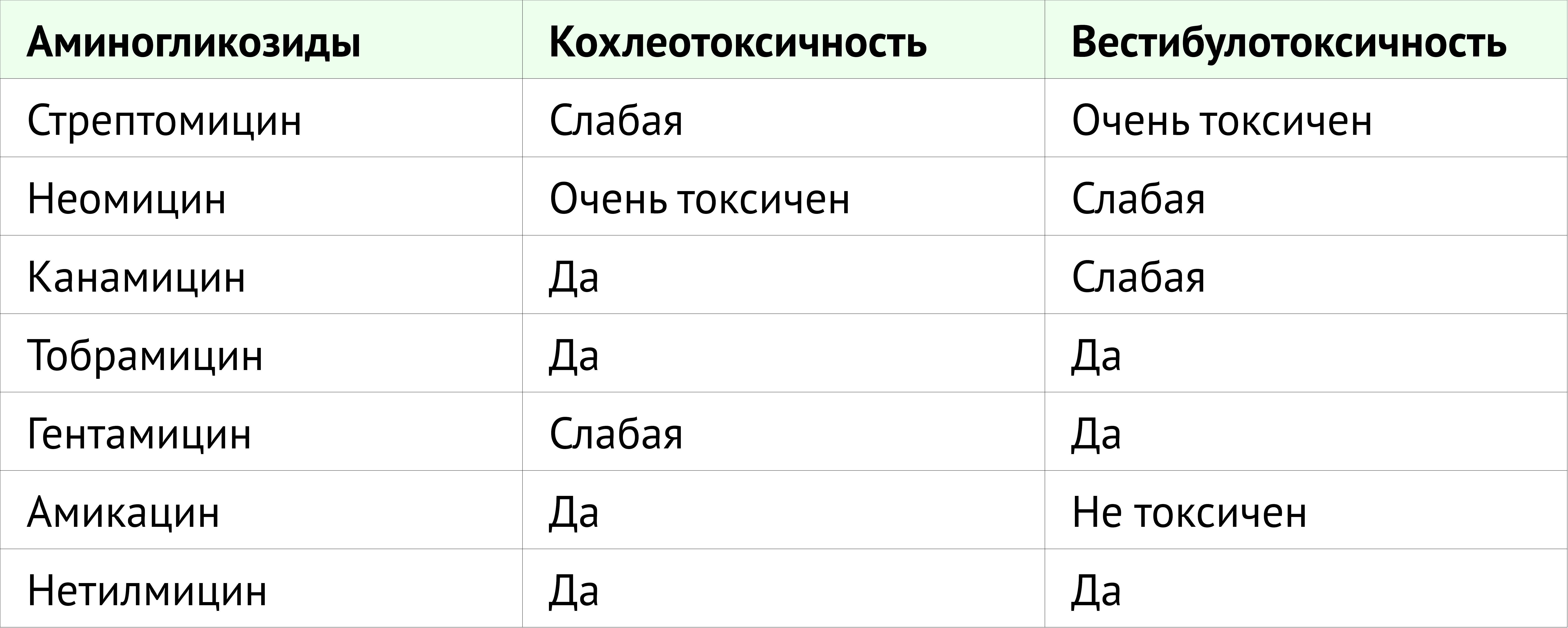
Недавний обзор Диепстратена с соавт. показывает, что потеря слуха возникает у 57% детей, получающих аминогликозиды [37].
Ланверс-Камински с соавт. описали, что тяжесть ототоксичности различается для разных аминогликозидов. Неомицин представляется высокотоксичным; гентамицин, канамицин и тобрамицин обладают средней токсичностью; а амикацин и нетилмицин считаются наименее токсичными аминогликозидами [38].
Токсичность для внутреннего уха может проявляться как кохлеотоксичность или вестибулотоксичность. Кохлеотоксичность может вызвать шум в ушах и/или нейросенсорную потерю слуха и привести к глухоте. Вестибулотоксичность может проявляться в виде головокружения, тошноты, нистагма и атаксии.
Стрептомицин и гентамицин преимущественно вестибулотоксичны, тогда как амикацин, неомицин и канамицин преимущественно кохлеотоксичны. Тобрамицин одинаково вестибулотоксичен и кохлеотоксичен [39]. Вестибулотоксичность может возникнуть в 60% курсов лечения. Пациенты часто сообщают о вестибулярных проблемах и шуме в ушах еще до того, как осознают потерю слуха; однако шум в ушах чаще всего носит субъективный характер. Частота возникновения шума в ушах неясна вследствие отсутствия специфических диагностических тестов [40].
Таблица 1. Токсичность аминогликозидов для улитки и преддверия.
Для проявления цитотоксического эффекта аминогликозиды должны проникнуть в ткани внутреннего уха (рисунок 1).
Гемато-лабиринтный барьер (ГЛБ) защищает клетки улитки от циркулирующих в крови макромолекул и форменных элементов. Он состоит из эндотелиальных клеток кровеносных сосудов улитки, соединенных плотными контактами [41]. Внутри улитки перилимфа имеет ионный состав, типичный для других внеклеточных жидкостей (т. е. с высоким содержанием Na+, низким содержанием K+ и миллимолярным Ca2+). Аминогликозиды могут попадать в перилимфатическое пространство из кровотока, но проникать в волосковые клетки им нелегко. Эндолимфа, омывающая апикальные поверхности волосковых клеток, имеет уникальный ионный состав в организме млекопитающих (т. е. с высоким содержанием K+, низким содержанием Na+ и ~ 20 мкМ Ca2+). В отличие от вестибулярной, кохлеарная эндолимфа имеет очень положительный потенциал ~ +80 мВ по отношению к крови или перилимфе, что имеет решающее значение для чувствительного слуха. Перилимфа и эндолимфа остаются разделенными эпителиальными клетками, которые между собой связаны плотными межклеточным контактами [42, 43].
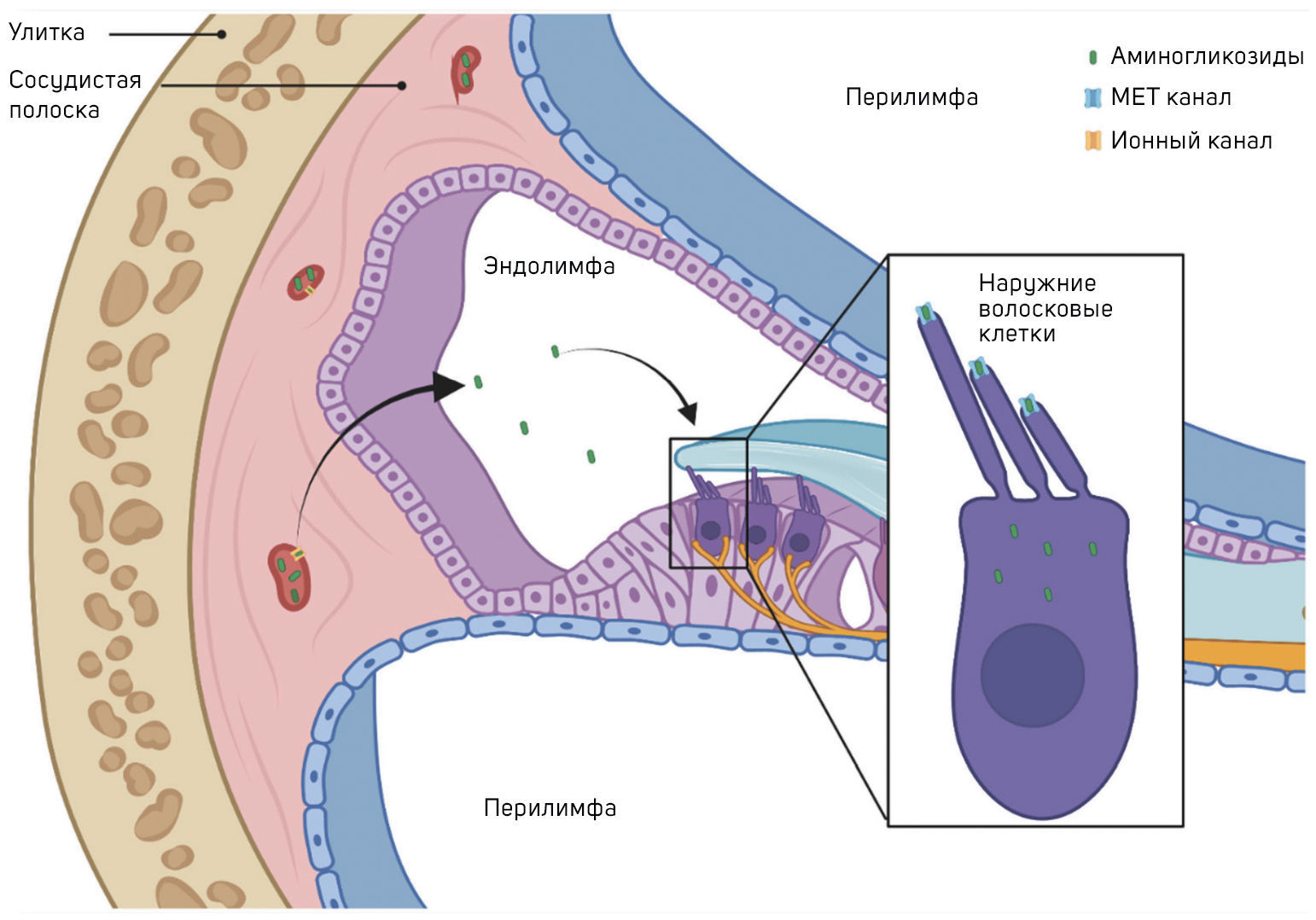
Тран Ба Хай с соавт. изучили кинетику гентамицина в жидкостях и тканях крыс и сообщили о более высоких уровнях аминогликозидов в перилимфе, чем в эндолимфе, предполагая, что накопление аминогликозидов в перилимфе, период полувыведения из которой чрезвычайно медленный, было основной причиной токсичности по отношению к волосковым клеткам [42]. После системного введения аминогликозиды попадают в перилимфу, но, по-видимому, таким образом они волосковых клеток не достигают. Фактически, когда Ли и Стейгер протестировали системно вводимый флуоресцентно меченный гентамицин, они продемонстрировали, что он более эффективно поглощается волосковыми клетками, чем меченый гентамицин, перфузируемый в барабанную лестницу. Таким образом, при системном применении гентамицин, по-видимому, легко проникает через ГЛБ и попадает в эндолимфу до того, как проникнет в волосковые клетки [43].
Способ поступления препарата в лимфу из капилляров сосудистой полоски в настоящее время неясен, но он может осуществляться через ионные каналы, мембранные транспортеры или путем трансцитоза [44].
Системно вводимые аминогликозиды могут проникать в волосковые клетки, пересекая ГЛБ сосудистой полоски латеральной стенки улитки, но если они вводятся в перилимфатический компартмент, то в изобилии накапливаются в эндолимфе [45]. Механизмы, с помощью которых аминогликозиды проникают через эндотелиальные клетки ГЛБ в сосудистую полоску и, проходя через маргинальные клетки, объединенные плотными контактами, попадают в эндолимфу, остаются неизвестными. Неясно и то, как системно вводимые аминогликозиды попадают в вестибулярные волосковые клетки, хотя переходные и темные клетки, по-видимому, поглощают аминогликозиды эффективнее, чем волосковые клетки и окружающие их поддерживающие клетки [46]. Чтобы вызвать необратимую ототоксичность, аминогликозиды, как и другие токсины, должны проникать в волосковые клетки. Они попадают в волосковые клетки из эндолимфы в первую очередь с помощью рецептор-опосредованного эндоцитоза, даже если возможны и другие механизмы.
Первый механизм проникновения связан с расположенными на апикальной мембране волосковых клеток каналами механоэлектрической трансдукции (МЭТ), которые представляют собой неселективные катионные каналы с асимметричной полостью, которая имеет широкое преддверие, обращенное к внеклеточному пространству, и узкий селективный фильтр. Полость MET-канала, по-видимому, образована димером трансмембранного каналоподобного белка 1 (TMC1) [47, 48, 49, 50].
МЭТ-каналы имеют высокую проницаемость, но низкую проводимость для ионов кальция (Ca2+). Ионы Ca2+ при низкой концентрации в эндолимфе связываются с отрицательно заряженными группами в преддверии МЭТ-канала, а затем внутри селективного фильтра, откуда они могут перемещаться в волосковые клетки или обратно в эндолимфу [51]. Поступление ионов Ca2+ в волосковые клетки обусловлено разностью потенциалов между эндолимфой (+80 мВ) и мембранным потенциалом покоя волосковых клеток улитки (от –40 до –70 мВ), что создает электрический градиент 120–150 мВ на апикальной мембране волосковых клеток [47]. МЭТ-каналы достаточно велики, чтобы позволить аминогликозидам и другим крупным катионам проникать в цитозоль волосковых клеток. Аминогликозиды, по-видимому, конкурируют с ионами Са2+ за связывание в поре канала. Попав внутрь волосковых клеток, аминогликозиды, вероятно, не могут выйти через МЭТ-каналы, поскольку внутриклеточная сторона не имеет преддверия и обладает высоким энергетическим барьером для повторного входа в канал из цитозоля [47, 48, 49]. Истощая внутриклеточный пул PIP2, аминогликозиды ингибируют потенциалзависимые калиевые каналы, предотвращая реполяризацию и приводя к устойчивой клеточной деполяризации волосковых клеток, что, вероятно, способствует их гибели [52].
Другие пути поступления аминогликозидов в волосковые клетки менее важны, чем МЭТ-каналы, но они приобретают значение, когда каналы МЭТ не функционируют. Имеются данные о роли в эндоцитозе аминогликозидов семейства ионных каналов, называемых каналами транзиторного рецепторного потенциала (TRP) [53].
Сначала системно вводимые аминогликозиды вызывают гибель наружных волосковых клеток (НВК) базальной области улитки, которые служат для восприятия высоких частот. Продолжение воздействия приводит к гибели НВК апикальных областей улитки, которые воспринимают более низкие частоты; кроме того, начинают отмирать внутренние волосковые клетки [54]. Окружающие поддерживающие клетки расширяются между отмирающими волосковыми клетками, соседние клетки формируют апикальные плотные контакты для поддержания структурной целостности ретикулярной пластинки кортиева органа, создавая подобие рубца [55].
Попадая во внутреннее ухо, аминогликозиды вызывают ототоксичность посредством множества механизмов, воздействуя на сенсорные волосковые клетки или несенсорные клетки с гомеостатическими функциями, например, на маргинальные и промежуточные клетки сосудистой полоски [56, 57]. Кроме того, ототоксичность может возникать в нервных путях между периферическим внутренним ухом и корой головного мозга, нарушая слуховое и вестибулярное восприятие.
В перилимфе аминогликозиды могут блокировать эфферентные синапсы у основания наружных волосковых клеток, ингибируя холинергические никотиноподобные рецепторы (nAchR) за счет вытеснения Ca2+ из мест его специфического связывания; такой блок на уровне постсинаптической мембраны наружных волосковых клеток нарушает медиальный оливокохлеарный рефлекс, который защищает слуховые волосковые клетки от воздействия громких звуков [58, 59].
В цитоплазме аминогликозиды связываются с сотнями белков; для большинства последствия неизвестны. Аминогликозиды также связываются с липидами семейства фосфатидилинозитолов, особенно с фосфатидилинозитол-4,5-бисфосфатом (PIP2), который блокирует потенциалзависимые калиевые каналы внутреннего выпрямления на базолатеральных мембранах НВК [52, 60]. Внутриклеточные аминогликозиды участвуют в деградации пресинаптических лент в волосковых клетках, что может лежать в основе жалоб на потерю слуховой функции в областях улитки, несмотря на наличие множества выживших волосковых клеток [61].
У бактерий аминогликозиды связываются с рибосомной РНК, вызывая нарушение считывания матричной РНК (мРНК) и, как следствие, накопление неправильно свернутых белков, что приводит к клеточному стрессу и лизису бактериальной клетки [62]. Поскольку аминогликозиды нацелены на бактерии, они также легко разрушают митохондрии внутри клеток, вызывая выход проапоптозных факторов и окислительных ферментов в цитоплазму и вызывая образование свободных радикалов [63, 64]. Фактически механизм цитотоксичности включает стресс эндоплазматического ретикулума и нарушение целостности митохондрий, вызывающее выработку токсичных активных форм кислорода, которые приводят к гибели клеток — прежде всего волосковых [63, 65]. Эстерберг с соавт. изучали роль аминогликозидов в волосковых клетках невромастов рыбок данио и показали, что они нарушают регуляцию функции эндоплазматического ретикулума, что приводит к току кальция в митохондрии и к генерации цитотоксических концентраций активных форм кислорода [63, 66, 67].
Отдельные митохондриальные мутации (преимущественно A1555G) в рибосомной РНК приводят к более высокому сродству связывания аминогликозидов и могут вызывать неправильную трансляцию мРНК во время синтеза белка, что приводит к гибели клеток [68, 69, 70].
Кроме того, некоторые аминогликозиды (гентамицин, стрептомицин) могут воздействовать на отолитовую мембрану, изменяя ее ионный состав и вызывая вестибулярную токсичность [71, 72].
5. Генетическая предрасположенность к ототоксичности аминогликозидов
Эффект аминогликозидов обусловлен взаимодействием с 30S-субъединицей бактериальной рибосомы. Они связываются с парами оснований C1409-G1491 в А-сайте бактериальной 16S-рРНК и, таким образом, вызывают нарушение трансляции белка или ее преждевременную терминацию [73].
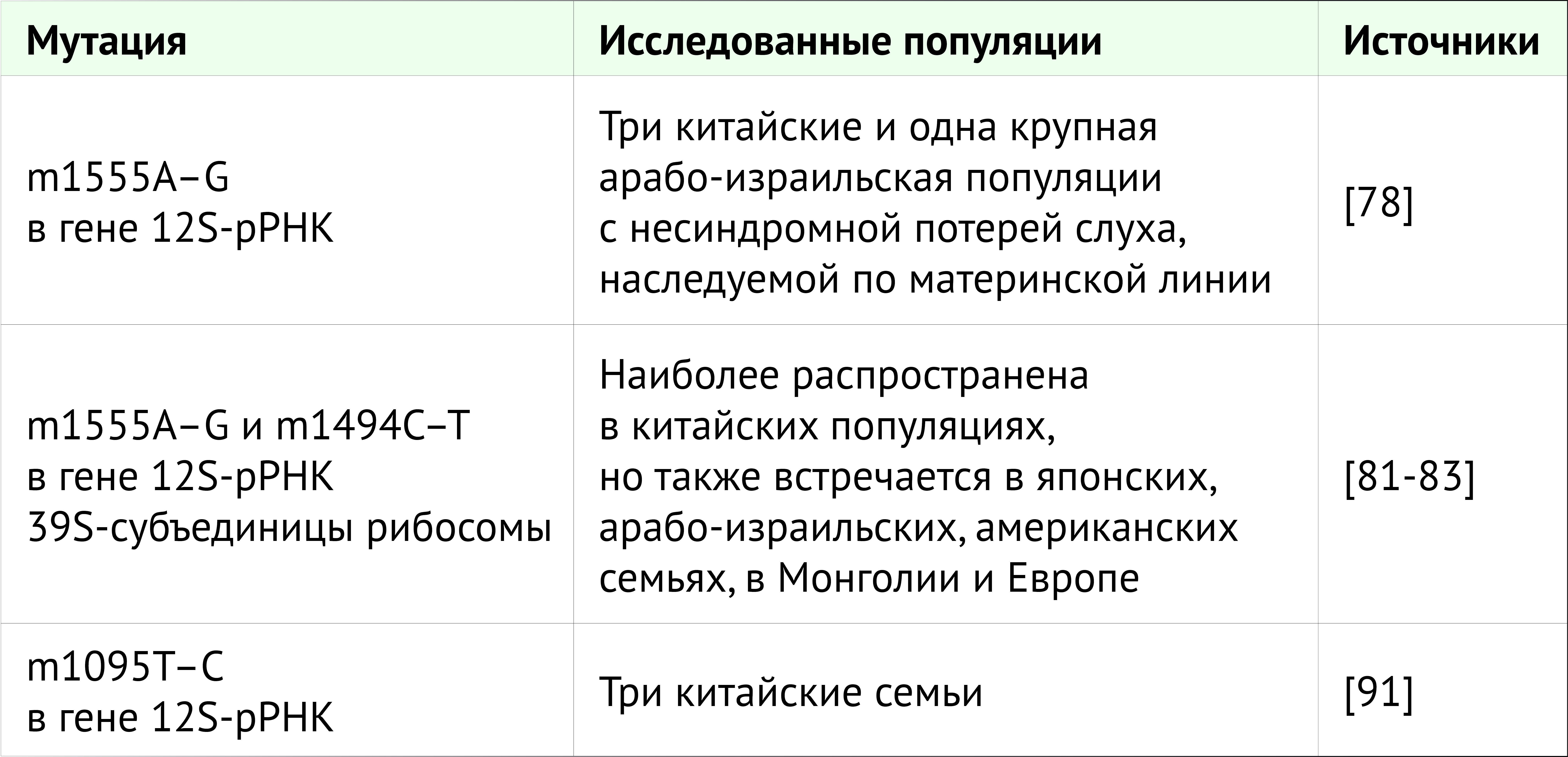
Рибосомные рРНК входят в состав двух субъединиц разного размера. Структура рибосом прокариот очень похожа на таковую у эукариот. Первая представляет собой 70S-рибосому, образованную малой субъединицей 30S и большой субъединицей 50S; 80S-рибосома эукариот образована субъединицами 40S и 60S [74]. Структурные различия между 70S- и 80S-рибосомами легли в основу создания антибиотиков, направленных против бактерий, но не повреждающих клетки человека [75]. Митохондриальные рибосомы образованы маленькой 28S- и большой 39S- субъединицами и выполняют функцию трансляции митохондриальной мРНК; митохондриальная рибосома содержит 12S-рРНК, митохондриальный гомолог прокариотической 16S-рРНК и эукариотической 18S-рРНК. Даже если митохондриальные рибосомы подобны бактериальным, регулярное введение аминогликозидов низкотоксично для клеток человека из-за двойной мембраны, которая окружает митохондрии и блокирует проникновение лекарств в органеллу [75, 76, 77]. Была исследована генетическая предрасположенность к ототоксичности, связанной с аминогликозидами. Такая чувствительность касается митохондриального генома млекопитающих и передается исключительно по женской зародышевой линии. Наиболее распространенные мутации РНК, предрасполагающие к ототоксичности аминогликозидов, представлены в таблице 2.
Презант с соавт. провели первое генетическое исследование ототоксической потери слуха, ища мутации в генах рРНК в трех китайских и большой арабо-израильской родословной с наследственной несиндромальной тугоухостью по материнской линии [78]. У пациентов с ототоксичностью, вызванной аминогликозидами, в отличие от контрольной группы, они обнаружили мутацию с заменой 1555A на G в гене 12S-рРНК. Наиболее хорошо изученными мутациями митохондриальной ДНК, связанными с ототоксической потерей слуха, являются мутации с заменой 1555A на G и 1494C на T в гене 12S-рРНК 39S-субъединицы. Аденин в положении 1555 в гене 12S-митохондриальной рРНК, по-видимому, эквивалентен положению 1491 в гене 16S-рРНК у Escherichia coli [79]. При замене 1555A на G вторичная структура 12S-рРНК изменяется и становится очень похожей на соответствующую область 16S-рРНК у E. coli. Эта мутация определяет конформационные изменения в структуре 12S-рРНК и, возможно, новая пара G–C образует сайт связывания аминогликозидов в А-сайте рРНК [80]. Ряд исследований был посвящен встречаемости мутации с заменой 1555A на G по всему миру: они наиболее распространены у лиц китайского происхождения, но были обнаружены также в семьях японцев, арабов Израиля, в США, в Монголии и Европе [81, 82, 83, 84]. Частота этой мутации составила примерно 33% в двух японских группах, 13% в китайской группе и 17% в двух группах из США и Испании [85, 86, 87, 88, 89].
Мутация с заменой 1494C на T встречается реже, чем мутация с заменой 1555A на G. Лю с соавт. исследовали встречаемость таких мутаций у китайских детей с потерей слуха и обнаружили частоту 3,96% для m1555A–G и 0,18% — для m1494С–Т [82]. Замена 1494C на T также способствует гиперчувствительности к аминогликозидам; С в положении 1494 А-сайта 12S-рРНК соответствует А в положении 1555; возможно, эта мутация определяет конформационные изменения, которые благоприятствуют связыванию аминогликозидов [90].
Сообщается о других мутациях митохондриальной рРНК, коррелирующих с несиндромальной потерей слуха, но они имеют низкую частоту. Чжао с соавт. показали замену 1095T на C в трех китайских семьях с ототоксической тугоухостью [91]. Эта мутация в гене 12S-рРНК может влиять на инициацию синтеза митохондриального белка [92]. Прочие мутации в разных локусах 12S рРНК имеют неясное значение.
Мутация с заменой 1555A на G вызывала снижение скорости синтеза белка в митохондриях на 28% и 50% в клеточных линиях лимфоцитов, полученных от бессимптомных и симптоматических пациентов из арабо-израильской семьи, соответственно [80, 93]. Однако в гибридных клеточных линиях с постоянным ядерным фоном не было обнаружено существенной разницы между двумя группами (35 и 37%): вероятно, ядерные гены также вносят вклад в биохимический фенотип клеток, несущих мутации.
Некоторые генетические исследования показали, что вариабельная пенетрантность потери слуха, связанной с аминогликозидами, может быть обусловлена ядерно-генетическим фоном. Были определены четыре ядерных гена: MTO1 (оптимизация митохондриальной транскрипции 1), GTPBP3 (GTP-связывающий белок 3), TRMU (5-метиламинометил-2-тиоуридилатеметилтрансфераза) и TFB1M (митохондриальный фактор транскрипции 1). Предполагается, что GTPBP3, MTO1 и TRMU действуют путем изменения точности взаимодействия между антикодоном тРНК и кодоном мРНК в A-сайте, но остается неясным, как на потерю слуха, связанную с аминогликозидами, влияет TFB1M [94, 95, 96].
У лиц с мутациями m1555A–G или m1494C–T эти замены представляют собой основные, но не единственные факторы развития глухоты; они делают людей склонными к ухудшению слуха. Мутации, происходящие в митохондриальной 12S-рРНК, вызывают конформационное изменение А-сайта, которое нарушает синтез белка в митохондриях, влияя на взаимодействие кодонов [69]. Кроме того, в этих клетках наблюдается снижение образования АТФ и увеличение продукции активных форм кислорода [97]. Системно введенные аминогликозиды концентрируются в клетках улитки и поглощаются митохондриями волосковых клеток [69]. В присутствии аминогликозидов в клетках, несущих одну из этих мутаций, скорость митохондриальной трансляции может снизиться примерно на 30%, что ниже минимального уровня, необходимого для выживания [80, 98]. В частности, в присутствии аминогликозидов мутация с заменой 1555A на G усиливает их связывание с 12S-рРНК и изменяет характер химических модификаций диметилсульфатом. Недостаточный синтез белка, усугубляемый накоплением аминогликозидов, приводит к апоптозу волосковых клеток. Повреждение начинается у основания улитки и распространяется к ее вершине, от наружных волосковых клеток ко внутренним [99].
Таблица 2. Наиболее распространенные мутации РНК, предрасполагающие к ототоксичности аминогликозидов, и их распространение в мире.
6. Факторы, повышающие риск ототоксичности, вызванной аминогликозидами
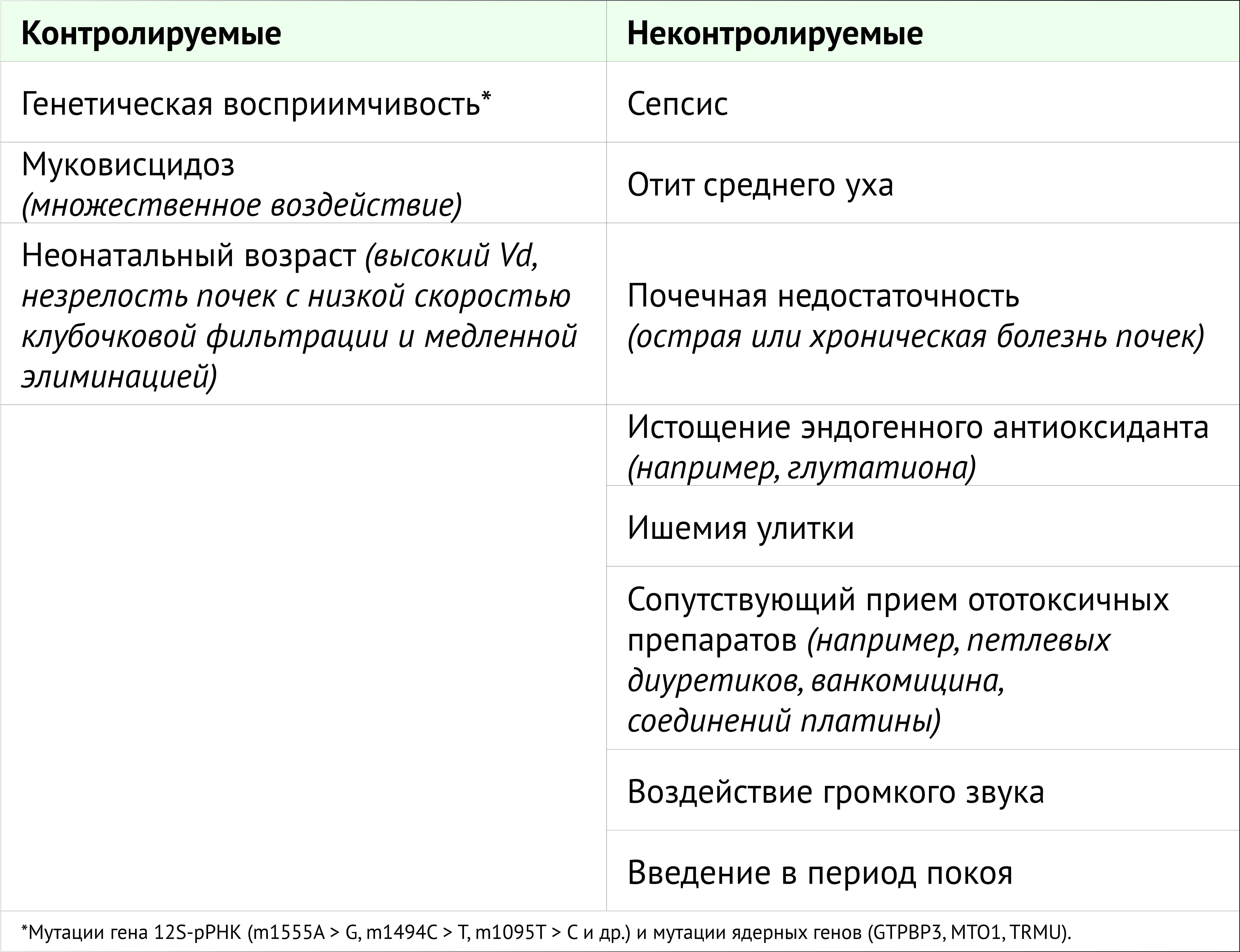
Помимо генетической предрасположенности, повышению риска нарушения слуха после воздействия аминогликозидов способствуют и внешние факторы (таблица 3).
Таблица 3. Факторы, усиливающие ототоксичность аминогликозидов.
Ототоксичность аминогликозидов усиливает септическое состояние: у мышей сепсис, вызванный парентеральным введением липополисахаридов (ЛПС), повышает степень потери слуха [44]. Механизмы, с помощью которых воспаление усугубляет вызванную аминогликозидами кохлеотоксичность, остаются неясными [100]. TRPV1 представляет собой ключевой канал доставки аминогликозидов из крови в чувствительные волосковые клетки, опосредуя поглощение этих соединений [43]. In vitro показано, что агонисты TRPV1 увеличивают поглощение гентамицина волосковыми клетками. Активация Toll-подобного рецептора 4 (TLR4) может усиливать активность TRPV1, а ЛПС служит мощным агонистом TLR4 [101]. Таким образом, системное введение ЛПС может активировать TLR4, усиливая экспрессию в улитке проницаемого для аминогликозидов TRPV1, способствуя клеточному поглощению аминогликозидов. Это может лежать в основе последующего обострения кохлеотоксичности [100] (рисунок 2).
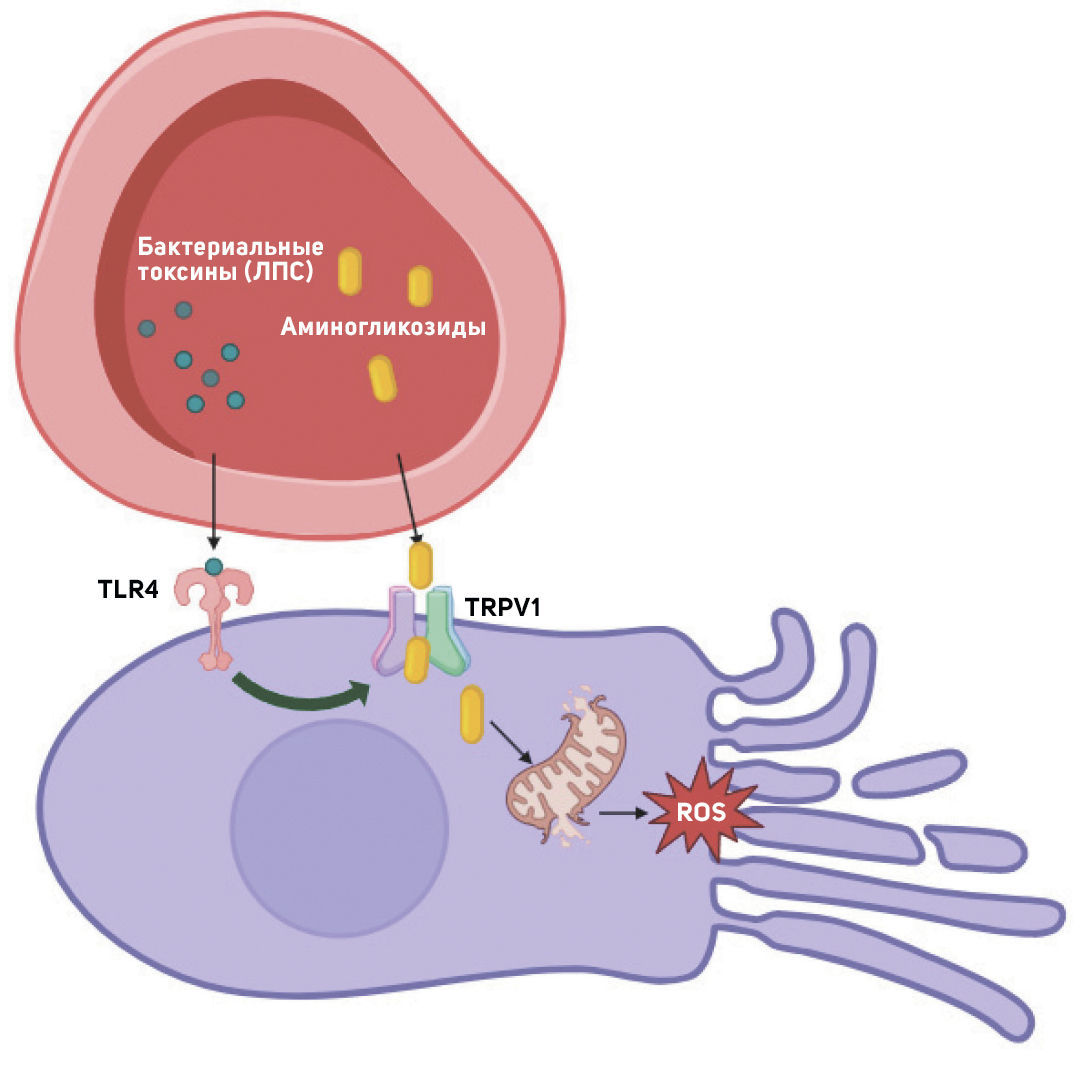
In vivo аминогликозиды, вводимые во время инфекции, лизируют бактерии и повышают уровень в крови иммуногенов, таких как ЛПС, усиливая провоспалительные сигнальные пути [102].
Ингибирование TRPV1 приводит к снижению уровня белка STAT1 (signal transducer and activation of transcription-1) по сравнению со STAT3 — транскрипционным фактором, способствующим выживанию волосковых клеток [103, 104]. Мутации TLR4 или TRPV1, которые снижают уровень проапоптозного STAT1, могут обусловливать способность значительной части людей с муковисцидозом сохранять типичные пороги слуха, несмотря на высокие кумулятивные дозы аминогликозидов [105]. Увеличение количества внеклеточных ионов кальция ингибирует входящие токи, опосредованные TRPV1, снижает поглощение клетками (флуоресцентно меченного) гентамицина и уменьшает цитотоксичность, вызванную лекарственными средствами [106].
Системное воспаление также обусловливает вазодилатацию в сосудистой полоске, что может усиливать поглощение аминогликозидов в улитке [44].
Местная инфекция, такая как острый отит среднего уха, также может усугубить ототоксическое повреждение аминогликозидами. На животных моделях было продемонстрировано, что воспаление уха усиливает поглощение флуоресцентно меченного гентамицина волосковыми клетками [107].
Другим клиническим фактором является сопутствующая почечная недостаточность, снижающая выведение аминогликозидов и повышающая их концентрацию в крови [108].
Исследование детей, страдающих хронической почечной недостаточностью, показало, что у этих пациентов на фоне применения фуросемида и аминогликозидов значительно увеличивалась частота возникновения сенсоневральной тугоухости [109]. Было высказано предположение, что при хронической почечной недостаточности происходят электролитные нарушения, которые могут изменить состав эндолимфы и быть причиной потери слуха [110].
Очевидно, что пациенты с хронической болезнью почек более склонны к развитию нейросенсорной тугоухости [111]. Уремические токсины могут вызывать серьезные повреждения улитки [112]. Снижение активности аденозинтрифосфатазной натрий-калиевой помпы (Na+/K+-АТФазы), амплитуд кохлеарных потенциалов и дальнейшее снижение скоростной проводимости слухового нерва приводят к ухудшению слуха. Гемодиализ, хотя и является заместительной почечной терапией при уремии, служит фактором риска развития нейросенсорной тугоухости из-за нарушения осмотического равновесия эндолимфы, развития ишемии и последующей реперфузии, что может привести к нарушению слуха [110, 113, 114, 115].
Истощение эндогенных антиоксидантов, типичное для состояния недостатка питательных веществ, может повысить потенциал ототоксичности аминогликозидов за счет усиления роли активных форм кислорода (АФК). Исследование на животных показало, что тяжесть потери слуха зависит от предсуществующего уровня глутатиона в тканях, который будет низким при диете с ограничением белка. Если уровень глутатиона восстанавливали с помощью пищевых добавок, глухота значительно уменьшалась. Напротив, было показано, что здоровым свиньям без дефицита питательных веществ дополнительное введение глутатиона не приносило пользы, а дальнейшее повышение уровня глутатиона предотвращается гомеостатическим контролем [116]. Кроме того, ишемия улитки и последующее реперфузионное повреждение могут усилить ототоксичность аминогликозидов, если их вводить после транзиторной ишемии [117]. Используя метод отслеживания флуоресцентного гентамицина, Лин с соавт. продемонстрировали повышение поглощения гентамицина после транзиторной ишемии улитки. То, что ишемия способствует ототоксичности аминогликозидов, может объяснить ряд факторов: она влияет на целостность и проницаемость гемато-лабиринтного барьера посредством микроциркуляторных нарушений и окислительного стресса, а также вызывает выделение свободного железа, которое может хелатировать аминогликозиды и запускать каскады образования АФК; кроме того, ишемия улитки усиливает апоптотическую гибель клеток посредством с участием каспаз [117].
Одновременное применение некоторых препаратов, например петлевых диуретиков и ванкомицина, синергически усиливает ототоксичность аминогликозидов. Исследование на животной модели показало, что комбинация антибиотиков (ванкомицина и гентамицина) повышает риск ототоксичности [118]. Другими ототоксичными препаратами являются петлевые диуретики [119]. Назначение аминогликозидов с последующим приемом фуросемида может увеличить риск ототоксичности; аминогликозид взаимодействует с клеточными мембранами внутреннего уха, повышая их проницаемость. Теоретически это позволяет петлевому диуретику проникать в клетки в более высоких концентрациях, вызывая более серьезные повреждения [120].
У онкологических пациентов риск ототоксичности, связанной с введением аминогликозидов, добавляется к ототоксическому действию соединений платины. Нарушение слуха представляет собой один из основных токсических эффектов соединений платины, возникающих в результате дегенерации волосковых клеток уха. Такая потеря слуха необратимая, двусторонняя и нейросенсорная. Цисплатин — наиболее ототоксичный агент. Его токсичность выше при более высоких кумулятивных дозах, в более раннем возрасте (наибольший риск наблюдается у детей до пяти лет) и при болюсной инфузии по сравнению с кратковременной [121, 122]. В исследованиях на животных сообщалось о синергическом токсическом эффекте аминогликозидов и цисплатина; комбинированное введение цисплатина и гентамицина морским свинкам усиливало ототоксический эффект, если цисплатин вводился в начале 14-дневного курса гентамицина [123].
В течение многих лет было известно, что кохлеотоксичность аминогликозидов усиливает воздействие шума; субототоксические дозы этих препаратов становятся токсичными при громких звуках. Шумовое воздействие вызывает расширение сосудов сосудистой полоски, что усиливает поступление аминогликозидов в улитку. Оно также способствует поглощению аминогликозидов, активируя проницаемые для аминогликозидов каналы, экспрессируемые волосковыми клетками [124]. Кроме того, шум приводит к образованию АФК и запускает гибель внешних волосковых клеток с участием AMPKα (ROS/5’-adenosine monophosphate activated protein kinase)-зависимого пути [125].
Воздействие громкого звука за два месяца до введения аминогликозидов усиливает ототоксичность по сравнению с таковой при введении аминогликозидов без предварительного шума [126]. Если воздействие громкого звука происходит по крайней мере на четыре недели позже, ототоксический синергизм незначителен или отсутствует. Воздействие шума в течение трех недель после введения препарата усиливает ототоксические эффекты, тяжесть которых со временем будет уменьшаться [127, 128].
Кроме того, тяжесть ототоксичности аминогликозидов варьируется в зависимости от циркадного времени ежедневного приема. Введение аминогликозидов во время отдыха было связано с повышенным риском потери слуха у мышей: вероятно, циркадный ритм влияет на ототоксичность [129, 130].
Наконец, состоянием, связанным с повышенным риском вызываемой аминогликозидами ототоксичности, является муковисцидоз, аутосомно-рецессивное генетическое заболевание. Пациентов часто госпитализируют из-за опасной для жизни инфекции легких, требующей внутривенной терапии антибиотиками, особенно аминогликозидами и гликопептидами, против Pseudomonas aeruginosa, резистентного к метициллину Staphylococcus aureus и других микроорганизмов. Таким образом, люди, страдающие муковисцидозом, в течение жизни проходят множество курсов терапии аминогликозидами [131, 132]. У пациентов с муковисцидозом кумулятивное внутривенное введение антибиотиков оказывает существенное негативное влияние на функции слуха [133]. Распространенность приобретенной глухоты у взрослых пациентов колеблется от 0 до 47% по сравнению с 11–18% в сопоставимых по возрасту группах взрослых без муковисцидоза или приема аминогликозидов в анамнезе [134, 135, 136].
Пациенты с муковисцидозом хронически колонизированы Pseudomonas aeruginosa, поэтому для лечения легочных обострений часто требуется несколько курсов внутривенного введения аминогликозидных антибиотиков. Поскольку эти антибиотики можно назначать в более высоких дозах реже, было проведено несколько исследований для оценки эффективности и безопасности внутривенного введения аминогликозидов один раз в день по сравнению с приемом препаратов несколько раз в день. Для детей введение один раз в день менее нефротоксично, чем многократное, что проявляется меньшей степенью повышения уровня креатинина по сравнению с исходным [137, 138]. В отношении ототоксичности результаты исследований не столь обнадеживают. Недавний Кокрейновский обзор показал, что при лечении легочных обострений муковисцидоза прием аминогликозидных антибиотиков один и три раза в день одинаково эффективен. При анализе частоты ототоксичности в двух группах значительной разницы в относительном риске между приемом препарата один раз и трижды в день выявлено не было: относительный риск составил 0,56 (95% ДИ от 0,04 до 7,96, данные среднего качества) [138].
7. Профилактика ототоксичности аминогликозидов
Ототоксический эффект аминогликозидов необратим, поскольку волосковые клетки не обладают способностью к регенерации [139], поэтому крайне важно определить стратегии для снижения риска потери слуха. Теоретически профилактику ототоксичности аминогликозидов можно реализовать на разных уровнях. Для предотвращения потери слуха, вызванной аминогликозидами, было предложено несколько отопротекторных средств. Однако ни один из разрабатываемых отопротекторов в настоящее время для этой цели не одобрен.
Поскольку в механизмах аминогликозидной ототоксичности участвуют АФК, тщательно изучалось блокирование продукции или воздействия свободных радикалов и проапоптозных факторов. Молекулы, ингибирующие один из многих этапов апоптотического каскада, эффективны для защиты волосковых клеток in vitro и, в некоторой степени, in vivo [140, 141]. Аминогликозиды связываются с большим количеством внутриклеточных белков, и пока неясно, какие из них имеют решающее значение для выживания клеток, а какие могут секвестрировать препарат для защиты клеток.
Введение антиоксидантов эффективно на животных моделях с ототоксическими аминогликозидами. Подавлялись как вестибулярные, так и кохлеарные побочные эффекты различных аминогликозидов [142, 143]. Аспирин (салицилат) считается антиоксидантным препаратом, способным связывать свободные радикалы кислорода. Обнаружено, что применение аспирина при терапии аминогликозидами снижает степень потери наружных волосковых клеток [144]. Кроме того, аспирин способствует транслокации NF-κB из цитоплазмы в ядро (и препятствует апоптозу во внешних волосковых клетках), что указывает на дополнительный механизм отопротекции [145, 146]. Таким образом, аспирин представляет собой недорогой антиоксидант, который оказывать благоприятные воздействия на орган слуха при терапии аминогликозидами.
Было показано, что антиоксидант D-метионин потенциально участвует в предотвращении ототоксичности, вызванной гентамицином и амикацином, за счет механизма детоксикации свободных радикалов, предотвращения гибели волосковых клеток и повышения уровня глутатиона в митохондриях улитки [147, 148]. Исследование на морских свинках продемонстрировало, что D-метионин обладает способностью дозозависимо снижать ототоксичность, вызванную тобрамицином, не влияя на противомикробное действие аминогликозидов или на уровень гентамицина в сыворотке [149]. Хотя отопротекторные механизмы D-метионина еще не выяснены полностью, известно, что он выступает в качестве антиоксиданта и не влияет на ингибирование 30S-субъединицы рибосомы.
Защита от ототоксичности аминогликозидов также была показана для широкого спектра антиоксидантов (например, липоевой кислоты, кофермента Q10, витамина Е) [150, 151].
При воздействии громкого звука введение антиоксидантов, таких как форсколин или N-ацетилцистеин (NAC), снижает образование АФК, предотвращает активацию AMPKα и тем самым уменьшает гибель наружных волосковых клеток и потерю слуха через час после завершения шумового воздействия [125]. Совместное применение NAC с аминогликозидами показало безопасность и отопротекторный эффект, в том числе у пациентов с терминальной стадией почечной недостаточности [152, 153]. Тем не менее, его рутинное использование не принято, поскольку NAC антогонистичен по отношению к антимикробной эффективности гентамицина и тобрамицина [154].
Фенофибрат представляется многообещающим для снижения окислительного стресса, вызванного аминогликозидами, в клинической практике. Он служит активатором рецепторов PPAR-α, используемых для снижения уровня холестерина у пациентов с риском сердечно-сосудистых заболеваний [155]. В доклинических исследованиях был показан отопротекторный эффект фенофибрата против потери слуха, вызванной гентамицином; он опосредовал индукцию экспрессии антиоксидантных ферментов [156].
У морских свинок как улитковую, так и вестибулярную токсичность аминогликозидов снижало применение хелаторов железа [143].
В недавнем исследовании проверяли применение экстракта моринги в качестве антиоксиданта для предотвращения потери слуха, вызванной аминогликозидами; данные in vitro показали значительную защиту волосковых клеток от гибели, вызываемой гентамицином, за счет подавления АФК, сохранения активности цитохромоксидазы и снижения активности каспаз и апоптоза клеток [157].
Альтернативной отопротекторной стратегией может быть блокирование поступления ототоксина в жидкость улитки и волосковые клетки. Необходимы дополнительные исследования, улучшающие понимание механизмов проницаемости гемато-лабиринтного барьера. Следует рассмотреть стратегию использования конкурентных блокаторов МЭТ-канала — основного канала поступления аминогликозидов в клетки. Было обнаружено, что различные блокаторы MЭT-каналов (например, амилорид, хинин или кураре) защищают волосковые клетки от гибели in vitro, но in vivo их терапевтические свойства не показаны [46]. Например, D-тубокурарин представляет собой блокатор МЭТ-каналов и в наружных волосковых клетках мышей in vitro проникает в них медленнее, чем аминогликозиды; при этом он защищает волосковые клетки в культурах рыбок данио и улитки мыши [158]. Однако это соединение оказывает антихолинергическое действие in vivo, блокируя рефлекс среднего уха, вызывая ремоделирование стереоцилий и временную потерю слуха [159].
Более того, с аминогликозидами в качестве блокатора МЭТ-каналов конкурирует кальций. В исследованиях на млекопитающих низкие уровни кальция приводят к значительному поглощению аминогликозидов волосковыми клетками и, наоборот, более высокие уровни кальция оказывают отопротекторное действие [160, 161]. Тем не менее, эксперименты in vivo показали противоположные результаты. Эстерберг с соавт. продемонстрировали, что скачки уровня кальция в эндоплазматическом ретикулуме и митохондриях усиливают митохондриальное дыхание и продукцию АФК и приводят к коллапсу мембранного потенциала митохондрий, выходу Ca2+ в цитозоль и последующей гибели клеток [66].
Новым отопротекторным препаратом может стать проникающая в клетки пептидная вакцина GV1001, которая, как недавно было показано, уменьшает воспалительные реакции, окислительный стресс и апоптоз. Недавнее исследование на мышах показало значительное снижение уровня гибели наружных волосковых клеток и, как следствие, уменьшение потери слуха, которые наблюдались при парентеральном введении пептида одновременно с дозой аминогликозида и фуросемида [162].
Внедрение доклинических механизмов отопротекции в клиническую практику остается сложной задачей на многих уровнях. Эти стратегии, изученные in vitro или in vivo, потенциально применимы в клинической практике, но нуждаются в валидации. Основным требованием для внедрения потенциального отопротектора в клиническую практику является то, что эффективность защиты не должна распространяться на бактерии.
Еще одним перспективным подходом является изменение структуры ототоксина для снижения ототоксичности. Например, апрамицин — аминогликозид, одобренный для использования в ветеринарии, — представляет собой антибиотик широкого спектра действия с относительно небольшой ототоксичностью, поскольку он обладает очень низкой активностью в отношении митохондриальных рибосом [70]. Так или иначе, целесообразной стратегией в клинической практике будет выбор наименее ототоксичных аминогликозидов. Известно, что амикацин менее ототоксичен, чем гентамицин [163]. Сходным образом, этимицин и амикацин показали меньшую ототоксичность волосковых клетках и меньшую нефротоксичность по сравнению с гентамицином из-за минимального окислительного потенциала этого препарата [164]. Многообещающей может оказаться оптимизация существующего аминогликозида сизомицина, направленная на уменьшение количества положительных зарядов, которые опосредуют его захват волосковыми клетками. Как следствие, был синтезирован новый препарат (N1MS) с меньшим, чем у сисомицина, сродством к МЭТ-каналам, но его нельзя использовать в клинической практике из-за суженного спектра антибактериальной активности [76].
Несомненно, важную роль в предотвращении ототоксичности играет рациональное использование антибиотиков, подразумевающее ограничения использования аминогликозидов и снижение риска бактериальной резистентности.
В нескольких исследованиях сравнивали однократное и многократное введение аминогликозидов в течение дня с точки зрения эффективности и нефротоксичности. Метаанализы этих клинических исследований показали небольшой, но статистически значимый клинический результат при приеме один раз в день и значительно меньшую частоту нефротоксичности [164, 165, 166, 167, 168]. Таким образом, схемы дозирования один раз в день имеют аналогичную или несколько большую эффективность, чем схемы приема препарата несколько раз в день. Если используются более короткие курсы терапии (не более 5–6 дней), режим приема один раз в день также может отсрочить наступление нефротоксичности по сравнению с режимом, при котором прием препарата происходит несколько раз в день.
Имеющиеся данные говорят о том, что у взрослых и детей прием аминогликозидов один раз в день переносится лучше, чем обычные схемы приема (два или три раза в день), и имеет потенциальные фармакодинамические преимущества [169, 170].
Поскольку мутации в 12S-рРНК вызывают генетическую предрасположенность к развитию тугоухости вследствие приема аминогликозидов, семейный анамнез приобретенной глухоты может ориентировать врачей на выбор альтернативных лекарств вместо аминогликозидов. Следует избегать сочетания аминогликозидов с другими ототоксичными препаратами.
8. Заключение
Аминогликозиды представляют собой краеугольный камень в терапии многих различных инфекционных заболеваний, и их часто используют для лечения детей. Однако они могут определять токсические эффекты, в том числе поражение слуха, особенно у детей и новорожденных, которые более восприимчивы к повреждению аминогликозидами из-за медленного выведения вследствие незрелости почек, повышенного Vd вследствие высокого содержания воды в организме и усиленной проницаемости гемато-лабиринтного барьера. Эти элементы делают детей более восприимчивыми к ототоксическому повреждению по сравнению со взрослыми, что приводит к более высокому риску нарушений речевого и когнитивного развития.
Имеющиеся на сегодняшний день знания говорят о том, что существует не так много стратегий, способных предотвратить ототоксичность аминогликозидов, за исключением способа введения и избегания совместного применения с диуретиками. Поиск средств, способных уменьшить повреждение слуха, вызываемое аминогликозидами, представляет собой задачу, которая до сих пор остается нерешенной. Преодоление этой трудности позволит добиться значительного улучшения качества жизни детей, проходящих терапию аминогликозидами.
