Старение клеток-предшественников и регенерация мышц: в чем связь?

В недавно в Nature была опубликована работа, в которой Моисеева с соавт. изучили стареющие клетки, среди которых фибро-/адипогенные клетки-предшественники (FAP), стволовые клетки мышц (СКМ) и макрофаги. Они создают воспалительную и фиброзную нишу, ингибируя активацию СКМ и регенерацию мышц [1]. Исследователи разработали метод для различия эндогенных стареющих клеток и показали важность клеточного старения как потенциальной мишени для улучшения регенерации и восстановления мышц (рис. 1) [1].
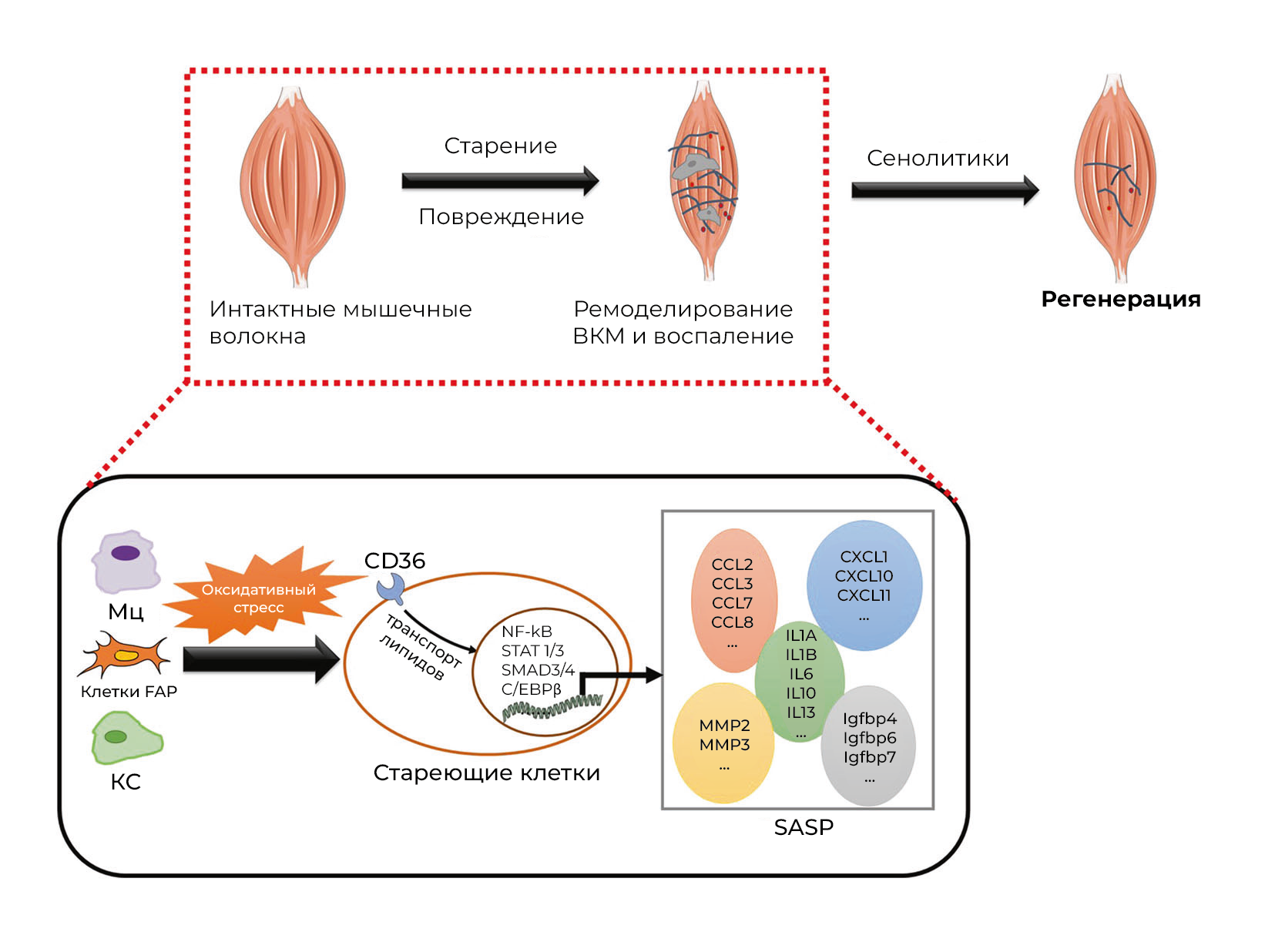
Мц — моноциты или макрофаги;
Клетки FAP — фибро/адипогенные клетки-предшественники;
КС — клетки-сателлиты;
SASP — секреторный фенотип, ассоциированный со старением;
ВКМ — внеклеточный матрикс.
FAP — это группа мезенхимальных стромальных клеток, которые специфически экспрессируют ген Pdgfrα. Многочисленные исследования последнего десятилетия показали, что FAP являются доминирующим типом клеток, которые способствуют ремоделированию внеклеточного матрикса (ВКМ). Ремоделирование приводит к мышечному фиброзу и жировой инфильтрации в процессах регенерации и дегенерации мышц. Более того, при изучении биологии клеток FAP выявляется проблема «палки о двух концах». Эти клетки поддерживают активацию СКМ в условиях регенерации. Напротив, FAP также могут дифференцироваться в адипоциты и миофибробласты, что приводит к фиброзно-жировой дегенерации в поврежденных или атрофированных мышцах. Помимо этого, FAP могут нарушать активацию СКМ путем воздействия на секретом в дегенерирующей мышце [2]. В общем, состояние FAP в значительной степени регулирует ниши стволовых клеток.
Клеточное старение — это необратимая остановка клеточного цикла в клетках, утративших функциональную активность, что выражается в устойчивости клеток к гибели [апоптозу] [1]. Старение может наблюдаться как в нормальных, так и в аномальных условиях, например, при поэтапном развитии клетки или же повреждении. В некоторых ситуациях старение оказывается полезным для здоровья. Например, его индукция в опухолевых клетках способна предотвратить онкогенез [3]. Однако такие клетки могут представлять и угрозу в период старения тканей: их секретом, иначе называемый секреторным фенотипом, ассоциированным со старением (SASP — от англ. senescence-associated secretory phenotype) влияет на воспалительное микроокружение, что может в значительной степени ухудшить регенерацию тканей [3].
Хотя несколько исследований показали, что старение клеток FAP может влиять на гомеостаз мышц, роль этих клеток в регенерации мышечной ткани остается спорной. Сайто с соавт. показали, что старение FAP, индуцированное физическими упражнениями, способствует регенерации острых повреждений мышечной ткани. Исследователи выявили, что физические упражнения запускают активацию сигнального пути AMPK и вызывают старение FAP. Кроме того, стареющие FAP могут легче элиминироваться макрофагами, что является ключевым этапом регенерации мышц [4]. Однако согласно данным другого исследования, стареющие клетки FAP в мышцах у больных прогерией негативно влияют на функцию СКМ. Мышечная дегенерация может быть предотвращена за счет элиминации стареющих FAP [5]. Исследования показывают, что усиление выведения стареющих FAP — многообещающий способ стимуляции регенерации мышц.
Настоящее исследование, опубликованное в Nature, подтверждает гипотезу о том, что старение FAP — нежелательное событие для регенерации мышц даже у молодых людей [1]. Авторы спроектировали методику, позволяющую отследить и изолировать стареющие клетки в условиях in vivo путем мечения классических биомаркеров старения p16INK4a (кодируется геном CDKN2A) и связанной с процессом старения β-галактозидазы (SA-β-gal); в эксперименте использовались мыши генетической линии p16-3MR и флуоресцентный зонд, названный SPIDER. Авторы обнаружили, что редкие стареющие клетки выявлялись в неповрежденных мышцах, однако их число резко возрастало на ранней стадии острой травмы (3 дня после травмы) и уменьшалось через 7 дней после травмы. У старых мышей этот процесс был заторможен. Затем исследователи обнаружили, что клеточное старение оказалось более выраженным в мышцах с хроническим повреждением. Данные результаты показывают, что стареющие клетки могут образовываться в результате травмы, а также наблюдается положительная корреляция между их появлением и старением человека или тяжестью травмы [1]. С результатами предыдущих исследований согласуется тот факт, что элиминация таких клеток может способствовать эффективной регенерации мышц независимо от возраста. Однако авторы также показали, что стареющие клетки молодых мышей характеризуются определенными «исходными» чертами нестареющих клеток. Например, экспрессируемые в различной степени гены и усиленное функционирование сигнальных путей в стареющих клетках FAP оказались крайне похожи на таковые в нестареющих клетках FAP. Однако усиленное функционирование сигнальных путей в стареющих клетках приводило к развитию необычных реакций в них у старых мышей, например, к активации сигнальных путей, связанных с макрофагами, и каскадов реакций комплемента/коагуляции [1].
К сожалению, основные причины подобной противоречивой роли стареющих клеток FAP в процессах регенерации мышц неясны. Одно из возможных объяснений заключается в том, что характеристики старения клеток FAP, вызванного физическими упражнениями, могут отличаться от таковых при естественном процессе старения. Ведь авторы обнаружили, что липотоксичность, в основе которой лежат процессы оксидативного стресса, стимулирует клеточное старение, регулируемое активацией рецептора жирных кислот CD36 (рис. 1), а использование физических упражнений может тормозить окисление и развитие липотоксичности [1,6]. Другим объяснением может служить то, что старение и гибель клеток происходят одновременно в поврежденных мышцах, а способность клеток FAP влиять на регенерацию мышц может зависеть от гибели этих клеток, а не от самого процесса старения.
Обобщая вышесказанное, стареющие клетки, в особенности FAP, могут создавать воспалительное и фиброзное микроокружение, которое вредно для активности стволовых клеток. Элиминация стареющих клеток — хорошая стратегия для регенерации мышц. Кроме того, следует дополнительно сосредоточится на изучении клеток FAP, а переход от старения к апоптозу в случае с этими клетками может стать многообещающим способом лечения дегенеративных патологий мышц.
