Онкоандрология

Онкоандрология, конечно, не является ни самостоятельной отраслью медицины, ни даже официальным термином: так условно обозначают раздел онкологии, изучающий опухоли мужской репродуктивной системы.
Мы этом обзоре мы рассмотрим злокачественные новообразования простаты, яичка и полового члена.
▶ Читайте также: Многоликий тестостерон: физиологические эффекты
Рак предстательной железы
Один из семи мужчин в США [1] и один из 25 во всем мире [2], вероятно, получит диагноз рака предстательной железы в течение своей жизни. Простата — это орган размером с грецкий орех, расположенный каудально к мочевому пузырю и краниально к половому члену. Как экзокринная железа простата вырабатывает семенную жидкость, которая питает и облегчает транспортировку спермы (вырабатываемой в яичках) во время и после эякуляции. Щелочная среда этой жидкости помогает защитить сперму в кислой среде влагалища [3]. Простата естественным образом увеличивается с возрастом, что известно как доброкачественная гиперплазия предстательной железы (ДГПЖ), вызывая определенные симптомы (например, учащенное мочеиспускание из-за сжатия мочевого пузыря) у трети мужчин старше 60 лет и примерно у половины старше 80 лет [4].
Некоторые характеризуют ДГПЖ как своего рода ступень навстречу раку предстательной железы из-за общей гистопатологии и молекулярных факторов, но их точная взаимосвязь остается крайне спорной [5, 6]. Рак предстательной железы стал особенно распространенным в развитых странах, хотя многие исследователи объясняют это всего лишь особенностями диагностики ввиду высокой доступности анализа крови на простатспецифический антиген (ПСА/PSA) как на главную причину роста заболеваемости, чрезмерной диагностики и чрезмерного лечения рака предстательной железы [7, 8].
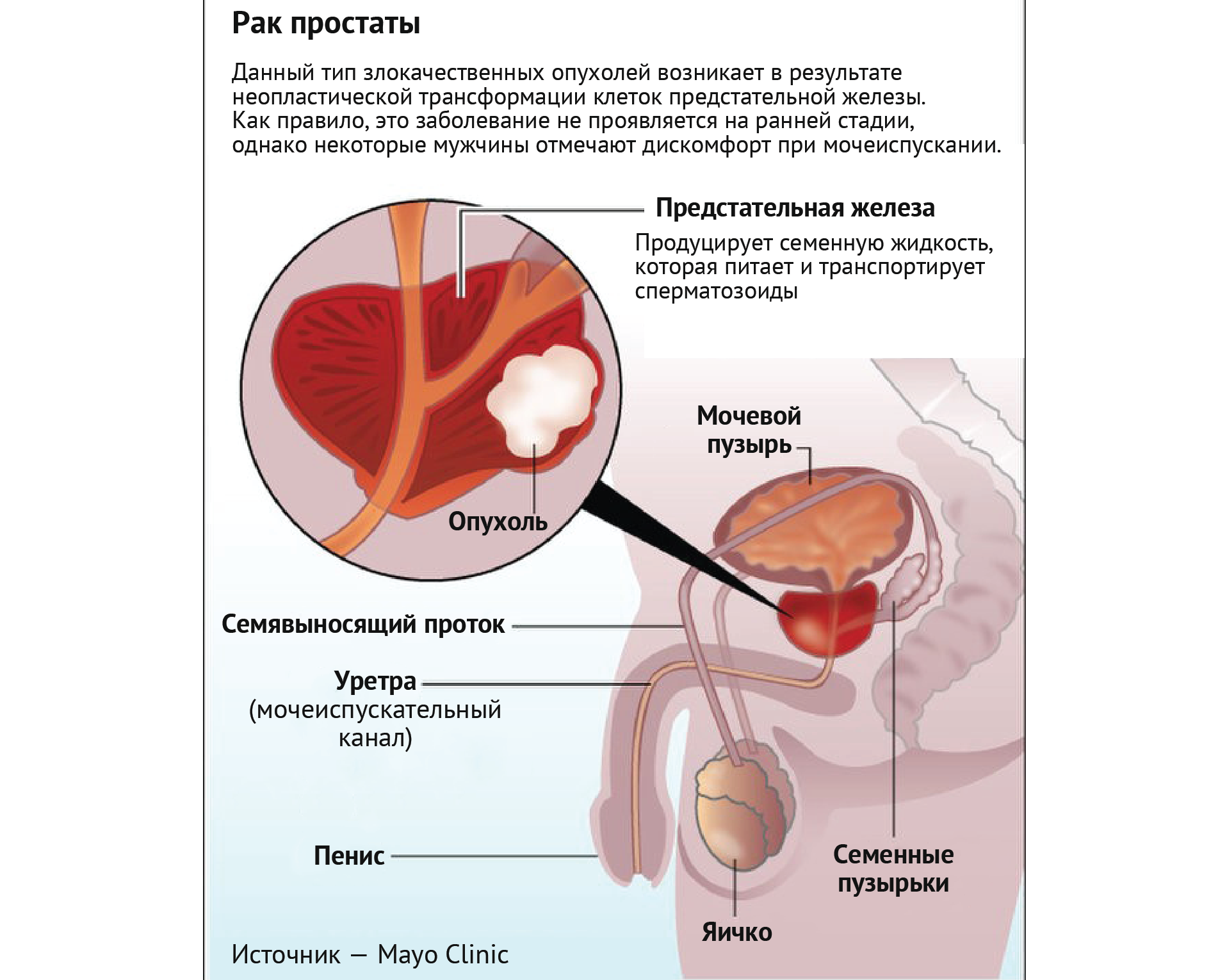
Рисунок 1 | Рак простаты
Рак предстательной железы распространен среди пожилых мужчин. В связи с увеличением тестирования на ПСА и ожидаемой продолжительности жизни у пожилых мужчин все чаще диагностируется рак предстательной железы [9].
Несколько наследственных мутаций, в первую очередь в гене BRCA2, связаны с повышенным риском развития рака предстательной железы. BRCA1 и 2 являются гомологичными рекомбинантными белками, мутации которых чаще встречаются среди еврейского населения ашкенази и связаны с повышенным риском рака молочной железы и яичников. Тем не менее, также было показано, что мутации BRCA2 увеличивают риск рака предстательной железы в 8,6 раза у мужчин старше 65 лет (кстати, рака поджелудочной железы тоже) или в 2,64 раза среди всех мужчин. Было показано, что BRCA1 обеспечивает меньший риск [10, 11]. Носители BRCA2 рекомендуются для скрининга рака предстательной железы, начиная с 40 лет [12]. Другие гены, связанные с раком предстательной железы, включают ATM (отношение шансов [OR] = 2,18); Homebox B13 (OR = 3,23); синдром Линча, мутацию в генах восстановления несоответствия (OR = 4,87); CHEK2 (OR = 1,98) [14].
Как генетические, так и экологические факторы предрасполагают к развитию рака предстательной железы. Риск развития рака предстательной железы возрастает у тех пациентов, члены семьи которых имели это заболевание в анамнезе; риск также представляет ранний возраст постановки диагноза, и он увеличивается в 2–3 раза у тех, у кого есть родственники первой линии с раком предстательной железы [15–17]. Около 5 % риска связано с унаследованным генетическим фоном, и около 20 % пациентов сообщают о положительном семейном анамнезе с повышенным риском генов с высокой пенетрантностью [18–21]. Гены наследственного рака предстательной железы, связанные с раком предстательной железы, включают HPC1 (расположены в 1q24–25) и HPCX (расположены в Xq27–28) [22, 23]. Мутации в гене RNASEL (расположены в 1q25) также связаны с развитием рака предстательной железы [24]. Ген RNASEL играет роль во врожденном иммунитете, оказывая сопротивление вирусам и регулируя апоптотическую гибель клеток [25]. Клинически более агрессивный вариант рака предстательной железы был замечен в подмножествах HPC с мутациями BRCA1 и 2 [26].
Среди немногих известных модифицируемых факторов риска рака предстательной железы лучше всего изучено ожирение. Ожирение связано с нарушением регуляции инсулиновой оси, передачей сигналов воспалительных цитокинов и индукцией повреждающего ДНК окислительного стресса, что повышает риск нескольких новообразований, включая рак молочной железы, колоректальный рак и рак предстательной железы [27–29]. Было обнаружено, что у мужчин с ожирением первой степени риск смертности от рака предстательной железы повышен на 20 %, в то время как у мужчин с ожирением второй степени риск повышен на 34 % [30]. Ожирение также было связано с повышенным риском более агрессивного течения заболевания, неэффективности лечения и смертности от рака предстательной железы, а также смертности от сопутствующих заболеваний [31].
Было показано, что курение табака увеличивает заболеваемость раком предстательной железы и смертность, вероятно, потому что мутагены, присутствующие в сигаретах, способствуют онкогенезу эпителиальных клеток предстательной железы. В исследовании мужчин среднего возраста было показано, что у курильщиков OR составляет 1,4 для диагностики рака предстательной железы, в то время как у курильщиков с более чем 40-летним анамнезом оно равно 1,6 [32]. Отдельное исследование показало, что риск смертности от рака предстательной железы также был в 1,6 раза выше среди курильщиков [33]. Отказ от курения, по-видимому, оказывает благоприятное влияние на заболеваемость раком предстательной железы и смертность, причем эффект усиливается по мере увеличения времени с момента прекращения курения [32, 33].
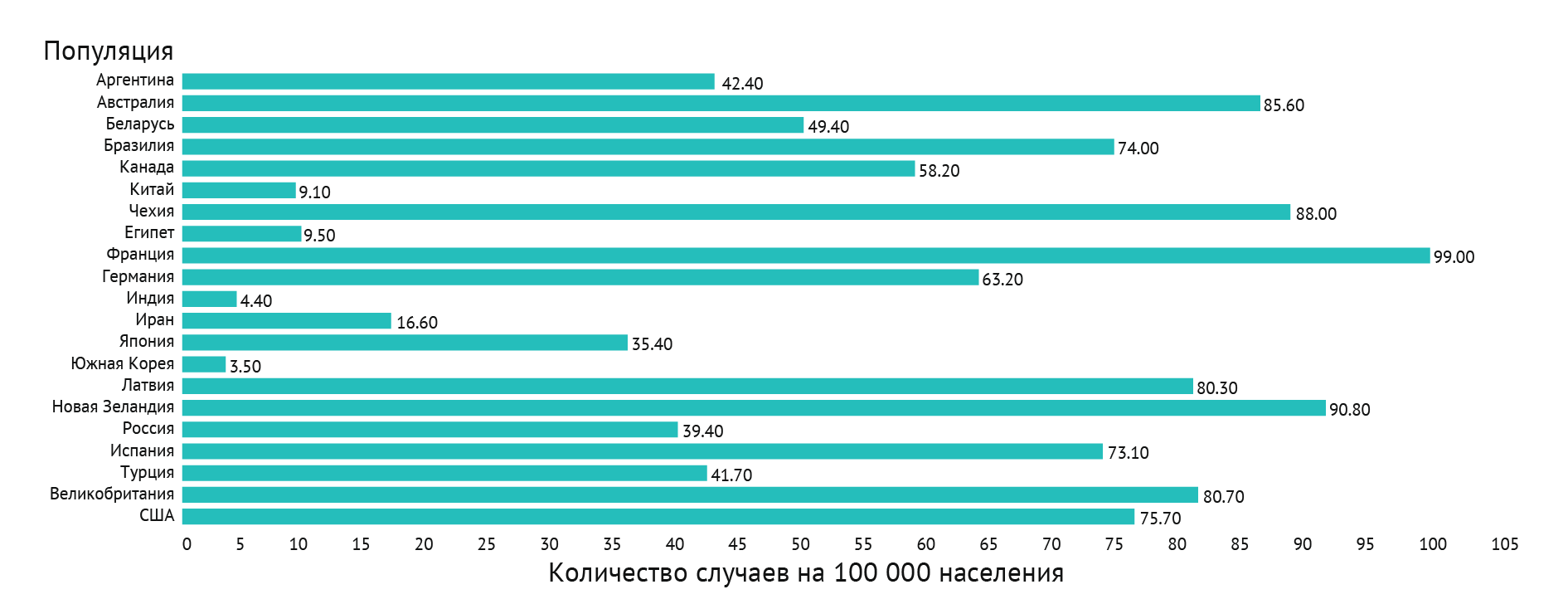
Рисунок 2 | График, демонстрирующий предполагаемый совокупный риск заболеваемости раком предстательной железы в 2018 году, мужчины в возрасте 0–74 лет
Среди методов диагностики рака предстательной железы применяют трансректальное узи (ТРУЗИ), МРТ и биопсия. Помимо этого, широко распространен анализ крови на ПСА — это быстро, дешево, безопасно, однако может приводить к гипердиагностике. Тестирование на ПСА было впервые применено в 1986 году как недорогое и эффективное средство выявления бессимптомных случаев рака предстательной железы. Регулярное тестирование всех взрослых мужчин на ПСА привело к быстрому росту заболеваемости раком предстательной железы в развитых странах, которая с тех пор снизилась, вероятно, отчасти из-за более строгих рекомендаций по тестированию на ПСА. В то время как ожидается, что уровень ПСА обычно повышается с возрастом (из-за ДГПЖ), уровень ПСА 4–10 нг/мл считается пограничным и предвещает примерно 25 %-ный риск развития рака предстательной железы; ПСА > 10 связан с риском более 50 % [34].
Тестирование на ПСА значительно улучшило показатели выживаемости при раке предстательной железы благодаря более раннему выявлению заболевания, что позволяет проводить резекцию и местное лечение до появления метастазов [35], однако было показано, что рутинное тестирование на ПСА у лиц с низким риском также имеет недостатки. Одно исследование показало, что за 10 лет тестирования 15 % мужчин получили ложноположительный результат, что заставило их пройти ненужные инвазивные диагностические процедуры, такие как биопсия [36]. Исследования показывают, что у 20–50 % мужчин, у которых диагностирован рак предстательной железы в результате тестирования на ПСА, может быть гипердиагностика: их заболевание оставалось бы бессимптомным на протяжении всей жизни, и поэтому лечение, которое они проходили, было ненужным [37].
Американское онкологическое общество рекомендует тестирование на ПСА для мужчин со средним риском, начиная с 50 лет, афроамериканцев — в 45 лет и в 40 лет — для мужчин высокого риска с ранним возрастом родственника первой линии с этим диагнозом. Тем не менее, Целевая группа по профилактике рака предстательной железы США не рекомендует проводить скрининг на ПСА из-за того, что вред перевешивает пользу [38]. Недавно одобренные молекулярные биомаркеры, такие как Decipher, Oncotype DX Prostate, Prolaris или ProMark, рекомендованы руководящими принципами NCCN для лечения заболеваний с низким риском, но не Американским обществом клинической онкологии (ASCO) или Американской урологической ассоциацией (AUA).
Положительный тест на ПСА обычно сопровождается биопсией. Биопсия рака предстательной железы с вероятностью около 1 % может привести к госпитализации из-за последствий процедуры [39]. Трансректальное ультразвуковое исследование и/или магнитно-резонансная томография (МРТ) часто используются для проведения биопсии и количественной оценки размера простаты для постановки диагноза.
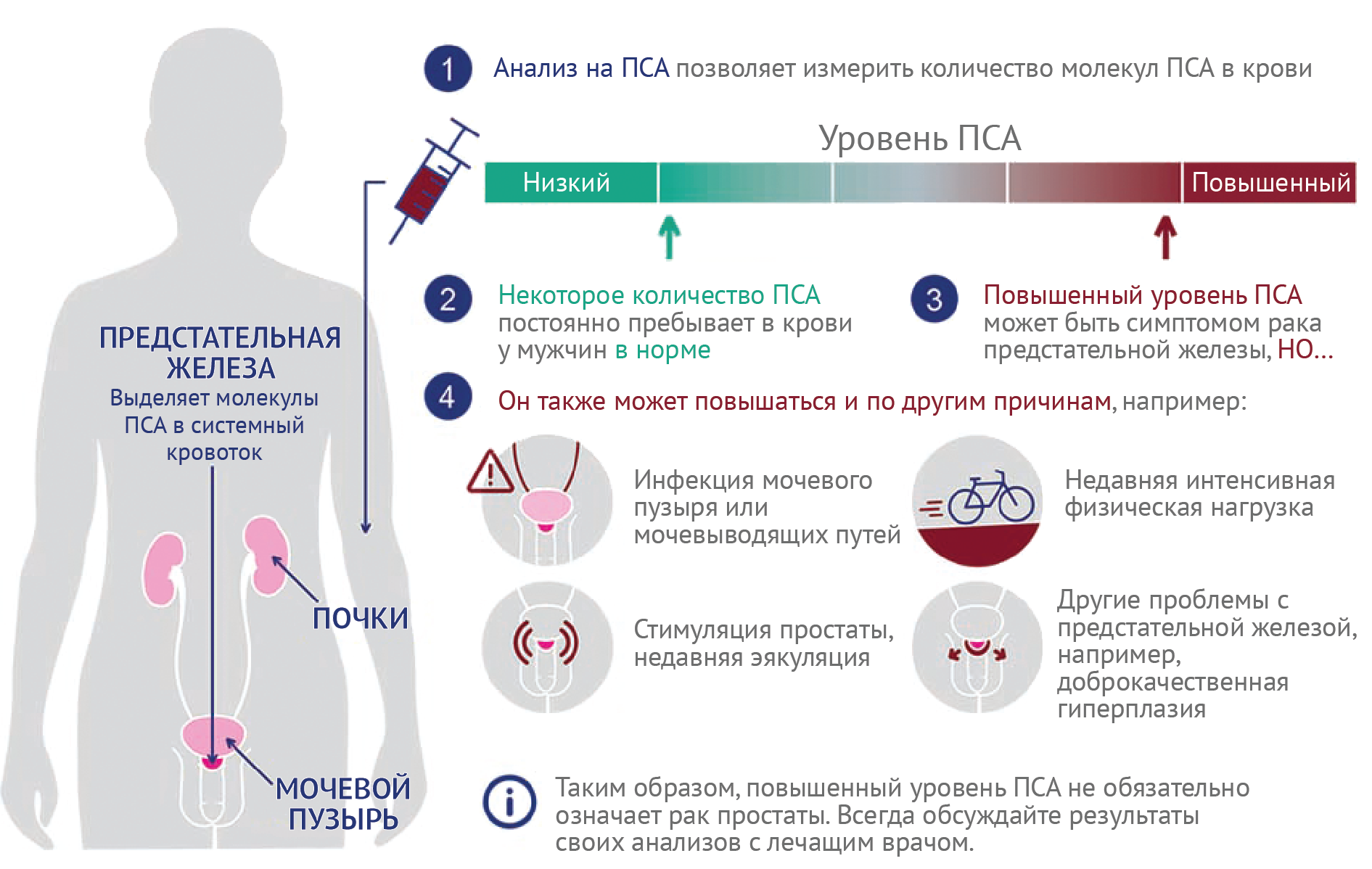
Рисунок 3 | Обновленная инфографика GOV.UK, помогающая понять значение ПСА
«Золотым стандартом» диагностики рака предстательной железы, как и любых других опухолей, является биопсия. В ходе этой процедуры врач-уролог отправляет образцы тканей на диагностику в патологоанатомическую лабораторию. Врач-патологоанатом очень часто сталкивается c опухолями предстательной железы: это в какой-то степени рутинный материал, для которого разработана своя система оценки. Оценка по Глисону является ведущей гистопатологической системой оценки рака предстательной железы. Первая степень соответствует хорошо дифференцированной дисплазии низкой степени, в то время как пятая степень соответствует наиболее аномальной диспластической ткани. Баллы из наиболее репрезентативных патологических образцов суммируются для получения общего балла. На основании суммы этих баллов высчитывается так называемый «Индекс Глисона» (ИГ). Предположим, у нашего пациента в двух репрезентативных участках опухоль получила по 3 балла, в таком случае ИГ = 3+3 (6). Согласно алгоритму оценки, ИГ может быть от 2 до 10, но на практике оценки ниже 6 встречаются редко [40].
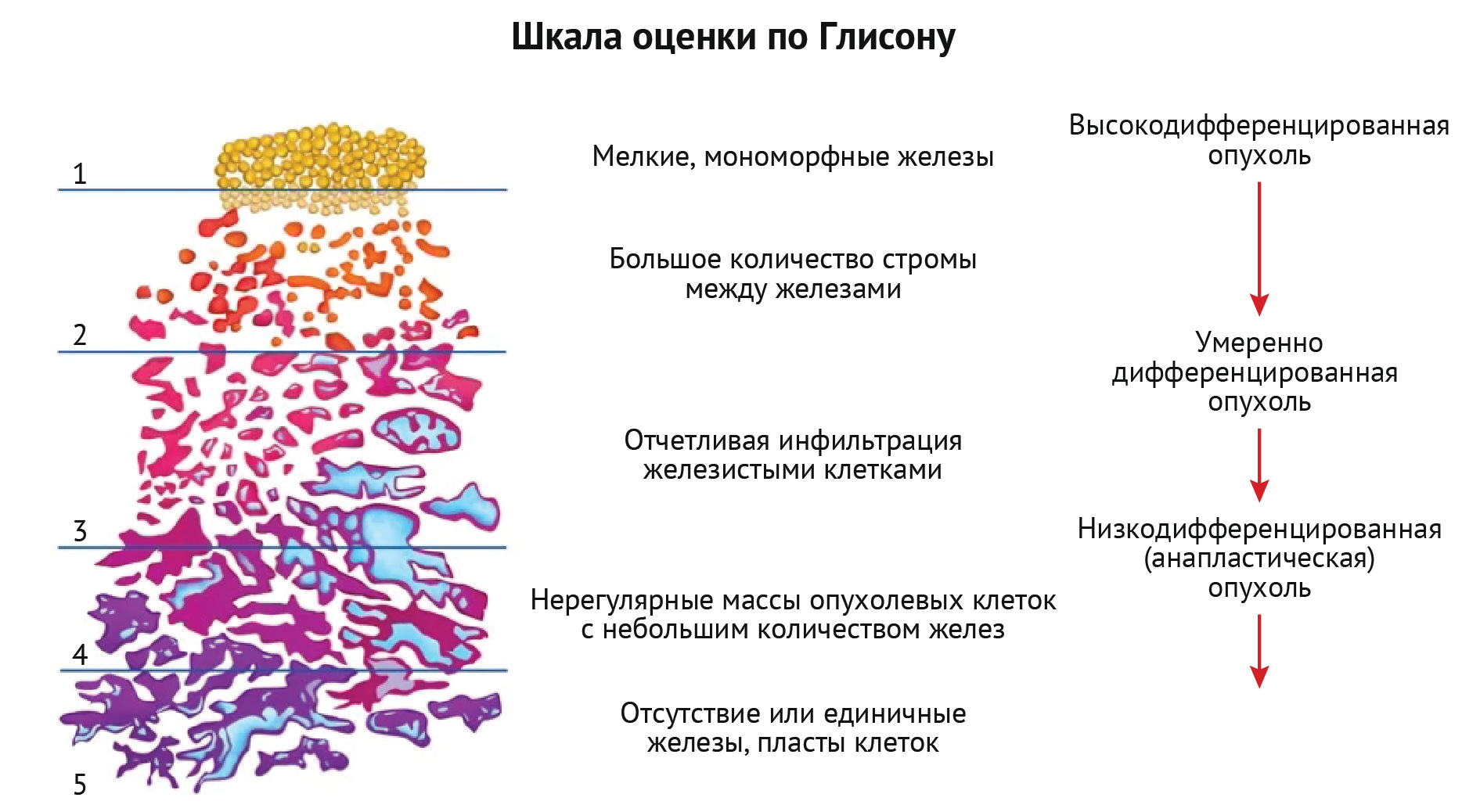
Рисунок 4 | Шкала оценки по Глисону
Для поиска метастазов и определения стадии метастатического рака предстательной железы используются несколько методов визуализации, таких как многопараметрическая МРТ (МП-МРТ) [41], сканирование костей (сцинтиграфия с использованием дифосфоната технеция-99 м) и компьютерная томография (КТ). Американская урологическая ассоциация рекомендует эти методы визуализации только для пациентов с высоким или неблагоприятным промежуточным риском [42]. В недавних исследованиях высказывается предположение о благотворной роли ПСА; МП-МРТ с последующей целевой биопсией очага поражения является заменой трансректальной биопсии под контролем ультразвука. Существует значительное преимущество для стратификации риска и избежания ненужной биопсии [43]. Чтобы преодолеть проблемы с точностью, связанные с трансректальным доступом, используется трансперинеальная биопсия [44]. МП-МРТ перед биопсией может в четверти случаев помочь избежать ненужных процедур и улучшает распознавание клинически значимых поражений, что позволяет снизить гипердиагностику клинически незначимых состояний [45]. В связи с важной ролью МРТ в диагностике рака предстательной железы было предложено множество приложений искусственного интеллекта (ИИ) для помощи в диагностике и выявлении РПЖ. Используются как семантические характеристики, такие как размер и форма, так и независимые характеристики, такие как текстуры. Наиболее значимые функции выбираются и используются в задаче обучения соответствующего алгоритма [46]. В настоящее время использование алгоритмов ИИ является очень молодым методом, требующим значительного технического оснащения, в связи c чем пока не получил широкого применения в клинической практике.
Лечение локализованного заболевания включает радикальную простатэктомию и/или лучевую терапию. Во время радикальной простатэктомии хирурги часто обследуют и удаляют сторожевые лимфатические узлы, чтобы оценить распространение опухоли. Лимфатические узлы также оценивают с помощью пункционной биопсии [47]. Дистанционная (внешняя) лучевая терапия может использоваться в качестве монотерапии для пациентов с низким или средним риском, а также в качестве вспомогательного лечения для пациентов с высоким риском после простатэктомии [48].
Высокодозная брахитерапия предполагает использование высоких доз облучения именно в опухоли, тем самым сохраняя структуру и функцию соседних органов. Она применяется в качестве монотерапии или в комбинации с дистанционной лучевой терапией [49, 50]. Лучевая терапия также может сочетаться с андроген-депривационной терапией (АДТ) у пациентов с высоким риском, хотя это увеличивает риск системных побочных эффектов и тяжелой эректильной дисфункции [51]. АДТ стала стандартом лечения первичного кастрационно-резистентного рака предстательной железы (как локального, так и метастатического) благодаря исследованию STAMPEDE, начатому еще в 2005 году [52]. Агонисты и антагонисты гонадотропин-рилизинг-гормона в значительной степени заменили хирургическую орхиэктомию в развитых странах что, как было показано, уменьшает такие симптомы, как боль в костях и замедляет прогрессирование опухоли.
Пациенты, у которых наблюдается прогрессирование заболевания (как метастатическое, так и не-метастатическое) во время АДТ (тестостерон <50 нг / дл), считаются резистентными к кастрации (CRPC) и нуждаются в эндокринных препаратах следующего поколения для подавления канцерогенеза. Такие схемы лечения могут включать препараты, которые ингибируют биосинтез андрогенов, такие как абиратерон [53], или новые и более часто используемые агенты, которые препятствуют андрогенной стимуляции клеток рака предстательной железы, такие как энзалутамид [54, 55], апалутамид [56] или даролутамид [57]. Цитотоксические агенты доцетаксел и кабазитаксел, которые стабилизируют микротрубочки и тормозят деление злокачественных клеток, также широко используются в клинической практике. Все эти препараты демонстрируют значительное улучшение выживаемости при комбинации c АДТ [58, 59, 60]. Энзалутамид значительно продлевает выживаемость мужчин с метастатическим кастрационно-резистентным раком предстательной железы после химиотерапии [61]. Таким образом, последовательная терапия, чередующаяся с химиотерапией и антигормональными препаратами, может быть более перспективным подходом в лечении метастатического кастрационно-резистентного рака предстательной железы [62]. Пембролизумаб, ингибитор PDL-1, недавно был одобрен для последующего линейного лечения пациентов с высокой экспрессией PDL-1 и микросателлитной нестабильностью (MSI) при разных типах рака [63]. Опухолевые клетки используют PDL-1, чтобы избежать противоопухолевого иммунного ответ, и моноклональные антитела против рецептора PDL-1 на Т-клетках могут свести на нет этот эффект. При раке предстательной железы было продемонстрировано, что пембролизумаб обладает длительной противоопухолевой активностью у пациентов, которые «прогрессировали» на эндокринной терапии (например, энзалутамид) и доцетакселе [64]. Другие варианты CRPC включают сипулейцел-T, другую иммунотерапию, показанную для пациентов с минимальной симптоматикой [65], и Radium-223, показанный для пациентов только с метастазами в кости (без висцеральных метастазов) [66].
Ингибиторы PARP в настоящее время оцениваются в клинических испытаниях в качестве передовой терапии для всех пациентов с мутациями в гомологичных генах рекомбинации, таких как BRCA1 / 2, ATM, CHEK2 и другими редкими мутациями [67, 68].
Рак яичка
Рак яичка является наиболее распространенным злокачественным новообразованием среди мужчин в возрасте от 14 до 44 лет, и заболеваемость в западных странах возросла за последние два десятилетия. Как генетические факторы, так и факторы окружающей среды способствуют развитию рака яичка, для которого крипторхизм (врожденный дефект, при котором одно или оба яичка не находятся в мошонке) является наиболее распространенным фактором риска [69-71].
Несмотря на самые высокие показатели заболеваемости в Европе, Северной Америке, Австралии и Новой Зеландии, на эти районы приходится лишь пятая часть смертей от рака яичка. Действительно, отношение заболеваемости к смертности составляет 26:1 в Северной Европе по сравнению с 2:1 в юго-восточной Азии, южно-центральной Азии и Африке [72], что указывает на крайнюю необходимость улучшения лечения в некоторых неевропейских странах. Приблизительно у 50 % пациентов во всем мире с раком яичка диагностируется семинома, а у остальных ~ 50 % пациентов диагностируются различные типы несемином или смешанные опухоли. Средний возраст при постановке диагноза для этих двух групп составляет 37 и 30 лет, соответственно [73, 74].
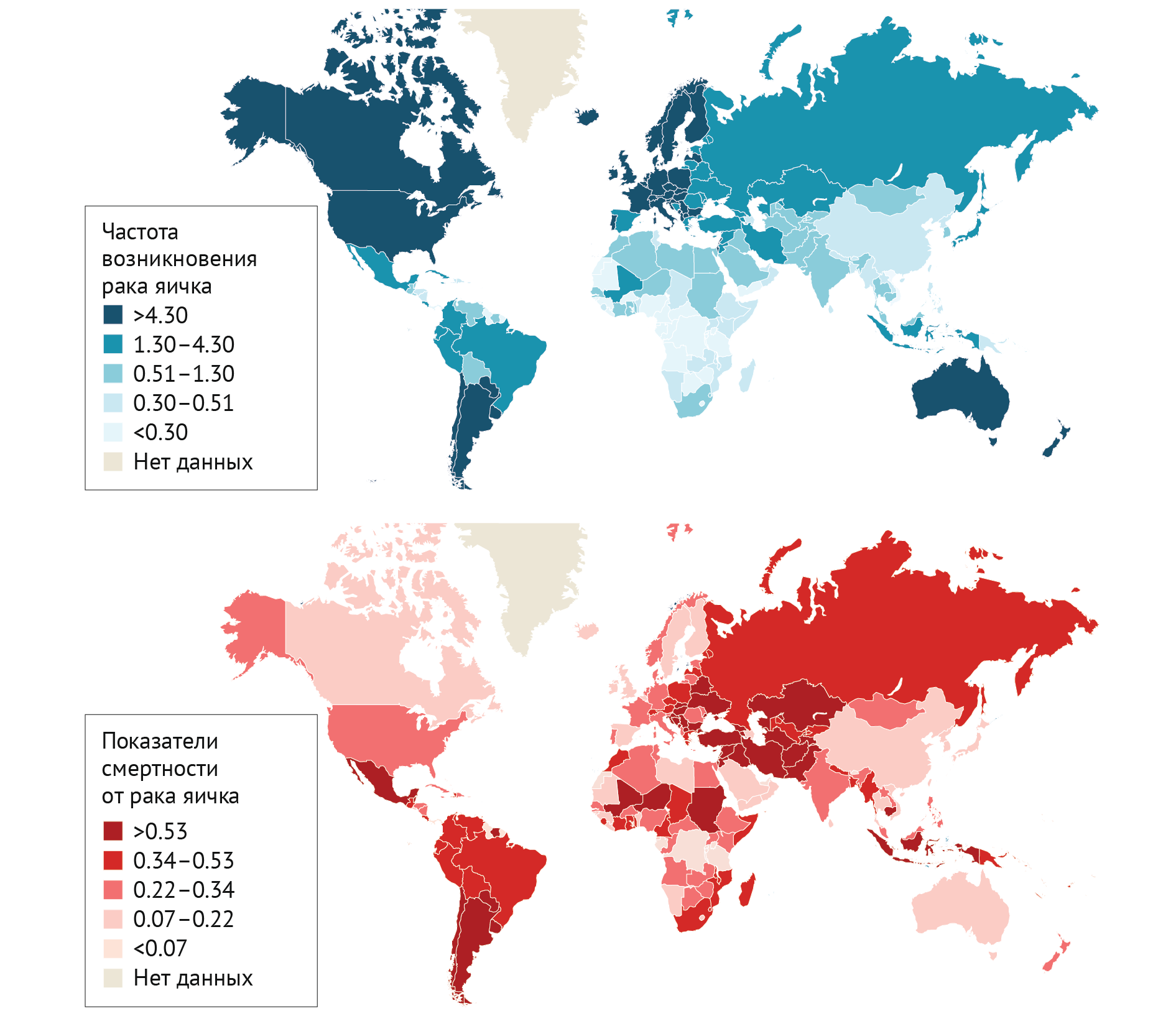
Опухоль зародышевых клеток (ОЗК) является преобладающим гистологическим типом у пациентов с раком яичка (95%) и подразделяется на семиномы и несеминомы, и причем семиномы встречаются несколько чаще, чем несеминомы [75]. ОЗК возникают из гоноцитов, которые не могут дифференцироваться в сперматогонии, а плюрипотентность этих клеток позволяет им развиваться в самые разнообразные опухоли. Семиномы блокируются на самом раннем этапе дифференцировки, тогда как несеминомы состоят из различных гистологических подтипов с различной степенью дифференцировки: эмбриональная карцинома (недифференцированная), хориокарцинома, карцинома желточного мешка или тератома (как зрелая, так и незрелая) [76]. Смешанные ОЗК встречаются часто и могут проявляться в любой форме, каждая из них может встречаться отдельно или в любой комбинации. Большинство несемином представляют собой сочетание как минимум двух различных подтипов герминогенных опухолей. Несеминомы также могут быть частично семиномами на любом процентном уровне менее 100 %. Например, опухоль, которая по своему строению на 99 % состоит из клеток семиномы и на 1 % из клеток карциномы желточного мешка, все равно диагностируется и лечится как несеминома.
Как правило, несеминомы имеют тенденцию к более быстрому росту и распространению, чем семиномы, но своевременная диагностика и лечение важны для обоих типов опухолей.
Другие, менее распространенные типы опухолей яичек включают опухоль из клеток Лейдига, опухоль из клеток Сертоли, лимфому яичка.
Диагностика рака яичек проводится путем клинической оценки, УЗИ яичек, орхиэктомии пораженного яичка и определения сывороточных онкомаркеров. Эти биомаркеры опухоли включают ЛДГ (лактатдегидрогеназу), АФП (альфа-фетопротеин) и β-ХГЧ (β-хорионический гонадотропин человека) и помогают в диагностике (семинома против несеминомы), стадировании, стратификации риска и последующем наблюдении после лечения пациентов с раком яичка [77]. АФП не производится семиномами, поэтому повышенный уровень АФП является признаком того, что опухоль не является чистой семиномой. β-хорионический гонадотропин человека (β-ХГЧ) часто, но не всегда, повышен у людей с семиномой или несеминомой, однако уровни β-ХГЧ выше 1000 МЕ/л обычно указывают на то, что опухоль не является семиномой.
Симптомы рака яичка могут включать:
- Безболезненный узел или припухлость в яичке. При раннем обнаружении опухоль яичка может быть размером с горошину, но может вырасти и намного больше.
- Боль, дискомфорт или онемение яичка или мошонки с отеком или без него.
- Ощущение тяжести в мошонке. Например, одно яичко может стать более твердым, чем другое, увеличиться или наоборот уменьшиться.
- Тупая боль внизу живота или в паху.
- Внезапно возникшее скопление жидкости в мошонке.
- Болезненность или увеличение груди. Некоторые опухоли яичек, хотя и редко, вырабатывают пролактин, который вызывает гинекомастию.
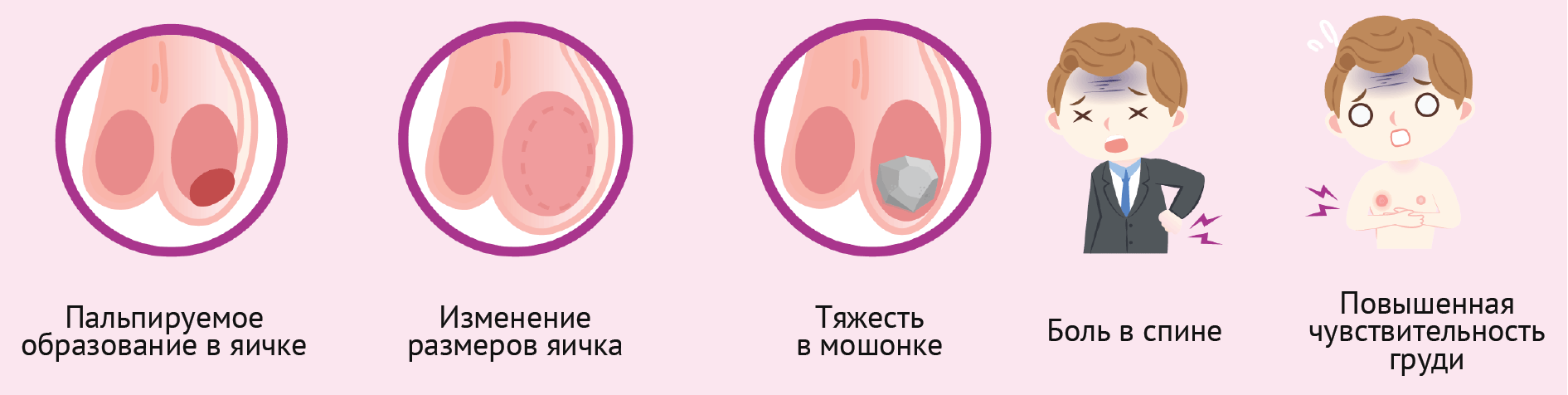
Рисунок 6 | Типичные симптомы, как правило, развивающиеся при раке яичка
Лечение рака яичка зависит от стадии и типа опухоли. Стадия I или локализованное заболевание, будь то семинома или несеминома, лечится орхиэктомией с последующим активным наблюдением или адъювантным лечением в зависимости от факторов риска и предпочтений пациента. Пациентам с семиномой IIA / B стадии проводится орхиэктомия с последующей лучевой терапией или химиотерапией, а пациенты с объемной семиномой IIC и III стадии получают химиотерапию после орхиэктомии [78]. Пациенты с диссеминированной несеминомой (IGCCC среднего или низкого риска) проходят четыре курса лечения по схеме BEP (блеомицин, этопозид и цисплатин) или VIP (этопозид, ифосфамид и цисплатин) после хирургического удаления пораженного яичка. В случае остаточного заболевания после завершения химиотерапии пациенты подвергаются хирургическому удалению пораженных лимфатических узлов и / или метастазов, которые не полностью исчезли после химиотерапии. Примерно 10-15% пациентов с диссеминированной опухолью нуждаются в терапии второй линии вследствие рецидива или рефрактерного заболевания [79]. В настоящее время доступны различные эффективные стратегии спасения, включая схемы химиотерапии в стандартных и высоких дозах. Выбор стандартной дозы восстановительного лечения зависит от того, какие препараты первоначально использовались в комбинации с цисплатином. Сообщалось о некоторых распространенных и эффективных методах лечения стандартными дозами с длительными ремиссиями от 23 до 54% при использовании VIP (цисплатин, ифосфамид и этопозид) [80], [81], 63% с использованием TIP (паклитаксел, ифосфамид и цисплатин) [82], 24% с использованием VeIP(винбластин, ифосфамид и цисплатин) [83] и 51% при использовании GIP (гемцитабин, ифосфамид и цисплатин) [84]. Высокодозная химиотерапия карбоплатином и этопозидом с аутологичной трансплантацией костного мозга первоначально был изучен у пациентов с прогнозируемым плохим исходом лечения стандартными дозами или у пациентов, которые уже не прошли предыдущее лечение стандартными дозами. Первоначальные результаты были исключительными с частотой полного ответа 26% [85]. Совсем недавно высокодозная химиотерапия с трансплантацией аутологичных периферических стволовых клеток продемонстрировала длительные ремиссии у 63% пациентов, включая пациентов, которые получали это в качестве лечения третьей линии [86]. Как показали представленные выше данные, как стандартная, так и высокодозная восстановительная химиотерапия способны преодолевать резистентность к цисплатину. Большое ретроспективное исследование также сообщает, что высокодозная химиотерапия превосходит химиотерапию в стандартных дозах в качестве первой линии терапии [86]. На сегодняшний день остается неясным, обеспечивает ли стандартная или высокодозная восстановительная химиотерапия лучшие результаты при использовании в качестве начального восстановительного лечения. Для решения этого вопроса в настоящее время проводится проспективное глобальное исследование (исследование TIGER) у пациентов с рецидивирующим или рефрактерным раком яичка. В этом исследовании пациенты рандомизируются между 4 курсами TIP и TI-CE [с 3 курсами высоких доз карбоплатина-этопозида с аутологичной трансплантацией периферических стволовых клеток] (идентификационный код исследования на ClinicalTrials.gov - NCT02375204).
Рак полового члена
Рак полового члена является редким видом рака с распространенностью 0,1–1 на 100 000 мужчин в развитых странах [87]. Однако глобальная заболеваемость значительно различается между различными группами населения в зависимости от факторов риска, таких как инфекция вирусом папилломы человека (ВПЧ), курение и плохая гигиена, или защитных факторов, таких как рутинное обрезание крайней плоти в младенческом возрасте [88]. Следовательно, рак полового члена может составлять до 10% злокачественных новообразований у мужчин в некоторых регионах Африки, Азии и Южной Америки [89]. В соответствии с классификацией ВОЗ 2016 года злокачественные опухоли полового члена могут быть разделены следующим образом:
Большинство случаев рака полового члена (95%) возникает из эпителиоцитов головки полового члена и крайней плоти и гистологически представляет собой плоскоклеточный рак. Меланомы и базальноклеточные карциномы встречаются гораздо реже. Мезенхимальные опухоли (саркома Капоши, ангиосаркома, эпителиоидная гемангиоэндотелиома) являются крайне редкими, описаны единичные случаи [90].
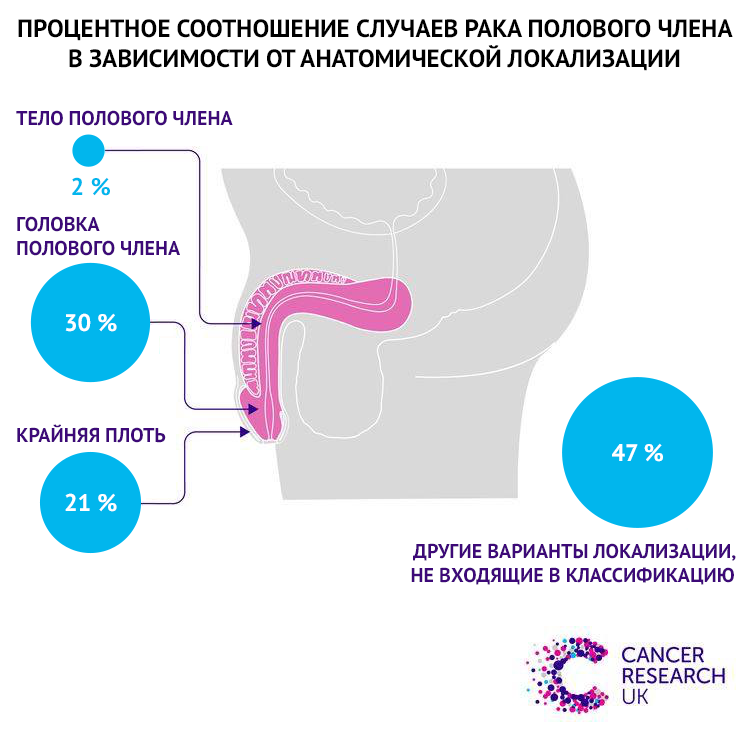
Рисунок 7 | Процентное соотношение случаев рака полового члена в зависимости от анатомической локализации
Как было сказано выше, рак полового члена может развиваться как по ВПЧ-зависимому, так и по ВПЧ-независимому пути. Считается, что первоначальным провоцирующим событием является ВПЧ-инфекция эпителиальных клеток слизистой оболочки полового члена как через специфические рецепторы, включая протеогликаны и интегрины, так и через физические микротравмы, которые, вероятно, возникают в результате сексуальной активности [91].Постоянное и/или рецидивирующее воздействие ВПЧ на ткани полового члена приводит к интеграции ДНК ВПЧ в геном организма- хозяина и возможной трансформации клеток в злокачественный фенотип. Возникающая в результате сверхэкспрессия вирусных онкопротеинов E6 и E7 вызывает нарушение регуляции клеточного цикла и нестабильность генома за счет взаимодействия с p53 и pRb соответственно, инициируя и поддерживая склонность к злокачественным новообразованиям [92]. E7 связывается с pRb, что приводит к высвобождению фактора транскрипции E2F, нарушению регуляции клеточного цикла и сверхэкспрессии p16INK4a, который является биомаркером плоскоклеточного рака, связанного с ВПЧ. Кроме того, E7 приводит к подавлению p21 и p27 и повышению активности циклина A и циклина E, что приводит к пролиферации, иммортализации клеток и канцерогенезу [93]. Канцерогенные эффекты Е6 обусловлены ингибированием р53 и гомологичного антагониста/киллера BCL-2, что приводит к ингибированию апоптоза и индукции хромосомной нестабильности, а также активацией теломеразы и киназ SRC, что вызывает пролиферацию клеток, иммортализацию и нарушение регуляции роста [94]. Эти драйверы канцерогенеза рака полового члена, опосредованного ВПЧ, достаточно хорошо известны, но исследования по изучению этих медиаторов остаются на ранней стадии [95, 96].
Геномные пути, связанные с канцерогенезом и прогрессированием рака полового члена, не связанным с ВПЧ, изучены недостаточно, и были идентифицированы только клинические этиологические факторы риска и движущие силы, а также их механистические мишени. Тем не менее, исследования по секвенированию генов расширили понимание геномных путей, которые управляют раком полового члена, не связанным с ВПЧ, преимущественно за счет эффектов хронического воспаления и изменений соматических генов. Хроническое воспаление вызывает злокачественную трансформацию клеток за счет продукции активных форм кислорода и реактивных промежуточных соединений азота, которые могут вызывать повреждение ДНК и нестабильность генома [97]. Многие хронические заболевания полового члена, в том числе баланопостит, фимоз и склероатрофический лихен, которые являются важными факторами риска развития рака полового члена, имеют общий механизм индукции экспрессии циклооксигеназы 2 (ЦОГ-2), который связан с развитием интраэпителиальной неоплазии [98]. Исследования показывают, что избыточная экспрессия ЦОГ-2 стимулирует перепроизводство простагландинов (прежде всего простагландина Е2) и тромбоксанов, что приводит к ангионеогенезу, пролиферации и инвазии через различные молекулярные пути, общие для рака полового члена, связанного с ВПЧ [99,100].
Первичные опухоли полового члена клинически очевидны, когда они представляют собой большие экзофитные поражения. Диагностический путь состоит в установлении гистологического подтипа и степени инвазии первичного поражения, а также оценку метастазов в регионарные или отдаленные лимфатические узлы. При клиническом осмотре следует оценить размер поражения, локализацию (например, головка, тело или крайняя плоть полового члена) и макроскопический вид (например, есть ли сосочковые выросты или опухоль представляет собой узел, есть ли корочки, изъязвления и т.д.).
Визуализация необходима для определения стадии рака, планирования хирургического лечения и выявления очагов поражения в кавернозных телах. Визуализация поперечного сечения, такая как КТ, позволяет определить стадию заболевания при постановке диагноза и идентифицировать аномальную паховую или тазовую лимфаденопатию, а также отдаленные метастазы. УЗИ полового члена и МРТ являются предпочтительными методами визуализации первичного поражения.
Морфологически аномальные лимфатические узлы могут подвергаться тонкоигольной аспирации. В качестве альтернативы МРТ ультразвуковое исследование также позволяет визуализировать первичную опухоль, чтобы визуализировать степень спонгиозной или кавернозной инвазии [101].
Клиническая оценка первичного поражения для оценки степени местной инвазии помогает в планировании операции. Поскольку большинство инвазивных поражений, расположенных на крайней плоти или головке полового члена, можно удалить с помощью процедур, сохраняющих половой член, пальпация головки и ствола полового члена коррелирует со степенью инвазии в губчатое или кавернозное тело [102]. Это позволяет планировать хирургическое вмешательство, например, глансэктомию, либо частичную пенэктомию [103]. Поражения также могут возникать из передней части уретры и инфильтрировать кавернозное тело без развития экзофитного поражения головки. Тщательное исследование отверстия уретры может обнаружить эти опухоли, а пальпация проксимального отдела уретры поможет убедиться в отсутствии других поражений.
Несмотря на препятствия, связанные с низкой распространенностью рака полового члена, в настоящее время появляются ценные данные о причинах заболевания и потенциальных биомаркерах. Эти новые знания позволяют исследовать потенциал прецизионной онкологии для преодоления неутешительных результатов лечения на основе химиотерапии, особенно при поздних стадиях заболевания.
Использованные источники:
- Howlander, N.; Noone, A.M.; Krapcho, M.; Miller, D.; Brest, A.; Yu, M.; Ruhl, J.; Tatalovich, Z.; Mariotto, A.; Lewis, D.R.; et al. SEER Cancer Statistics Review 1975–2016. Natl. Cancer Inst. 2016, 19. Available online: https://seer.cancer.gov/archiv...
- Bray, F.; Ferlay, J.; Soerjomataram, I.; Siegel, R.L.; Torre, L.A.; Jemal, A. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018, 68, 394–424.
- Hayward, S.W.; Cunha, G.R. The prostate: Development and physiology. Radiol. Clin. N. Am. 2000.
- Langan, R.C. Benign Prostatic Hyperplasia. Prim. Care Clin. Off. Pract. 2019.
- McVary, K.T.; Roehrborn, C.G.; Avins, A.L.; Barry, M.J.; Bruskewitz, R.C.; Donnell, R.F.; Foster, H.E., Jr.; Gonzalez, C.M.; Kaplan, S.A.; Penson, D.F.; et al. Update on AUA guideline on the management of benign prostatic hyperplasia. J. Urol. 2011.
- Miah, S.; Catto, J. BPH and prostate cancer risk. Indian J. Urol. 2014.
- Cuzick, J.; Thorat, M.A.; Andriole, G.; Brawley, O.W.; Brown, P.H.; Culig, Z.; Eeles, R.A.; Ford, L.G.; Hamdy, F.C.; Holmberg, L.; et al. Prevention and early detection of prostate cancer. Lancet Oncol. 2014.
- Mohler, J.; Armstrong, A.; Bahnson, R.; D’Amico, A. NCCN clinical practice guidelines in oncology: Prostate cancer. J. Natl. Compr. Cancer Netw. 2016. Prostate Cancer Incidence. Available online: https://www.cancerresearchuk.o... (accessed on 31 May 2020).
- Adeloye, D.; David, R.A.; Aderemi, A.V.; Iseolorunkanmi, A.; Oyedokun, A.; Iweala, E.E.J.; Omoregbe, N.; Ayo, C.K. An Estimate of the Incidence of Prostate Cancer in Africa: A Systematic Review and Meta-Analysis. Available online: https://journals.plos.org/plos... (accessed on 31 May 2020).
- Dasgupta, P.; Baade, P.D.; Aitken, J.F.; Ralph, N.; Chambers, S.K.; Dunn, J. Geographical Variations in Prostate Cancer Outcomes: A Systematic Review of International Evidence. Front. Oncol. 2019, 9, 238. [Google Scholar] [CrossRef]
- Rawla, P. Epidemiology of Prostate Cancer. World J. Oncol. 2019, 10, 63–89. [Google Scholar] [CrossRef]
- Cancer Stat Facts: Prostate Cancer. SEER; 2018. Available online: https://seer.cancer.gov/statfa... (accessed on 31 May 2020).
- DeSantis, C.E.; Siegel, R.L.; Sauer, A.G.; Miller, K.D.; Fedewa, S.A.; Alcaraz., K.I.; Jemal, A. Cancer statistics for African Americans, 2016: Progress and opportunities in reducing racial disparities. CA Cancer J. Clin. 2016. [Google Scholar] [CrossRef]
- SEER*Explorer. Available online: https://seer.cancer.gov/explor... (accessed on 31 May 2020).
- Dess, R.T.; Hartman, H.E.; Mahal, B.A.; Soni, P.D.; Jackson, W.D.; Cooperberg, M.R.; Amling, C.L.; Aronson, W.J.; Kane, C.J.; Terris, M.K.; et al. Association of Black Race with Prostate Cancer-Specific and Other-Cause Mortality. JAMA Oncol. 2019. [Google Scholar] [CrossRef] [PubMed]
- Rebbeck, T.R.; Devesa, S.S.; Chang, B.-L.; Bunker, C.H.; Cheng, I.; Kathleen, C.; Eeles, R.; Fernandez, P.; Giri, V.N.; Gueye, S.M.; et al. Global Patterns of Prostate Cancer Incidence, Aggressiveness, and Mortality in Men of African Descent. Prostate Cancer. 2013. [Google Scholar] [CrossRef] [PubMed]
- Oh, M.; Alkhushaym, N.; Fallatah, S.; Althagafi, A.; Aljadeed, A.; Alsowaida, Y.; Jeter, J.; Martin, J.R.; Babiker, H.N.; McBride, A.; et al. The association of BRCA1 and BRCA2 mutations with prostate cancer risk, frequency, and mortality: A meta-analysis. Prostate 2019. [Google Scholar] [CrossRef] [PubMed]
- Gallagher, D.J.; Gaudet, M.M.; Pal, P.; Kirchhoff, T.; Balisteri, L.; Vora, K.; Bhatia, J.; Stadler, Z.; Fine, S.W.; Reuter, V.; et al. Germline BRCA mutations denote a clinicopathologic subset of prostate cancer. Clin. Cancer Res. 2010, 16, 2115–2121. [Google Scholar] [CrossRef] [PubMed]
- Ashworth, A.; Lord, C.J. Synthetic lethal therapies for cancer: What’s next after PARP inhibitors? Nat. Rev. Clin. Oncol. 2018, 15, 564–576. [Google Scholar] [CrossRef]
- Wang, G.; Zhao, D.; Spring, D.J.; Depinho, R.A. Genetics and biology of prostate cancer. Genes Dev. 2018, 32, 1105–1140. [Google Scholar] [CrossRef]
- Lichtenstein, P.; Holm, N.V.; Verkasalo, P.K.; Iliadou, A.; Kaprio, J.; Koskenvuo, M.; Pukkala, E.; Skytthe, A.; Hemminki, K. Environmental and heritable factors in the causation of cancer—Analyses of cohorts of twins from Sweden, Denmark, and Finland. N. Engl. J. Med. 2000, 343, 78–85. [Google Scholar] [CrossRef]
- Bruner, D.W.; Moore, D.; Parlanti, A.; Dorgan, J.; Engstrom, P. Relative Risk of Prostate Cancer for Men with Affected Relatives: Systematic Review and Meta-Analysis. Int. J. Cancer 2003, 107, 797–803. [Google Scholar] [CrossRef]
- Zeegers, M.P.; Jellema, A.; Ostrer, H. Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: A meta-analysis. Cancer 2003, 97, 1894–1903. [Google Scholar] [CrossRef]
- Gallagher, R.P.; Fleshner, N. Prostate cancer: 3. Individual risk factors. CMAJ 1998, 159, 807–813. [Google Scholar]
- Carroll, P.R.; Grossfeld, G.D. Prostate Cancer; Decker Inc.: Hamilton, ON, Canada; London, UK, 2002. [Google Scholar]
- Ferris-i-Tortajada, J.; Garcia-i-Castell, J.; Berbel-Tornero, O.; Ortega-Garcia, J.A. Constitutional risk factors in prostate cancer. Actas Urológicas Españolas 2011, 35, 282–288. [Google Scholar] [CrossRef] [PubMed]
- Sridhar, G.; Masho, S.W.; Adera, T.; Ramakrishnan, V.; Roberts, J.D. Association between family history of prostate cancer. JMH 2010, 7, 45–54. [Google Scholar]
- Smith, J.R.; Freije, D.; Carpten, J.D.; Gronberg, H.; Xu, J.; Issacs, S.D.; Brownstein, M.J.; Bova, G.S.; Guo, H.; Bujnovszky, P.; et al. Major susceptibility locus for prostate cancer on chromosome 1 suggested by a genome-wide search. Science 1996, 274, 1371–1374. [Google Scholar] [CrossRef] [PubMed]
- Xu, J.; Meyers, D.; Freije, D.; Issacs, S.; Wiley, K.; Nusskern, D.; Ewing, C.; Wilkens, E.; Bujnovszky, P.; Bova, G.S.; et al. Evidence for a Prostate Cancer Susceptibility Locus on the X Chromosome. Nat. Genet. 1998, 20, 175–179. [Google Scholar] [CrossRef] [PubMed]
- Carpten, J.; Nupponen, N.; Isaacs, S.; Sood, R.; Robbins, C.; Xu, J.; Faruque, M.; Ewing, M.C.; Gillanders, E.; Hu, P.; et al. Germline mutations in the ribonuclease L gene in families showing linkage with HPC1. Nat. Genet. 2002, 30, 181–184. [Google Scholar] [CrossRef]
- Zhou, A.; Paranjape, J.; Brown, T.L.; Nie, H.; Naik, S.; Dong, B.; Chang, A.; Trapp, B.; Colmenares, C.; Silverman, R.H. Interferon action and apoptosis are defective in mice devoid of 2′,5′-oligoadenylate-dependent RNase L. EMBO J. 1997, 16, 6355–6363. [Google Scholar] [CrossRef] [PubMed]
- Erkko, H.; Xia, B.; Nikkila, J.; Schleutker, J.; Syrjakoski, K.; Mannermaa, A.; Kallioniemi, A.; Pylkas, K.; Karppinen, S.M.; Rapakko, K.; et al. A recurrent mutation in PALB2 in Finnish cancer families. Nature 2007, 446, 316–319. [Google Scholar] [CrossRef] [PubMed]
- Singh, N.; Baby, D.; Rajguru, J.; Patil, P.; Thakkannavar, S.S.; Pujari, V.B. Inflammation and cancer. Ann. Afr. Med. 2019, 18, 121–126. [Google Scholar] [CrossRef] [PubMed]
- Pollak, M. The insulin and insulin-like growth factor receptor family in neoplasia: An update. Nat. Rev. Cancer 2012, 12, 159–169. [Google Scholar] [CrossRef]
- Lauby-Secretan, B.; Dossus, L.; Marant-Micallef, C.; His, M. Obesity and Cancer. Bull. Cancer 2019, 106, 635–646. [Google Scholar] [CrossRef] [PubMed]
- Porter, M.P.; Stanford, J.L. Obesity and the risk of prostate cancer. Prostate 2005, 62, 316–321. [Google Scholar] [CrossRef] [PubMed]
- Allott, E.H.; Masko, E.M.; Freedland, S.J. Obesity and prostate cancer: Weighing the evidence. Eur. Urol. 2013, 63, 800–809. [Google Scholar] [CrossRef] [PubMed]
- Plaskon, L.A.; Penson, D.F.; Vaughan, T.L.; Stanfordz, J.L. Cigarette smoking and risk of prostate cancer in middle-aged men. Cancer Epidemiol. Biomark. Prev. 2003, 12, 604–609. [Google Scholar]
- Kenfield, S.A.; Stampfer, M.J.; Chan, J.M.; Giovannucci, E. Smoking and prostate cancer survival and recurrence. JAMA J. Am. Med. Assoc. 2011, 305, 2548–2555. [Google Scholar] [CrossRef]
- World Cancer Research Fund. Diet, nutrition, physical activity and prostate cancer. World Cancer Res. Fund Int. 2014. [Google Scholar] [CrossRef]
- Bhindi, B.; Wallis, C.J.D.; Nayan, M.; Farrell, A.M.; Trost, L.W.; Hamilton, R.J.; Kulkarni, G.S.; Finelli, A.; Fleshner, N.E.; Boorjian, S.A.; et al. The association between vasectomy and prostate cancer: A systematic review and meta-analysis. JAMA Intern. Med. 2017, 177, 1273–1286. [Google Scholar] [CrossRef]
- Perletti, G.; Monti, E.; Magri, V.; Cai, T.; Cleves, A.; Trincheri, A.; Montanari, E. The association between prostatitis and prostate cancer. Systematic review and meta-analysis. Arch. Ital. Urol. Androl. 2017, 89, 259–265. [Google Scholar] [CrossRef]
- Doat, S.; Cénée, S.; Trétarre, B.; Rebillard, X.; Lamy, P.J.; Bringer, J.P.; Iborra, F.; Murez, T.; Sanchez, M.; Menegaux, F. Nonsteroidal anti-inflammatory drugs (NSAIDs) and prostate cancer risk: Results from the EPICAP study. Cancer Med. 2017, 6, 2461–2470. [Google Scholar] [CrossRef]
- Ross, A.E.; Feng, Z.; Pierorazio, P.M.; Landis, P.; Walsh, P.C.; Carter, H.B.; Trock, B.J.; Schaeffer, E.M. Effect of treatment with 5-α reductase inhibitors on progression in monitored men with favourable-risk prostate cancer. BJU Int. 2012, 110, 651–657. [Google Scholar] [CrossRef]
- Liss, M.A.; Thompson, I.M. Prostate cancer prevention with 5-alpha reductase inhibitors: Concepts and controversies. Curr. Opin. Urol. 2018, 28, 42–45. [Google Scholar] [CrossRef]
- Kilpeläinen, T.P.; Tammela, T.L.J.; Roobol, M.; Hugosson, J.; Ciatto, S.; Nelen, V.; Moss, S.; Maattanen, L.; Auvinen, A. False-positive screening results in the European randomized study of screening for prostate cancer. Eur. J. Cancer. 2011, 47, 2698–2705. [Google Scholar] [CrossRef]
- Fenton, J.J.; Weyrich, M.S.; Durbin, S.; Liu, Y.; Bang, H.; Melnikow, J. Prostate-specific antigen-based screening for prostate cancer evidence report and systematic review for the us preventive services task force. JAMA J. Am. Med. Assoc. 2018, 319, 1914–1931. [Google Scholar] [CrossRef] [PubMed]
- Pierorazio, P.M.; Walsh, P.C.; Partin, A.W.; Epstein, J.I. Prognostic Gleason grade grouping: Data based on the modified Gleason scoring system. BJU Int. 2013, 111, 753–760. [Google Scholar] [CrossRef] [PubMed]
- Bonekamp, D.; Jacobs, M.A.; El-Khouli, R.; Stoianovici, D.; Macura, K.J. Advancements in MR imaging of the prostate: From diagnosis to interventions. Radiographics 2011, 31, 677–703. [Google Scholar] [CrossRef]
- Carter, B.H.; Albertsen, P.C.; Barry, M.J.; Etzioni, R.; Freedland, S.J.; Greene, L.; Holmberg, L.; Kantoff, P.; Konety, B.R.; Murad, M.H.; et al. American Urological Association (AUA) Guideline GUIDELINE American Urological Association Prostate Cancer. AUA Guidel. 2013. [Google Scholar]
- Ghai, S.; Haider, M.A. Multiparametric-MRI in diagnosis of prostate cancer. Indian J. Urol. 2015, 31, 194–201. [Google Scholar] [CrossRef]
- Leslie, S.W.; Soon-Sutton, T.L.; Sajjad, H.; Siref, L.E. Prostate Cancer. In StatPearls; StatPearls Publishing: Treasure Island, FL, USA, 2020. Available online: https://www.ncbi.nlm.nih.gov/b... (accessed on 25 May 2020).
- Hegde, J.V.; Mulkern, R.V.; Panych, L.P.; Fennessy, F.M.; Fedorov, A.; Maier, S.E.; Tempany, C.M.C. Multiparametric MRI of prostate cancer: An update on state-of-the-art techniques and their performance in detecting and localizing prostate cancer. J. Magn. Reson. Imaging 2013, 37, 1035–1054. [Google Scholar] [CrossRef] [PubMed]
- El-Shater Bosaily, A.; Parker, C.; Brown, L.C.; Gabe, R.; Hindley, R.G.; Kaplan, R.; Emberton, M.; Ahmed, H.U. PROMIS—Prostate MR imaging study: A paired validating cohort study evaluating the role of multi-parametric MRI in men with clinical suspicion of prostate cancer. Contemp. Clin. Trials 2015, 42, 26–40. [Google Scholar] [CrossRef]
- Ahmed, H.U.; Bosaily, E.-S.; Brown, L.C.; Gabe, R.; Kaplan, R.; Parmar, M.K.; Collaco-Moraes, Y.; Ward, K.; Hindley, R.G.; Freeman, A.; et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): A paired validating confirmatory study. Lancet 2017, 389, 815–822. [Google Scholar] [CrossRef]
- Skouteris, V.M.; Crawford, E.D.; Mouraviev, V.; Arangua, P.; Metsinis, M.P.; Skouteris, M.; Zacharopoulos, G.; Stone, N.N. Transrectal Ultrasound-guided Versus Transperineal Mapping Prostate Biopsy: Complication Comparison. Rev. Urol. 2018, 20, 19–25. [Google Scholar] [CrossRef] [PubMed]
- Bill-Axelson, A.; Holmberg, L.; Garmo, H.; Taari, K.; Busch, C.; Nordling, S.; Haggman, M.; Andersson, S.O.; Andren, O.; Steineck, G.; et al. Radical prostatectomy or watchful waiting in early prostate cancer. N. Engl. J. Med. 2014, 379, 2319–2329. [Google Scholar] [CrossRef] [PubMed]
- Yaxley, J.W.; Coughlin, G.D.; Chambers, S.K.; Occhipinti, S.; Samaratunga, H.; Zajdlewicz, L.; Dunglison, N.; Carter, R.; Williams, S.; Payton, D.J.; et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: Early outcomes from a randomised controlled phase 3 study. Lancet 2016, 388, 1057–1066. [Google Scholar] [CrossRef]
- Haglind, E.; Carlsson, S.; Stranne, J.; Wallerstedt, A.; Wilderang, U.; Thorsteinsdottir, T.; Lagerkvist, M.; Damber, J.E.; Bjartell, A.; Hugosson, J.; et al. Urinary Incontinence and Erectile Dysfunction after Robotic Versus Open Radical Prostatectomy: A Prospective, Controlled, Nonrandomised Trial. Eur. Urol. 2015, 68, 216–225. [Google Scholar] [CrossRef]
- Moncada, I.; López, I.; Ascencios, J.; Krishnappa, P.; Subirá, D. Complications of robot assisted radical prostatectomy. Arch. Esp. Urol. 2019, 72, 266–276. [Google Scholar]
- Bratu, O.; Oprea, I.; Marcu, D.; Spinu, D.; Niculae, A.; Geavlete, B.; Mischianu, D. Erectile dysfunction post-radical prostatectomy–A challenge for both patient and physician. J. Med. Life 2017, 10, 13–18. [Google Scholar]
- Hamdy, F.C.; Donovan, J.L.; Lane, J.A.; Mason, M.; Metcalfe, C.; Holding, P.; Davis, M.; Peters, T.J.; Turner, E.L.; Martin, R.M.; et al. 10-year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N. Engl. J. Med. 2016, 375, 1415–1424. [Google Scholar] [CrossRef]
- Mendez, L.C.; Morton, G.C. High dose-rate brachytherapy in the treatment of prostate cancer. Transl. Androl. Urol. 2018, 7, 357–370. [Google Scholar] [CrossRef]
- Hannoun-Lévi, J.M. Brachytherapy for prostate cancer: Present and future. Cancer Radiother. 2017, 21, 469–472. [Google Scholar] [CrossRef]
- Parker, C.C.; James, N.D.; Brawley, C.D.; Clarke, N.W.; Hoyle, A.P.; Ali, A.; Ritchie, A.W.S.; Attard, G.; Chowdhury, S.; Cross, W.; et al. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): A randomised controlled phase 3 trial. Lancet 2018, 392, 2353–2366. [Google Scholar] [CrossRef]
- Carthon, B.C.; Antonarakis, E.S. The STAMPEDE trial: Paradigm-changing data through innovative trial design. Transl. Cancer Res. 2016, 5, S485–S490. [Google Scholar] [CrossRef] [PubMed]
- Ryan, C.J.; Smith, M.R.; De Bono, J.S.; Molina, A.; Logothetis, C.J.; de Souza, P.; Fizazi, K.; Mainwaring, P.; Piulats, J.M.; Ng, S.; et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N. Engl. J. Med. 2013, 368, 138–148. [Google Scholar] [CrossRef] [PubMed]
- Siegel, R. L., Miller, K. D. & Jemal, A. Cancer statistics, 2018. CA Cancer J. Clin. 68, 7–30 (2018).
- Ghazarian, A. A., Kelly, S. P., Altekruse, S. F., Rosenberg, P. S. & McGlynn, K. A. Future of testicular germ cell tumor incidence in the United States: forecast through 2026. Cancer 123, 2320–2328 (2017).
- Trabert, B., Chen, J., Devesa, S. S., Bray, F. & McGlynn, K. A. International patterns and trends in testicular cancer incidence, overall and by histologic subtype, 1973–2007. Andrology 3, 4–12 (2015).
- Fitzmaurice, C. et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: a systematic analysis for the global burden of disease study. JAMA Oncol. 3, 524–548 (2017).
- Berney, D. M. et al. Germ cell neoplasia in situ (GCNIS): evolution of the current nomenclature for testicular pre-invasive germ cell malignancy. Histopathology 69, 7–10 (2016).
- Moch, H., Cubilla, A. L., Humphrey, P. A., Reuter, V. E. & Ulbright, T. M. The 2016 WHO classification of tumours of the urinary system and male genital organs—part A: renal, penile, and testicular tumours. Eur. Urol. 70, 93–105 (2016).
- Moch, H., Humphrey, P. A., Ulbright, T. M. & Reuter, V. E. in WHO Classification of Tumours of the Urinary System and Male e Genital Organs 4th edn (eds Moch, H. & Ulbright, T. M.) (International Agency for Research on Cancer (IARC), 2016).
- Oosterhuis, J. W. & Looijenga, L. H. Testicular germ-cell tumours in a broader perspective. Nat. Rev. Cancer 5, 210–222 (2005).
- Cheng, L., Lyu, B. & Roth, L. M. Perspectives on testicular germ cell neoplasms. Hum. Pathol. 59, 10–25 (2017).
- Albers, P. et al. Guidelines on testicular cancer: 2015 update. Eur. Urol. 68, 1054–1068 (2015). This paper presents the European Association of Urology guidelines on the treatment of testicular cancer.
- Oldenburg, J. et al. Testicular seminoma and non-seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 24 (Suppl. 6), vi125–vi132 (2013). This paper presents the European Society for Medical Oncology guidelines on the management of testicular cancer.
- Hanna, N. H. & Einhorn, L. H. Testicular cancer —discoveries and updates. N. Engl. J. Med. 371, 2005–2016 (2014). This is a comprehensive state of the art review on testicular cancer.
- Hanna, N. & Einhorn, L. H. Testicular cancer: a reflection on 50 years of discovery. J. Clin. Oncol. 32, 3085–3092 (2014).
- Tandstad, T. et al. Practice makes perfect: the rest of the story in testicular cancer as a model curable neoplasm. J. Clin. Oncol. 35, 3525–3528 (2017).
- Feldman, D. R., Bosl, G. J., Sheinfeld, J. & Motzer, R. J. Medical treatment of advanced testicular cancer. Jama 299, 672–684 (2008).
- Chovanec, M., Hanna, N., Cary, K. C., Einhorn, L. & Albany, C. Management of stage I testicular germ cell tumours. Nat. Rev. Urol. 13, 663–673 (2016).
- Fung, C. et al. Multi-institutional assessment of adverse health outcomes among North American testicular cancer survivors after modern cisplatin-based chemotherapy. J. Clin. Oncol. 35, 1211–1222 (2017).
- Kerns, S. L., Fung, C., Monahan, P. O., Ardeshir-Rouhani-Fard, S. & Abu Zaid, M. I. Cumulative burden of morbidity among testicular cancer survivors after standard cisplatin-based chemotherapy: a multi-institutional study. J. Clin. Oncol. 36, 1505–1512 (2018).
- Douglawi, A. & Masterson, T. A. Penile cancer epidemiology and risk factors: a contemporary review. Curr. Opin. Urol. 29, 145–149 (2019).
- Olesen, T. B. et al. Prevalence of human papillomavirus DNA and p16(INK4a) in penile cancer and penile intraepithelial neoplasia: a systematic review and meta-analysis. Lancet Oncol. 20, 145–158 (2019).
- Dräger, D. L., Milerski, S., Sievert, K. D. & Hakenberg, O. W. Psychosocial effects in patients with penile cancer: a systematic review. Urologe A 57, 444–452 (2018).
- Novara, G., Galfano, A., De Marco, V., Artibani, W. & Ficarra, V. Prognostic factors in squamous cell carcinoma of the penis. Nat. Clin. Pract. Urol. 4, 140–146 (2007).
- Woldu, S. L. et al. Usage and survival implications of surgical staging of inguinal lymph nodes in intermediate- to high-risk, clinical localized penile cancer: a propensity-score matched analysis. Urol. Oncol. 36, 159.e7–159.17 (2018).
- Ross, G. L. et al. The learning curve for sentinel node biopsy in malignant melanoma. Br. J. Plast. Surg. 55, 298–301 (2002).
- Flaig, T. W. et al. NCCN Guidelines Version 2.2020 Penile Cancer (NCCN, 2020).
- Hakenberg, O. W. et al. EAU guidelines on penile cancer: 2014 update. Eur. Urol. 67, 142–150 (2015).
- Pagliaro, L. C. et al. Neoadjuvant paclitaxel, ifosfamide, and cisplatin chemotherapy for metastatic penile cancer: a phase II study. J. Clin. Oncol. 28, 3851–3857 (2010).
- Agarwal, G., Gupta, S. & Spiess, P. E. Novel targeted therapies for the treatment of penile cancer. Expert Opin. Drug Discov. 9, 959–968 (2014).
- Montes Cardona, C. E. & García-Perdomo, H. A. Incidence of penile cancer worldwide: systematic review and meta-analysis. Rev. Panam. Salud Publica 41, e117 (2017).
- Bray, F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 68, 394–424 (2018).
- Ferlay, J. et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int. J. Cancer 144, 1941–1953 (2019).
- Visser, O. et al. Incidence and survival of rare urogenital cancers in Europe. Eur. J. Cancer 48, 456–464 (2012)
- Barnes, K. T. et al. Obesity is associated with increased risk of invasive penile cancer. BMC Urol. 16, 42 (2016).
- Vieira, C. B. et al. Profile of patients with penile cancer in the region with the highest worldwide incidence. Sci. Rep. 10, 2965 (2020).
- Alnajjar, H. M., Randhawa, K. & Muneer, A. Localized disease: types of reconstruction/plastic surgery techniques after glans resurfacing/glansectomy/partial/ total penectomy. Curr. Opin. Urol. 30, 213–217 (2020)
