Пренатальное развитие иммунной системы человека

Аннотация
Кровь и иммунная система в период раннего эмбриогенеза развиваются параллельно. Возникающие при этом очаги гемопоэза, разделенные в анатомическом пространстве и времени, дают начало циркулирующим и резидентным иммунным клеткам. Предыдущие исследования основывались на животных моделях, которые отличаются от людей как сроками развития, так и набором микроорганизмов, с которыми они взаимодействуют. Определение состава иммунной системы человека в настоящее время возможно благодаря использованию мультиомиксного подхода к единичной клетке. Крупномасштабная одноклеточная геномика, технологии визуализации и инициатива Human Cell Atlas вместе позволили осуществить картирование на уровне развивающейся иммунной системы человека и возникающих в ходе развития свойств. Хотя точные роли специфических иммунных клеток в процессе эмбриогенеза требуют дальнейшего изучения, система в целом проявляет гибкие свойства и высокую чувствительность в соответствии с потребностями развития и проблемами окружающей среды.
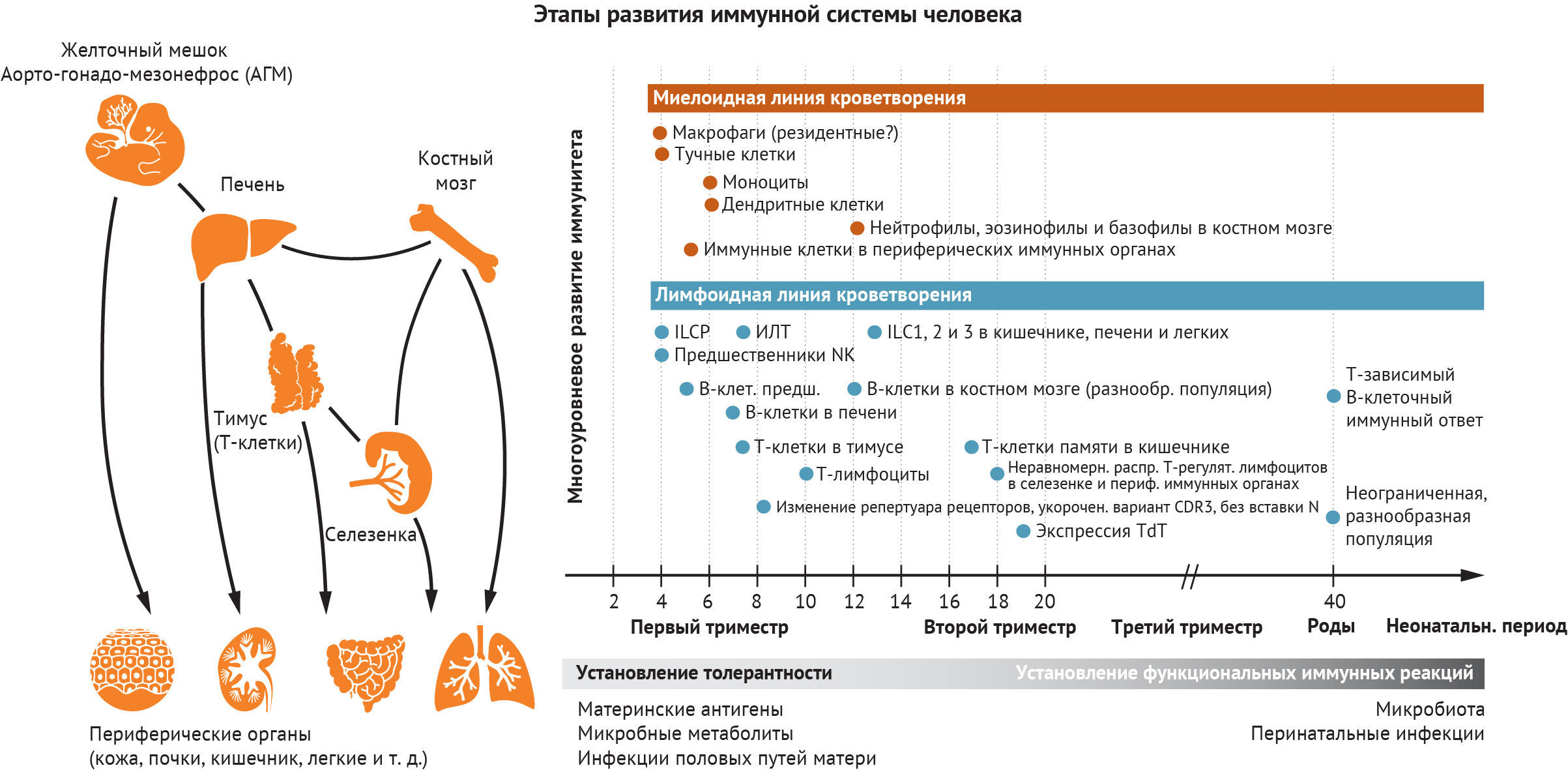
Животные модельные системы предоставили фундаментальные доказательства, которые формируют наше понимание процесса развития гемопоэза. Исследования, проведенные на мышах, рыбах данио-рерио и курах, показали, что гемопоэз и иммунногенез происходят в разных анатомических участках (рис. 1). Первые клетки крови развиваются вне зародыша и в условиях тесной связи с эндотелиальными клетками желточного мешка [1]. Эмбриональные гемопоэтические стволовые клетки (ЭГСК), способные репопулировать при трансплантации в организм взрослого хозяина, происходят из области аорто-гонадо-мезонефроса (АГМ) [2]. Печень и костный мозг плода (КМ) впоследствии наполняются как предшественниками, полученными из желточного мешка, так и ЭГСК, поступающими из АГМ [3].
Однако сроки развития иммунной системы неодинаковы у разных видов. Например, тимус плода мыши заметно менее развит по сравнению с таковым у человека, что создает условия для полной дифференцировки наивных Т-клеток в утробе матери [4]. Кроме того, некоторые маркеры, определяющие популяцию тех или иных лимфоцитов, сохраняются недостаточно хорошо, что затрудняет непосредственное применение результатов исследований на животных к людям. Влияние микробной экспозиции системы «мать-плод» на иммунное развитие плода признается научным сообществом все чаще; и как комменсальный, так и патогенный состав микробиоты у разных видов может различаться. Исследования, направленные на изучение развития иммунной системы человека, были затруднены из-за сложного доступа к тканям, а также вследствие экспериментальных и этических ограничений, но мультиомиксные технологии, направленные на анализ единичных клеток, ускорили появление новых открытий. В данном обзоре мы обсуждаем, как эти технологии позволяют получить беспрецедентное представление о внутриутробном развитии иммунной системы. Мы опишем ключевые идеи о том, как меняется иммуногенез во времени и пространстве, и объясним, как иммунные клетки подготавливают плод к взаимодействию с антигеном, а также играют неканонические роли в иммуногенезе.
От отдельных клеток к развитию на уровне системы
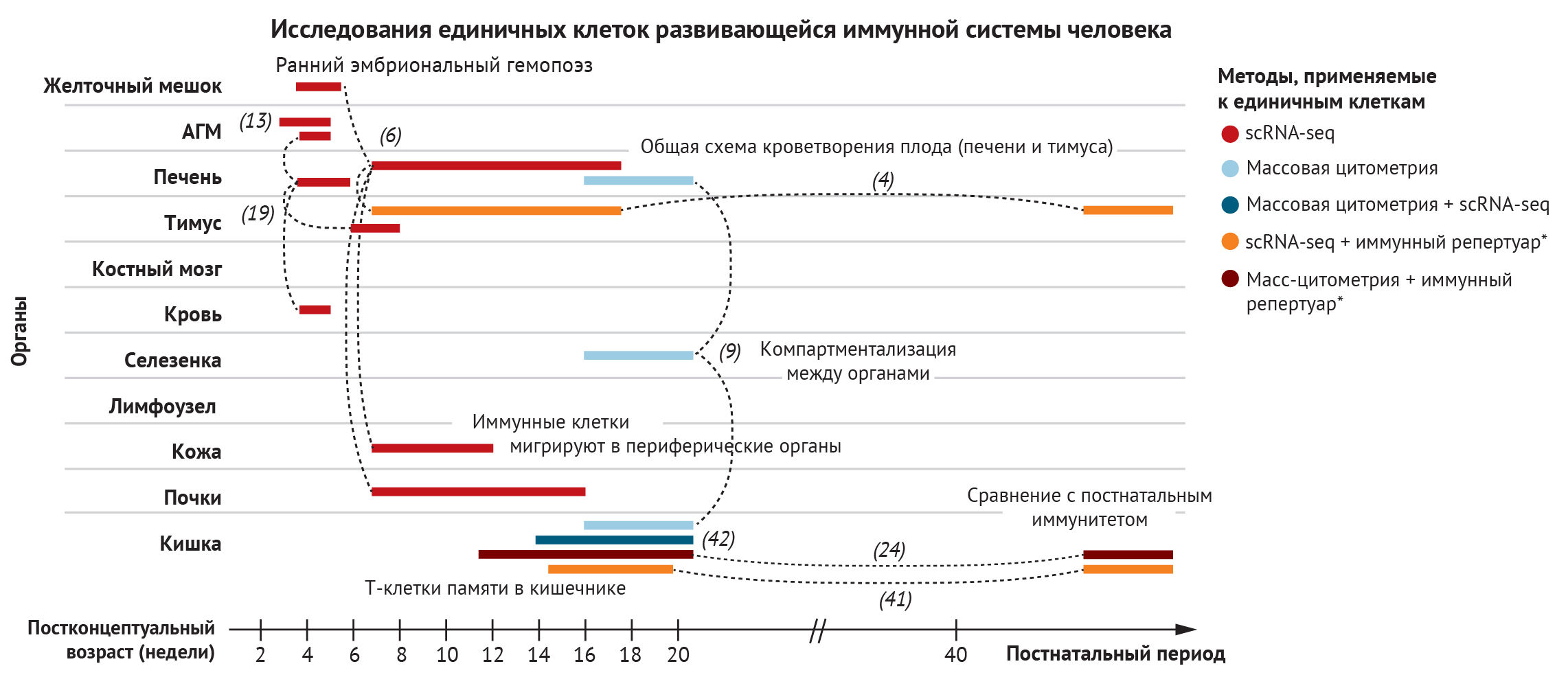
Для того, чтобы проанализировать развитие элементов крови ииммунной системы в пренатальном периоде, необходимs высокоэффективные средства. Секвенирование РНК единичных клеток (scRNA-seq) стало мощным инструментом для комплексного понимания иммунной системы, позволяя объективно определять состояние клеток и изучать сложные и гетерогенные многоклеточные структуры [5]. Методы капельного секвенирования scRNA-seq, такие как 10X, теперь масштабируются до такой степени, что становится возможным адекватно проанализировать целые органы. Так, авторы создали профили отдельных клеток из желточного мешка и печени для реконструкции раннего кроветворения, из тимуса — для изучения развития Т-клеток, из кожи и почек — для выяснения заселения иммунными клетками периферических органов [4, 6]. Вычислительные методы позволили сравнить состояния клеток в разных тканях и предсказать важнейшие взаимодействия рецепторов и соответствующих лигандов, которые играют критическую роль в формировании судьбы иммунных клеток в определенных тканях [7].
Корреляция с методами визуализации — например, транскриптомикой in situ, — позволила провести комплексную характеристику микроокружения тканей [4, 7–9]. Траектории развития были прослежены по отдельности для каждой ткани, так как клетки просматривались на разных стадиях дифференцировки и путем интеграции образцов из разных гестационных возрастов. Этот метод позволяет осуществить всестороннее изучение внутриутробного развития иммунитета. Между тем, на сегодняшний день сохраняются значительные проблемы в отслеживании происхождения определенных иммунных клеток по отдельным очагам кроветворения. Достижения в секвенировании ДНК единичных клеток в сочетании с аналитическими методами для отслеживания различных клонов могут приблизить исследователей к этой цели.
Развитие иммунной системы в пространстве и времени
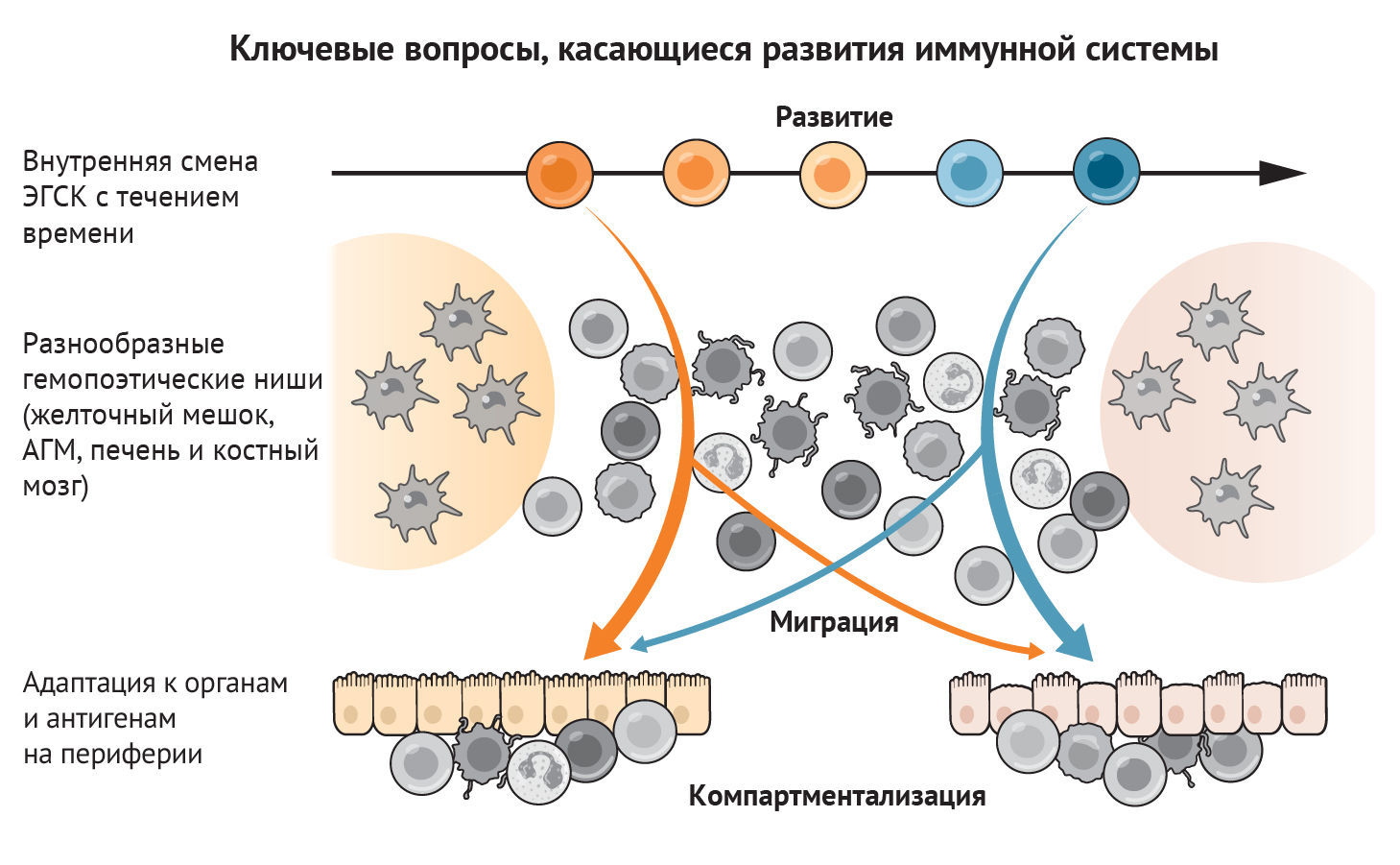
В этом разделе мы рассмотрим ход развития иммунной системы человека в пространстве и времени. Мы начнем с характеристики типов клеток по мере их появления в желточном мешке или печени плода, а затем рассмотрим тимус как ключевой орган, где происходит развитие Т-клеток. Это, к сожалению, не будет исчерпывающим описанием иммуногенеза, поскольку на сегодняшний день в иммунокомпетентных органах и тканях идентифицировано около 40 различных состояний иммунных клеток. Вместо этого мы сосредоточимся на понимании того, как мультиомиксные подходы к изучению одной клетки продвинули понимание функционирования всей иммунной системы плода человека (рис. 2).
Желточный мешок и аорто-гонадо-мезонефрос
Анализ эмбрионального желточного мешка человека демонстрирует присутствие ЭГСК-подобных предшественников, макрофагов, тучных клеток (ТК), предшественников натуральных киллеров (NK) и лимфоидных клеток врожденного иммунитета (ЛВИ) наряду с мегакариоцитами и эритроидными клетками уже на четвертой неделе внутриутробного развития (ВУР) [6]. Происхождение макрофагов интенсивно изучалось, потому что тканевые макрофаги возникают независимо от ЭГСК и способны к самообновлению в условиях гомеостаза на мышиных моделях [10]. Тканерезидентные макрофаги в печени, легких, мозге и эпидермисе, как было показано с помощью картирования развития клеток, возникают в процессе гемопоэза в желточном мешке из эритромиелоидного предшественника [11, 12]. И хотя остаточный вклад желточного мешка сохраняется в ряде тканей (например, в печени, головном мозге и эпидермисе), макрофаги постепенно замещаются моноцитами, происходящими из ЭГСК, и в других местах (например, в кишечнике, легких и сердце).
Этот процесс отчасти зависит от того, насколько «открытой» остается ниша для циркулирующих клеток [10]. У мышей точный вклад первой и второй волн гемопоэза из желточного мешка и ответ на вопрос о возникновении макрофагов из моноцитов до сих остаются неизвестными [10]. При развитии эмбриона у человека тканеспецифичные макрофаги можно наблюдать с самых ранних временных точек [6, 13, 14]. Одноклеточная диссекция АГМ эмбриона человека выявила определенную гемогенную эндотелиальную популяцию, которая дает начало макрофагам [13]. К 6 неделе ВУР эмбриональная поджелудочная железа уже содержит макрофаги, микроглия сопровождает развивающийся мозг, а клетки Хофбауэра выстилают плаценту [7,14,15]. Идентификация этих клеток в значительных количествах до начала гемопоэза в печени плода на 6–9 неделе ВУР свидетельствует о заселении периферических тканей макрофагами, происходящими из желточного мешка или АГМ. Попытки использовать транскрипционное сходство между макрофагами желточного мешка и макрофагами печени плода для анализа онтогенеза макрофагов в тканях недостаточно надежны вследствие влияния окружения на экспрессию генов после оседания этих клеток в тканях.
Однако данный анализ позволил охарактеризовать разнообразие макрофагов, существенно важное для развития, например, макрофагов эритроидных островков, обеспечивающих стимуляцию эритропоэза и клеток Купфера с ярко выраженной фагоцитарной активностью в печени плода [6]. Кроме того, помимо макрофагов, картирование развития клеток показало, что ТК у мышей возникают как из желточного мешка, так и из предшественников, происходящих из ЭГСК, и что паттерны удержания ТК, происходящих из желточного мешка, являются тканеспецифичными [16, 17]. В развитии человека четкий профиль ТК выявляется как в желточном мешке, так и в печени плода [6]. ТК соединительной ткани в коже и почках плода обнаруживают значительное сходство с ТК фетальной печени по профилю экспрессии генов [6]. Эта ранняя «ориентированность» эмбриона н производство ТК вызывает удивление. Наиболее характерной функцией этих клеток является их участие в аллергических реакциях на связывание иммуноглобулина E (IgE) с помощью высокоаффинного рецептора IgE [18]. ТК печени и желточного мешка плохо приспособлены для этой задачи, поскольку они не экспрессирует ген альфа-субъединицы рецептора IgE (FCER-1-A) [6]. Ранняя продукция ТК может происходить для заселения развивающихся участков слизистой оболочки и соединительных тканей резидентными иммунными клетками или же для создания пула эффекторов врожденного иммунитета, способных реагировать на ассоциированные с патогеном молекулярные паттерны. Кроме того, предсказаны и дополнительные функции, заключающиеся в том, что ТК могут способствовать ангиогенезу. У эмбрионов мышей ТК кожи экспрессируют гены, участвующие в формировании паттернов сосудов и нервов [6, 16]. У взрослых млекопитающих ТК поддерживают как физиологический, так и воспалительный ангиогенез [18].
Роль тучных клеток в пренатальном развитии сосудов требует дальнейшего изучения. NK-клетки, предшественники ЛВИ и их общие лимфоидные предшественники могут быть идентифицированы по транскриптому отдельных клеток желточного мешка и печени плода [6, 19]. На более поздних стадиях они обнаруживаются уже с большей степенью разнообразия и дифференцировки в различных фетальных органах [9, 20]. В отличие от материнских децидуальных NK-клеток, роль которых во время беременности хорошо охарактеризована [7, 21], понимание функции фетальных NK-клеток на сегодняшний день ограничено. Хотя NK-клетки плода считаются незрелыми и гипореактивными по сравнению с NK-клетками у взрослых, они уже обладают высокой степенью киллерной активности [22, 23]. Более того, NK-клетки плода или младенца сходны с таковыми у взрослых по целому ряду признаков, что позволяет предположить, что они уже могут реагировать на соответствующие стимулы, такие как, например, вирусная инфекция [23]. Соответственно, NK-клетки в изобилии присутствуют в кишечнике младенцев, содержат цитолитические гранулы, а их способность к дегрануляции превышает таковую у NK-клеток кишечника взрослого человека [20]. В дополнение к NK-клеткам было показано, что и другие типы ЛВИ у плода присутствуют в большем количестве, чем у младенцев [24]. В их числе — клетки-индукторы лимфоидной ткани (ИЛТ), которые играют важнейшую роль в формировании вторичных лимфоидных органов [25, 26]. Взаимодействуя со стромальными клетками, клетки ИЛТ индуцируют положительную обратную связь для привлечения дополнительных клеток ИЛТ и других иммунных клеток, создавая лимфоидное окружение [27]. Таким образом, ЛВИ развиваются у эмбриона человека очень рано и участвуют как в защите тканей, так и в их ремоделировании. В этой наиболее ранней стадии гемопоэза в желточном мешке значительная роль отводится развитию иммунных клеток со структурными и физиологическими функциями наряду с приобретением эмбрионом базового набора врожденных эффекторов иммунитета. Точная роль этих клеток в развитии тканей и участие в прохождении контрольных точек, которые предотвращают повреждающие иммунные реакции в утробе матери, требует дальнейшего изучения.
Печень и костный мозг
Дефинитивные ЭГСК могут генерировать полный набор линий эритроидных, миелоидных, лимфоидных клеток и мегакариоцитов в печени плода, однако нейтрофилы будут отсутствовать до установления гемопоэза в костном мозге (КМ) [28]. В отличие от макрофагов, моноциты и дендритные клетки (ДК) считаются ЭГСК-зависимыми популяциями. У мышей они прослеживаются вплоть до клоногенного предшественника в КМ, называемого предшественником ДК-макрофагов [29]. В процессе человеческого эмбриогенеза первые признаки пролиферации ДК наблюдаются в печени плода уже примерно с 6 недели ВУР [6]. Обычные ДК1, ДК2 и плазмоцитоидные ДК обнаруживаются в тканях плода — включая легкие, селезенку, кожу и тимус — на 12 недели ВУР и являются относительно многочисленными по сравнению с популяцией ДК во взрослых тканях [30]. ДК плода, как и их аналоги во взрослом организме, способны мигрировать, реагировать на Toll-подобные рецепторы и стимулировать пролиферацию и активацию T-клеток [30]. Фетальные ДК обладают особой способностью индуцировать дифференцировку регуляторных Т-лимфоцитов, стимулировать выработку Т-клеточного интерлейкина 4 и ингибировать выработку фактора некроза опухоли альфа (TNF-α) с помощью аргиназы II [30]. Таким образом, ДК играют важную роль в поддержании толерантности во время ВУР. Популяция В-клеток впервые появляется в печени плода с 7 недели ВУР в виде предшественников В-лимфоцитов; зрелые же B-клетки присутствуют только после 9 недели ВУР [6].
Частично это можно объяснить изменением способности ЭГСК продуцировать B-клетки и соответствующего микроокружения печени, необходимого для их дифференцировки [30]. В середине беременности КМ становится основным источником B-клеток, а зрелые B-клетки в изобилии обнаруживаются в селезенке [31]. И хотя разнообразие эмбриональных В-лимфоцитов достигается еще на ранних стадиях [24, 32], формирование герминативных центров подавляется до воздействия антигенов после рождения, что сопровождается активной соматической гипермутацией [33]. Сравнение В-клеток кишечника, полученных от плодов второго триместра, с В-клетками младенцев при помощи масс-цитометрии, комбинированной с анализом репертуара рецепторов В-клеток, хорошо продемонстрировало, что кишечные В-клетки у плода — это, прежде всего, фолликулярные и переходные В-клетки, тогда как плазматические В-клетки в большей степени представлены у младенцев [24]. Другим интересным аспектом дифференцировки В-клеток, который интенсивно изучался на мышиной модели, является поэтапное развитие клеток В-1, сходных с клетками врожденного иммунитета. Они преобладают в начале беременности, а затем появляются и обычные клетки В-2 [34]. Однако окончательно идентичность человеческих B-1-подобных клеток еще не определена [35]. Будущие исследования по созданию клеточного атласа КМ и селезенки плода человека позволят лучше понять онтологию B-клеток, подчеркнув специфические для тех или иных органов различия в нишевых факторах, которые поддерживают дифференцировку B-клеток.
«Клинические последствия иммунного развития и функции плода выходят далеко за пределы жизни в утробе матери»
Тимус и периферические иммунные органы
Тимус обеспечивает среду, необходимую для развития Т-клеток. Ранние лимфоидные предшественники, происходящие из печени плода, мигрируют в тимус на 8 неделе ВУР, где они развиваются в наивные Т-клетки [36]. Развитие и созревание вилочковой железы (тимуса) опосредовано взаимодействием между стромальными клетками тимуса и иммунными компонентами и было в значительной степени изучено на мышиных моделях. Комплексное профилирование транскриптома единичных клеточных компонентов развивающегося тимуса человека показало четкую взаимосвязь между эпителиальными клетками тимуса, клетками мезенхимы, ранними предшественниками тимоцитов, развивающимися и зрелыми Т-клетками и другими популяциями иммунных клеток [4, 19]. Количественные соотношения разных клеточных популяций также демонстрируют скоординированные изменения в процессе развития, что еще раз доказывает важность взаимодействий между несколькими типами клеток для правильного развития органов [4]. Исследования клеток печени и тимуса плода позволили подробно описать молекулярные характеристики, сопровождающие переход от ранних предшественников тимуса к наивным Т-клеткам [4, 6, 19]. Ху и его коллеги сосредоточились на составлении молекулярного профиля клеток-предшественниц, населяющих тимус [19]. Группа авторов данного обзора расширила этот анализ до более поздних этапов развития [4].
Вместе эти исследования выявили непрерывный ряд развития от ранних предшественников тимуса до разнообразных типов зрелых Т-клеток. Наивные Т-клетки выходят из вилочковой железы и мигрируют в другие ткани. Циркулирующие Т-клетки обнаруживаются у плода уже через 10–11 недель после функционального развития тимуса [37]. Отсутствие или наличие микроорганизмов в плодном окружении пока остается предметом дискуссий. Хотя считается, что при нормальном течении беременности это окружение, скорее всего, стерильно, ненаследуемые материнские аллоантигены и побочные продукты обмена микробиоты могут потенциально активировать иммунную систему плода. Чтобы избежать аллореактивности, плод должен поддерживать иммунологическую толерантность. Как следствие, наивные Т-клетки, возникающие у плода, с большей вероятностью приобретают судьбу Т-регуляторных по сравнению со наивными Т-клетками взрослого организма [38]. Фетальные регуляторные Т-клетки подавляют пролиферацию и секрецию цитокинов другими фетальными Т-клетками, которые потенциально обладают самореактивностью [39].
Т-клетки памяти были обнаружены в кишечнике плода, что подчеркивает способность фетальных Т-клеток реагировать на чужеродные антигены [9, 24, 40, 421]. Исследования CD4+ T-лимфоцитов кишечника с помощью технологий анализа единичных клеток в сочетании с определением репертуара клеточных рецепторов выявили существование пула T-клеток памяти и регуляторных T-клеток с признаком клональной экспансии, что демонстрирует баланс между активацией и подавлением адаптивного иммунного ответа у плода [24, 42]. CD4+ Т-клетки кишечника также могут играть роль в стимуляции дифференцировки, как показано в случае умеренной экспрессии TNF-α [41]. Таким образом, адаптивный иммунитет плода оказывается значительно более зрелым, чем предполагалось ранее. Области будущих исследований иммунной системы плода включают изучение антигенных сигналов, лежащих в основе активации фетальных Т-клеток, и роли, которую они играют в развитии и защите плода. При помощи такого анализа онтогенеза иммунитета плода во времени и пространстве авторы отмечают появление как врожденных, так и адаптивных иммунных клеток с характерными свойствами, отличающимися от таковых у взрослых. Среди компонентов, отсутствующих в этом обзоре, можно назвать нейтрофилы. Последние данные свидетельствуют о том, что около трети эмбриональных клеток костного мозга являются нейтрофилами или их предшественниками уже к 10–13 неделе ВУР, и доля их увеличивается до двух третей к 21 неделе ВУР [43]. Младенцы, рожденные недоношенными или маловесными, имеют меньшее количество циркулирующих нейтрофилов, более низкий нейтрофильный пул и более высокой риск смерти от сепсиса [44]. Понимание работы нейтрофильного компартмента у плода , даст представление о том, как можно поддерживать иммунную защиту в раннем возрасте.
Заключение
Мульти-«омиксные» и пространственные технологии предоставили идеальные платформы для подробного анализа и реконструирования развивающейся иммунной системы [4, 6, 9, 13, 19, 24, 41, 42]. Однако многие аспекты остаются неизученными (рис. 3). Как изменяются гемопоэтические предшественники в процессе развития? Как различные тканевые ниши, такие как желточный мешок, печень, КМ, тимус и селезенка, влияют на популяции предшественников и развитие иммунных клеток? Как иммунные клетки мигрируют и адаптируются в периферических нелимфоидных тканях? Как иммунная система взаимодействует с организмом, обучается и формирует память для будущих встреч с антигеном? Завершение разработки иммунного атласа путем сосредоточения внимания на органах и недостающих временных точках, расширение анализа для сравнения со иммунными клетками взрослого организма, а также системное и межвидовое сравнение дадут дополнительные знания о том, как развивалась и развивается иммунная система человека. Клиническое значение понимания развития и функционирования иммунной системы плода выходят далеко за пределы жизни в утробе матери. Характерные для плода гемопоэтические клетки-предшественники в настоящее время признаны вероятными источниками происхождения бластных клеток опухолей системы крови, включая острый мегакариобластический лейкоз, ассоциированный с синдромом Дауна, ювенильный миеломоноцитарный лейкоз и острый лимфобластический лейкоз у детей. Ранние первичные иммунодефицитные состояния с нарушением реакции на заражение патогеном и/или аутоиммунные патологии также могут зависеть от нарушений процесса развития. В этих условиях аберрантный гемопоэз также приводит к изменению функционирования иммунной системы. Биологическое понимание онтогенеза иммунной системы может совершить революцию в технологиях трансплантации стволовых клеток и тканевой инженерии, необходимых для иммунотерапии и регенеративной медицины в ближайшем будущем.