Как аспирин способен защитить от генотоксичности

Лучевая болезнь — одна из самых трудных патологий для лечения [1]. Поиски средств для противодействия негативному влиянию радиации начались после применения ядерного оружия во время Второй мировой войны. В дальнейшем этот поиск стимулировался новыми радиологическими катастрофами по всему миру. Также радиопротекторы для профилактики применяют те, кто работает с источниками излучения: пилоты и космонавты, которые подвержены высокому риску космического облучения, а также пациенты, получающие лучевую терапию. Несмотря на десятки лет исследований, безопасный, эффективный и экономичный радиопротектор по-прежнему не создан.
Ацетилсалициловая кислота (аспирин) — один из старейших препаратов в истории медицины. Такие растения, как мирт, таволга и ива, содержащие салицилаты, были известны уже 4 тыс. лет назад. Аспирин широко применяется для лечения боли, проявлений воспаления, лихорадки, а в последнее время — для профилактики сердечно-сосудистых заболеваний и злокачественных новообразований [2, 3].
Повреждение костного мозга — основная причина летальных исходов после облучения. Следовательно, защита костного мозга является основной целью разработки мер противодействия радиации. Воспаление — это ключевой исход и движущая сила индуцированного радиацией повреждения тканей [4]. Учитывая противовоспалительное действие аспирина, авторы задались вопросом, способно ли это вещество защитить от радиации. При введении мышам аспирин защищал от вызванного облучением повреждения костного мозга (рис. 1а) и подавлял индукцию провоспалительных генов, таких как Ifnb1, Mx1 и Tnfa in vivo и в моноцитах костного мозга (МКМ).
Паттерн-распознающие рецепторы (PR-рецепторы) играют центральную роль в инициации воспаления и гибели клеток; в число этих рецепторов входят Toll-подобные рецепторы (TLR), RIG-I-подобные рецепторы (RLR) и цитозольные ДНК-сенсоры (CDS) [5]. Передача сигналов от PR-рецепторов осуществляется через специальные адаптерные белки: MyD88 и TRIF (для TLR), MAVS (для RLR) и STING (для CDS). Для оценки влияния аспирина на вышеупомянутые сигнальные пути, авторы стимулировали моноциты костного мозга (МКМ) специфическими агонистами PR-рецепторов, такими как лиганды TLR (липопетид Pam3CSK4, полиинозиновая-полицитидиловая кислота Poly(I:C)), RIG-I (трансфекция Poly(I:C)), cGAS- STING (трансфекция поли(dA:dT) или cGAMP) и AIM2. Авторы выяснили, что аспирин ингибирует экспрессию генов воспалительного ответа, опосредованную всеми указанными PR-рецепторами, кроме рецепторов инфламмасомы AIM2. Чтобы выяснить, связаны ли радиопротективные свойства аспирина с подавлением воспалительного ответа, обусловленного PR-рецепторами, исследователи сравнили мышей дикого типа (WT, wild-type) с мышами с дефектом передачи сигнала от PR-рецепторов. Выяснилось, что, как и у мышей дикого типа, аспирин защищает от радиации костный мозг у мышей с тройным нокаутом генов сигнальных путей TLR и RLR (Myd88-/-Trif-/-Mavs- /-) (рис. 1b), с дефектом цитозольных ДНК-сенсоров (Sting-/-) (рис. 1c) и с подавленной экспрессией генов воспалительного ответа. Следовательно, наблюдаемое подавление активности костного мозга не зависело от воспаления, запускаемого сигналами от PR-рецепторов, а также радиопротекция аспирина не связана с противовоспалительным действием этого препарата.
Двухцепочечные разрывы ДНК — одни из наиболее опасных последствий облучения, а микроядра — самые важные для исследователей структуры, образующиеся в результате таких разрывов [6]. Известно, что у клеток линии HEK293 отсутствует передача сигнала с PR-рецепторов и снижено число простагландин-эндопероксидсинтаз ЦОГ-1 и ЦОГ-2 — ключевых медиаторов воспаления и болевой чувствительности, наиболее известных мишеней аспирина [7,8]. Однако аспирин подавляет индуцированное радиацией образование микроядер в клетках HEK293, что свидетельствует о том, что такой эффект не связан с его противовоспалительной активностью. При облучении клеток на льду для предотвращения спонтанной репарации ДНК, а затем при переносе их со льда в условия +37 °C для стимуляции репарации, восстановление двухцепочечных разрывов происходило быстрее, если клеточный материал был предварительно обработан аспирином (рис. 1d, e). Также аспирин ускоряет репарацию двухцепочечных разрывов ДНК, вызванных противоопухолевым препаратом доксорубицином.
Репарация двухцепочечных разрывов ДНК обусловлена гомологичной рекомбинацией (HR) и негомологичным соединением концов (NHEJ). С помощью репортерной системы на основе зеленого флуоресцентного белка GFP удалось обнаружить, что аспирин стимулирует именно гомологичную рекомбинацию, а не негомологичное соединение концов. BRCA1 и 53BP1 — ключевые белки контрольных точек репарационных механизмов гомологичной рекомбинации и негомологичного соединения концов соответственно. Аспирин усиливал привлечение белков BRCA1, но не 53BP1, к участкам поврежденной ДНК (рис. 1f, g). Соответственно, при делеции гена BRCA1 запуск репарации двухцепочечных разрывов ДНК с помощью аспирина в значительной степени тормозился. Напротив, подавление экспрессии гена 53BP1 или ингибирование киназы DNA-PKc (белок, участвующий в негомологичном соединении концов) не влияли скорость репарации.
Разуплотнение хроматина необходимо для запуска механизмов репарации ДНК в участках повреждения [9]. N-конец хвоста гистона H4 — ключевая зона для межнуклеосомного взаимодействия. Ацетилирование гистона H4 по лизину K16 (Ac-H4K16) крайне важно для того, чтобы уменьшить взаимодействие нуклеосом между собой (стэкинг) и фолдинг хроматина, благодаря чему в зону повреждения удается привлечь репарационные белки, тем самым запуская механизм гомологичной рекомбинации [10]. Среди клеток, подвергнутых воздействию аспирина, был выявлен повышенный уровень ацетилирования гистона H4K16 и усиление привлечения в места повреждения ДНК белка BRCA1 (но не 53BP1) (рис. 1h, I). Поскольку ацетилсалициловая кислота — донор ацетильных групп, в клетках, обработанных ингибитором гистон-ацетилтрансферазы, или после инкубации непосредственно с изолятами хроматина, повышалось ацетилирование гистона H4K16. Напротив, концентрация ацетилированного гистона H3K27 уже была высокой в равновесном состоянии и оставалась практически неизменной после добавления аспирина (рис. 1j). По всей видимости, участок H4K16 более доступен для прямого ацетилирования аспирином, учитывая его расположение на N-конце хвоста гистона H4, где он выполняет роль первой точки контакта, закрепляющей хвост H4 на соседней нуклеосоме.
Чтобы проверить, способен ли аспирин влиять на конденсацию хроматина, авторы воспользовались клеточной линией AO3 с вставками копий последовательности лактозного оперона Escherichia coli (E. coli) (LacO) в гетерохроматиновой области. При деконденсации хроматина эта область расширяется, что может быть визуализировано благодаря экспрессии лактозного репрессора LacR с флуоресцентной меткой mCherry. Аспирин усиливал ацетилирование гистона Н4 (Ac-H4K16) и активность оперона LacO (рис. 1h-j).
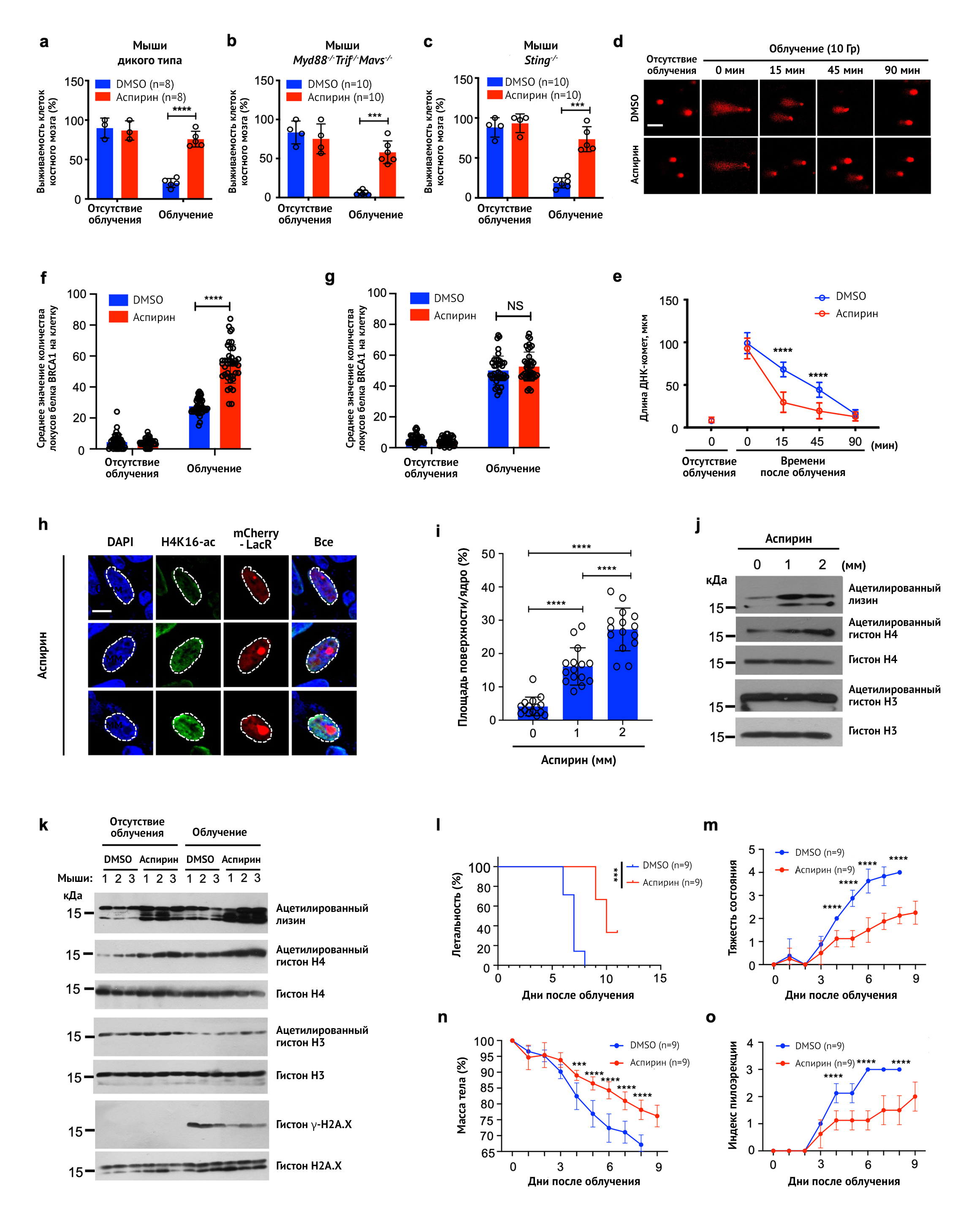
d, e: Аспирин способствует репарации ДНК. Полученные с помощью флуоресцентного конфокального микроскопа изображения (d) и измерение длины (e) ДНК-комет моноцитов костного мозга, предварительно обработанных аспирином или DMSO, подвергнутых облучению (9 Гр на льду), а затем — инкубированию при 37 °C для репарации ДНК. Масштабная линейка — 50 мкм.
f, g: Локусы белка BRCA1 (f) и белка 53BP1 (g), в соотношении на одно ядро спустя 1 ч после облучения (9 Гр) клеток HEK293, предварительно обработанных DMSO или аспирином. Данные представлены в виде средних значений ± СОср (стандартная ошибка среднего), n = 30. Однофакторный ANOVA тест, NS — статистически не значимо, P > 0,5, ****P < 0,0001.
h, i: Аспирин стимулирует разуплотнение хроматина. Изображения клеток линии AO3, обработанных аспирином, полученные с помощью флуоресцентного конфокального микроскопа (h) и отношение поверхности клетки к ядру (i). Данные представлены как среднее ± СОср. Двусторонний t-критерий Стьюдента, ****P < 0,0001. Масштабная линейка — 10 мкм.
j: Метки ацетилирования гистонов в хроматине, выделенном из обработанных аспирином клеток линии AO3.
k: Аспирин индуцирует ацетилирование H4K16 in vivo, а также наблюдается связь со снижением концентраций маркеров повреждения ДНК. Ацетилирование гистонов и γ-H2A.X в составе хроматина клеток костного мозга мышей, получавших (или же не получавших) аспирин с последующим облучением.
I-o: Аспирин защищает от лучевой болезни и повышает выживаемость. Летальность (I), тяжесть состояния (m), потеря массы тела (n) и индекс пилоэрекции (o) у мышей, получавших и не получавших аспирин, после γ-облучения (18 Гр). Различия в заболеваемости (l) анализировали с помощью логарифмического рангового критерия, ***P < 0,001. Графики m–o показаны как средние значения ±СОcр. Однофакторный ANOVA тест, ∗∗∗P < 0,001.
Далее авторы выделили хроматин из клеток костного мозга мышей. У животных, получавших аспирин, уровень ацетилирования H4K16 оказался повышен, а при воздействии облучения наблюдалось снижение уровня γ-H2A — маркера повреждения ДНК, что согласуется с обнаруженной способностью аспирина стимулировать репарацию ДНК in vivo. Выживаемость в группе мышей, получавших аспирин, была выше, а симптомы облучения были менее выраженными (рис. 1k–o).
Предполагается, что терапевтические эффекты аспирина обусловлены его способностью подавлять воспаление, что достигается за счет ингибирования ЦОГ-1 и ЦОГ-2 [7,8]. В данной работе показано, что, хотя аспирин и подавляет воспаление, блокируя несколько сигнальных путей PR-рецепторов, помимо противовоспалительного действия, аспирин стимулирует репарацию ДНК по механизму гомологичной рекомбинации. Полученные данные подтверждают модель, согласно которой, ацетилируя H4K16, аспирин увеличивает деконденсацию хроматина и, таким образом, усиливает привлечение факторов репарации для гомологичной рекомбинации в места повреждения.
Двухцепочечные разрывы ДНК крайне опасны для здоровья. Помимо прямого следствия в виде гибели клеток, в случае отсутствия или же неправильно протекающей репарации такие разрывы способны приводить к хромосомным делециям и транслокациям, что, в свою очередь, ведет к долгосрочным опасным последствиям, например, злокачественным опухолям и наследственным патологиям. Двухцепочечные разрывы ДНК также являются причиной воспаления [4], а оно, в свою очередь, — ключевой индуктор повреждения тканей, вызываемого лучевой/химиотерапией, например фиброза, который в значительной степени влияет на качество жизни пациентов. Возможно, помимо ускорения репарации двухцепочечных разрывов ДНК, аспирин также может косвенно способствовать защите генома, подавляя повреждение ДНК, вызванное воспалением. Таким образом, способность аспирина ингибировать воспалительные пути и влиять на репарацию двухцепочечных разрывов посредством гомологичной рекомбинации подчеркивает его потенциал в лечении воспалительных заболеваний и патологий, вызванных нестабильностью генома. Кроме того, открытие того, что аспирин является модулятором структуры и восстановления хроматина, предлагает новый механизм, который может объяснять некоторые из многочисленных преимуществ этого препарата, например, профилактику злокачественных новообразований.
