Ожирение матери и влияние связанного с ним воспаления в начале жизни потомства на его здоровье в долгосрочной перспективе
Частота ожирения в Соединенных Штатах высока и продолжает возрастать: около 25% женщин репродуктивного возраста имеют избыточный вес или страдают ожирением. Метавоспаление — состояние хронического слабовыраженного воспаления, вызванное изменением метаболизма, часто встречается при беременности, осложненной ожирением. В результате плоды у таких матерей подвергаются воздействию внутриутробной среды с измененным набором питательных веществ и цитокинов. Следует отметить, что и в исследованиях на людях, и в доклинических исследованиях показано, что у детей, рожденных матерями с ожирением, повышен риск развития хронических заболеваний, затрагивающих различные системы органов. В этом обзоре авторы описали роль цитокинов и воспаления во время здоровой беременности и определили, как ожирение меняет воспалительный ландшафт матери, приводя к перепрограммированию плода. Далее обсуждено негативное долгосрочное влияние на здоровье потомства в различных контекстах заболеваний, включая риск развития у потомства психоневрологических расстройств (аутизм, дефицит внимания и гиперактивное расстройство), метаболических заболеваний (ожирение, диабет второго типа), атопии и злокачественных новообразований, а также потенциальное изменение иммунного/воспалительного статуса потомства как фактора, способствующего этим заболеваниям. Наконец, авторы перечислили критические пробелы в знаниях в области программирования развития здорового организма и заболеваний у потомства матерей с ожирением, особенно — недостаточно изученной роли гемопоэтических стволовых клеток и клеток-предшественников.
Введение
Распространенность ожирения среди женщин детородного возраста неуклонно растет в течение последних трех десятилетий (Poston et al., 2016; Chen et al., 2018). В 2017–2018 годах в США распространенность ожирения среди женщин детородного возраста составляла до 40% (Hales et al., 2020). Материнское ожирение связано с плохими исходами как у матерей, так и у их потомства. Женщины с ожирением до беременности более склонны к бесплодию, самопроизвольному прерыванию беременности, врожденным аномалиям у детей, гестационному диабету, более высокому риску кесарева сечения, раневым осложнениям, повышенному риску венозной тромбоэмболии, депрессии и затруднениям при грудном вскармливании (Sebire et al., 2001; Rasmussen, 2007; Luke et al., 2011; Wloch et al., 2012; Cnattingius et al., 2013; Aune et al., 2014; Gyamf, 2014; Tuthill et al., 2022). Помимо проблем со здоровьем у матерей с ожирением, дети, рожденные от таких матерей, на протяжении всей жизни с большей вероятностью будут страдать от многочисленных хронических заболеваний, включая ожирение, сердечно-сосудистые осложнения и нервно-психические расстройства (Getz et al., 2016; Andersen et al., 2018; Voerman et al., 2019; Razaz et al., 2020). Фактически, как доклинические, так и клинические исследования подтверждают вывод о том, что воздействие субоптимальной внутриутробной среды предрасполагает потомство к развитию этих хронических заболеваний. Однако наши знания об основных механизмах такого программирования остаются ограниченными. «Метавоспаление» — это слабовыраженное воспалительное состояние, вторичное по отношению к нарушению профиля иммунных клеток, которое приводит к активации провоспалительных путей и все чаще считается ранним фактором, влияющим на здоровье потомства (Gregor and Hotamisligil, 2011; Pantham et al., 2015). Хотя по сравнению с небеременным состоянием для самой беременности характерен измененный воспалительный профиль, для имплантации, плацентации и здорового продолжения беременности необходим строго регулируемый баланс между про- и противовоспалительными цитокинами (Ashkar et al., 2000; Aluvihare et al., 2004; Fest et al., 2007; Care et al., 2013; Griffith et al., 2017). Ожирение матери связано с хроническим метаболическим воспалительным состоянием, которое смещает этот жесткий баланс в сторону провоспалительного состояния (Sisino et al., 2013; Thakali et al., 2014; Saben et al., 2014; Nakajima et al., 2016; Castellana et al., 2018). В настоящем обзоре авторы рассматривают общие модели, используемые для изучения иммунной системы при нормальной беременности и беременности, осложненной ожирением, и кратко обсуждают роль воспаления во время здоровой беременности и известные изменения, связанные с материнским ожирением. В последней части статьи представлен углубленный обзор неблагоприятного воздействия материнского ожирения на здоровье потомства в долгосрочной перспективе и предложена новая модель, в которой изменения иммунной функции у потомства потенциально способствует различным болезненным состояниям.
Модели беременности и материнского ожирения
Клинические исследования, предназначенные для получения лонгитюдных данных и биопроб на разных стадиях беременности от матерей с нормальным весом (индекс массы тела [ИМТ] 20–25) и матерей с ожирением (ИМТ > 30), несомненно, являются мощным исследовательским инструментом (Haas et al., 2015; Rees et al., 2022). Фактически, они дают всестороннее понимание картины на основе определения изменений в профилях циркулирующих цитокинов и иммунных клеток, связанных с ожирением матери (Maguire et al., 2021; Sureshchandra et al., 2021a; Ross et al., 2022). Пуповинная кровь и ткани плаценты, собранные при родах, также помогают понять иммунную адаптацию различных компартментов (материнская плазма, трансплацентарный барьер, фетальная плазма) во время беременности (Challier et al., 2008; Laskewitz et al., 2019; Enninga et al., 2021; Jaramillo-Ospina et al., 2021). Хотя такие исследования дают прямое представление о биологии беременности у людей, неизвестно, связаны ли результаты непосредственно с влиянием материнского ожирения или же других факторов, способствующих развитию ожирения, таких как нездоровое питание или генетические риски. Кроме того, невозможно оценить изменения профилей цитокинов и иммунных клеток в трансплацентарном барьере и внутриутробном кровообращении в разные периоды времени. Наконец, эпидемиологические исследования на людях демонстрируют взаимосвязь воздействия материнского ожирения и неблагоприятного состояния здоровья потомства, но эти исследования говорят о прямом вкладе материнского ожирения и о молекулярных механизмах, способствующих развитию заболеваний у потомства.
Чтобы преодолеть ограничения исследований на людях, часто используют животные модели. Материнское ожирение моделировали на мышах (Lee et al., 2020; Mu et al., 2022; Zhang et al., 2022; Thapa et al., 2022), крысах (Lin et al., 2019; Zhang et al., 2020; Deshpande et al., 2021) и нечеловеческих приматах (Rivera et al., 2015; Harris et al., 2016; Salati et al., 2019). Мышиные и крысиные модели чаще всего применяются для выявления эффектов и механизмов передачи болезней от поколения к поколению из-за короткой продолжительности их беременности. Мышиные модельные системы также позволяют исследователям анализировать влияние определенных факторов со стороны матери (например, переедание, ожирение, резистентность к инсулину) на развитие болезней у потомства и определять молекулярные пути в различных тканях и системах органов потомства. Основная стратегия, используемая для индукции ожирения перед беременностью в мышиных и крысиных моделях, — это рацион с высоким содержанием жиров (Lin et al., 2019; Moazzam et al., 2021; Zhou et al., 2021) или западная диета (с высоким содержанием жира и сахарозы) (Muller et al., 1985; Victorio et al., 2021; Chung et al., 2021; Chaix et al., 2021). Значительным ограничением этого подхода служит то, что у матерей, получавших рацион с высоким содержанием жиров, вес плодов и новорожденных детенышей часто бывает снижен (Christians et al., 2019). Тем не менее, использование западной диеты с 45% жировых калорий, по-видимому, приводит к появлению новорожденных детенышей с неизменной (Fornes et al., 2017) или повышенной (Rosario et al., 2015; Aye et al., 2015) массой тела при рождении. Такой подход может быть более репрезентативным для беременности, осложненной материнским ожирением, но все же не позволяет отличить вклад рациона от эффектов ожирения матери. Это ограничение можно обойти с помощью различных стратегий. Например, беременных животных можно держать на диете с высоким содержанием жиров в выбранный период времени (Cerf and Louw, 2014), а новорожденных детенышей можно передавать другим родителям, чтобы определить роль рациона с высоким содержанием жиров в разные периоды беременности и лактации. В качестве альтернативы Isganaitis et al для моделирования материнского ожирения и материнской резистентности к инсулину во время беременности без необходимости диетической индукции использовали мышей с гаплонедостаточным субстратом инсулинового рецептора 1 (IRS-1) (Isganaitis et al., 2014). Кроме того, исследователи учитывали ключевые различия в развитии иммунных клеток у мышиных моделей и людей. Например, обнаружено, что у новорожденных мышей печень и селезенка являются экстрамедуллярными участками кроветворения (Wolber et al., 2002). С другой стороны, развитие иммунной системы у нечеловеческих приматов очень похоже на таковое у человека (Makori et al., 2003). Таким образом, нечеловеческие приматы представляют собой подходящую модель для понимания иммунных адаптаций трансплацентарного барьера и кровообращения плода, а также того, как эта адаптация реагирует на материнское ожирение (Salati et al., 2019; Dunn et al., 2022).
Воспаление при беременности
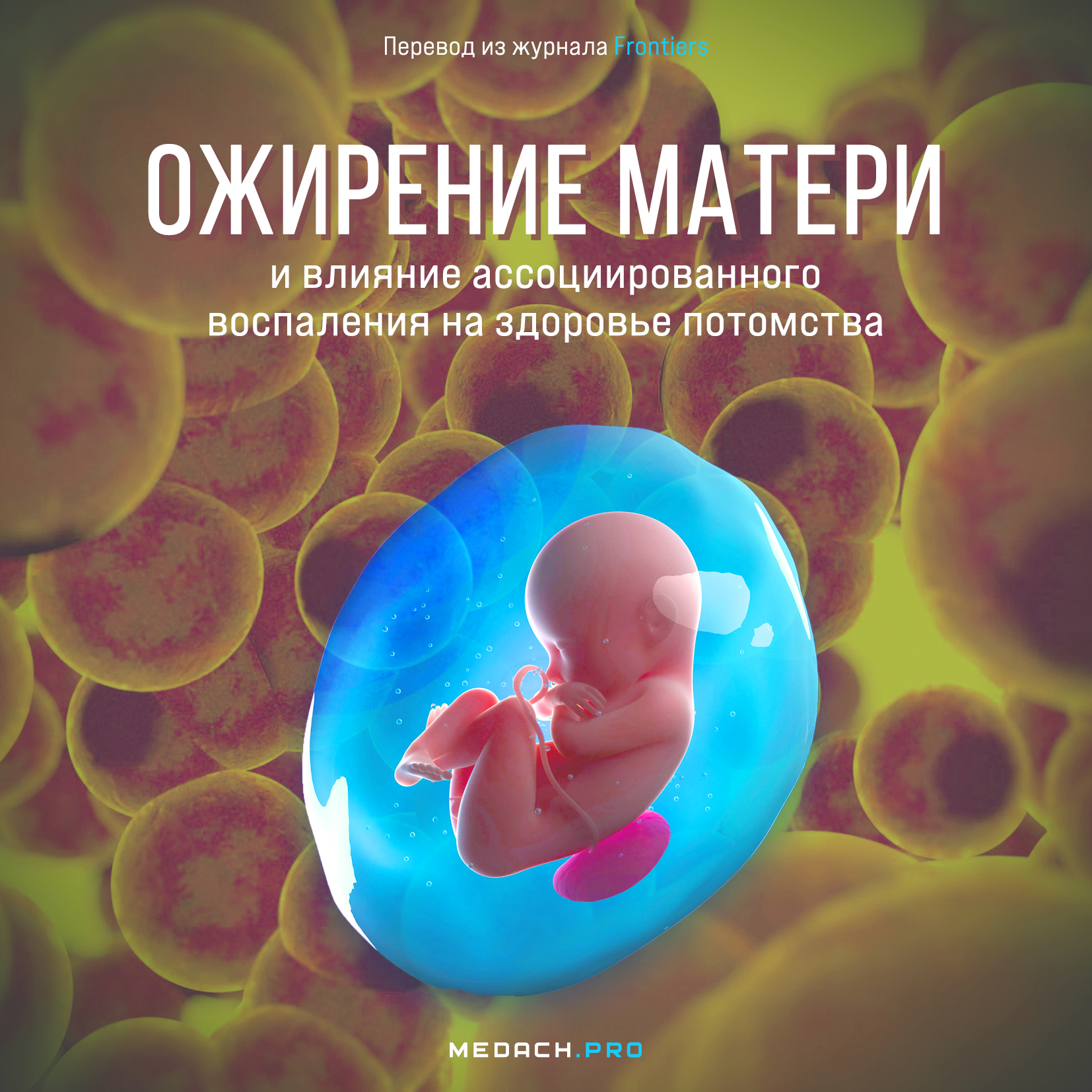
Для имплантации, плацентации и продолжения беременности требуется строгая регуляция воспалительных факторов (Gude et al., 2004; Mor et al., 2017). Физиологическая адаптация материнского организма к беременности определяется контролируемой выработкой цитокинов и других воспалительных факторов различными подтипами клеток трансплацентарного барьера (рисунок 1) (Abrahams et al., 2004; Mjosberg et al., 2010; Svensson et al., 2011; Amsalem et al., 2014). Изменения типов иммунных клеток в плаценте, включая лимфоциты, натуральные киллеры (NK), нейтрофилы, дендритные клетки и лимфоидные клетки врожденного иммунитета на разных стадиях беременности, подробно описаны в статье St-Germain et al (2020). В целом иммунная регуляция при беременности обеспечивается адаптивными Т-хелперами (Huang et al., 2020) и врожденными иммунными реакциями (Aghaeepour et al., 2017), однако большинство этих исследований основано на профилях циркулирующих цитокинов и иммунных клеток. Т-хелперные Т-лимфоциты первого типа (Th1) и Т-хелперные лимфоциты второго типа (Th2) представляют собой две основные подгруппы CD4+ Т-хелперных (Th) клеток, которые регулируют адаптивный иммунный ответ (Zhu, 2018). Th1-клетки вырабатывают высокие уровни интерферона (IFN)-γ, интерлейкина (IL)-2 и фактора некроза опухолей (TNF)-β, отвечают за фагоцитозависимое воспаление, а также за защиту от внутриклеточных патогенов (Zhu, 2018). Они также играют важную роль в развитии органоспецифических аутоиммунных и хронических воспалительных заболеваний (Zhu, 2018). Th2-клетки продуцируют IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13, что приводит к сильному антительному ответу путем регуляции рекомбинации для переключения класса B-клеток и активации эозинофилов; при этом фагоцитарная функция ингибируется (Romagnani, 2000). Mor et al описали три различные иммунологические стадии, основанные на воспалительной реакции организма во время беременности (Mor et al., 2017). Первому триместру соответствует начальная провоспалительная стадия, которая жизненно важна для имплантации и плацентации. С началом второго триместра наступает противовоспалительная и иммунная стадия с участием клеток Th2-типа, необходимая для роста плода. Наконец, считается, что в третьем триместре вторая провоспалительная стадия и иммунный статус Th1-типа инициируют роды (Mor et al., 2017). В дополнение к значимой роли Th1- и Th2-лимфоцитов в ходе беременности, в ее здоровое течение вносят вклад другие Т-хелперные клетки трансплацентарного барьера, такие как T-хелперы 17 (Th17), T-хелперы 22 (Th22), фолликулярные T-хелперы (Tfh) и регуляторные T-клетки (Treg). Th17 и Th22 участвуют в индукции иммунитета против внеклеточных патогенов в трансплацентарном барьере (Bettelli et al., 2006; Barnes et al., 2021). Неконтролируемые реакции Th1 и Th17 связаны с неудавшейся имплантацией и невынашиванием беременности (Kwak-Kim et al., 2003; Wang et al., 2010; Lee et al., 2012). Клетки Treg усиливают иммунную толерантность к плоду путем подавления чрезмерного иммунитета Th1 и Th17 и аутоиммунной реакции (Aluvihare et al., 2004). Число клеток Tfh повышено в третьем триместре; известно, что они обеспечивают гуморальный иммунитет, праймируя В-клетки для инициации ответов антител внефолликулярной области и герминативного центра (Monteiro et al., 2017). Tfh также обеспечивают баланс Th1/Th2, благоприятствуя Th2. Профиль T-хелперов при беременности подробно обсуждается в работе Wang et al (2020).
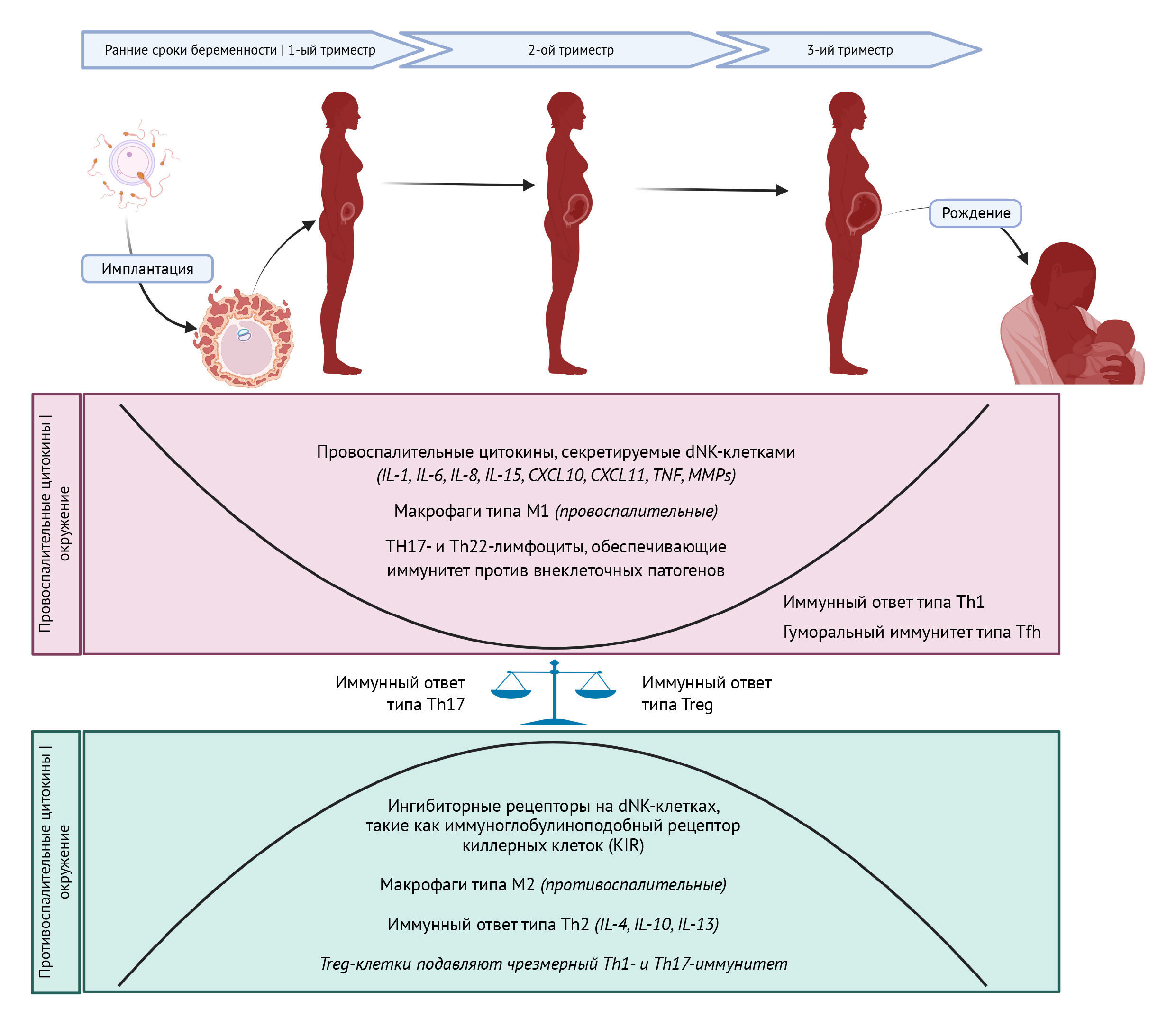
Другие компоненты врожденной иммунной системы, такие как NK-клетки, тучные клетки, макрофаги, дендритные клетки и нейтрофилы, играют ключевую роль в тонкой настройке иммунологических стадий беременности. Децидуальные лейкоциты человека в первом триместре представлены в основном NK-клетками (70%) и макрофагами (20%) (Moffett-King, 2002; Huhn et al., 2021). Децидуальные NK-клетки (dNK) экспрессируют более высокие уровни хемокинов, цитокинов и ангиогенных факторов по сравнению с NK-клетками периферической крови (pNK). На ранних стадиях беременности dNK-клетки играют ключевую роль в имплантации, секретируя провоспалительные факторы, включающие IL-8, IL-15, IL-6, CXCL10 и CXCL11 (Zhang and Wei, 2021). dNK-клетки также участвуют в ремоделировании сосудистой сети эндометрия, продуцируя ангиогенные факторы, такие как фактор роста эндотелия сосудов С (VEGFC), плацентарный фактор роста (PIGF), ангиопоэтин 2 (ANG2), IL-8, ангиогенин, стромальный фактор-1. (SDF-1/CXCL12), IFN-γ, матриксные металлопротеиназы (MMP) 9 и MMP2 (Moffett-King, 2002; Radomska-Lesniewska et al., 2021). С другой стороны, ингибиторные рецепторы, в высокой степени экспрессируемые на dNK-клетках, такие как иммуноглобулиноподобный рецептор киллерных клеток KIR, распознают лиганды HLA для ингибирования цитотоксичности NK-клеток и поддержания иммунной толерантности трансплацентарного барьера во время противовоспалительной стадии беременности (Ferreira et al., 2017). На поздних сроках беременности реактивация dNK-клеток и секреция провоспалительных цитокинов из активированных dNK-клеток вызывают роды путем нарушения иммунной толерантности (Zhang and Wei, 2021). Установлено, что нарушение регуляции dNK-клеток связано с неблагоприятными исходами беременности, включая повторяющиеся спонтанные выкидыши, преэклампсию, а также другие репродуктивные проблемы, такие как эндометриоз и рецидивирующие неудачные имплантации (Fu et al., 2021; Fukui et al., 2021). Макрофаги также играют важную роль в поддержании здоровой беременности. Например, преобладание макрофагов типа М2 (противовоспалительные, или альтернативно активируемые), в отличие от макрофагов типа М1 (провоспалительные, или классически активируемые), в трансплацентарном барьере необходимо для поддержания толерантности матери к плоду (Yao et al., 2019). В недавнем исследовании оценивали основные подгруппы иммунных клеток и их функции с помощью масс-цитометрии; было показано, что регуляция иммунной системы при здоровой доношенной беременности имеет точные временные рамки, и предложена новая роль активации STAT5ab с участием интерлейкина 2 как модуляторного пути для этого ответа (Aghaeepour et al., 2017).
Материнское ожирение и воспаление
Несмотря на некоторые противоречивые результаты, большинство исследований показали, что матери с ожирением до беременности имеют повышенные уровни провоспалительных маркеров/цитокинов, таких как IL-8, IL-6, CRP, TNF-α и IFN-γ (Madan et al., 2009; Zhu et al., 2010; Englich et al., 2017; Kretschmer et al., 2020; Maguire et al., 2021), и измененный уровень адипокинов (Hinkle et al., 2019; Jara et al., 2020; Jaramillo-Ospina et al., 2021). Тем не менее, важно знать, что изменения содержания цитокинов неоднозначны, как обсуждается в работе Pendeloski et al (2017). Противоречивость результатов может быть связана со множеством факторов, включая биологические различия в популяциях людей, типы образцов (сыворотка или плазма) или голодное состояние матерей (de Jager et al., 2009; Lee et al., 2016; Martinez-Garcia et al., 2019). Тем не менее, остается опасение, что измененное воспалительное состояние может косвенно негативно повлиять на растущий плод, изменяя различные функции плаценты (например, инвазию трофобласта и транспорт питательных веществ) (Kwak-Kim et al., 2014; Goldstein et al., 2020). Aye et al обнаружили, что повышенный ИМТ матери связан с активацией сигнальных путей p38-MAPK и STAT в плаценте без изменений в классических воспалительных путях или системном воспалительном профиле плода (Aye et al., 2014). Это открытие снова демонстрирует различия в иммунной адаптации в ответ на действие стрессоров и позволяет предположить, что воспаление, связанное с ожирением матери, регулируется измененной функцией плаценты. И наоборот, есть данные о том, что повышенный уровень цитокинов матери во время вторичной по отношению к инфекции иммунной активации повышает уровень цитокинов в эмбриональном компартменте у недоношенных детей как человека (Shobokshi and Shaarawy, 2002), так и макаки-резуса (Short et al., 2010); это подчеркивает различия в иммунном ответе/адаптации к специфическим стрессорам в разных компартментах системы «мать — плод». Тем не менее, эти данные свидетельствуют о том, что иммунная активация / провоспалительное состояние у матери может привести к повышению уровня цитокинов у растущего плода либо за счет индукции секреции цитокинов из плаценты, либо путем прямого транспорта через нее.
Неблагоприятное влияние материнского ожирения на здоровье потомства
В мета-анализе, проведенном Lutsiv et al, было показано, что материнское ожирение связано с неблагоприятными исходами для матери и ребенка, включая преэклампсию, гестационный диабет, кесарево сечение, кровотечение, низкий рН пупочной артерии, низкие баллы по шкале Апгар (внешний вид, пульс, гримаса, активность, дыхание), врожденные пороки развития и госпитализацию в отделение интенсивной терапии новорожденных (Lutsiv et al., 2015). Помимо перинатальных неблагоприятных исходов, материнское ожирение также связано с долгосрочными заболеваниями у детей. В основополагающей статье 1990 года доктор Дэвид Баркер предложил модель «источников развития болезней взрослых». Там он выдвинул гипотезу о том, что воздействие субоптимальной среды в раннем периоде жизни младенца формирует его будущее здоровье (Barker, 1990). Первоначально он показал, что люди с низкой массой тела при рождении во взрослом возрасте подвержены более высокому риску развития метаболических и сердечно-сосудистых заболеваний, вторичных по отношению к ограничению внутриутробного роста вследствие недостаточного потребления питательных веществ. Напротив, состояния, связанные с внутриутробным «перееданием» и повышенным воспалением, такие как гестационный диабет и ожирение матери, также негативно влияют на здоровье потомства в долгосрочной перспективе. Данные, полученные на людях, говорят о том, что активация провоспалительного состояния во время беременности связана с долгосрочными заболеваниями потомства, включая детское ожирение (Englich et al., 2017), нервно-психические расстройства (Allswede et al., 2016; Ghassabian et al., 2018; Volk et al., 2020; Goldstein et al., 2021), а также синдром легочной обструкции и аллергические заболевания у детей (Kim et al., 2008; Rothers et al., 2018). Осложнения, наблюдаемые при этих заболеваниях, делают детей уязвимыми для дальнейших осложнений, таких как подавление иммунного ответа. Например, детское ожирение связано с плохой реакцией на иммунизацию (Simo Minana et al., 1996). Хотя основной механизм, способствующий этим заболеваниям у детей, определить сложно, доклинические модели выявили роль усиления воспаления во время беременности, сопровождающейся ожирением матери. В исследовании, проведенном на крысах, потомство самок с ожирением, вызванным диетой (ОВД), имело ускоренный постнатальный рост и более высокий общий уровень ожирения (Howie et al., 2009). Интересно, что добавление в пищу конъюгированной линолевой кислоты (КЛК) — противовоспалительного липида — во время беременности привело к устранению метаболической дисфункции у потомства самок с ОВД. Кроме того, употребление КВК матерью с ОВД предотвращало увеличение экспрессии TNF-α, IL-1β и NLRP3 в кишечнике потомства мужского пола; это позволяет предположить, что неблагоприятные эффекты воздействия материнского ожирения могут возникать из-за изменений в воспалительном профиле матери (Reynolds et al., 2015). Необходимо дальнейшее изучение специфических механизмов, ответственных за увеличение провоспалительных цитокинов у того или иного пола потомства матерей с ожирением.
Нервно-психические расстройства
Появляется все больше данных о том, что дети, рожденные от матерей с ожирением, более склонны к нарушениям развития нервной системы и нервно-психическим расстройствам. Например, когортный анализ для более чем 240 000 случаев родов показал, что у потомства матерей с ожирением чаще наблюдались расстройства аутистического спектра (РАС) и госпитализации, связанные с психоневрологическими заболеваниями. Дополнительные исследования показали, что дети, рожденные от матерей с ожирением, имеют более низкие коэффициенты интеллекта (IQ) (Neggers et al., 2003; Tanda et al., 2013; Pugh et al., 2015; Coo et al., 2019), более высокую частоту РАС (Bilder et al., 2013; Gardner et al., 2015; Getz et al., 2016; Windham et al., 2019), синдрома дефицита внимания и гиперактивности (СДВГ) (Buss et al., 2012; Andersen et al., 2018; Jenabi et al., 2019; Parker et al., 2022), детского церебрального паралича (Crisham Janik et al., 2013; Villamor et al., 2017; Xiao et al., 2018; Zhang et al., 2019) и аффективных расстройств (Robinson et al., 2013; Mina et al., 2017). Животные модели материнского ОВД позволили лучше понять механизмы, с помощью которых воздействие материнского ожирения приводит к развитию нейро-психических расстройств у потомства. На моделях грызунов у потомства матерей с ожирением были отмечены значительные изменения в структуре мозга. Эти изменения включают снижение пролиферации нейральных предшественников в гиппокампе (Tozuka et al., 2009), снижение уровня апоптоза в гиппокампе и дифференцировки нейронов в зубчатой извилине (Niculescu and Lupu, 2009), нарушение миграции и созревания нейральных стволовых клеток в области желудочков и коры (Stachowiak et al., 2013), атрофию дендритов в гиппокампе и миндалине (Janthakhin et al., 2017) и снижение миелинизации в коре головного мозга потомства (только у самцов) (Graf et al., 2016). Также было показано, что потомство самок с ОВД имеет нарушения обучения и когнитивных функций (White et al., 2009; Page et al., 2014; Ding et al., 2018; Mucellini et al., 2019), а также аномалии поведения, включая гиперактивность (Dias et al., 2020), тревожность (Wright et al., 2011; Winther et al., 2018), пониженную социальность (Kang et al., 2014; Buffington et al., 2016), расстройства пищевого поведения (Bayol et al., 2007; Vucetic et al., 2010) и поведение, сходное с аддиктивным (Vucetic et al., 2010; Sarker et al., 2019); некоторые из них были специфичны для одного из полов. Такие поведенческие фенотипы, обнаруженные у грызунов, могут соответствовать нейро-психическим расстройствам, таким как СДВГ, тревожное расстройство, РАС и шизофрения. Усиление перекисного окисления липидов, активация микроглии и повышенная экспрессия провоспалительных цитокинов у потомства матерей с ожирением позволяют предположить, что важную роль в неблагоприятных исходах для нейронов играют нейровоспаление и окислительный стресс. Клетки микроглии — резидентные макрофаги, происходящие из примитивных миелоидных клеток-предшественников во внезародышевом желточном мешке и заселяющих зачаток мозга в период раннего развития плода, — в силу их большой продолжительности жизни и способности к самообновлению являются хорошими кандидатами на роль клеток, ответственных за долгосрочные изменения в мозге (Alliot et al., 1999; Yoo and Kwon, 2021). Edlow et al обнаружили, что у потомства мышей с ожирением по сравнению с контролем была увеличена выработка TNF-α в ответ на липополисахарид (ЛПС) в клетках плаценты CD11b+, а также в микроглии мозга (Edlow et al., 2019). Гиперпродукция провоспалительных цитокинов была лучше выражена у потомков мужского пола, что может быть связано с преобладанием у мужчин определенных нейро-психических расстройств, связанных с ожирением матери (Hanamsagar and Bilbo, 2016; Santos et al., 2022; Breach and Lenz, 2022). Сходным образом, в другом исследовании продемонстрировали, что у потомства матерей с ОВД наблюдается гиперактивация клеток микроглии и усиленная экспрессия мРНК toll-подобного рецептора (TLR) 4 и повышение уровня IL-1β в ответ на действие ЛПС (Graf et al., 2016). Провоспалительное окружение, формирующееся за счет повышенной экспрессии провоспалительных белков pJNK и TNF-α, влияет на метаболизм мозгового нейротрофического фактора (BDNF) и экспрессию триптофангидроксилазы 2 (TPH2). BDNF является важной молекулой для нейрогенеза гиппокампа, а TPH2 служит ключевым ферментом для синтеза серотонина. Известно, что изменения метаболизма BDNF и экспрессии TPH2 связаны с усилением сходного с тревожным поведения во взрослом возрасте (Peleg-Raibstein et al., 2012; Dias et al., 2020). В дополнение к данным по грызунам было обнаружено, что у приматов рацион с высоким содержанием жиров и последующее ожирение у матери связаны с повышенным количеством микроглии в базолатеральной миндалине у ювенильных потомков (Dunn et al., 2022).
Хотя работы по выяснению молекулярных механизмов при нарушениях развития нервной системы у того или иного пола активно развиваются, знания о том, почему частота таких нарушений выше у потомков мужского пола, остаются ограниченными. Одна из теорий состоит в том, что специфическая для пола активация иммунных путей в плаценте может способствовать влиянию пренатального стресса на программирование путей развития потомства. На мышиной модели раннего пренатального стресса Bronson и Bale показали, что связанные с иммунитетом гены, включая провоспалительные цитокины (IL-1β, IL-6) и хемокины (CCL5, хемокиновый лиганд 10), активируются ранним пренатальным стрессом (РПС) — особенно у самцов, — что говорит о провоспалительном состоянии плаценты плодов мужского пола. Эффект РПС частично смягчался при приеме нестероидных противовоспалительных препаратов (НПВП). Анализ взрослых потомков мужского пола выявил гиперактивный фенотип, который у самцов купировался, если мать употребляла НПВП. У самцов, подвергшихся РПС, также было обнаружено нарушение дофаминергической регуляции, что может быть ведущим фактором развития у них гиперактивного фенотипа (Bronson and Bale, 2014). Уязвимость плаценты эмбриона мужского пола к материнскому стрессу и воспалению и, как следствие, предрасположенность к нарушениям развития нервной системы могут быть связаны с определенными генами в половых хромосомах. Уровни N-ацетилглюкозаминтрансферазы (OGT), кодируемой Х-сцепленным геном, выше в плаценте женских эмбрионов, чем в плаценте мужских эмбрионов, поскольку соответствующий ген избегает инактивации Х-хромосомы. Известно, что OGT усиливает метилирование гистонов, создавая общую репрессивную метку — H3K27me3 (гистон H3, триметилированный по гистону 27). В дальнейшем уровни OGT в плаценте у обоих полов снижаются в ответ на РПС, что приводит к значительно более низкому ее содержанию в плаценте мужских эмбрионов. Значительно сниженные уровни OGT и ее контроль над H3K27me3 в плаценте мужских эмбрионов предрасполагает хроматин у потомков мужского пола к реактивному состоянию и делает его более устойчивым к стрессу у матери (Bale, 2016).
Атопия и развитие легких
Несколько исследований и мета-анализов показывают, что дети матерей с ожирением подвержены более высокому риску развития атопических заболеваний, включая атопический дерматит и астму (Harpsoe et al., 2013; Forno et al., 2014; Dumas et al., 2016; Polinski et al., 2017; Huang et al., 2018; Drucker et al., 2019; Liu et al., 2020; Wei et al., 2022). Такое повышение риска указывает на то, что у потомства, рожденного от матерей с ожирением, изменяется функция иммунных контрольных точек, регулирующих развитие атопии/аллергии. Повышенные уровни провоспалительных цитокинов CRP и TNF-α у матерей с ожирением связаны с легочной обструкцией и инфекциями нижних дыхательных путей у потомства (Morales et al., 2011; Halonen et al., 2013). В недавнем исследовании была показана связь повышенного содержания лептина в пуповине с более высоким риском астмы в возрасте трех лет у детей, рожденных от матерей с ожирением (Castro-Rodriguez et al., 2020).
Это подтверждается исследованиями на животных, в которых изучалась взаимосвязь между материнским рационом с высоким содержанием жиров и атопией у потомства. MacDonald et al показали, что потомство самок с ОВД имело повышенную гиперреактивность дыхательных путей при провокационной пробе с метахолтном и применении техники конечного вдоха по сравнению с потомством матерей, получавших диету с нормальным содержанием жира (MacDonald et al., 2017). В том же исследовании наблюдалось повышенное количество клеток в жидкости бронхиального альвеолярного лаважа с увеличенным процентным содержанием нейтрофилов и повышенной концентрацией IL-6. Это позволяет предположить, что активированное провоспалительное состояние может играть роль в развитии реактивных заболеваний дыхательных путей у детей, рожденных от матерей с ожирением. В другом исследовании было обнаружено повышение реактивности метахолина, а также повышенные уровни провоспалительных цитокинов (IL-1β, IL-5 и CXCL1), MMP-3 и MMP-8 в легочном лаваже — все это только у потомства женского пола (Pascoe et al., 2022). Обострение аллергической реакции у потомства мышей с ожирением также наблюдалось в ответ на введение аллергена (овальбумина) (RR et al., 2019). В этом исследовании усиленная реакция на овальбумин потенциально вызывалась более высоким уровнем miR-155 в мононуклеарных клетках периферической крови, который может стимулировать ответ Th2, и более низким уровнем miR-133b в трахее и легочной ткани, который может индуцировать более высокие уровни TGF-β1 в легочном лаваже (RR et al., 2019). У потомства, рожденного от матерей, получавших диету с высоким содержанием жиров, также наблюдалась повышенная репликация респираторно-синцитиального вируса в тканях легких при соответствующей инфекции (RSV) (Griffiths et al., 2016). Помимо более высокой частоты реактивных заболеваний дыхательных путей, ожирение матери влияет на развитие и функцию легких плода (Mayor et al., 2015; Baack et al., 2016; Smoothy et al., 2019; Heyob et al., 2019). Хотя данные показывают, что материнское ожирение является фактором риска развития ряда легочных осложнений, молекулярные механизмы, лежащие в основе этой связи, требуют дальнейшего изучения.
Кардиометаболические заболевания
Воздействие на плод метаболических нарушений, вызванных ожирением матери, предрасполагает детей к кардиометаболическим заболеваниям, изменяя развитие ключевых органов, ответственных за кардиометаболическое здоровье. В результате обширных популяционных исследований установлено, что даже в молодом возрасте (1–25 лет) потомство, рожденное от матерей с ожирением, подвержено более высокому риску развития сердечно-сосудистых заболеваний (за исключением врожденных пороков сердца) (Razaz et al., 2020). Недавний мета-анализ также продемонстрировал положительную связь между ИМТ матери до беременности и артериальным давлением у потомства вне зависимости от ИМТ последнего (Eriksson et al., 2014; Eitmann et al., 2022). Помимо сердечно-сосудистых заболеваний, дети, рожденные от матерей с ожирением, также подвержены более высокому риску развития повышенного ИМТ, резистентности к инсулину и, в конечном итоге, диабета второго типа. Мета-анализ данных отдельных участников среди 162 129 матерей и их детей от 37 беременностей и возрастных когорт из Европы, Северной Америки и Австралии показал, что более высокий ИМТ матери до беременности и увеличение массы тела во время беременности были связаны с повышенным риском избыточной массы тела / ожирения у потомства на протяжении всего периода детства; при этом сильнее всего эффект проявлялся в более позднем возрасте (Voerman et al., 2019). Связь чрезмерного увеличения веса матери с ИМТ потомства может быть обусловлена как семейным (генетическим) риском, так и рисками в результате внутриутробных воздействий. Действительно, популяционное исследование с использованием проспективно набранной когорты показало, что увеличение веса матери во время беременности было сильнее связано с ИМТ сиблингов, рожденных от матерей с нормальным ИМТ, что предполагает вклад генетических рисков. Напротив, у женщин с ожирением, развившимся до беременности, большая прибавка в весе матери была сильнее связана с ИМТ неродственных детей, что свидетельствует о большей роли внутриутробных механизмов у потомства, рожденного от матерей с ожирением (Godfrey et al., 2017). Данные литературы позволяют предполагать, что дети, на которых воздействовало материнское ожирение, подвержены повышенному риску развития метаболического синдрома, даже если состояние матери не соответствует критериям гестационного сахарного диабета (ГСД) (Boney et al., 2005). Хотя связь набора матерью избыточного веса с дальнейшим ИМТ потомства в значительной степени обусловлена общими семейными факторами риска ИМТ, исследование сиблингов в проспективной когорте показало, что у женщин, страдающих ожирением на ранних сроках беременности, повышенный прирост массы тела в дополнение к общим семейным характеристикам может быть связан с ИМТ потомства в дальнейшем через внутриутробные механизмы (Lawlor et al., 2011). Исследования на животных с моделями материнского ОВД подтверждают данные, полученные для человека и, как правило, проясняют механизмы, участвующие во взаимосвязи ожирения у матерей и кардиометаболических заболеваний у потомства. В мышиной модели материнского ожирения, вызванного диетой, Samuelsson et al показали, что потомство имело повышенное содержание жировой ткани, нарушение обмена липидов и глюкозы и более высокое кровяное давление через несколько месяцев после рождения (Samuelsson et al., 2008). В нескольких исследованиях показано, что материнское ожирение оказывает полоспецифическое влияние на метаболизм глюкозы и кардиометаболические профили потомства в пользу мужского пола (Sun et al., 2012; Lecoutre et al., 2016; Kulhanek et al., 2020; Casasnovas et al., 2021). Одна гипотеза, объясняющая половые различия в этом случае, состоит в том, что функция β-клеток поджелудочной железы может быть частично связана с повышенным окислительным стрессом в островках самцов (Yokomizo et al., 2014). У самцов в потомстве матерей, получавших диету с высоким содержанием жиров, выявлялось повышение уровня мРНК NOX4 и NAD(P)H-оксидазы gp91phox — ключевых регуляторов продукции супероксида в изолированных островках поджелудочной железы, хотя значительных изменений в уровне мРНК у потомства женского пола не было. У последнего защитную роль против окислительного стресса, возникшего в результате материнского ожирения, может играть эстроген (Hernandez et al., 2000). В совокупности исследования как на людях, так и на животных показывают, что ожирение у матери является фактором риска неблагоприятных кардиометаболических исходов у потомства, а преобладание нарушений метаболизма инсулина у особей мужского пола может быть вторичным по отношению к повышенному окислительному стрессу в β-клетках поджелудочной железы на фоне дефицита эстрогена.
Другой потенциальный механизм, который исследуется в контексте связи между материнским ожирением и нарушением регуляции метаболического состояния потомства, — это изменения в адипокиновых сигнальных путях, которые являются следствием увеличения количества жировой ткани. Адипокины представляют собой цитокины, секретируемые жировой тканью, которые регулируют слабовыраженное воспаление, связанное с ожирением. К хорошо известным адипокинам относятся лептин, адипонектин, резистин и грелин. Лептин является продуктом гена ожирения (ob) (Zhang et al., 1994). Его секретируют в кровь адипоциты; лептин регулирует аппетит, метаболизм и энергетический гомеостаз посредством своего специфического рецептора (лептиновый рецептор, LEPR), который расположен в вентромедиальном, дорсомедиальном, латеральном и дугообразном ядрах гипоталамуса. Ключевым регулятором метаболизма лептина служит инсулин. Гиперинсулинемия приводит к увеличению концентрации лептина (Saad et al., 1998). Более того, ожирение связано с состоянием гиперлептинемии и ослабленной реакцией на лептин, что препятствует функции лептина — это приводит к нарушению регуляции энергетического гомеостаза. Концентрация лептина в пуповинной крови детей, рожденных от матерей с ожирением, была повышена по сравнению с таковой у худых матерей (Guzman-Barcenas et al., 2016). Также такие младенцы были более резистентны к инсулину, и такая резистентность положительно коррелировала с количеством неонатальной жировой ткани (Catalano et al., 2009; Guzman-Barcenas et al., 2016; Costa et al., 2016). Исследования на животных подтверждают данные, полученные на человеке (Rajia et al., 2010). У мышей материнское ожирение, вызванное диетой с высоким содержанием жиров, было связано с гиперлептинемией, гиперинсулинемией и гиперфагией у потомства и усугублялось диетой с высоким содержанием жиров после прекращения грудного вскармливания (Rajia et al., 2010). Несмотря на четкие свидетельства повышенного уровня лептина у младенцев, рожденных матерями с ожирением, основные механизмы связи между повышенным уровнем лептина и большим размером для гестационного возраста (LGA) или детским ожирением, а также наличие признаков воспаления жировой ткани у этих младенцев нуждается в дальнейшем изучении. Помимо своей ключевой регулирующей функции в энергетическом гомеостазе, лептин оказался плацентарным гормоном, влияющим на функцию плаценты, имплантацию эмбриона и рост плода (Masuzaki et al., 1997; Ben et al., 2001; Magarinos et al., 2007; Perez-Perez et al., 2008; Childs et al., 2021). В различных исследованиях на людях продемонстрировали изменение метаболизма лептина в плаценте матерей с ожирением (Misra et al., 2013; Tuersunjiang et al., 2017). Высокоуглеводная диета матери связана со снижением метилирования лептина в плаценте (Daniels et al., 2020). Воздействие измененного уровня/функции плацентарного лептина на потомство матерей с ожирением представляет собой сложный процесс, непостоянный во времени на протяжении беременности (Hinkle et al., 2019). Усиленная доставка питательных веществ плацентой вследствие повышенного уровня лептина способствует чрезмерному росту плода у матерей с ожирением (Jansson et al., 2003).
Изменения микробиома кишечника
Новые исследования показывают, что у людей с ожирением и у худых микробиота кишечника различается, и что она участвует в развитии ожирения и связанных с ним метаболических рисках. Учитывая, что первым микробным воздействием на потомство является микробиота матери во время беременности, можно предположить, что статус питания матери влияет на микробиом кишечника и последующее метаболическое и иммунологическое программирование. В когортном исследовании с участием 170 беременных женщин дети, рожденные от матерей с избыточным весом или ожирением, имели более низкое содержание бактерий, продуцирующих короткоцепочечные жирные кислоты, и более низкие уровни масляной кислоты в кале в возрасте одного месяца, что может служить прогностическим фактором риска увеличенного количества жировой ткани в дальнейшем (Gilley et al., 2022). У безмикробных мышей, которые были колонизированы микробами из стула двухнедельных младенцев, рожденных от матерей с ожирением, была повышена проницаемость кишечника, нарушена активность макрофагов и усиленное перипортальное воспаление по сравнению с мышами, колонизированными микробами из стула младенцев матерей с нормальным весом. Кроме того, у таких мышей наблюдался ускоренный набор веса и развитие ожирения печени после воздействия западной диеты (Soderborg et al., 2018). Myles et al показали, что у потомства мышей, получавших западную диету, была повышена восприимчивость к инфекции и ее осложнениям, а также увеличивалась частота экспериментального аутоиммунного энцефалита и анафилаксии. Было обнаружено, что измененные иммунные реакции и чувствительность к болезням у потомства, получавшего западную диету, были связаны с измененной микробиотой кишечника, и совместное содержание потомства мышей, получавших западную диету, и мышей, получавших диету с низким содержанием жиров, для уравновешивания их микробиомов устраняло их восприимчивость к инфекции (Myles et al., 2013). Повышенный риск некротизирующего энтероколита после воздействия материнского ожирения поддерживает повышенную восприимчивость к инфекциям, вторичным по отношению к измененной микробиоте кишечника (Babu et al., 2018). Измененный микробиом кишечника у детенышей мышей, получавших диету с высоким содержанием жиров, был связан с повышенной чувствительностью к колиту, индуцированному декстрансульфатом натрия, во взрослом возрасте и усилением экспрессии провоспалительных цитокинов (Xie et al., 2018). Измененная ранняя микробиота также связана с увеличением количества жировой ткани и повышенным риском ожирения в дальнейшем (Dogra et al., 2015). У детенышей мышей-реципиентов микробиоты особей, получавших диету с высоким содержанием жиров, наблюдались когнитивные и социально-поведенческие расстройства (Liu et al., 2021). Как и в других исследованиях с совместным содержанием, совместное проживание этих детенышей с детенышами реципиентов кишечной микробиоты мышей, которые получали диету с высоким содержанием жиров и клетчатки, показало улучшение когнитивных функций, повышение общительности и большее предпочтение социальной новизне (Liu et al., 2021). Другое исследование, проведенное на юкатанских свиньях, показало, что западная диета матери во время беременности и лактации даже при отсутствии ожирения приводила к повышению уровня триглицеридов и свободных жирных кислот в крови, а также к снижению активности кишечной микробиоты у потомства (Val-Laillet et al., 2017). Однако, в отличие от грызунов, поросята, рожденные от матерей, которых держали на западной диете, обладали лучшими когнитивными способностями с более высокой кратко- и долговременной памятью, несмотря на меньший слой гранулярных клеток гиппокампа и сниженный нейрогенез (Val-Laillet et al., 2017). Хотя данные говорят о том, что воздействие материнского ожирения приводит к изменениям в микробиоме кишечника, для определения долгосрочных последствий измененной микробиоты кишечника для здоровья потомства и выяснения основных молекулярных механизмов необходимы дальнейшие исследования.
Злокачественные новообразования
О влиянии ожирения матери на канцерогенез потомства известно мало. В проспективном когортном исследовании, проведенном в Пенсильвании, было обнаружено, что дети, рожденные от матерей с ИМТ до беременности 40 или выше, имеют на 57% более высокий риск развития лейкоза (Stacy et al., 2019). Сходным образом, в ретроспективном исследовании случай–контроль в Калифорнии дети, рожденные от матерей с избыточным весом (ИМТ 25–30), подвергались повышенному риску лейкоза, а чрезмерное увеличение веса во время беременности было связано с повышенным риском развития астроцитомы у потомства (Contreras et al., 2016). Учитывая значительную роль стрессовых факторов окружающей среды в раннем возрасте для здоровья потомства, весьма вероятно, что материнское ожирение может увеличить риск развития злокачественной опухоли у потомства. Это может происходить косвенно, поскольку потомки матерей с ожирением с большей вероятностью сами будут страдать ожирением, а ожирение является независимым фактором риска злокачественных новообразований (Divella et al., 2022). Напротив, воздействие материнского ожирения в раннем возрасте может напрямую перепрограммировать ткани различных систем органов, так что они с большей вероятностью будут подвергаться канцерогенезу. Исследования на животных также показывают, что ожирение матери увеличивает риск развития гепатоцеллюлярной карциномы (Sun et al., 2020), рака молочной железы (La Merrill et al., 2010; Zhang et al., 2020), рака предстательной железы (Benesh et al., 2013; Yang et al., 2018; Liu et al., 2019) и легкого (Shi et al., 2021); некоторые из этих повышенных рисков связаны с перепрограммированием иммунных клеток в микроокружении опухоли. Однако клиническая значимость данных недостаточно ясна и нуждается в дальнейшем исследовании.
Гемопоэтические стволовые клетки и клетки-предшественники как клеточный источник нарушения иммунной функции у потомства матерей с ожирением
Существуют убедительные данные о том, что воздействие ожирения и хронического воспалительного состояния у матерей увеличивает риск развития у потомства широкого спектра хронических заболеваний, многие из которых имеют признаки измененной иммунной/воспалительной активации (Kim et al., 2008; Allswede et al., 2016; Englich et al., 2017; Ghassabian et al., 2018; Rothers et al., 2018; Volk et al., 2020). Такие результаты служат поводом для исследования причин изменения иммунных состояний на клеточном уровне. Все иммунные клетки происходят из гемопоэтических стволовых клеток и клеток-предшественников (HSPC). Характеристика популяций клеток-предшественников — потомков гемопоэтических стволовых клеток HSC в 2000-х годах привела к созданию модели, в которой гемопоэз изображается как дерево, которое ветвится от HSС до зрелых форменных элементов крови (Orkin, 2000). Если говорить кратко, HSC обладают двумя фундаментальными характеристиками: способностью к самообновлению и дифференцировке во все зрелые линии форменных элементов крови. Как только HSC дифференцируются в мультипотентные клетки-предшественники (MPP), клетки MPP дают две основные линии: общий миелоидный предшественник (CMP) и общий лимфоидный предшественник (CLP). CMP далее дифференцируется в мегакариоцитарно-эритроидные клетки-предшественники (MEP) и гранулоцитарно/моноцитарные предшественники (GMP), в конечном итоге превращаясь во все зрелые форменные элементы крови, за исключением лимфоидной линии: эритроциты, тромбоциты, моноциты, макрофаги и гранулоциты (нейтрофилы, эозинофилы, базофилы). CLP далее дифференцируются в В-лимфоциты, Т-лимфоциты и NK-клетки (Lim et al., 2013). Недавние исследования дают основания предполагать, что гемопоэтическая дифференцировка сложнее, чем эта классическая модель, поскольку пул HSC функционально и молекулярно гетерогенен, и эти клетки способны к клональной экспансии (Stier et al., 2002; Dykstra et al., 2007; Sanjuan-Pla et al., 2013; Pietras et al., 2015). Кроме того, новая «континуальная модель кроветворения» предполагает, что кроветворение представляет собой непрерывный процесс, в котором нет дискретных фенотипических изменений внутри субпопуляций (Velten et al., 2017; Laurenti and Gottgens, 2018).
Хотя HSPC должны образовывать все функциональные кроветворные линии, включая иммунные клетки, число исследований, сосредоточенных на влиянии материнского ожирения на гемопоэз, ограничено. Известно, что на функцию HSPC у взрослых влияет воспаление, вызванное рядом других факторов (Masamoto et al., 2016; van den Berg et al., 2016; Emmons et al., 2017). Однако влияние провоспалительного состояния при ожирении матери на функцию HSPC у потомства в долгосрочной перспективе еще предстоит установить. В многочисленных обзорах приведены данные об изменении иммунитета плода в ответ на воздействие материнского ожирения (Sureshchandra et al., 2019; St-Germain et al., 2020; Monaco-Brown and Lawrence, 2022). В исследовании, проведенном на небольшой когорте, у младенцев, рожденных матерями с ожирением, среди мононуклеарных клеток из пуповинной крови было выявлено повышенное содержание клеток CD4+ и уменьшение популяции миелоидных клеток. Тем не менее, у таких детей была повышена концентрация IL-12p40 и макрофагального хемокина — двух молекул, вырабатываемых активированными миелоидными клетками и известных в качестве хемоаттрактантов для некоторых других иммунных клеток, включая макрофаги, моноциты, клетки Th2, NK-клетки и дендритные клетки (Enninga et al., 2021). Другое когортное исследование с участием 18 беременных женщин показало, что в пуповинной крови, взятой из плаценты матерей с ожирением, было повышено количество субпопуляций лимфоцитов CD3+, CD4+, CD8+, NK и CD8+CD25+Foxp3+ Treg-клеток, в то время как число клеток CD34+ — популяции, обогащенной HSPC, — было снижено (Gonzalez-Espinosa et al., 2016). Более того, воздействие материнского ожирения было связано с изменением эпигенома CD4+ Т-клеток в пользу эффекторных клеток памяти, но со значительным снижением выработки цитокинов в ответ на стимуляцию CD3/CD28 (Sureshchandra et al., 2021b). Моноциты из пуповинной крови матерей с ожирением дают ослабленный ответ на стимуляцию ЛПС; было установлено, что это связано с гипометилированием промоторов и регуляторных областей генов, участвующих в передаче сигналов TLR в покоящихся моноцитах пуповинной крови (Sureshchandra et al., 2017). Беременность, осложненная ожирением, была связана с ослаблением ответа моноцитов и дендритных клеток плода на лиганды TLR (Wilson et al., 2015). Члены семейства TLR играют ключевую роль в провоспалительном ответе на бактериальные инфекции; следовательно, нарушение регуляции сигнальных путей TLR связано с бактериальными заболеваниями, включая некротизирующий энтероколит (Jilling et al., 2006). Интересно отметить, что, как обнаружили Cifuentes-Zúñiga et al, в плазме детей, рожденных от матерей с ожирением, был повышен уровень лептина — провоспалительного адипокина, в то время как фенотип моноцитов и образующихся из них макрофагов у таких детей имели противовоспалительный фенотип, но с подавлением противовоспалительных медиаторов в ответ на поляризацию макрофагов в сторону М2.
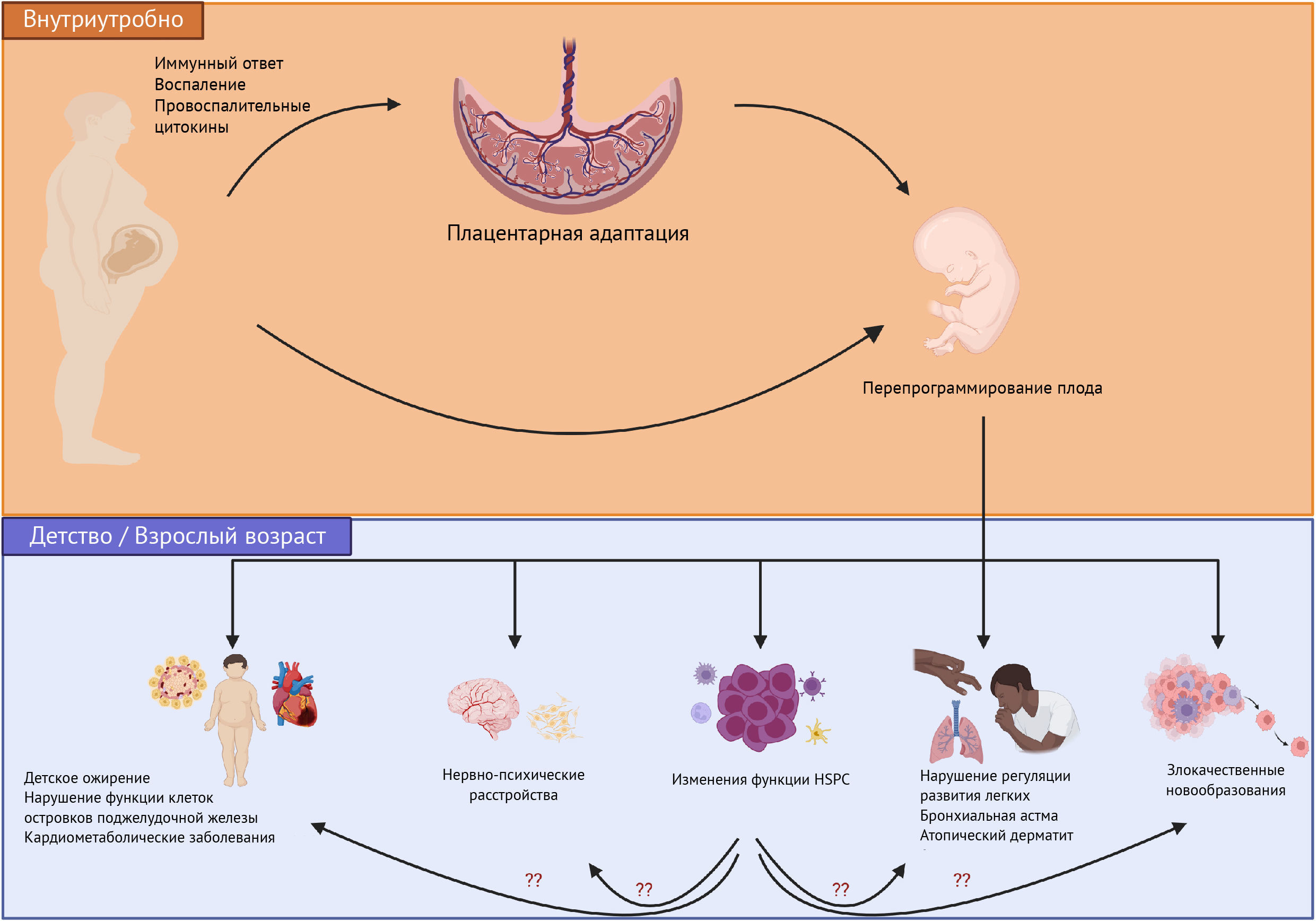
Несбалансированный ответ моноцитов на М1- и М2-стимуляцию и у детей матерей с ожирением может оказывать неблагоприятное воздействие на воспалительные изменения, что может объяснять развитие некоторых хронических состояний, связанных с перепрограммированием плода, вызванным воздействием материнского ожирения (Cifuentes-Zuniga et al., 2017). Опять же, большинство этих исследований проводится с использованием циркулирующих иммунных клеток и, вероятно, не отражает иммунный ландшафт в различных системах органов, о чем говорят исследования на животных (например, иммунные клетки в жировой ткани (Corken and Thakali, 2021) и печени [Nash et al., 2021]). Тем не менее, эти результаты говорят о вероятности того, что у потомства, рожденного от матерей с ожирением, в долгосрочной перспективе изменяется функция HSPC. В настоящее время существует только одна мышиная модель, при помощи которой оценивали острое влияние материнской диеты с высоким содержанием жиров на функцию HSPC плода. Kamimae-Lanning et al исследовали влияние материнского ожирения у мышей на HSPC, выделенных из печени эмбрионов, которая является основным органом внутриутробного кроветворения (Kamimae-Lanning et al., 2015). Они показали, что у плодов самок мышей, которых постоянно кормили пищей с высоким содержанием жиров, наблюдались не только признаки неблагоприятного программирования плода, такие как ограничение роста, но и снижение количества HSPC в печени. Несмотря на снижение общего числа HSPC, доля В220+-лимфоидных и Gr-1+/Ter119+-миелоидных клеток в фетальной печени была увеличена, что свидетельствует о тенденции к миелоидной и В-клеточной дифференцировке. Значительных изменений в процентном содержании клеток CD3+ не наблюдалось. Исследование методом конкурентной трансплантации, при котором клетки печени плода мышей, матери которых получали диету с высоким содержанием жиров и контрольную диету, пересаживали облученным мышам, которые также получали одну из этих двух типов диет, показало, что химеризм фетальных клеток печени, прекондиционированных диетой с высоким содержанием жиров, у самцов, получавших такую же диету, был понижен. Транскриптомный анализ фетальной печени, на которую влиял рацион с высоким содержанием жиров, выявил наличие ряда мишеней, участвующих в регуляции множества путей, включая развитие, метаболизм, иммунитет и воспаление, активацию комплемента, инсулиновый сигналинг и кроветворение. Хотя некоторые исследования, проведенные на людях и грызунах, дали противоречивые результаты, а лежащие в их основе механизмы требуют дальнейшего изучения, очевидно, что воздействие материнского ожирения оказывает существенное влияние на иммунный ответ потомства (Wilson et al., 2015; Gonzalez-Espinosa et al., 2016; Enninga et al., 2021; Sureshchandra et al., 2021b). На рисунке 2 предлагается новая концепция влияния материнского ожирения на HSPC и потенциальные воспалительные/иммунные пути, запускаемые при изменении функции HSPC и способные привести к вышеупомянутым нарушениям, связанным с материнским ожирением.
Заключение
Исследования как на людях, так и на животных показывают, что дети, рожденные от матерей с ожирением, подвержены более высокому риску развития широкого спектра хронических заболеваний. Тем не менее, текущее понимание того, как активируются различные пути в контексте потомства матерей с ожирением, и точных механизмов, ведущих к программированию развития, все еще плохо изучено. В настоящее время имеются убедительные данные, что ранние изменения воспалительных маркеров могут быть предикторами различных заболеваний в более позднем возрасте. Таким образом, необходимо дальнейшее изучение воспалительных профилей потомства на разных стадиях развития. Помимо этого, существует острая потребность в определении все более широко признаваемых половых различий в восприимчивости потомства к заболеваниям с использованием как эпидемиологических данных для человека, так и исследований на животных. Кроме того, связь между пренатальным воздействием метаболических и воспалительных изменений, вызванных ожирением матери, и заболеваниями потомства с участием иммуномодуляции как в детском, так и во взрослом возрасте указывает на необходимость лучшего понимания влияния нарушения регуляции обмена веществ на HSPC.
