Теломеры: Начало и Конец

Введение
25 апреля отмечается День ДНК — праздник, посвященный самой важной молекуле для всех живых существ, определяющей каждое мгновение нашего бытия, незримо дирижирующей всеми протекающими в организме процессами. В честь этого события мы подготовили статью об одних из наиболее важных структур в ДНК людей, а также большей части эукариот — теломерах. На первый взгляд, это непримечательные структуры из часто повторяющихся комбинаций нуклеотидов, которые находятся на концах хромосом. Однако без их существования процесс воспроизведения нашей ДНК был бы невозможен и прервался бы в саморазрушительной агонии еще на этапе деления эмбриональных клеток в утробе матери.
Как это связано с молекулярной машинерией процесса репликации, что такое лимит Хейфлика, в чем была циничная несправедливость Нобелевского комитета и как теломеры связаны со старением? Эта статья частично ответит на вопросы, ответы на которые ищет уже не одно поколение.
Хейфлик и его лимит
Теломеры — это повторяющиеся последовательности нуклеотидов, которые располагаются на концах хромосом. Они были впервые описаны в 1938 году Германом Мюллером [1].
Он стал первым исследователем, который заметил, что концы хромосом имеют уникальные свойства. В классическом эксперименте по мутагенезу у дрозофилы Мюллер использовал рентгеновские лучи, чтобы вызывать различные мутации, многие из которых включали разрывы и слияние хромосом. Во время этих экспериментов он наблюдал, что концы хромосом были удивительно устойчивы к мутагенному воздействию рентгеновских лучей.
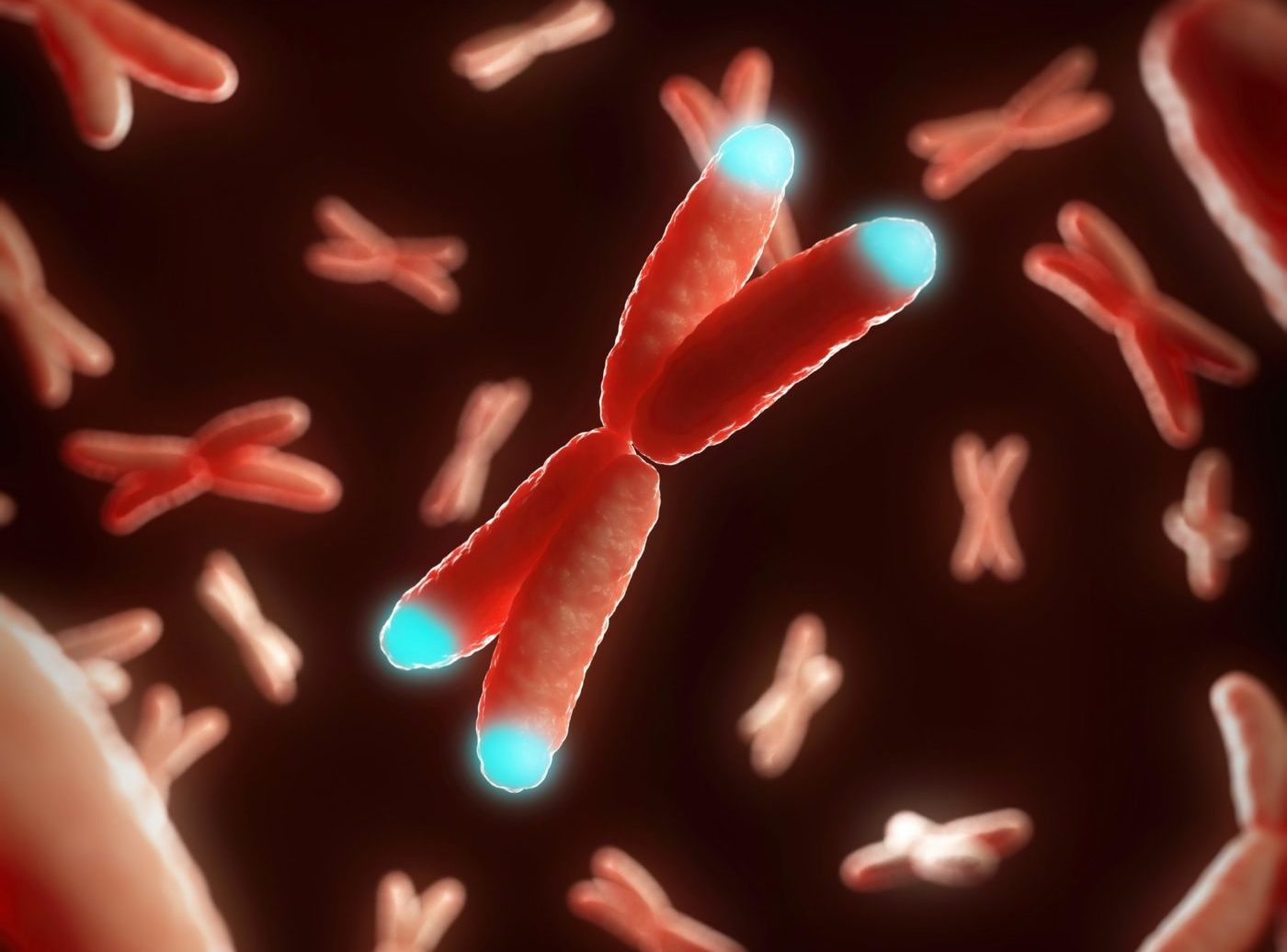
Рис.1 | 3D Модель хромосомы с подсвеченными теломерами.
Мюллер предположил, что ген на концах хромосом должен иметь особую функцию, предохраняющую концы хромосом, и что по какой-то причине хромосома не может продолжительно существовать без этого гена на своих концах.
Теперь мы знаем, что Мюллер был прав только частично. Теломеры действительно играют важную роль в стабилизации концов хромосом, однако они не выполняют активной функции в защите хромосом от того же ионизирующего излучения. Вместо этого теломеры состоят из массивов часто повторяющихся последовательностей ДНК и специфических связывающих белков, формирующих уникальную структуру на конце хромосомы.
По мере того, как теория о хранении наследственной информации в хромосомах набирала обороты в первой половине двадцатого века, ученые стали все больше интересоваться пониманием воздействия мутагенов, таких как рентгеновские лучи, на структуру и поведение хромосом.
В последующем Барбара Макклинток, талантливый цитогенетик, которая разработала методы выделения и окрашивания хромосом кукурузы, сделала ключевые открытия в понимании роли теломер.
В ходе своих экспериментов Макклинток обнаружила, что разорванные в результате действия рентгеновского излучения концы хромосом были крайне нестабильными, что приводило к хромосомным перестройкам и неправильному поведению хромосом во время деления клеток. Тем не менее, когда эти разорванные концы были закрыты специфическими структурами, которые Макклинток называла терминальными, хромосомы становились стабильными.
Макклинток также обратила внимание на то, что подобные структуры присутствовали на всех нормальных хромосомах, что указывало на их важную роль в поддержании стабильности хромосом. Кроме того, она обнаружила, что эти структуры могут передаваться между поколениями, что говорило об их роли в поддержании стабильности хромосом [2].
Важность теломер и их стабилизирующей функции подтвердилась и в дальнейших исследованиях, включая работу над репликацией ДНК и другие эксперименты с мутагенами. С течением времени, благодаря развитию молекулярных и цитогенетических методов, исследователи смогли получить более подробную картину структуры и роли теломер.

Рис.2 | Барбара Макклинток с главными объектами ее исследований на фоне, ДНК и кукуруза.
Однако их истинное значение, связанное с делением клеток, стало ясным лишь после проведения экспериментов Леонарда Хейфлика в 1961 году.

Рис.3 | Леонард Хейфлик в лаборатории
Работая в Вистаровском институте, Хейфлик занимался культивацией клеточных культур для экспериментов других исследователей из института. Помимо этого, Хейфлик также проводил и собственные исследования по изучению воздействия вирусов на клетки.
В то время считалось, что клетки могут делиться бесконечно, если для этого созданы подходящие условия. Это убеждение пошло от исследований 1911 и 1912 годов, проведенных французским ученым и лауреатом Нобелевской премии Алексисом Каррелем. Результатом исследований на культуре клеток сердечной ткани курицы стали выводы о том, что клетки способны делиться бесконечно, поскольку в его экспериментах удавалось поддерживать деление клеток в течение неограниченно долгих периодов времени [3]. В дальнейшем Каррель сделал заявление о том, что его культуры клеток продолжали существовать на протяжении 7, 12 лет и вплоть до 34 лет. Несмотря на то, что кроме Карреля, никому не удавалось достичь подобных результатов, научное сообщество в привычной и сейчас ему манере предпочло просто довериться авторитету Карреля, а не доказательной базе. И вот, спустя лишь 50 лет, происходит открытие, которое полностью изменяет представление о бесконечном делении клеток.

Рис. 4 | Алексис Каррель, автор теории о бесконечном делении клеток
В результате проведенных исследований Хейфлик обнаружил, что культуры диплоидных клеток человека имеют ограниченное число делений — около 50 ± 10 раз, — после чего клетки перестают делиться и входят в состояние сенесценции (старения) [4]. В своих экспериментах Хейфлик использовал диплоидные клетки человека, которые он культивировал в питательной среде; когда клетки достигали предела своего деления, они становились плоскими, увеличивались в размерах и теряли способность к дальнейшему делению.
Алексей Оловников — созерцая репликацию
Алексей Оловников — русский биолог, в 1971 году предсказавший роль теломер, механизм укорочения линейной ДНК в процессе репликации, а также существование теломеразы. Он предположил, что теломеры предотвращают потерю генетической информации в ходе деления стволовых и половых клеток, свою теорию он назвал маргинотомией [5].

Рис.5 | Алексей Матвеевич Оловников
Идея заключается в том, что потеря информации с концов хромосом может быть связана с тем, что ДНК-полимераза не способна полностью копировать линейную ДНК, при этом неизбежно теряется определенное количество информации. Именно эти потери являются своеобразным счетчиком, определяющим лимит делений клеток по Хейфлику. Одновременно с этим Оловников предположил, что должен существовать механизм, противодействующий этому и удлиняющий хромосомы стволовых и половых клеток, так как в противном случае существование жизни с линейными хромосомами было бы невозможным. С тех пор было проведено множество исследований, и современное представление о механизме репликации ДНК включает множество подробностей и нюансов.
В настоящее время мы уже достоверно знаем о том, что Оловников был прав в своей теории. Проблема репликации линейных хромосом заключается в том, что ДНК-полимеразы работают только в одном направлении, синтезируя новую цепь от 5'-конца к 3'-концу. В результате на одной из цепей ДНК (ведущей) репликация происходит непрерывно, а на другой (отстающей) цепи — кусочками, называемыми фрагментами Оказаки. После синтеза каждого фрагмента Оказаки РНК-праймер удаляется и заменяется ДНК. Однако ДНК-полимераза не может копировать последний участок отстающей цепи, где был присоединен последний праймер, так как нет свободного 3'-конца для продолжения синтеза. Это приводит к постепенному укорочению хромосом с каждым клеточным делением.
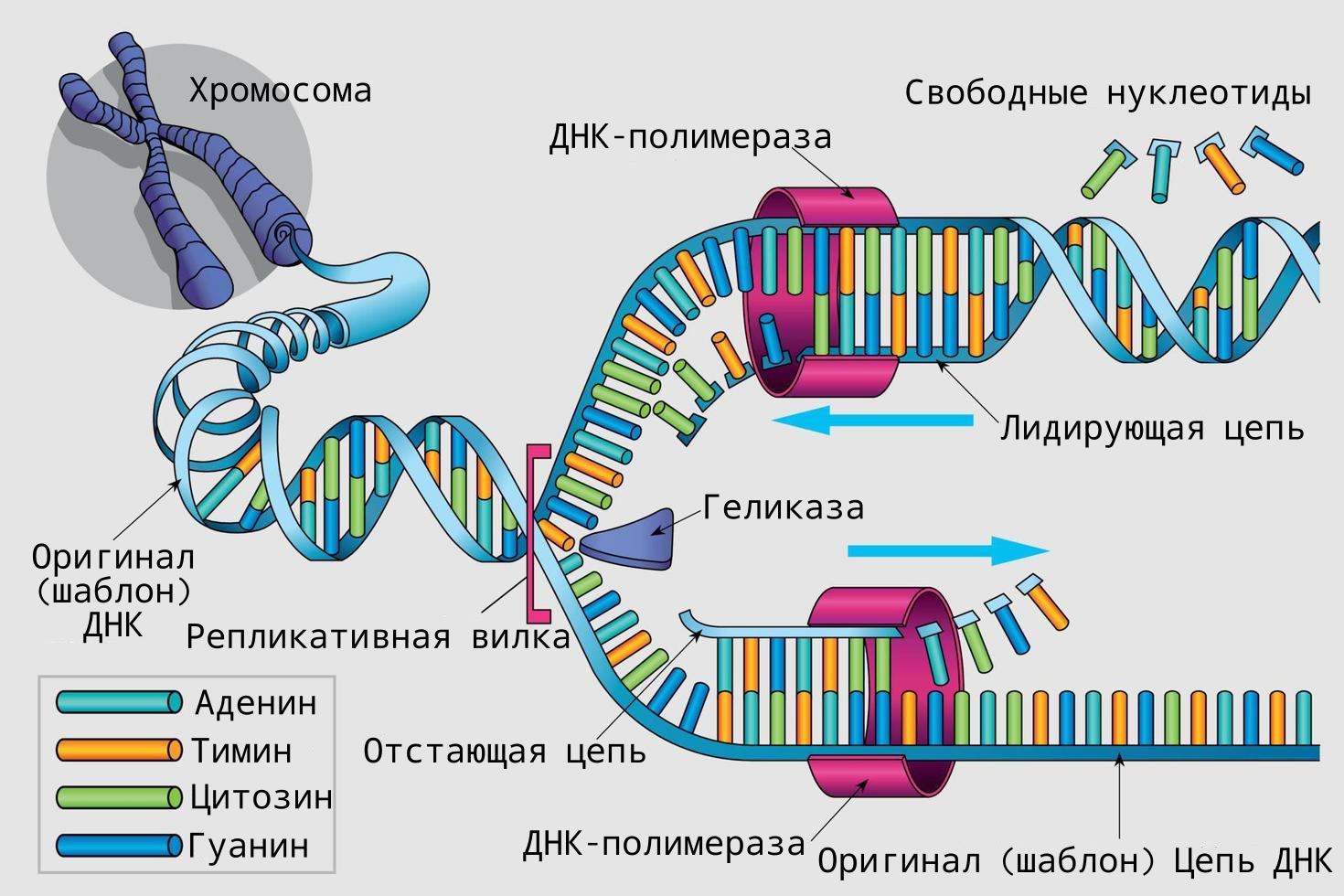
Рис.6 | Процесс репликации ДНК
Теория маргинотомии Оловникова стала основой для понимания репликационного укорачивания теломер. Оловников предположил, что теломеры служат буферной зоной, предотвращающей потерю важных генетических последовательностей в процессе репликации. Когда теломеры достигают критической длины, клетка перестает делиться, что может приводить к старению и клеточной смерти.
Со временем исследователи выяснили, что существует фермент теломераза, который способен восстанавливать укороченные теломеры путем добавления повторяющихся последовательностей к их концам. Теломераза активна в стволовых, репродуктивных и некоторых раковых клетках, что позволяет им обойти репликационное укорочение и продолжать деление.
В 2009 году за открытие теломеразы была вручена Нобелевская премия, но увы, это был счастливый конец не для Алексея Оловникова.
Забытый первооткрыватель
В 1985 году Элизабет Блэкберн и Кэрол Грайдер сделали поворотное открытие, которое изменило наше понимание клеточного старения. В процессе своей работы они нашли загадочный фермент, который, как предполагал Оловников, играет ключевую роль в поддержании длины теломер, защищая их от укорочения.
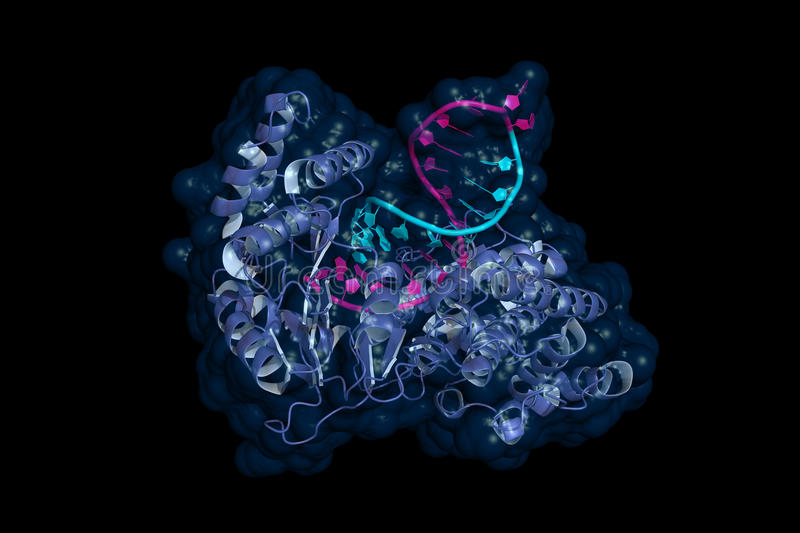
Рис.7 | 3D Модель теломеразы
В своей первоначальной работе, где было описано это открытие «Identification of a specific telomere terminal transferase activity in Tetrahymena extracts» («Определение специфической теломерной активности терминальных трансфераз в экстрактах Tetrahymena»), они использовали одноклеточный организм Tetrahymena thermophila (ресничная инфузория) в качестве модели для изучения теломер и их роли в клетке. В процессе было обнаружено, что этот организм содержит фермент, который обладает способностью продлевать теломеры, предотвращая их укорочение и, соответственно, клеточное старение. Именно этот фермент и был назван теломеразой.
В 2009 году Элизабет Блэкберн, Кэрол Грейдер и Джек Шостак были номинированы на Нобелевскую премию, однако, как можно уже догадаться, заложившего теоретический фундамент Алексея Оловникова подобной чести не удостоили [7].

Рис.8 | Элизабет Блекберн получает награду от короля Швеции Карла XVI
На фоне этого не менее удивительно выглядели тогда заявления коллег Оловникова, о том что он своей награды не заслуживает в силу исключительно теоретической сути его вклада в открытие.
Подобное лицемерие и нигилизм становятся особенно ироничны, если вспомнить, что в науках о жизни есть целые дисциплины, занимающиеся исключительно теоретической частью. Как минимум та же биоинформатика, максимально удаленная от «мокрой» экспериментальной биологии дисциплина, занимающаяся самой что ни на есть теорией.
Не говоря уж о том, что такие фундаментальные открытия, как законы Менделя, являются чисто математической теорией, которую он наблюдал эмпирически, но не имел возможности экспериментально подтвердить наличие носителя наследственной информации и ее передачу. Труды Дарвина, вылившиеся в современную синтетическую теорию эволюции, в своем изначальном виде также были «сухой» теорией, основанной на эмпирическом наблюдении закономерностей, без экспериментального подтверждения. Из более актуального и не менее значительного можно вспомнить «любовный» треугольник Уотсона, Крика и Франклин; последняя, увы, не дожила до вручения первым двум Нобелевской премии в 1962 году за открытие структуры ДНК. И вновь, без твердой экспериментальной базы, а по большей части лишь за предположения на основе имеющихся данных, они были номинированы на Нобелевскую премию.
Можно вспомнить Нобелевскую премию 1975 года, которую разделили Дэвид Балтимор, Ренато Дульбекко и Ховард Мартин Темин, за то, что заложили основы понимания ретровирусов и предположили, что они интегрируют свою ДНК в геном хозяина. Даже пресс-релиз Нобелевского комитета указывал на то, что эти ученые заложили концептуальный фундамент для дальнейших экспериментов [9].
Теломераза: Жизнь и смерть
Теломеры и их роль в продолжительности жизни организмов привлекали внимание ученых на протяжении многих лет. В не столь давнем прошлом считалось, что длина теломер и скорость их укорочения коррелируют с продолжительностью жизни организма. Однако недавние исследования показывают, что связь между этими показателями не столь прямолинейна, и множество факторов влияют на продолжительность жизни.
Например, у мышей, которые являются одними из ближайших родственников человека среди млекопитающих (помимо приматов), теломеры длиннее, чем у людей, в 5–10 раз. Несмотря на это, продолжительность жизни мышей значительно меньше человеческой, в 30 раз меньше [13]. Это говорит о том, что длина теломер не является единственным фактором, определяющим продолжительность жизни организма.
Рис.9 | Лабораторная мышь
Сегодня в геронтологической среде существует убеждение в том, что большую роль играет скорость укорочения теломер, однако основания для таких предположений кажутся слабыми и неясными. Возможно, это заблуждение, аналогичное убеждению времен Алексиса Карреля о бесконечном делении взрослых клеток, или же это все же подтвердится благодаря исследованиям ученых, таких как Михаил Оловников и Элизабет Блэкберн.
К сожалению, академический мир страдает от гонок за громкими заголовками и нежелания перепроверять кажущиеся очевидными вещи. Эталонным примером такого подхода является регулярно повторяемое некоторыми специалистами заявление, что технология CRISPR неперспективна, так как это уже не ново и все этим все и так занимаются. Можно лишь представить, что было бы, если бы в компьютерных науках царила аналогичная атмосфера, и развитие тех же транзисторов, открытых в 1947 году, забросили бы где-нибудь в 1957 году. Вероятно, современного цифрового мира не было бы вовсе. Он бы продолжал существовать лишь в виде изолированных островков тонн металлических машин с мощностью карманного калькулятора, сосредоточенных на военных базах и в исследовательских лабораториях.
В настоящее время в сфере геронтологии, в вопросах, касающихся теломер, теломеразы и их роли в клеточном строении, можно с уверенностью сказать лишь одно: надежных данных пока что недостаточно. Вполне возможно, что главным препятствием для получения таких данных является именно закрытость индустрии и нежелание академического сообщества отказаться от старых догм.
Выходом из этой ситуации могли бы быть ранее уже предложенные облегчения регуляций вокруг биотехнологической индустрии, чтобы порог входа на рынок не требовал стартового капитала в миллиарды долларов, так как текущий подход к регулированию индустрии приводит к созданию эхо-камеры из уже устоявшихся на рынке олигополистов. Если бы такие изменения были реализованы, это могло бы способствовать более быстрому и глубокому изучению теломер, теломеразы и их роли в продолжительности жизни и клеточной структуре. Больше исследователей и компаний могли бы получить доступ к необходимым ресурсам для проведения своих исследований, что, в свою очередь, увеличило бы вероятность открытия новых факторов, влияющих на продолжительность жизни и возможности их регуляции.
С разнообразием идей и подходов, возможно, мы бы обнаружили, что продолжительность жизни зависит не только от длины теломер и скорости их укорочения, но и от множества других факторов. Это, в свою очередь, могло бы открыть новые перспективы для разработки лекарств, направленных на продление жизни и улучшение ее качества у неумолимо стареющей популяции.
За гранью Начала и Конца
Вирулентное сходство
Теломераза — простая, но столь важная для нашего существования молекулярная машина, которая на протяжении бесчисленных циклов борется с саморазрушительной природой репликации линейных хромосом. В этой вечной битве за цельность генома она трудится над тем, чтобы сохранить длину теломер достаточной, чтобы мы могли передать нашу ДНК в наследство новым поколениям, а также чтобы эти новые поколения не столкнулись с лимитом Хейфлика еще на этапе эмбрионального развития, даруя эмбриональным клеткам реактивную способность к пролиферации без последствий для их теломер.
Рис.10 | 3D-симуляция вириона ВИЧ
Молекулярный комплекс теломеразы состоит из рибонуклеопротеина, включающего две основные части: РНК-шаблон и фермент обратную транскриптазу (ревертазу). Все начинается с того, что обратная транскриптаза, увлекаемая своим рибонуклеиновым напарником, находит свое место на конце теломеры. Далее теломераза начинает синтезировать новые последовательности ДНК, используя РНК-шаблон в качестве матрицы. Да, вторая цепь ДНК тут не участвует, так как из-за особенности работы ДНК-полимеразы мы бы все так же столкнулись с укорочением длины. Но обратная транскрипция РНК в ДНК нам более знакома как участница других, менее благоприятных процессов: знакомо, не так ли?
Давайте заглянем в эволюционную родословную теломеразы: там для нас открывается любопытное семейное древо, где представлены ревертазы ретровирусов, а также ретротранспозонов. И те, и те могут плавно перетекать из одного в другое, и вопрос, кто был первым, весьма затруднителен, так как, в отличие от дилеммы курицы и яйца, в случае ретротранспозонов и вирусов совершенно непонятно, кто тут курица, а кто — яйцо. Но это отдельная история, уходящая корнями в тему зарождения жизни; оставим РНК-мир и первые органические репликаторы для обсуждения в другой статье.
Однако, мы точно можем говорить о родстве используемых ими молекулярных систем, и фермент ревертаза — как раз та зацепка, что позволяет нам объединить ретротранспозоны, ретровирусы (да, да, в том числе столь зловредный ВИЧ) и столь жизненно необходимую теломеразу. А хотя столь ли жизненно необходимую [14–15]?
В последние годы наблюдается возрастающий интерес к изучению теломеразы и теломер в контексте возможных терапевтических применений, включая замедление процесса старения, улучшение регенерации тканей и даже предотвращение развития рака. Важно понимать, что сохранение длины теломер — это лишь одна из составляющих успешной борьбы со старением и другими заболеваниями.
На пути к разработке эффективных стратегий для продления жизни и улучшения качества старения необходимо изучать и другие факторы, такие как окружающая среда, питание, физическая активность, стресс, социальные связи, а также генетическая предрасположенность. Только комплексный подход, учитывающий все эти факторы, позволит нам найти новые пути для продления жизни и улучшения качества жизни стареющего населения.
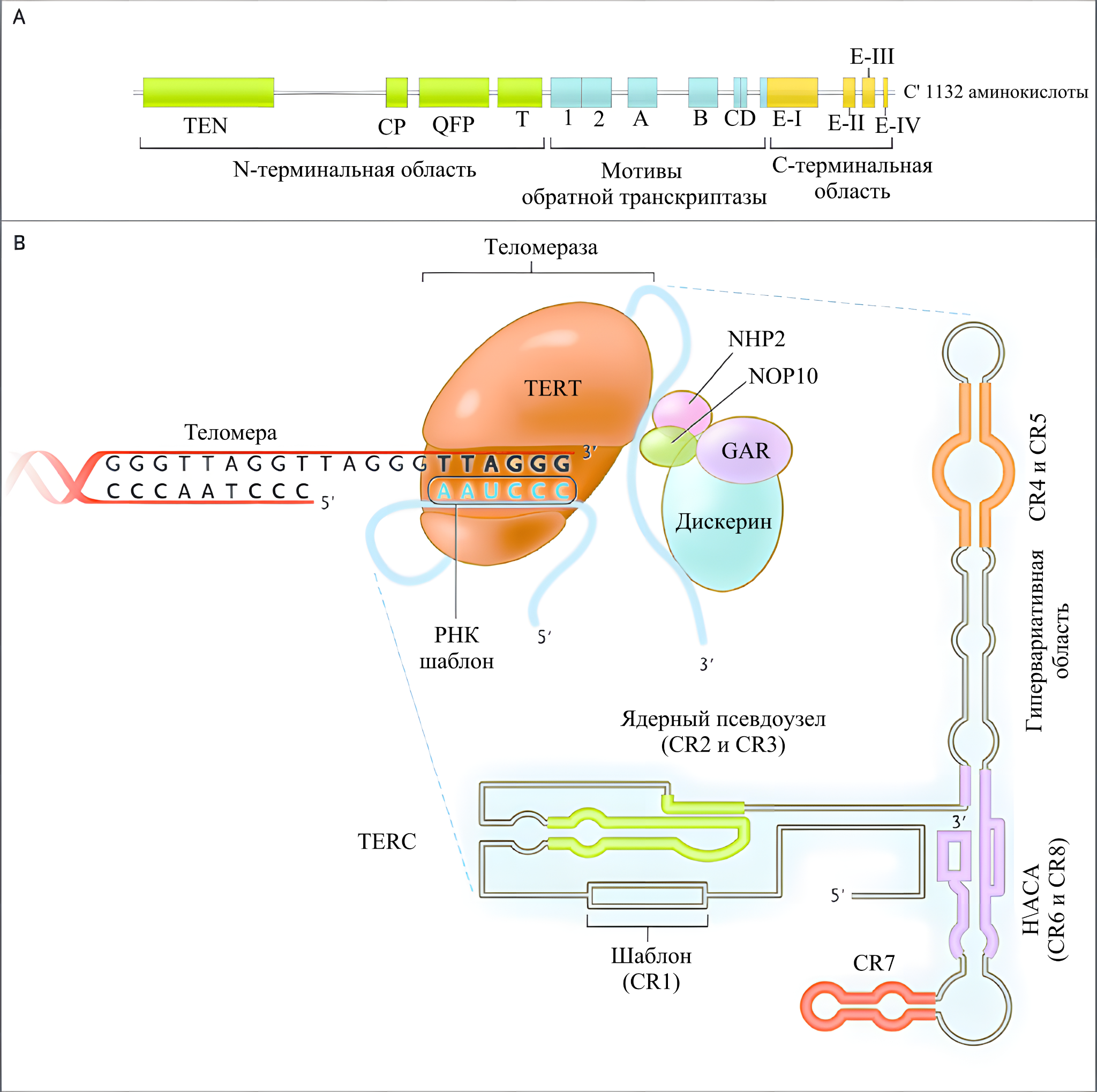
Рис.11 | Изображение теломеразы и ее компонентов в процессе наращивания теломер
Теломеры в стиле ретро
Науки о жизни удивительны, в них всегда есть место для новых открытий и падения в пучину небытия, потерявших актуальность старых знаний, которые, впрочем, мировое научное сообщество™ будет до посинения повторять, словно мантры, ближайшие полвека, а потом еще полвека со скрипом будет от них отказываться, злобно шипя и огрызаясь.
Да, жизнь эукариот с линейными хромосомами (а они не всегда линейные — да, и тут опять обман) возможна без теломеразы, и на помощь снова приходят вольные кочующие гены, а именно транспозоны. Кто же отличился такой необычной системой поддержания целостности генома? Наверное, кто-то из легионов разных клад, скрывающихся под общим именем протозоа, какой-нибудь колониальный миксомицет, сорняк с гигантским геномом? Drosophila melanogaster.

Рис.12 | Drosophila melanogaster (Плодовая мушка)
Да, обычная плодовая мушка, излюбленная всеми обитателями лабораторий не меньше, чем крысы и мыши, в качестве модельного организма, кроет в себе столь удивительную особенность. Вместо привычных «одомашненных» теломер и теломеразы, которые, в общем-то, тоже своего рода ретротранспозоны, дрозофила особенная и использует для этого non-LTR (non-Long Terminal Repeat, другими словами, короткие концевые повторы) ретротранспозоны. Более того, представлены они даже не одной группой, а сразу несколькими: HeT-A, TART и TAHRE [16].
Не мусорные гены
Не утихают дебаты о том, активная или пассивная роль у большей части нашего генома, полного «мусорных» генов, с которыми, казалось бы, есть уверенность хотя бы в том, что никаких белков они не экспрессируют. Однако, как не трудно догадаться, и тут все оказалось не так однозначно. Да, казалось бы, теломеры, состоящие из коротких бессмысленных повторов, которые никакой роли, кроме как защитного буфера, не играют, умеют экспрессировать белок.
Открытие это не сказать что совсем уж новое: еще в 2011 году группа исследователей из Флориды, работавшая над наследственной формой бокового амиотрофического склероза, выявила, что виновником была молекула РНК, содержащая повтор из шести оснований, который экспрессировал ряд токсичных белков, состоящих из двух аминокислот, повторяющихся одна за другой.
В уже другом исследовании, опубликованном в этом году за авторством Аль-Турки и Джека Гриффита, заметили поразительное сходство этой РНК с РНК, полученной при транскрипции с теломеры. В ходе своего эксперимента они показали, что теломерная ДНК может производить сигнальные белки, которые они назвали VR (валин-аргинин) и GL (глицин-лейцин).
Затем Аль-Турки и Гриффит химически синтезировали VR и GL, чтобы изучить их свойства с помощью электронных и конфокальных микроскопов, а также современных биологических методов; было обнаружено, что белок VR присутствует в повышенных количествах в некоторых раковых клетках человека, а также в клетках пациентов, страдающих заболеваниями, связанными с дефектами теломер [17].
Итог
Итак, что мы можем сказать о теломерах и теломеразе? Они играют важную роль в поддержании стабильности хромосом и обеспечении бесконечного круговорота жизни, переходящего из поколения в поколение. Однако их функции и механизмы действия могут быть намного сложнее, либо совершенно иными, чем мы думаем.

Рис.13 | Нейросетевая иллюстрация спирали ДНК
Открытия о сходстве теломеразы и ревертазы ретровирусов и ретротранспозонов, а также об экспрессии белков, синтезированных из теломерной РНК, показывают, что даже, казалось бы, крайне далекие друг от друга сущности могут иметь родственную природу.
Существование же транспозонов, замещающих теломеразу у Drosophila melanogaster, заставляет задуматься о том, что есть альтернативные механизмы поддержания геномной стабильности в процессе репликации и что все явно не ограничивается одними лишь теломерами.
Однако, как и во времена Карреля, перед стремящимися к истине исследователями стоят аналогичные проблемы.
Академия, в которой преобладает внимание к громким заголовкам, личным связям и уважению к авторитетам, иногда упускает возможность акцентировать внимание на воспроизводимости результатов и анализе различных подходов, включая неудачные. Это может создать впечатление, что в исследованиях ценится только успех.
Даже усилиями тысяч людей вряд ли получится в ближайшем, да и не очень будущем кардинально изменить эту ситуацию. Однако никто не мешает изменить ситуацию лично для вас: не продолжайте порочный цикл, разорвите его. Будьте Хейфликом, который делал рутинную работу, но будучи честным с собой, не отказывался от объективной реальности в пользу постулатов полувековой давности. Будьте Оловниковым в его упорстве к подтверждению или опровержению своих предположений. Не стремитесь разве что к признанию от академии и международного научного сообщества. Это не те две вещи, которые заслуживают того, чтобы трепетно ждать от них чего-либо.
Источники
- O'Connor, Clare. Telomeres of human chromosomes. Nature Education. 2008.
- McClintock, Barbara. The stability of broken ends of chromosomes in Zea mays. Genetics. 1941.
- Carrel, Alexis. On the permanent life of tissues outside of the organism. The Journal of experimental medicine. 1912.
- Hayflick, Leonard. The limited in vitro lifetime of human diploid cell strains. Experimental cell research. 1965.
- Olovnikov, Alexeij M. A theory of marginotomy: the incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon. Journal of theoretical biology. 1973.
- Greider, Carol W., and Elizabeth H. Blackburn. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Сell. 1985.
- Varela, E., and M. A. Blasco. 2009 nobel prize in physiology or medicine: telomeres and telomerase. Oncogene. 2010.
- The Nobel Prize in Physiology or Medicine: Press release. 1975.
- Coffin, John M., and Hung Fan. The discovery of reverse transcriptase. Annual review of virology. 2016.
- Calado, Rodrigo T., and Bogdan Dumitriu. Telomere dynamics in mice and humans. Seminars in hematology. WB Saunders, 2013.
- Mather, Karen Anne, et al. No associations between telomere length and age-sensitive indicators of physical function in mid and later life. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences 2010.
- Nakamura, Toru M., and Thomas R. Cech. Reversing time: origin of telomerase. Cell. 1998.
- Belfort, Marlene, M. Joan Curcio, and Neal F. Lue. Telomerase and retrotransposons: Reverse transcriptases that shaped genomes. Proceedings of the National Academy of Sciences. 2011.
- Casacuberta, Elena. Drosophila: retrotransposons making up telomeres. Viruses. 2017.
- Al-Turki, Taghreed M., and Jack D. Griffith. Mammalian telomeric RNA (TERRA) can be translated to produce valine–arginine and glycine–leucine dipeptide repeat proteins. Proceedings of the National Academy of Sciences. 2023.
