Уменьшение острых побочных эффектов, связанных с химиотерапией у пациентов с онкологическими заболеваниями

Аннотация
Несмотря на энтузиазм, связанный с появлением новых агентов с направленным действием и иммунотерапии, химиотерапия — как сама по себе, так и в комбинации с другими подходами — остается основным способом лечения большинства злокачественных новообразований человека. Тем не менее, бремя побочных эффектов, ассоциированных с химиотерапией (ПЭАХ), остается высоким и, что важно, связанным со значительной заболеваемостью, смертностью и затратами, которые обременяют пациентов в разных сферах жизни, включая выполнение физических, эмоциональных и социальных функций. ПЭАХ могут непосредственно влиять на исход лечения пациента и косвенно увеличивать риск рецидивов злокачественных новообразований, снижая интенсивность лечения и нарушая его непрерывность. Систематические усилия по выявлению и критическому обобщению данных по подходам к контролю ПЭАХ остаются ограниченными. Авторы настоящего обзора рассматривают наиболее распространенные острые ПЭАХ, оказывающие значительное влияние на выживаемость, качество жизни, функции и/или продолжение оптимальной терапии. Они сосредотачиваются на выбранных острых токсических эффектах, которые возникают во время лечения, обобщая их основную патофизиологию, многофакторную этиологию, доказанные методы лечения, стратегии профилактики и рекомендации по ведению пациентов. Авторы также обобщают доступные данные о факторах риска, проверенных инструментах оценки риска и других усилиях по оптимизации контроля симптомов у пациентов, для которых терапевтический эффект наиболее вероятен, чтобы персонализировать профилактику и лечение острых ПЭАХ. Наконец, они обсуждают инновационные подходы для мониторинга симптомов и поддерживающую терапию, которые разрабатываются для улучшения результатов лечения пациентов с онкологическими заболеваниями.
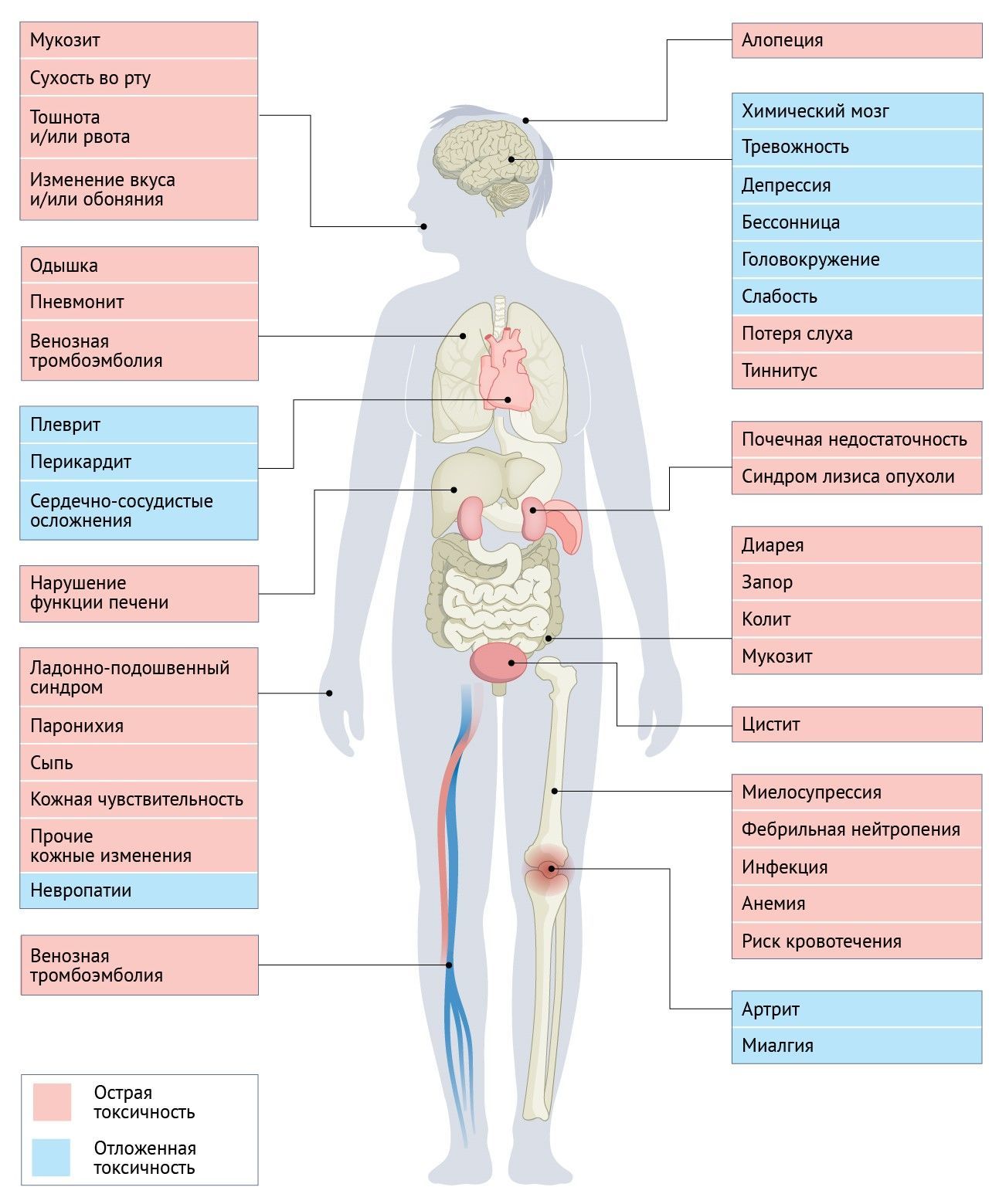
«Primum non nocere» (во-первых, не навреди) остается самым фундаментальным принципом медицинской профессии, чтобы не причинять нашим пациентам больше вреда, чем пользы. Тем не менее, с ее частыми токсическими и даже потенциально смертельными осложнениями, противоопухолевая терапия продолжает бросать вызов усилиям врачей, направленным на то, чтобы избежать причинения серьезного вреда при попытке вылечить пациентов с опасными для жизни злокачественными новообразованиями. Бремя побочных эффектов, ассоциированных с химиотерапией (ПЭAХ), в какой-то момент курса лечения затрагивает большинство пациентов с онкологическими заболеваниями, часто имеет многофакторную этиологию и оказывает широкий спектр воздействий на физические, психологические и социальные функции (рис. 1). Нередко ПЭАХ побуждают к ослаблению и отсрочке лечения, тем самым уменьшая относительную интенсивность дозы (ОТД) химиотерапии, что может поставить под угрозу контроль над заболеванием и возможность излечения. В статье приведен широкий обзор острых ПЭАХ с особым вниманием к тем, для которых доступны общепризнанные фармакологические воздействия на основе опубликованных испытаний и/или руководств по клинической практике (РКП) от профессиональных организаций. Авторы сосредоточились на наиболее распространенных ПЭАХ и тех, которые представляют наибольший риск серьезных осложнений. Они обсуждают патофизиологические основы ПЭАХ, уделяя особое внимание их фармакологическому лечению и профилактике. Авторы подчеркивают двунаправленное неблагоприятное воздействие ПЭАХ, которые не только напрямую влияют на физическое, эмоциональное, социальное и экономическое благополучие и выживаемость пациентов, но и могут косвенно воздействовать на исходы терапии через ухудшение способности пациента получать и переносить рекомендуемую дозу и схему лечения, что может поставить под угрозу контроль над заболеванием. В обзоре представлены актуальные рекомендации крупнейших профессиональных организаций по лечению и профилактике ПЭАХ, направленные на улучшение клинического исхода в кратко- и долгосрочной перспективе у онкологических больных. Наконец, авторы описывают ключевые инновационные стратегии мониторинга симптомов и персонализированной поддерживающей терапии, которые разрабатываются для дальнейшего улучшения результатов лечения пациентов. Следует отметить, что дополнительные ПЭАХ, которые, как известно, охватывают весь континуум выживаемости, а также отложенные эффекты, выходят за рамки этой статьи и будут рассмотрены в будущих обзорах.
Тяжелая и фебрильная нейтропения
Проблематика
Тяжелая нейтропения (ТН; степень 4) возникает, когда абсолютное количество нейтрофилов составляет < 500 на микролитр крови. Фебрильная нейтропения (ФН) определяется как подъем температуры ≥ 38,3 °C (или 38,0 °C в течение ≥1 ч) у пациентов с умеренной нейтропенией или ТН (< 1000 нейтрофилов на микролитр; степень 3 или 4) и представляет собой угрожающее жизни заболевание, требующее немедленной оценки и лечения эмпирическими антибиотиками широкого спектра действия до получения результатов культивирования микроорганизмов и визуализации [1–4]. ТН и ФЕ остаются основными токсическими явлениями, ограничивающими дозу цитотоксических агентов; они связаны со значительной заболеваемостью, смертностью и расходами на здравоохранение [5–7]. Как ТН, так и ФН могут вызвать снижение ОТД химиотерапии, что способно привести к увеличению частоты рецидивов заболевания и смертности от злокачественных опухолей [8–26] (рис. 2a). Риски и осложнения СН и ФН, согласно рандомизированным контролируемым исследованиям (РКИ), значительно различаются в зависимости от применяемых схем химиотерапии, хотя они обычно ниже, чем те, о которых сообщается в реальных популяциях с меньшей степенью отбора пациентов, участвовавших в обсервационных исследованиях [27–30]. Обсервационные исследования в реальных условиях не отобранных онкологических больных показали, что средний уровень смертности, связанный с госпитализацией при ФН, составляет 5–11%, а риск смертности достигает 24–82% среди пациентов с сопутствующим поражением легких, печени, почек, сердца и сосудов головного мозга, легочной эмболией, инвазивными грибковыми инфекциями, пневмонией, бактериемией, гипотензией или септическим шоком [7, 31–34].
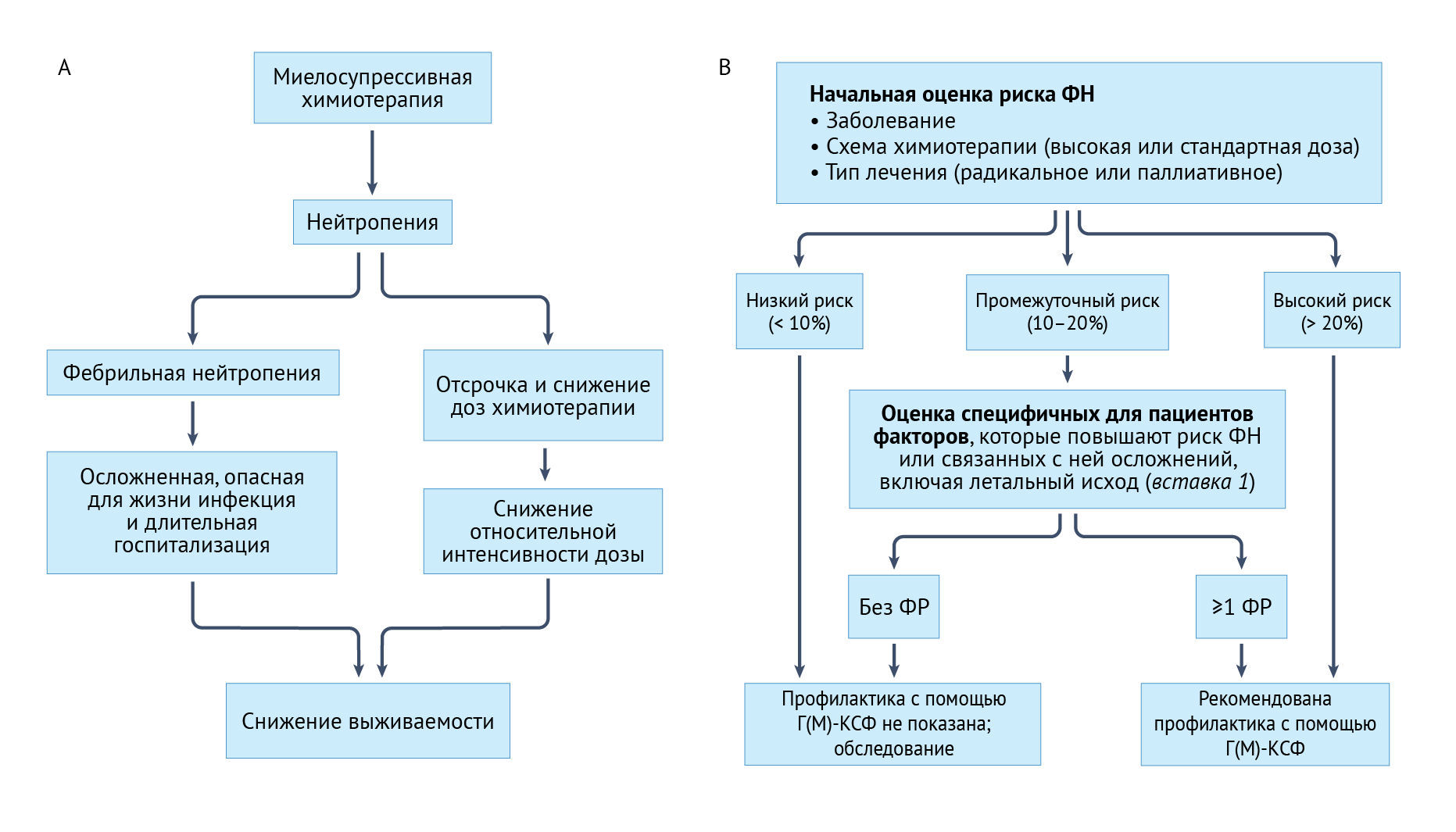
b | Краткое изложение основных подходов к оценке риска, обсуждаемых в руководствах ASCO [4, 49, 67], NCCN [46] и EORTC [58], для стратификации пациентов на категории риска фебрильной нейтропении (ФН) в соответствии с заболеванием, режимом химиотерапии и типом лечения. Рекомендация для пациентов с промежуточным риском заключается в дальнейшей стратификации на основе дополнительных основных факторов риска развития ФН или ее серьезных осложнений, включая смертность (вставка 1). Главным среди этих факторов является прогрессирующее увеличение риска смерти от ФН с ростом числа основных сопутствующих заболеваний. Этот риск еще более возрастает при выявлении конкретного источника или очага инфекции — например, пневмонии, что, вероятно, указывает на более серьезные инфекции [7, 26, 47, 49, 54–62]. Часть b адаптирована с разрешения [58], Elsevier.
Факторы риска
Риск ФН напрямую связан с наблюдаемой тяжестью и продолжительностью нейропении после химиотерапии [35–37]. Наибольший риск начального события ФН постоянно наблюдается в РКИ и в исследованиях в реальных условиях во время первого цикла лечения, когда большинство пациентов получают химиотерапию полной дозы. Этот риск снижается в последующих циклах — обычно потому, что ОТД уменьшается вследствие снижения дозы и задержек и/или введения процедур для профилактики последующих событий ФН [38–43].
Многочисленные исследования были направлены на выявление факторов риска развития ФН для лучшего отбора пациентов с повышенным риском и, таким образом, определения надлежащего использования доступных мер поддерживающей терапии [26, 43–49] (вставка 1). Учитывая множество потенциальных факторов риска разной важности, врачи в отсутствие формальных инструментов оценки риска для ФН испытывают большие трудности [50, 51]. В крупном проспективном когортном исследовании, в котором участвовало более 4000 амбулаторных пациентов с солидными опухолями или лимфомами, начавших новый режим химиотерапии, была разработана прогностическая модель для ФН [43]. Многопараметрический анализ выявил несколько независимых факторов, в значительной степени связанных с ФН, включая предыдущую химиотерапию, исходную лейкопению, почечную дисфункцию, большинство миелосупрессивных химиотерапевтических препаратов, запланированную ОТД > 85% и отсутствие профилактического введения миелоидных факторов роста (таких как Г-КСФ или ГМ-КСФ, обозначенный здесь как Г(M)-КСФ). Связь с другими факторами, такими как тип новообразования, нарушение функции печени или использование, помимо химиотерапии, дополнительных иммунодепрессантов, не столь сильна из-за ограниченной статистической мощности, но, вероятно, имеет клиническое значение. Модель была проверена на независимом наборе данных, полученных из электронных медицинских карт взрослых пациентов с недавно диагностированным раком молочной железы, яичников или легких либо лимфомой, которые проходили химиотерапию [52]. Впоследствии другая исследовательская группа подтвердила эффективность модели, используя данные крупной интегрированной системы здравоохранения [53], что по-прежнему требует формального сравнения с текущей клинической практикой. Кроме того, были выявлены множественные факторы риска ФН, а также тяжелые исходы (включая смерть) у пациентов с установленной ФН [7, 26, 47, 49, 54–62] (вставка 1). Одна из первых моделей риска серьезных осложнений ФН была разработана Многонациональной ассоциацией поддерживающей терапии при онкологических заболеваниях (MASCC) и предназначена для выявления пациентов с низким риском осложнений, связанных с ФН, которых можно безопасно лечить в амбулаторных условиях [61–64]. Несмотря на рано завоеванную популярность модели MASCC, независимые проверочные исследования обнаружили некоторые ограничения у нее и других моделей выявления пациентов, которым можно безопасно оказывать амбулаторную помощь, включая ограниченную чувствительность определения всех пациентов с серьезным риском осложнений [65, 66]. Хотя эти модели по-прежнему важны для информирования клиницистов о факторах риска, связанных с неблагоприятными исходами для пациентов после развития ФН, профессиональные руководства содержат более полный список факторов риска ФН и ее осложнений, подтвержденных более чем в одном исследовании [46, 49, 58, 67] (вставка 1).

Лечение и рекомендации
Несмотря на значительный прогресс в лечении ФН за последние несколько десятилетий, пациенты с ФН по-прежнему подвержены риску длительной госпитализации, серьезных осложнений и летального исхода, что подчеркивает необходимость профилактических мер для лиц с повышенным риском. У пациентов с солидными опухолями, если предполагается, что нейтропения не продлится более семи дней, профилактическое введение антибиотиков не улучшает выживаемость, оказывает ограниченное влияние на серьезные инфекции и может существенно увеличить риск устойчивости к противомикробным препаратам, что приводит к ухудшению клинических исходов инфекции [67, 68].
Метаанализ 17 РКИ с участием более 3500 пациентов с солидными опухолями или лимфомами показал, что первичное профилактическое введение Г-КСФ (начиная с первого цикла химиотерапии) связано со значительным снижением относительного риска (ОР) ФН (ОР 0,54; P < 0,001), смертности от инфекционных причин (ОР 0,55; р = 0,018) и ранней смертности от всех причин (ОР 0,60; р = 0,002) по сравнению с отсутствием профилактики или применением плацебо [34]. Последующий метаанализ с более длительным периодом наблюдения показал снижение абсолютного риска (САР) на 3,4% для смертности от всех причин в РКИ со средней продолжительностью наблюдения ≥ 5 лет [69, 70]. Среди 37 исследований, в которых общая выживаемость была основным результатом, мета-регрессионный анализ продемонстрировал значительное снижение относительного риска летального исхода с увеличением САР (P = 0,0043) у пациентов, рандомизированно выбранных для получения Г-КСФ [70].
Несмотря на эти установленные преимущества, использование Г(М)-КСФ связано с неблагоприятными исходами, а также высокими затратами на лечение [71]. Наиболее частым симптомом, о котором сообщают пациенты, получающие эти факторы роста, является преходящая боль в костях, которая обычно устраняется с помощью обычных анальгетиков, хотя иногда она может быть сильной [34]. Также неоднократно возникает вопрос о повышении риска вторичного острого миелоидного лейкоза (AML) или миелодиспластического синдрома (МДС) в связи с приемом Г(М)-КСФ. В ретроспективном анализе пожилых пациентов (в возрасте ≥ 65 лет) с диагнозом рак молочной железы на ранней стадии, которые получали адъювантную химиотерапию, абсолютное повышение риска развития ОМЛ или МДС составляло 1,8% у тех, кто получал при этом Г(М)-КСФ по сравнению с 0,7% у пациентов без Г(М)-КСФ [72]. Метаанализ 25 РКИ с участием > 12 000 пациентов и продолжительностью наблюдения ≥ 2 лет показал абсолютное повышение риска ОМЛ или МДС на 0,79% и 0,36% с поддерживающим приемом Г(М)-КСФ и без него, соответственно [69]. Однако прямую причинно-следственную связь установить не удалось вследствие того, что поддерживающий прием Г(М)-КСФ позволил обеспечить более высокую ОТД химиотерапевтических агентов, обладающих лейкемогенным действием [69, 70]. В исследованиях экономической эффективности изучали баланс между дополнительными затратами на Г(М)-КСФ и их способностью снижать риск дорогостоящих госпитализаций и влиять на долгосрочный контроль заболевания [6, 70, 73–77]. Другие усилия по регулированию постоянно растущей стоимости Г(М)-КСФ включают внедрение биоаналогов, восемь из которых в настоящее время одобрены FDA, хотя экономические последствия этого во многом остаются неопределенными.
Сообщения как о недостаточном, так и о чрезмерном использовании Г(М)-КСФ побудили к разработке РКП, основанных на оценке риска, которые должны способствовать его доказательному и экономически эффективному применению [49, 58, 78, 79]. Текущие РКП рекомендуют рутинное первичное профилактическое введение этих факторов роста для пациентов с высоким (> 20%) риском ФН (рис. 2b). РКП также рекомендуют рассмотреть вопрос о профилактике для пациентов с промежуточным риском (10–20%), с известными факторами риска ФН и ее осложнений (вставка 1), включая возраст и основные сопутствующие заболевания. Для пациентов с низким риском (<10%) рутинная профилактика не рекомендуется [46, 49, 58].
Инновационные стратегии
В дополнение к первоначальной форме Г-КСФ с коротким периодом действия, требующей ежедневных инъекций, начиная c 1–2 дня химиотерапии, сходную эффективность при профилактике ФН продемонстрировала пегилированная версия с длительным действием, которую можно вводить один раз на цикл химиотерапии [80]. Кроме того, была одобрена установка в день химиотерапии нательного инъектора с автоматической доставкой Г-КСФ длительного действия, которая может осуществляться дома в соответствии с установленным графиком [81]. Для снижения риска ФН, связанной с химиотерапией, были разработаны новые агенты с конкурентным или аддитивным действием, такие как ингибитор CDK4/6 трилациклиб. Этот препарат вызывает временную остановку клеточного цикла в фазе G1 у кроветворных стволовых клеток и лимфоцитов, пролиферация которых зависит от CDK4/6, что защищает их от воздействия химиотерапии [82, 83]. Некоторые злокачественные клетки, такие как клетки мелкоклеточного рака легкого, пролиферируют без участия CDK4/6 из-за утраты RB1. Таким образом, у пациентов с этими типами рака трилациклиб, по-видимому, не влияет на эффекты химиотерапии, обеспечивая при этом защиту от нарушений кроветворения [82]. В 2021 году FDA одобрило трилациклиб в качестве первого в своем классе терапевтического средства для снижения частоты миелосупрессии (включая нейтропению, анемию и тромбоцитопению), связанной с некоторыми видами химиотерапии у пациентов с распространенным мелкоклеточным раком легкого. Другим вариантом является плинабулин — низкомолекулярный агент, который избирательно способствует дестабилизации микротрубочек и, благодаря своему влиянию на сигнальный путь JNK, по-видимому, способствует созреванию дендритных клеток и антиген-индуцированной активации Т-клеток, потенциально усиливая противоопухолевый иммунитет [84]. Кроме того, плинабулин может предотвращать ТН за счет увеличения количества гемопоэтических стволовых клеток, при этом предварительные данные свидетельствуют о том же влиянии на ФН, что и у Г-КСФ в виде пегфилграстима, хотя и со снижением сопутствующей боли в костях [85]. Исследование PROTECTIVE-2, представленное в 2020 году, показало, что добавление плинабулина к пегфилграстиму снижает риск ТН в большей степени, чем только пегфилграстим; в результате FDA рассмотрело заявку на регистрацию такой комбинации в приоритетном порядке [86]. Однако 1 декабря 2020 года FDA выпустило полное ответное письмо, содержащее вывод о том, что имеющихся в настоящее время данных о применении плинабулина для профилактики нейтропении, вызванной химиотерапией, недостаточно для одобрения. Также необходимы некоторые знания в других областях, в том числе больше данных о полном влиянии ФН и его осложнений на более уязвимых пациентов, патофизиологии, качестве жизни (КЖ), социальном, поведенческом и физическом функционировании пациентов, факторах зародышевой линии или других молекулярных предикторах, а также (что важно) о том, как адаптировать профилактические меры для уязвимых и/или пожилых пациентов, которые могут подвергаться риску неблагоприятных исходов, несмотря на получение схем противоопухолевого лечения с низким риском [87].
Венозная тромбоэмболия
Проблематика
Онкологические пациенты подвержены повышенному риску венозной тромбоэмболии (ВТЭ), что, в свою очередь, связано с увеличением риска летального исхода и осложнений [88–90], включая легочную гипертензию [91] и посттромботический синдром. Последний встречается примерно у 25–50% пациентов с тромбозом глубоких вен (ТГВ) и характеризуется хронической болью и отеком, которые могут серьезно повлиять на физические функции [92]. Исследование аутопсийных образцов, полученных от пациентов со злокачественными новообразованиями, которое было проведено в 1970-х годах, показало, что ВТЭ является основной (18%) или сопутствующей (43%) причиной смерти [88]. Тем не менее, такие данные редко собирают у пациентов, к которым применяют современные методы борьбы со злокачественными новообразованиями, что затрудняет определение истинного влияния ВТЭ на смертность у онкологических больных в настоящее время. Подобно другим ПЭАХ, ВТЭ отрицательно влияет на проведение противоопухолевой терапии, ухудшает связанное со здоровьем качество жизни и увеличивает расходы на здравоохранение [93]. Патофизиология тромбоза, ассоциированного с онкологическими заболеваниями (ТАОЗ), сложна и включает взаимодействие между факторами, связанными с опухолью, иммунной системой и каскадом свертывания крови, тромбоцитами и стенками кровеносных сосудов [94–96] (рис. 3a,b).
Факторы риска
Ключевые факторы риска ТАОЗ, обычно называемые триадой Вирхова, включают гиперкоагуляцию крови, повреждение эндотелия и венозный стаз [97] (рис. 3а). ТАОЗ отражает многостороннее взаимодействие вышеупомянутых факторов риска ВТЭ, а также факторов, непосредственно связанных с онкологическими заболеваниями и их лечением, и факторов риска со стороны пациента, которые возможно модулировать различными физиологическими и молекулярными биомаркерами (рис. 3c). Онкологические пациенты чаще, чем люди в общей популяции, подвергаются тромбозу из-за многочисленных протромботических стимулов, включая агрессивную природу опухоли — то есть опухоли высокой степени злокачественности и находящиеся на поздних стадии, — а также, вероятно, наличие определенных соматических опухолевых мутаций, а также протромботических изменений клеток зародышевой линии [89, 98–101]. Среди наиболее распространенных солидных опухолей у пациентов с раком поджелудочной железы, желудка и опухолями центральной нервной системы (ЦНС) самый высокий риск ВТЭ, а у пациентов с раком легких, яичников, яичек и уротелия риск промежуточный [102, 103]. Среди лиц с распространенными гематологическими злокачественными новообразованиями наибольший риск наблюдается среди пациентов с множественной миеломой и агрессивными лимфомами. Риск ВТЭ у пациентов с онкологическими заболеваниями в последние десятилетия растет, продолжая увеличиваться при госпитализации, даже с поправкой на количество процедур визуализации, основные сопутствующие заболевания и активную противоопухолевую терапию (включая хирургическое вмешательство, центральные венозные катетеры, химиотерапию, гормональные препараты и некоторые новые таргетные методы лечения) [102, 104–108] (рис. 3c). Пациенты, получающие противоопухолевую химиотерапию, у которых развивается ВТЭ, подвержены большему риску ранней смертности, чем пациенты без ВТЭ, даже после поправки на степень и стадию опухоли, основные сопутствующие заболевания и общее состояние [109, 110]. Использование устройств для венозного доступа, переливания крови и средств поддерживающей терапии, таких как эпоэтин α, также увеличивает риск ВТЭ [104, 111, 112].
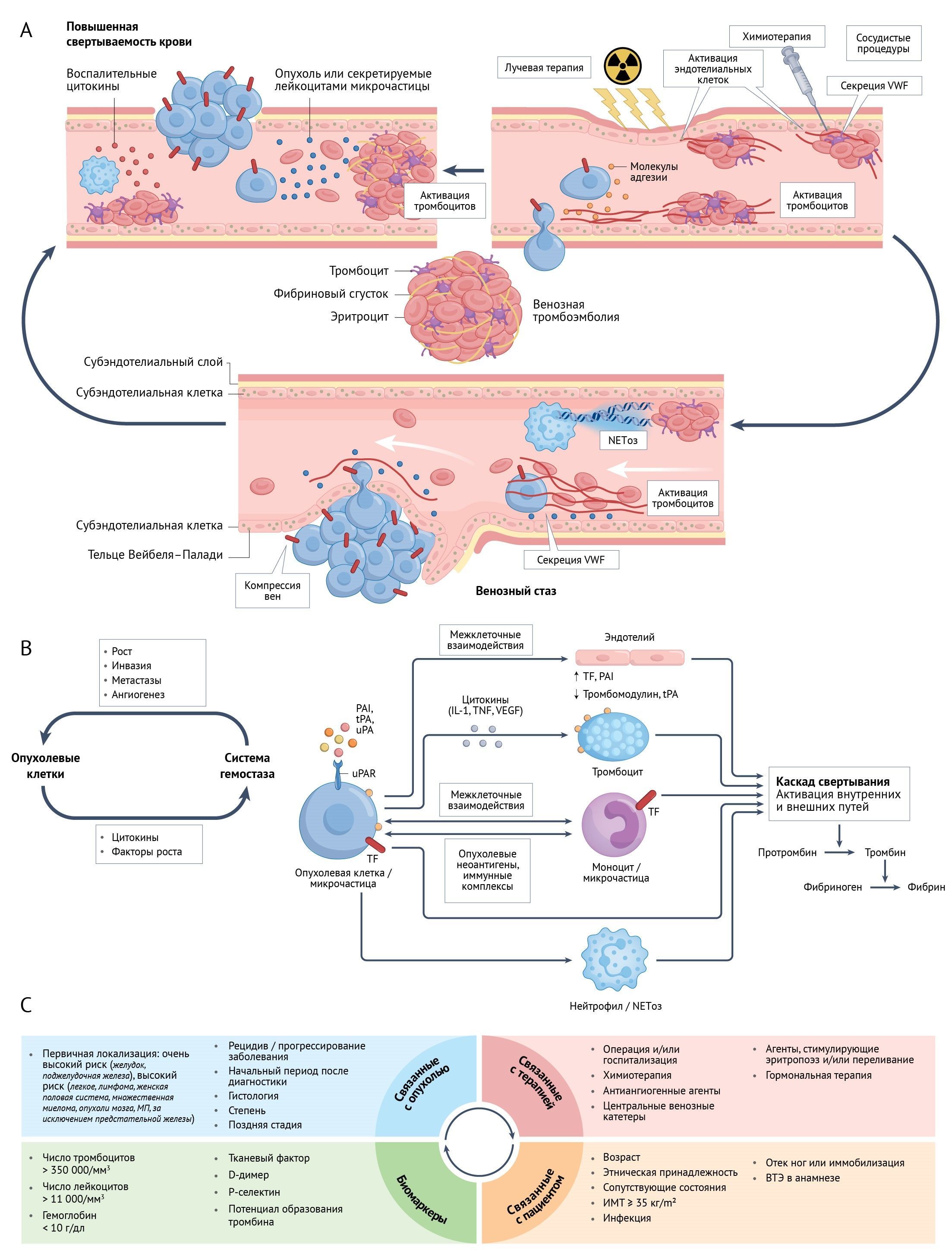
b | Опухолевые клетки способствуют состоянию гиперкоагуляции и активируют систему свертывания с помощью белков клеточной поверхности, таких как тканевой фактор (TF), активатор плазминогена тканевого типа (tPA), активатор плазминогена урокиназного типа (uPA) и ингибиторы активатора плазминогена (PAI) 1 и 2. Взаимодействие с форменными элементами крови и клетками сосудов (такими как моноциты, тромбоциты и эндотелиальные клетки) происходит либо напрямую (межклеточные взаимодействия), либо опосредованно — с помощью выделения цитокинов или микрочастиц, которые прямо или косвенно активируют каскад свертывания через изменения в тромбоцитах, моноцитах, нейтрофилах (активируя нейтрофильные внеклеточные ловушки —NET) или вызывая изменения в эндотелии. В то же время активация системы свертывания (включая опухолевые тромбы, богатые тромбоцитами и фибрином), по-видимому, дополнительно способствует росту опухоли, ангиогенезу и механизмам инвазии в ткани, которые участвуют в образовании метастазов [94–96].
c | Основные известные факторы риска ТАР могут быть связаны с пациентом, опухолью или терапией и сопровождаются потенциальными биомаркерами ТАР, предсказывающими возникновение венозной тромбоэмболии (ВТЭ) у онкологических пациентов [89, 90, 98–112, 246–250]. МП — мочеполовой, NETоз — формирование NET; uPAR — рецептор uPA; VWF — фактор фон Виллебранда. Часть а адаптирована с разрешения [96], Thieme. Часть b адаптирована с разрешения [94, 95], ASCO и Krage.
Шкала Хорана (ШХ) представляет собой многовариантную модель прогнозирования риска ВТЭ у амбулаторных пациентов с солидными опухолями и лимфомами, начинающих новый режим химиотерапии. Эта модель была подтверждена в нескольких РКИ, а также в проспективных и ретроспективных когортных исследованиях с участием более 20 000 пациентов [108, 113–117] (рис. 3c), хотя она не прошла проверку в исследованиях с участием пациентов с раком легкого [118–120]. ШХ основана на типе злокачественной опухоли, высоком индексе массы тела, низком уровне гемоглобина, применении эпоэтина α и повышенном количестве лейкоцитов и/или тромбоцитов в течение двух недель до начала химиотерапии. ШХ была включена в РКП и использовалась для отбора пациентов с промежуточным или высоким риском ВТЭ для включения в РКИ тромбопрофилактических методик [113]. ШК также связана с ранней смертностью у онкологических пациентов, получающих химиотерапию, вне зависимости от ВТЭ [121]. Усилия по дальнейшему улучшению прогностической эффективности ШХ включают введение тестирования на D-димер и, возможно, другие биомаркеры [108, 116, 121, 122]. Впоследствии были разработаны и подтверждены другие модели риска ВТЭ для пациентов с множественной миеломой, получающих иммуномодулирующие препараты [123,124].
Лечение и рекомендации
Для онкологических пациентов доступны различные антикоагулянты как для лечения ВТЭ, так и для профилактики тромбозов. Среди амбулаторных пациентов со злокачественными новообразованими, считающихся подверженными повышенному риску ВТЭ, низкомолекулярные гепарины (НМГ) снижают относительный риск почти на 50%, хотя их среднее значение CAP составляет < 5% [125, 126]. Следует отметить, однако, что в исследованиях с использованием высоких доз тромбопрофилактических препаратов у пациентов с раком поджелудочной железы с высоким риском САР при ВТЭ составляет ~ 10% [125]. Важно, что абсолютное увеличение риска больших кровотечений, наблюдаемое в РКИ НМГ, обычно составляет ≤ 1% для всех подтипов злокачественных новообразований [125]. Метаанализ данных отдельных пациентов подтвердил безопасность и эффективность тромбопрофилактики c применением НМГ у онкологических пациентов [126]. Симптоматическую ВТЭ рутинно лечат у всех пациентов; однако бессимптомная субсегментарная и дистальная ВТЭ без лечения часто вызывает беспокойство у пациентов с опухолями как ранний предвестник образования более серьезных тромбов. Действительно, онкологические заболевания и их лечение редко являются преходящими протромботическими стимулами и часто персистируют после острого события, еще больше увеличивая количество тромбов даже во время терапии, направленной на ТАОЗ.
В нескольких РКИ тромбопрофилактических подходов использовали ШХ для отбора онкологических пациентов с повышенным риском ВТЭ (рис. 3с). Вышеупомянутый метаанализ показал безопасность и эффективность тромбопрофилактики с помощью НМГ у пациентов с высоким риском по ШХ, что впоследствии было подтверждено в ретроспективном анализе данных проспективных РКИ [126, 127]. ШХ также использовалась для отбора амбулаторных онкологических пациентов с высоким риском ВТЭ, получающих системную противоопухолевую терапию, в двух крупных РКИ, оценивающих тромбопрофилактику с помощью низких доз пероральных антикоагулянтов прямого действия (ПОАК) [128, 129]. В испытании CASSINI пациенты с ШХ ≥ 2 были рандомизированы в группы, получавшие ПОАК ривароксабан, и плацебо [129]. Для включения в испытание требовался базовый скрининг на основе ультразвукового исследования, что привело к выявлению 49 пациентов (~ 5% исследуемой когорты) с клинически невыявленным ТГВ. Интересно, что у некоторых пациентов с обнаруженной при скрининге, но не выявленной клинически ВТЭ, присутствовали многочисленные тромбы, в том числе двусторонний проксимальный ТГВ крупных вен; таким образом, эти пациенты не подходили для рандомизации [129]. Испытание APERT ПОАК апиксабана имело почти идентичный дизайн без требования исходного скрининга ВТЭ, что частично объясняет более высокую частоту симптоматической ВТЭ, наблюдаемую в контрольной группе [128]. В совокупности эти два РКИ с участием пациентов с высоким риском, проходящих химиотерапию, продемонстрировали снижение относительного риска ВТЭ на 44% (ОР 0,56) у тех, кто профилактически получал ПОАК, по сравнению с плацебо [130]. Объединенное САР для ВТЭ в обоих исследованиях составило 3,3% и 6% у пациентов с ШХ 2 (высокий риск) и ≥ 3 (очень высокий риск), соответственно, без значительного увеличения абсолютного риска одновременного большого кровотечения (1% по сравнению с 1,4%) [130].
Рекомендации, предложенные в РКП профессиональными организациями, последовательно согласуются в аспектах, включая использование подтвержденной оценки риска для выявления амбулаторных пациентов с онкологическими заболеваниями с благоприятным соотношением риска и пользы профилактики тромбообразования. РКП ASCO рекомендует проводить профилактику с помощью НМГ или ПОАК у амбулаторных пациентов с высоким или очень высоким риском ВТЭ и отсутствием противопоказаний к антикоагулянтной терапии или вероятного лекарственного взаимодействия [131]. РКП Американского общества гематологов рекомендуют тромбопрофилактику с помощью НМГ или ПОАК апиксабана и ривароксабана у амбулаторных онкологических пациентов, получающих химиотерапию, с очень высоким риском ВТЭ, и либо отсутствие тромбопрофилактики, либо профилактику с помощью ПОАК для пациентов с высоким риском [132]. Согласно текущим РКП, пациенты с низким риском ВТЭ или с риском крупных кровотечений не должны получать рутинную тромбопрофилактику.
РКП также рекомендуют постоянно оценивать пациентов с онкологическими заболеваниями на предмет риска как ВТЭ, так и крупных кровотечений, а также обсуждать связанные с этим преимущества и недостатки тромбопрофилактики. Учитывая важность ранней диагностики, пациенты также должны быть проинформированы о симптомах и признаках ВТЭ и сообщать о любых изменениях симптомов или признаках кровотечения.
Инновационные стратегии
Несмотря на вышеупомянутые рекомендации, необходимы дополнительные данные о безопасности и эффективности ПОАК в реальных условиях у онкологических пациентов с серьезными сопутствующими заболеваниями и потенциальными лекарственными взаимодействиями [133]. Также ожидаются данные текущих исследований новых антикоагулянтов с пониженным риском кровотечения, направленных на дальнейшее улучшение соотношения риска и пользы. Кроме того, оцениваются новые биомаркеры ВТЭ и геморрагических осложнений для повышения эффективности выявления пациентов с высоким риском и, таким образом, обеспечения расширенной индивидуальной тромбопрофилактики. Тестирование на D-димер может помочь в дальнейшем улучшении стратификации риска, но стандартизация этого анализа в медицинских учреждениях остается сложной задачей [122]. Оптимальный мониторинг влияния на жизненные функции, качество жизни и результаты лечения, о которых сообщают пациенты, наряду с персонализированным скринингом ВТЭ и соблюдением РКП обещают дальнейшее снижение заболеваемости и, возможно, смертности, связанной с ВТЭ.
Тошнота и рвота
Проблематика
Тошнота и рвота, вызванные химиотерапией (ТРВХ), — одни из самых неприятных и изнуряющих ПЭАХ, что напрямую влияет на качество жизни пациентов и их готовность продолжать противоопухолевую химиотерапию. ТРВХ могут привести к серьезным метаболическим нарушениям, недоеданию и слабости, а также к раннему прекращению эффективной системной терапии злокачественных новообразований. Результаттом плохо контролируемых ТРВХ часто становится повышение частоты незапланированных посещений клиник и отделений неотложной помощи, а также увеличение потребности во внутривенной гидратации и госпитализации с соответствующим повышением расходов на со стороны системы здравоохранения [134].
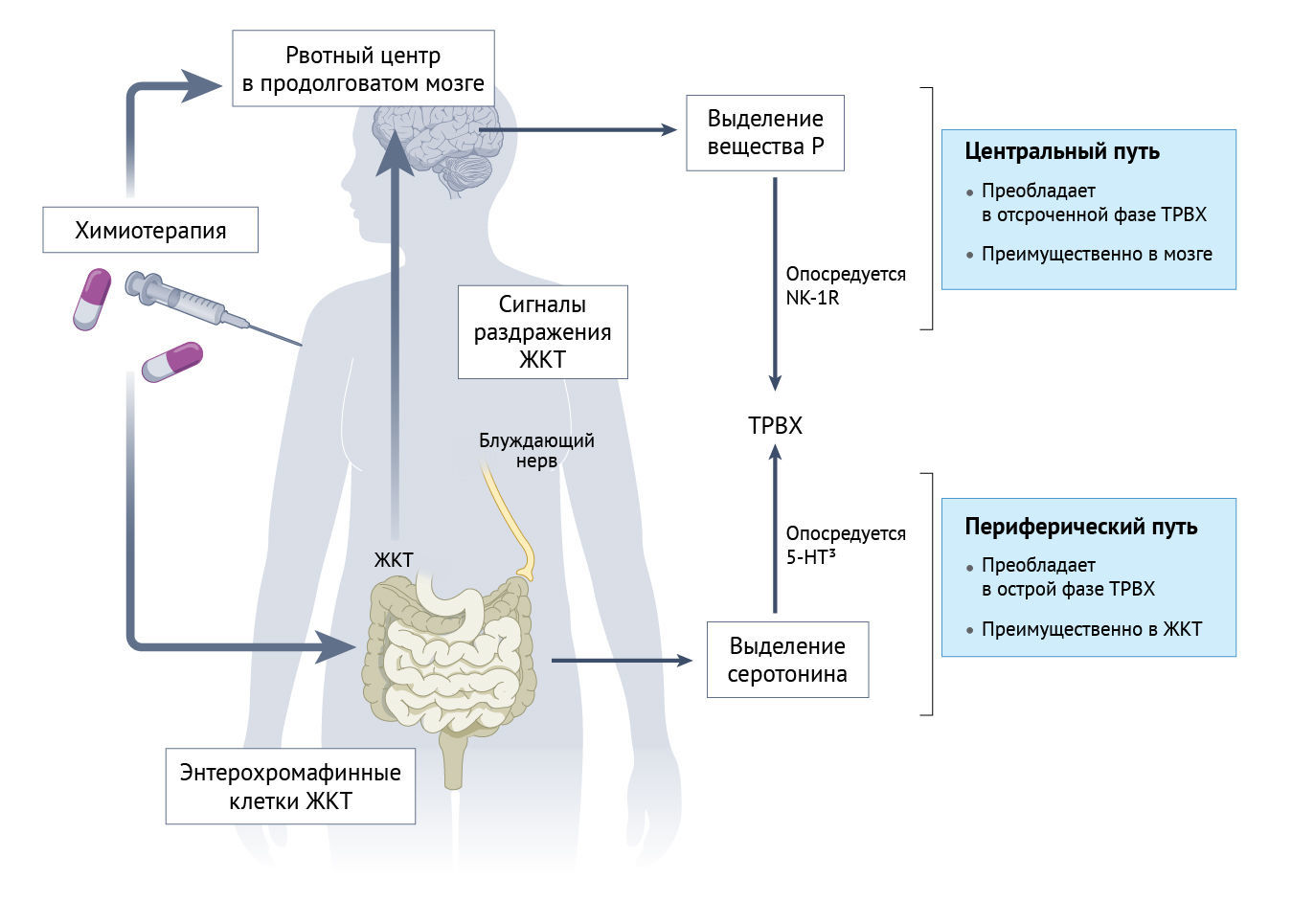
Тошнота опосредуется вегетативной нервной системой. Рвота возникает в результате стимуляции хеморецепторной триггерной зоны в головном мозге и дополнительно модулируется стимулами коры головного мозга и лимбической системы в ответ на ряд внешних, физических и эмоциональных стрессоров, передаваемых через блуждающий нерв и спинномозговые симпатические нервы [135, 136] (рис. 4). Активация многочисленных путей, стимулирующих хеморецепторную триггерную зону и рвотный центр, приводит к выделению нейромедиаторов, запускающих рвотную реакцию, которая сильно варьирует у разных людей в зависимости от эметогенного стимула [137]. Риск острых ТРВХ (т. е. возникающих в течение 24 часов после химиотерапии) значительно варьируется в зависимости от эметогенного потенциала вводимых химиотерапевтических средств, что иногда приводит к раннему прекращению потенциально эффективного противоопухолевого лечения. Считается, что в острой фазе ТРВХ участвует периферический путь, который индуцирует выделение серотонина (или 5-гидрокситриптамина (5-HT)) энтерохромаффинными клетками в желудочно-кишечном тракте и, как следствие, вагусный эффект в стволе мозга при связывании серотонина с соответствующими рецепторами подгруппы 5-HT3 [138, 139]. Отсроченные ТРВХ обычно возникают через 2–5 дней после химиотерапии и часто связаны с длительным применением алкилирующих агентов, таких как цисплатин, циклофосфамид, ифосфамид и антрациклины. Считается, что отсроченная фаза ТРВХ является результатом серотониновой сенсибилизации блуждающего нерва к нейропептиду (веществу P), которое связывается с NK-1R, и последующей стимуляции блуждающего нерва в области рвотного центра [136–138] (рис. 4).
Факторы риска
Тяжесть, время появления и продолжительность симптомов ТРВХ значительно различаются между отдельными пациентами в зависимости от типа химиотерапевтических агентов. Пациенты с плохим контролем ТРВХ в предшествующей химиотерапии подвергаются наибольшему риску в последующих циклах той же схемы. ТРВХ чаще встречаются у молодых людей (младше 60 лет), у женщин с утренним недомоганием во время беременности в анамнезе, а также у лиц, в анамнезе которых были укачивание или тревожность [138–140]. Дополнительные факторы риска включают нарушение баланса жидкости и электролитов, обезвоживание, недоедание, серьезные инфекции, уремию и инвазию опухоли в желудочно-кишечный тракт, печень или ЦНС [138]. Помимо химиотерапии, ТРВХ могут усугублять опиоиды, алкоголь и сопутствующие заболевания, такие как сердечно-сосудистые заболевания, сахарный диабет, желудочно-кишечные расстройства, нарушения опорно-двигательного аппарата и щитовидной железы [141], а также недавнее хирургическое вмешательство или лучевая терапия в течение 4–6 недель.
Лечение и рекомендации
Определение путей, задействованных в ТРВХ, помогло в выборе и определении сроков профилактического применения противорвотных средств [136–138] (рис. 4). Антагонисты 5-HT3, такие как ондансетрон и гранисетрон, используются в первую очередь для предотвращения острых ТРВХ, тогда как антагонисты NK-1R, такие как фосапрепитант, эффективны для уменьшения отсроченных ТРВХ. Антипсихотический препарат оланзапин обладает большей аффинностью к 5-HT2A-рецепторам серотонина, чем к D2-дофаминовым рецепторам, и показал дополнительную эффективность в контроле рвоты при добавлении к вышеуказанным агентам у пациентов с высоким риском ТРВХ. Из-за влияния воспаления на риск и тяжесть ТРВХ к противорвотным средствам практически при всех уровнях риска часто добавляют дексаметазон [140].
ТРВХ, на которые не действуют противорвотные средства, считаются рефрактерными. Упреждающая тошнота или рвота перед последующими циклами химиотерапии могут возникать у пациентов, перенесших ТРВХ в предыдущих циклах лечения, и представляют собой результат действия условных раздражителей, связанных с процессом лечения или местом его проведения. Таким образом, трудно переоценить важность обеспечения эффективного контроля ТРВХ с самого начала эметогенной химиотерапии для снижения риска в последующих циклах и устранения предшествующих неприятных симптомов [141]. Эффективный профилактический контроль ТРВХ также способствует продолжению режима химиотерапии в соответствии с графиком [142]. Прорывом ТРВХ называют состояние, при котором симптомы сохраняются, несмотря на несколько дней профилактического приема противорвотных средств; оно требует применения препаратов резервной терапии, обсуждаемых ниже. Наконец, хроническая тошнота и рвота вне курса химиотерапии у онкологических пациентов могут быть идиопатическими или иметь различную этиологию (со стороны ЦНС, желудочно-кишечного тракта, метаболических или вызываться лекарственными препаратами или облучением) [143, 144].
Для снижения частоты и тяжести тошноты и рвоты в настоящее время доступен ряд новых противорвотных препаратов и их комбинаций. РКП от ASCO, MASCC и NCCN классифицируют химиотерапевтические препараты на основе связанного с ними риска ТРВХ, который может быть высоким (> 90%), средним (30–90%), низким (10–30%) или минимальным (< 10%) [143, 144]. Область применения противорвотной терапии для взрослых, получающих комбинированные схемы химиотерапии, должна быть скорректирована в соответствии с противоопухолевым препаратом с наибольшим риском рвоты. Взрослым, получающим химиотерапию с высоким риском рвоты, рекомендована комбинация из четырех препаратов, включающая антагонист NK-1R, антагонист 5-HT3, дексаметазон и оланзапин, причем прием последних двух препаратов следует продолжать в течение 2–4 дней [143]. Для тех, кто получает терапию противоопухолевыми препаратами со средним риском рвоты, рекомендуется комбинация антагониста 5-HT3 и дексаметазона в первый день; для пациентов, получающих схемы, которые вызывают отсроченную тошноту и рвоту, прием дексаметазона продолжается на второй и третий дни. Для тех, кто получает терапию противоопухолевыми препаратами с низким риском рвоты, рекомендуется однократная доза антагониста 5-HT3 или 8 мг дексаметазона до начала химиотерапии. Наконец, противорвотная профилактика не рекомендуется для взрослых, получающих противоопухолевые препараты с минимальным риском рвоты. Кортикостероиды эффективны либо в качестве монотерапии при низкоэметогенной химиотерапии, либо в сочетании с многокомпонентными комбинированными противорвотными схемами при умеренно- или высокоэметогенной химиотерапии. Рекомендация для пациентов с прорывом ТРВХ заключается в добавлении к стандартной химиотерапии оланзапина или агента другого класса. Текущие данные о медицинских каннабиноидах и других альтернативных методах лечения (таких как добавки на основе имбиря или иглоукалывание) для лечения ТРВХ недостаточны для того, чтобы рекомендовать их рутинное применение. Необходима дальнейшая разработка эффективных и безопасных противорвотных средств наряду с дальнейшими усилиями по более персонализированному мониторингу пациентов с риском ТРВХ.
Диарея
Проблематика
Диарея, связанная с химиотерапией (ДСХ), является еще одним частым ПЭАХ со стороны желудочно-кишечного тракта, возникающим у 50–80% пациентов, получающих фторпиримидины (такие как 5-фторурацил или капецитабин) или иринотекан [145–148]; реже у тех, кто получает антиметаболиты, алкилирующие агенты или таксаны [149]. ДСХ также часто встречается у пациентов с нейроэндокринными опухолями и у тех, кто подвергается процедуре трансплантации костного мозга [150]. Фторпиримидины, пеметрексед, иринотекан и кабазитаксел часто вызывают острую ДСХ (в течение 24 ч) в результате холинергически опосредованного повреждения слизистой оболочки кишечника. Это приводит к секреторной диарее, а также к потенциальному снижению экспрессии лактазы, и, как следствие — к непереносимости лактозы и осмотической диарее [145, 146, 151]. Помимо этого, иринотекан может вызывать отсроченную диарею (спустя 24 ч) с компонентом экссудата; такая диарея может быть тяжелой [152, 153].
Лечение и рекомендации
Вследствие потенциально опасных для жизни эффектов ДСХ ее диагностика у пациентов, получающих химиотерапию, имеет решающее значение. В соответствии с критериями общей терминологии для нежелательных явлений Национального института рака (NCI CTCAE) версии 5.0 ДСХ классифицируется на основе частоты стула и признаков потенциально серьезных осложнений. Пациентов следует расспрашивать о частоте и консистенции стула, о других признаках и симптомах ДСХ (таких как тошнота или рвота и спазмы в животе), а также о симптомах, связанных с инфекциями, нейтропенией, лихорадкой, гипотензией и обезвоживанием (такими как головокружение и ортостаз), которые повышают риск летальных осложнений [145]. Для снижения числа более серьезных осложнений и обеспечения возможности продолжения рекомендованной химиотерапии необходимы просвещение и тщательный мониторинг пациентов с ранней медицинской помощью в случае возникновения симптомов.
ДСВ низкой (≤ 2) степени тяжести и без осложнений обычно лечится путем устранения потенциальных провоцирующих факторов или лекарств, изменения диеты и, при необходимости, приема противодиарейных средств [145]. Рекомендуется избегать продуктов, которые могут усугубить ДСВ; также можно использовать пероральную регидратацию, если она хорошо переносится, или внутривенную гидратацию при наличии показаний. Может быть полезна специальная диета (включая бананы, рис, яблочное пюре и тосты, — такая диета известна как BRAT) [147].
Тяжелая ДСВ включает диарею третьей (≥ 7 раз в день) или четвертой степени (которая имеет потенциально опасные для жизни последствия, требующие госпитализации для восполнения жидкости и электролитов и клинической стабилизации) [145–147]. Такая ДСХ может потребовать изменения схемы химиотерапии, включая снижение дозы, отсрочку лечения или возможное его прекращение. Лабораторные исследования должны включать общий анализ крови [154], панель электролитов сыворотки, посев крови и кала, окрашивание фекальных лейкоцитов и тестирование на Clostridioides difficile [145, 146, 155]. К часто встречающимся патогенам относятся энтерогеморрагическая кишечная палочка, Entamoeba histolytica и шига-токсин [145–147]. Пациентов с лейкозом, проходящих индукционную химиотерапию, и пациентов с другими видами злокачественных новообразований после трансплантации гемопоэтических стволовых клеток (ТГСК), а также пациентов с желудочно-кишечными симптомами после высокодозной химиотерапии следует проверять на нейтропенический некротизирующий энтероколит [156]. Пациентам с ФН и болью в животе, перитонеальными симптомами и/или диареей с кровью требуется КТ брюшной полости и таза, а также хирургическая консультация для обеспечения неотложной терапии этого потенциально летального осложнения [145–147].
В случае исключения инфекционной этиологии при неосложненной ДСХ 1–2 степеней тяжести наиболее часто используемым опиоидом является лоперамид в низких дозах. При более тяжелых или резистентных к лоперамиду ДСХ все чаще применяются противосекреторные препараты, в том числе ингибиторы простагландинов в слизистых оболочках (такие как аналог соматостатина октреотид) [146, 157]. Острая ДСХ, связанная с иринотеканом, возникает в результате острого избытка ацетилхолина; в этом случае полезным может быть использование агониста атропина. Антибиотики широкого спектра действия применяются у пациентов с лихорадкой, нейтропенией, гипотензией, перитонеальными симптомами или диареей с кровью до тех пор, пока не будет диагностирована специфическая инфекция. Пациентам с хронической ДСХ следует проводить эндоскопический осмотр [145–147, 160]. Несмотря на прогресс в профилактике и лечении ДСХ, пациентам как с острой, так и с отсроченной ДСХ нужны дополнительные терапевтические возможности, а клиницистам — более эффективные способы выявления лиц с высоким риском этого потенциально серьезного ПЭАХ.
Мукозит, связанный с химиотерапией
Проблематика
Мукозит и эзофагит определяются как воспалительные и язвенные процессы, поражающие слизистые оболочки полости рта и желудочно-кишечного тракта, соответственно. Хотя у онкологических пациентов этим процессам могут способствовать инфекции, иммунодефицит и прием сопутствующих лекарственных препаратов, наиболее распространенными причинными факторами являются высокодозная химиотерапия рака и лучевая терапия. Мукозит, ассоциированный со злокачественными новообразованиями (МАЗН), обычно сопровождает более интенсивные схемы химиотерапии, часто используемые для пациентов с гематологическими опухолями, химиолучевую терапию, часто применяемую при раке головы и шеи, и схемы абляции костного мозга, проводимые до трансплантации кроветворных стволовых клеток (ТКСК) [161].
Предполагается, что большинство химиотерапевтических агентов вызывают МАЗН благодаря своим цитотоксическим эффектам с механизмом, подобным тому, что приводит к миелосупрессии. Тем не менее, патобиология лежащего в основе повреждения сложна и проявляется в виде ряда событий: инициации повреждения химиотерапией и/или лучевой терапией, активации и выделения сигнальных молекул и провоспалительных цитокинов, а также активации сигнальных путей и усиления повреждения через петли обратной связи, приводящие к воспалению и изъязвлению слизистой оболочки [161–164] (рис. 5).
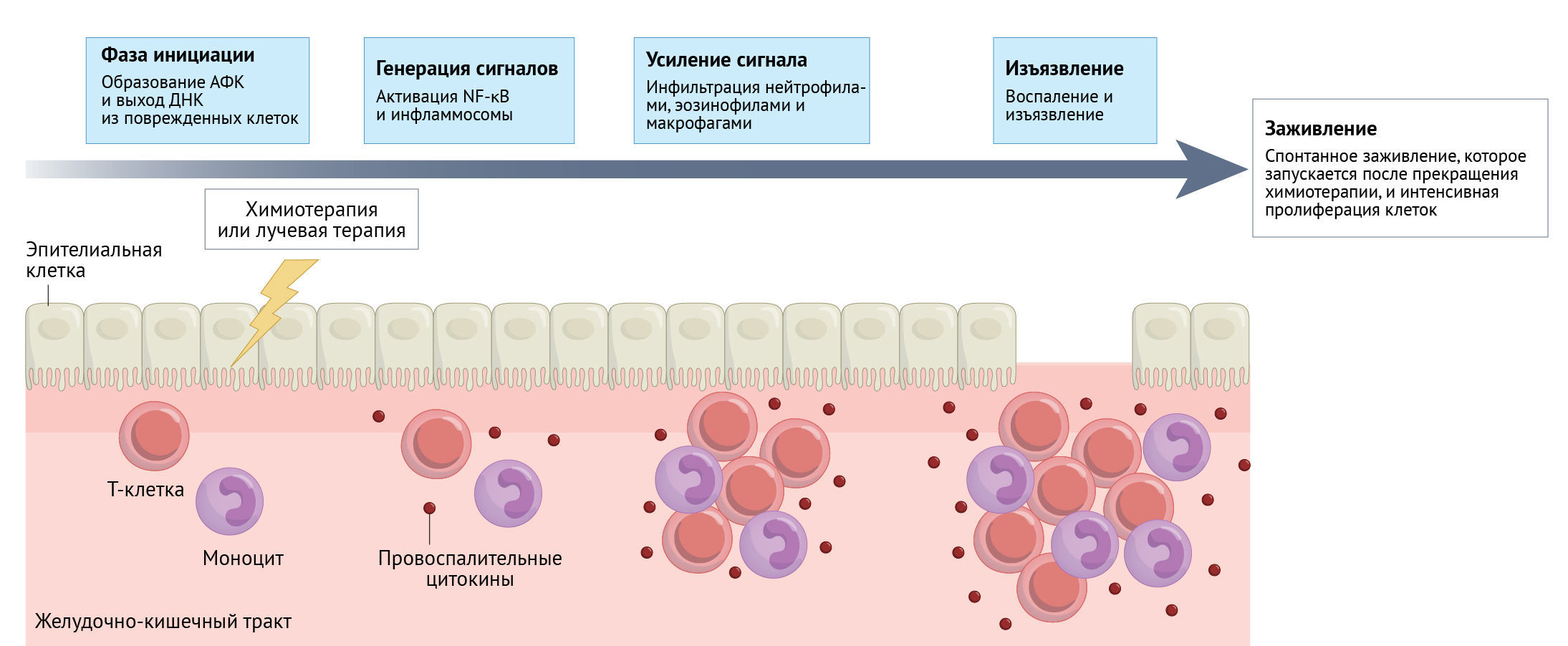
Обычно МАЗН возникает вскоре после начала терапии — в течение 3–5 дней, достигает пика примерно на седьмой день и затем начинает разрешаться, завершаясь полным заживлением в течение 10–14 дней одновременно с восстановлением абсолютного числа нейтрофилов [161–163, 165]. Клинически мукозит начинается с эритемы мягких тканей с ощущением жжения во рту и последующим развитием одиночных приподнятых белых пятен десквамации, за которым следует отторжением эпителия, что приводит к множественным неглубоким изъязвлениям. У пациентов с сопутствующей нейтропенией эрозивный мукозит может осложняться вторичной инфекцией и сепсисом.
NCI CTCAE v5.0 [166] оценивает тяжесть МАЗН по шкале от 1 до 5 на основе клинических данных и симптоматики. Другие шкалы включают шкалу оральной токсичности ВОЗ [167] и шкалу оценки пероральной токсичности университета Небраски, которая была проспективно оценена у пациентов, проходящих курс высокодозной химиотерапии или ТКСК [168]. Специализированные, ориентированные на пациентов инструменты оценки симптомов включают Шкалу оценки орального мукозита, разработанную Группой по изучению мукозита [169], и Шкалу симптомов орального мукозита на основе опроса пациентов [170]; обе они одобрены для пациентов со злокачественными новообразованиями.
Факторы риска
На степень и тяжесть МАЗН могут влиять различные факторы, в том числе конкретный агент, доза и график введения. Кроме того, индивидуальная переносимость у пациентов может зависеть от генетических вариантов, участвующих в путях метаболизма лекарств, иммунном сигналинге и механизмах повреждения и восстановления клеток [171]. Химиотерапевтические препараты различных классов могут вызывать мукозит и эзофагит. К ним относятся, помимо прочего, цитотоксические агенты, такие как цитарабин, доксорубицин, этопозид, мелфалан и метотрексат, а также новые агенты с молекулярной направленностью, такие как VEGFR, mTOR, CDK4/6, ингибиторы PARP или EGFR [172,173].
Лечение и рекомендации
Различные подходы криотерапии (такие как сосание кусочков льда до, во время и/или после быстрых инфузий при системной химиотерапии) показали эффективность для профилактики оральной МАЗН, особенно у пациентов со множественной миеломой, получающих мелфалан, и у пациентов с солидными опухолями, получающих 5-фторурацил [174, 175]. Палифермин, рекомбинантная форма FGF7 [176], был протестирован в III фазе клинических испытаний с участием пациентов, перенесших аутологичную ТКСК с облучением всего тела. Частота мукозита 3–4 степени составила 63% и 98% при применении палифермина и плацебо, соответственно, а средняя продолжительность составила шесть и девять дней, соответственно [177]. На основании этих результатов FDA одобрило применение палифермина для снижения частоты и тяжести тяжелого орального МАЗН у пациентов с гематологическими злокачественными новообразованиями, получающих миелотоксическую терапию, требующую ТКСК. Кокрановский метаанализ пяти РКИ, проведенный MASCC, позволяет сделать вывод, что палифермин эффективен для предотвращения перорального МАЗН у пациентов, перенесших аутологичную ТКСК, которая включала облучение всего тела [178]. Имеющиеся в настоящее время данные плацебо-контролируемого РКИ с участием пациентов, перенесших аутологичную ТКСК без облучения всего тела, указывают на отсутствие положительного эффекта [179]. Палифермин продемонстрировал эффективность в профилактике мукозита ≥ 2 степени, связанного с 5-фторурацилом (частота в цикле 1: 29% по сравнению с 61% в группе плацебо), но в целом он не используется широко из-за его очень высокой стоимости [180].
Фотобиомодуляция с помощью внутриротового гелий-неонового лазера — вариант низкоинтенсивной лазерной терапии — является еще одним потенциальным вариантом лечения МАЗН у пациентов, проходящих кондиционирующую терапию для ТКСК [181]. Фотобиомодуляция рекомендуется в согласованных РКП от MASCC и ESMO для снижения частоты перорального МАЗН у пациентов, проходящих режим кондиционирования перед ТКСК [182, 183]. Кроме того, РКП от MASCC рекомендует фотобиомодуляцию для предотвращения ассоциированного с терапией МАЗН у пациентов с раком головы и шеи, которые проходят лучевую терапию совместно с химиотерапией или без нее [182]. Было показано, что многие другие препараты, включая сукральфат, аллопуринол, глютамин и витамин Е, неэффективны по сравнению с плацебо [184]. В случае вызванного облучением эзофагита пользы от различных препаратов, в том числе сукральфата и амифостина, обнаружено не было [185, 186].
Пациенты с установленным МАЗН получают поддерживающую терапию, в которую входит хороший уход за полостью рта (включая полоскание физиологическим раствором и/или растворами бикарбоната натрия) и местное или системное обезболивание. Качественная гигиена полости рта эффективна. Рекомендуется изменение рациона с ограничением кислых, соленых и/или сухих продуктов, и тех, которые требуют тщательного пережевывания. Были исследованы различные растворы для полоскания рта для паллиативного лечения мукозита. РКИ трех различных растворов для полоскания рта, включая соль и соду, хлоргексидин и «волшебную жидкость для полоскания рта» (лидокаин, дифенгидрамин, гидроксид алюминия и гидроксид магния), не выявили различий в их способности уменьшать симптомы МАЗН в течение 12 дней [187]. Кроме того, в систематическом обзоре не было найдено никаких доказательных данных в пользу применения «волшебной жидкости» для лечения орального мукозита [188–190]. Учитывая сравнимую эффективность различных растворов для полоскания рта, обычно предпочтение отдается наименее дорогостоящему составу на основе соли и соды [191]. Наконец, во II фазе испытаний частота стоматита ≥ 2 степени, связанного с эверолимусом и экземестаном, у пациенток с гормональным HER2-отрицательным раком молочной железы с метастазами, применявших раствор для полоскания рта на основе дексаметазона, составила 2%, что значительно ниже, чем было показано в ходе ретроспективного когортного исследования (33%) [192].
Для уменьшения боли, связанной с МАЗН, используют как местные, так и системные анальгетики. Растворы лидокаина для местного введения облегчают боль, но требуют частого применения [193]. Хотя местное использование доксепина — трициклического антидепрессанта — может обеспечить клинически значимое облегчение вызываемой МАЗН боли, в обновленном систематическом обзоре его общая эффективность не подтверждается [182, 194, 195, 194, 195]. Местные аппликации сульфата морфина могут уменьшить продолжительность и интенсивность боли во рту, связанной с МАЗН [196], хотя при сильной боли может быть предпочтительным чрескожное и парентеральное введение. В прочих случаях в рамках первой линии рекомендуется парентеральное контролируемое пациентом обезболивание морфином [197]. Еще одним вариантом, который подходит для пациентов, не способных глотать, является чрескожное введение фентанила. Исследования ряда других методов лечения (включая средства, защищающие слизистую оболочку, глицерилдиолеат, образующий биоадгезивный барьер, каолин-пектин для местного применения, пероральные антациды, сукральфат и витамин Е) не продемонстрировали явной эффективности [198].
Кожные реакции
Помимо изменений слизистой, химиотерапия может значительно повлиять на кожу, ногти, язык, конъюнктиву и волосяной покров [199, 200]. Другие факторы, которые способствуют кожным изменениям, включают сопутствующие лекарственные препараты и инфекции, а также паранеопластические эффекты самой опухоли.
Экзантематозные высыпания
Экзантематозные и эритематозные высыпания, связанные с противоопухолевой химиотерапией, включают широкий спектр состояний, таких как макулопапулезная, диффузная эритема, эксфолиативный дерматит, фиксированные лекарственные реакции и даже подострую кожную красную волчанку, склеродермоподобные изменения, дерматомиозит и синдромы Шегрена и Рейно. Часто вызывают раздражение такие агенты, как флударабин, гемцитабин, цитарабин и пеметрексед [201, 202].
Изменения пигментации
Доброкачественные изменения пигментации наблюдаются при применении практически всех химиотерапевтических препаратов, чаще всего — алкилирующих агентов и противоопухолевых антибиотиков [203–206]. Усиление пигментации кожи обычно, хоть и не всегда, со временем проходит после прекращения приема препарата, хотя изменения ногтей и слизистой иногда могут сохраняться в течение многих лет. Изменение цвета волос может происходить в сторону более светлых, рыжих или более темных оттенков, что иногда создает полосы разных цветов (это явление часто называют «знаком флага»). Помимо влияния на цвет волос пигментные изменения могут быть локальными или змеевидными (по ходу основной вены). С изменениями пигментации обычно связаны такие химиотерапевтические агенты, как 5-фторурацил, бусульфан, гидроксимочевина, винорелбин, метотрексат и прокарбазин.
Тяжелые кожные лекарственные реакции
Хотя практически любое химиотерапевтическое средство может вызывать кожные реакции, большинство из них являются легкими или умеренными (степень ≤ 2) и имеют неиммунологическую природу. В редких случаях могут появляться иммуноопосредованные и более тяжелые (степень ≥ 3) реакции гиперчувствительности (включая анафилаксию), которые опосредованы IgE или представляют собой реакции гиперчувствительности типа III–IV. Наиболее тяжелыми кожными реакциями являются синдром Стивена–Джонсона / токсический эпидермальный некролиз и эозинофилия, а также системные симптомы, которые встречаются редко, но потенциально опасны для жизни и характеризуются обширным некрозом и отслойкой эпидермиса [207–209]. Чтобы избежать летальных осложнений, пациенты с такими ПЭАХ в дальнейшем никогда не должны подвергаться воздействию препарата, вызывающего эти реакции. Факторы риска недостаточно охарактеризованы, но ему может способствовать одновременное применение других препаратов или само злокачественное новообразование.
Фоточувствительность и радиационный дерматит в ранее облученной области
При применении определенных химиотерапевтических препаратов ранее облученная или подвергавшаяся интенсивному воздействию солнца кожа может впоследствии испытывать воспалительную реакцию; в ответ на облучение или дозу химиотерапии может возникать радиационный дерматит. Известно, что многие химиотерапевтические агенты повышают фоточувствительность к ультрафиолетовому излучению. К обычным сенситизирующим химиотерапевтическим препаратам относятся метотрексат, 5-фторурацил и дакарбазин. Также известно, что некоторые агенты, такие как гемцитабин, метотрексат, доцетаксел, этопозид и доксорубицин, вызывают реакции на участках кожи, ранее подвергавшихся лучевой терапии или интенсивной инсоляции. Местное применение стероидов может уменьшить воспаление, хотя первой рекомендацией является сведение к минимуму инсоляции [200, 210]. Часто результатом этих событий становится резкое выделение участков кожи, подвергающихся воздействию солнца, и в некоторых случаях для подтверждения диагноза необходима фото-аппликационная проба. Фоточувствительность может проявляться как фотоаллергическая реакция, эритема на месте предыдущего солнечного ожога (так называемое фотоусиление) и может напоминать распространенный солнечный ожог, в том числе сильное покраснение и образование волдырей.
Заболевания ногтей
Через несколько недель после воздействия различных химиотерапевтических агентов, сходных с теми, которые вызывают пигментацию кожи или слизистых оболочек, может возникать гиперпигментация ногтевого ложа или пластинки [211]. Другие распространенные неспецифические доброкачественные поражения ногтей включают линии Бо и отслойку ногтя (онихолизис), вызванные повреждениями ногтевого ложа [212]. Несколько исследований с участием небольших когорт предполагают, что профилактическое использование замороженных носков или перчаток может уменьшить эти ПЭАХ, но вызванный этим дискомфорт и опасения по поводу ослабления химиотерапевтического воздействия ограничивают их применение на практике [213, 214]. Болезненное воспаление ногтевых валиков (паронихия), которое может быть экссудативным и прогрессировать до гнойных инфекций и абсцессов, чаще всего наблюдается при применении паклитаксела и доцетаксела [199].
Ладонно-подошвенный синдром
Акральная эритема, более известная как ладонно-подошвенный синдром, является частым побочным эффектом нескольких противоопухолевых препаратов, включая цитарабин, доцетаксел, винорелбин и фторпиримидины, такие как капецитабин [215, 216]. Патофизиология ладонно-подошвенного синдрома изучена недостаточно. Пациенты часто испытывают сильную боль, ограничивающую рутинную деятельность, такую как ходьба и захват предметов. В дополнение к снижению дозы химиотерапии и ее отсрочке возможные варианты профилактики и лечения включают смягчающие средства, местное применение стероидов, уход за ранами и местное применение кремов с 10% мочевиной [217]. Ладонно-подошвенный синдром обычно проходит в течение одного месяца после прекращения лечения [215].
Алопеция
Облысение, связанное с химиотерапией, является распространенным явлением, и хотя оно не представляет серьезной угрозы для пациентов, оно может быть разрушительным в эмоциональном и социальном плане, даже вызывая у некоторых пациентов отказ от лечения или его досрочное прекращение [218, 219]. Несмотря на то, что алопеция, как правило, обратима, восстановление быстро делящихся кератиноцитов волосяного фолликула может занять от нескольких месяцев до нескольких лет. Факторы риска алопеции связаны с типом, интенсивностью химиотерапии и комбинацией препаратов, при этом еженедельные режимы химиотерапии вызывают в основном истончение волос, а не полное их выпадение. Иногда алопеция может быть длительной и даже постоянной — особенно при приеме доцетаксела (в дозах ≥ 75 мг/м2) и, в меньшей степени, при приеме паклитаксела [220–222]. Сообщалось, что волосы лиц афроамериканской или азиатской национальности имеют разную скорость роста и восстановления, хотя данных о частоте алопеции, скорости повторного роста или пользе профилактических мер у получающих химиотерапию онкологических пациентов в зависимости от расовой принадлежности недостаточно.
Возможности в некоторой степени скомпенсировать проблему, такие как ношение париков, шляп, повязок или применение охлаждающих устройств, следует обсудить с пациентами перед химиотерапией. Несколько автоматических устройств для охлаждения кожи головы в настоящее время одобрены FDA. Однако опасения, что охлаждение кожи головы может оказывать защитное действие на опухолевые клетки, не подтвердились в небольших нерандомизированных исследованиях [226]. Во многом из-за нехватки данных эти устройства не рекомендуются пациентам, получающим лечение от гематологических злокачественных новообразований, а также пациентам, перенесшим трансплантацию костного мозга и стволовых клеток, или пациентам с некоторыми солидными опухолями, включая мелкоклеточный рак легкого и опухоли кожи, такие как злокачественная меланома [227]. Эти устройства также связаны с высокими финансовыми тратами, могут увеличивать продолжительность каждого цикла химиотерапии и вызывать головные боли, тошноту и клаустрофобию [218, 219]. Несмотря на описанную эффективность таких средств для пациентов с раком молочной железы, получающих химиотерапию на основе таксанов, остаются вопросы об их пользе для пациентов, получающих химиотерапию на основе антрациклинов [228]. Также доступны специальные колпачки для ручного охлаждения кожи головы, но они не регламентированы, и в связи с этим их применение может нести больший риск.
Синдром лизиса опухоли
Проблематика
Синдром лизиса опухоли (СЛО) — неотложная онкологическая ситуация, возникающая в результате массивного лизиса опухолевых клеток, приводящего к опасным для жизни метаболическим нарушениям. Хотя СЛО может возникать спонтанно, обычно он появляется после терапии агрессивных гематологических злокачественных новообразований, включая острые лейкозы с очень высоким уровнем лейкоцитов и лимфомы высокой степени злокачественности, а также быстро пролиферирующих солидных опухолей [229]. СЛО вызывается быстрым попаданием в кровоток внутриклеточного содержимого, в том числе нуклеиновых кислот, калия, лактатдегидрогеназы и фосфора, после гибели опухолевых клеток (рис. 6). Выделяемые продукты метаболизма нуклеиновых кислот приводят к гиперурикемии. Мочевая кислота в высоких концентрациях может кристаллизоваться в почечных канальцах, потенциально приводя к обструкции почек и острой почечной недостаточности.
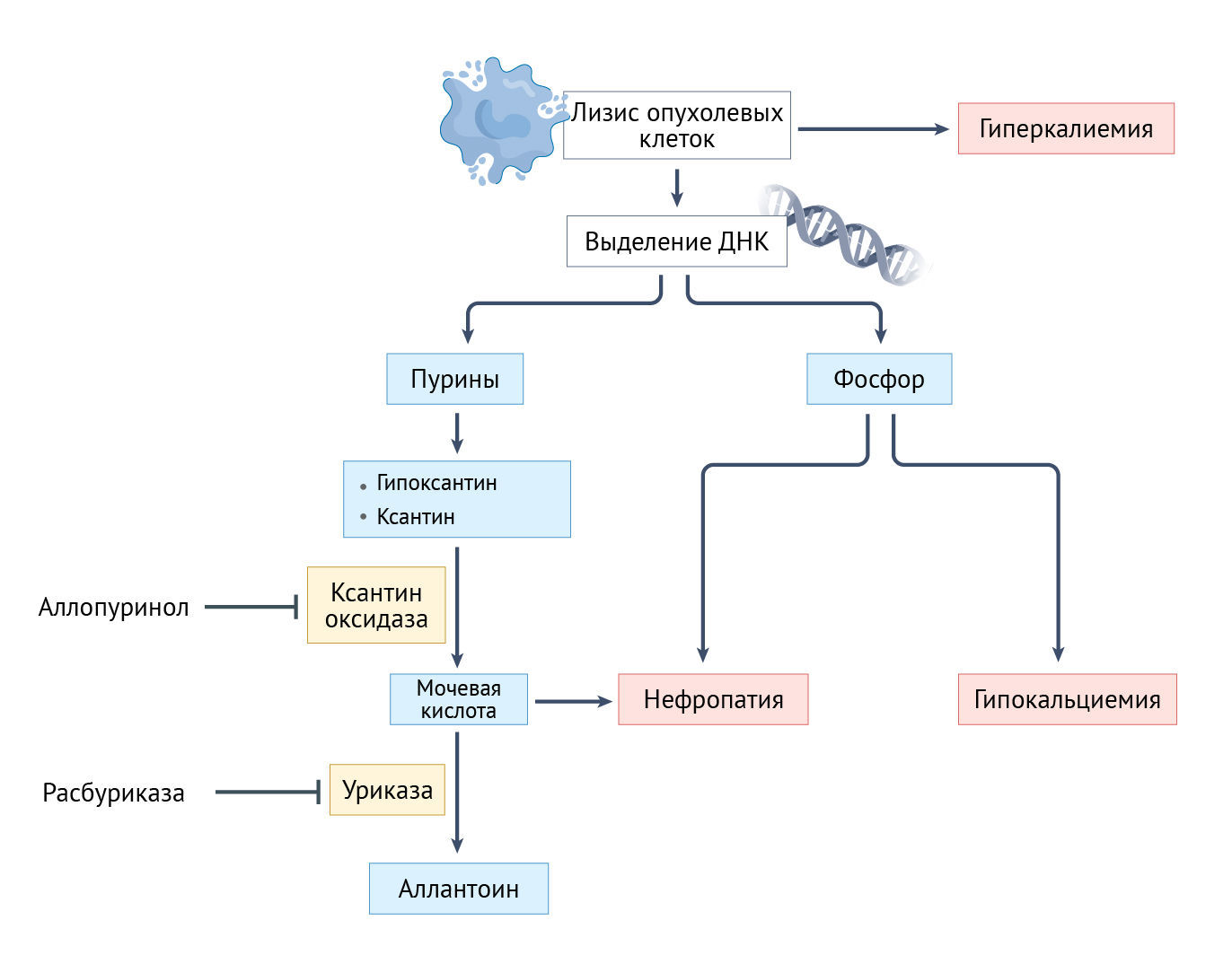
Результатом высвобождения внутриклеточного калия и нарушения функции почек может стать гиперкалиемия, которая, в свою очередь, может вызвать опасные для жизни аритмии. Наконец, повышенный уровень фосфора может привести к гипокальциемии и тетании, судорогам и аритмиям [230].
СЛО обычно возникает в течение 12–72 ч после начала химиотерапии и может проявляться метаболическими нарушениями или нарушением функции почек [231, 232]. Симптомы широко варьируют и включают тошноту, рвоту, диарею, анорексию, вялость и/или гематурию. Лабораторные анализы обычно выявляют повышенный уровень мочевой кислоты, фосфора, калия и лактатдегидрогеназы наряду с гипокальциемией в сыворотке. Всем пациентам с выраженными нарушениями электролитного баланса необходимо провести электрокардиограмму для исключения серьезных аритмий и нарушений проводимости. Система определения Каира–Бишопа предоставляет конкретные лабораторные критерии для диагностики и классификации СЛО, а также для установления степени тяжести СЛО [229].
Лечение и рекомендации
Основу профилактики СЛО составляют интенсивная гидратация и использование гипоурикемических средств. Ключевыми клиническими параметрами для наблюдения за пациентами с повышенным риском СЛО служат измерение диуреза и последовательные анализы электролитов сыворотки и уровней мочевой кислоты. Целью внутривенной гидратации является усиление почечной перфузии и повышение диуреза для снижения риска отложения в канальцах мочевой кислоты и/или фосфата кальция. Однако для пациентов с острым повреждением почек или сердечной дисфункцией необходимо поддерживать баланс жидкости и предотвращать перегрузку объемом. Международная группа экспертов по СЛО рекомендует взрослым с повышенным риском СЛО первоначально получать 2–3 л/м2 жидкости внутривенно в день [229]. После постановки диагноза СЛО лечение включает устранение нарушений электролитного баланса и мочевой кислоты и, при необходимости, заместительную почечную терапию [233].
Решающую роль в профилактике СЛО играют гипоурикемические средства аллопуринол, расбуриказа и фебуксостат, поскольку они уменьшают образование новой мочевой кислоты и снижают частоту обструкции мочевыводящих путей. Аллопуринол ингибирует ксантиноксидазу, блокируя превращение гипоксантина и ксантина в мочевую кислоту [234]. Поскольку аллопуринол подавляет синтез мочевой кислоты, уровень этого метаболита в сыворотке крови снижается не сразу и, таким образом, этот препарат следует использовать только у пациентов, у которых уровень мочевой кислоты до его приема существенно не повышен. Учитывая опасность появления тяжелых кожных побочных реакций на аллопуринол, особенно тех, которые связаны с аллелем HLA-B*58:01 в популяциях азиатских рас, пациентам с высоким риском рекомендован генетический скрининг, а тем, кто является носителем аллеля, рекомендовано избегать приема препарата [235]. Расбуриказа способствует быстрому расщеплению мочевой кислоты до водорастворимого аллантоина и, таким образом, эффективна как для профилактики, так и для лечения гиперурикемии. В III фазе сравнительного испытания нормализация уровня мочевой кислоты в сыворотке крови на 3–7-й день чаще достигалась при применении расбуриказы, чем при применении аллопуринола (у 87% и 66% пациентов, соответственно; р = 0,001). Расбуриказа также превосходит аллопуринол по медианному времени, необходимому для контроля уровня мочевой кислоты в сыворотке (4 часа и 27 часов, соответственно) [236]. Фебуксостат — новый гипоурикемический препарат, который ингибирует как окисленную, так и восстановленную формы ксантиноксидазы, — считается эффективным для пациентов с гиперурикемией, которые не переносят аллопуринол, а расбуриказа недоступна или противопоказана из-за соответствующего заболевания печени [237].
Заключение
Несмотря на значительные успехи в таргетной терапии и иммунотерапии злокачественных новообразований, основой противоопухолевого лечения и большинства комбинированных схем остается системная химиотерапия. Следовательно, ПЭАХ продолжают оказывать серьезное негативное влияние на клинические исходы, качество жизни и возможность безопасного проведения эффективной химиотерапии. Полное влияние ПЭАХ на долгосрочное физическое, эмоциональное и психосоциальное функционирование и возникающую в результате инвалидность среди постоянно растущего числа выживших онкологических пациентов по-прежнему требует оценки [238]. Тем не менее, данные о влиянии ПЭАХ на социально-экономические проблемы, такие как потеря работы, финансовое бремя и общий уровень бедности, остаются ограниченными.
Кроме того, диапазон проявления токсичности сильно различается для каждого человека, и разные траектории ПЭАХ могут включать различные острые и долгосрочные нежелательные явления, которые могут возникать по отдельности или в совокупности как во время химиотерапии, так и спустя долгое время после лечения. К ним относятся такие токсические эффекты, как связанная со злокачественными заболеваниями утомляемость, невропатия, вызванная химиотерапией, повреждение сердца и бесплодие, которые могут возникать во время острой фазы лечения и проявляться как хронические токсические явления спустя долгое время после завершения противоопухолевой терапии. Этот спектр токсических эффектов иллюстрирует сложность профилактики и терапевтического ландшафта ПЭАХ, возможность трансформации острой токсичности в хронические состояния, которые продолжают проявляться спустя годы, а также способность вызывать отдаленные последствия и последующую инвалидность, которые редко оцениваются в клинических испытаниях. Хотя это и выходит за рамки данного обзора, отсроченные и долгосрочные нежелательные явления, связанные с химиотерапией злокачественных новообразований, заслуживают серьезного клинического рассмотрения и дальнейших исследований.
Усовершенствованные стратегии информирования о сложных последствиях потенциальной токсичности и комплексов вредных симптомов необходимы как клиницистам [239, 240], так и пациентам, которые могут утаивать свои симптомы из-за беспокойства, что их отстранят от терапии и клинических испытаний [241]. Несмотря на то, что оптимальное информирование и совместное принятие решений необходимо, чтобы пациенты не сожалели о том, что проходят терапию, такие беседы страдают от недостатка информации о долгосрочных осложнениях [239, 242]. Противоопухолевая терапия, в том числе поддерживающая, сопряжена со значительным финансовым бременем, которое более заметно для женщин и представителей меньшинств. Необходимы усовершенствованные методы стратификации риска для пациентов, чтобы обеспечить им персонализированную поддерживающую терапию, а также доступ к междисциплинарной помощи, в которой будут задействованы пациенты и их семьи. Уязвимые группы населения и меньшинства рискуют остаться далеко позади, если у них будет ограниченный доступ к Интернету и будущим инновационным технологиям мониторинга токсичности. Для таких групп необходимо развернуть стратегическое использование региональных ресурсов.
Тем не менее, в результате клинических исследований, проведенных в последние несколько лет, произошел значительный прогресс в мониторинге, оценке риска, лечении и профилактике ПЭАХ. Можно ожидать и значительного дополнительного прогресса как следствия текущих исследований, посвященных основной патофизиологии и выявлению оптимальных биомаркеров, благодаря реализации новых подходов в поддерживающей медицинской помощи, связанных с психосоциальной, реабилитационной и комплементарной медициной, продвинутой многопрофильной помощи, а также удаленного мониторинга и обучения пациента. Уже показано, что тщательный мониторинг симптомов и оценка результатов лечения пациентами улучшают качество наблюдения, снижают смертность и уменьшают частоту ПЭАХ [243, 244]. Кроме того, инструменты гериатрической оценки обеспечивают расширенный анализ и профилактику токсичности у пожилых пациентов [87, 245]. Таким образом, поддерживающая терапия злокачественных новообразований еще никогда не была столь многообещающей, и возможно, мы вскоре сможем отказаться от предостережения Уильяма Ослера: «Человек, принимающий лекарство, должен выздороветь дважды: один раз от болезни и один раз от лекарства».
