Атопический дерматит: диагностика, влияние микробиома, современные методы лечения

Атопический дерматит (далее — АД) представляет собой мультифакторное, генетически детерминированное, воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением,возрастными особенностями локализации и морфологией очагов поражения. АД — один из наиболее распространенных хронических заболеваний во всем мире и чаще всего отмечается в развитых странах. Примерно одинаково часто встречается у мужчин и женщин всех рас, независимо от возраста, и нередко протекает в сочетании с другими аллергическими заболеваниями (например, бронхиальной астмой и/или аллергическим ринитом) [1].За последние десятилетия АД стал самым распространенным кожным заболеванием, он встречается как минимум у 230 млн человек во всем мире [2]. Этот факт — глобальная проблема для мирового здравоохранения. Согласно международному перекрестному веб-опросу, проведенному в США, Канаде, Франции, Германии, Италии, Испании, Великобритании и Японии, внутри стран наблюдалась региональная изменчивость распространенности АД среди взрослых пациентов: она составила 4,9 % в США, 4,4 % в странах Евросоюза, 3,5 % в Канаде и 2,1 % в Японии [3]. АД может проявляться в любом возрасте, но пик заболеваемости приходится на младенчество: примерно 45 % всех случаев возникают в течение первых шести месяцев жизни, 60 % — в течение первого года и 80–90 % — в возрасте до пяти лет [2,4]. Ранняя диагностика и своевременное лечение могут предотвратить тяжелое течение заболевания и связанные с ним осложнения: нарушения сна, хронические поствоспалительные изменения кожи, рубцевание от расчесывания, а также развитие вторичных кожных инфекций, вызванных стафилококками, стрептококками и герпесвирусами [5].
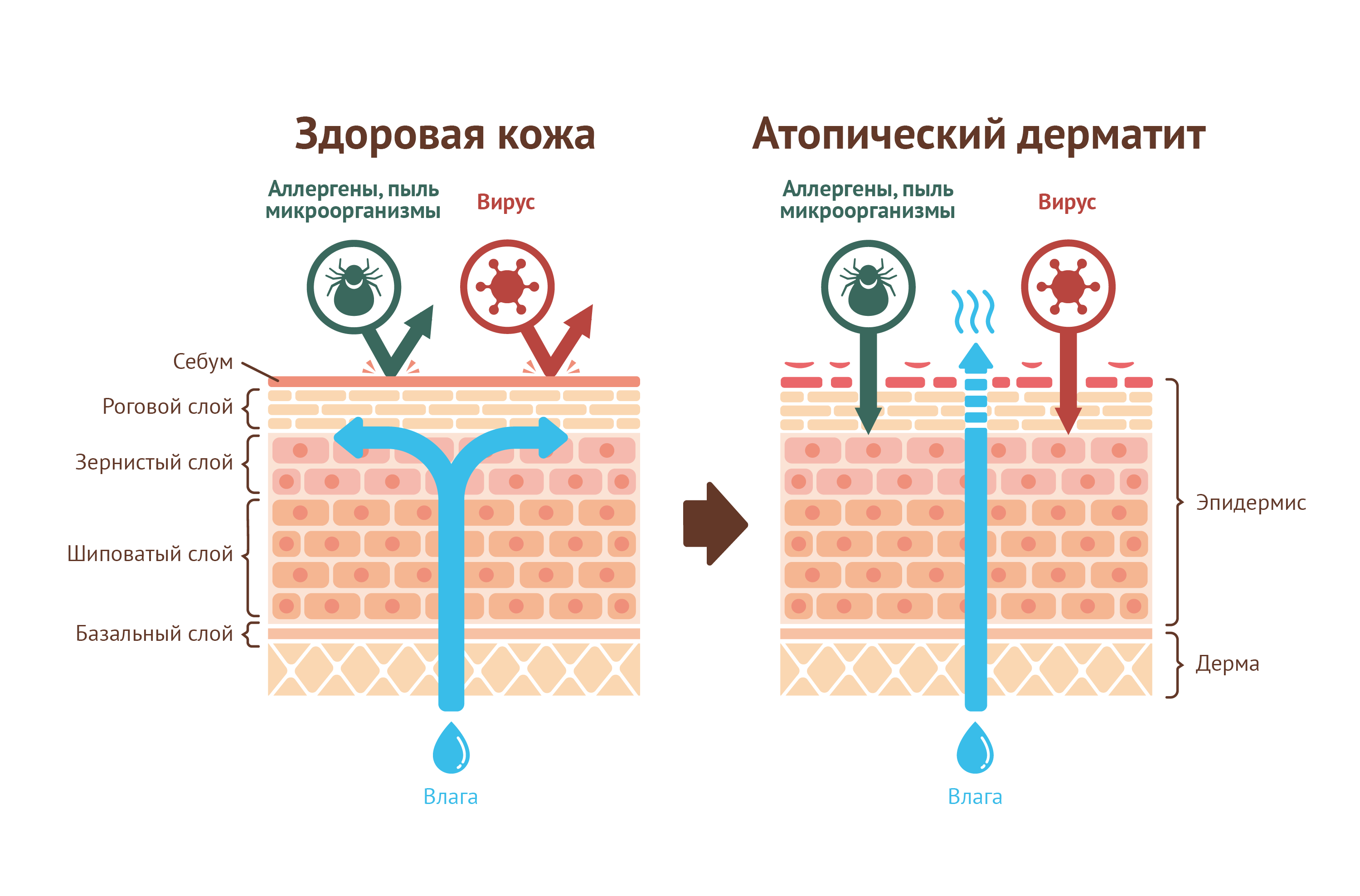
Рисунок 1 | Нормальная кожа и кожа c атопическим дерматитом
Атопический дерматит может проявляться в трех клинических вариантах, которые нередко сменяют друг друга.
- При остром АД наблюдается везикулярная, мокнущая, корковая сыпь.
- При подостром — сухие, чешуйчатые, эритематозные папулы и бляшки.
- При хроническом АД возникает утолщение кожи и усиление ее рисунка — лихенификация от постоянных расчесов.
Белый лишай — гипопигментированные бляшки, покрытые мелкими чешуйками, с нечеткими границами, — чаще всего встречается у детей. АД чаще поражает сгибательные поверхности тела, переднюю и боковую части шеи, веки, лоб, лицо, запястья, тыльную поверхность стоп и руки. Поскольку АД может проявляться по-разному, простор для дифференциальной диагностики остается широким.
Существует два морфологических типа АД: фолликулярный тип с плотно агрегированными фолликулярными папулами (часто встречается у негроидов и монголоидов) и хронический тип c эритематозными, часто экскориированными папулами и уплотненными узлами (что нередко наблюдается у пациентов с длительно существующим заболеванием). У младенцев часто обнаруживаются распространенные и более тяжелые кожные проявления, характеризующиеся выраженной эритемой, отеком, экскориациями и обильным серозным экссудатом, который проявляется в виде мокнущей жидкости и образования корок. Такие корки обычно локализуются на лице, щеках, туловище и в области соприкосновения с подгузником. Позже проявления АД становятся более локализованными, бледнеют, кожа уплотняется от постоянных расчесов. У подростков и взрослых может наблюдаться как диффузный характер АД, так и локальные поражения чаще всего на лице и конечностях.
Атопический дерматит считается заболеванием с крайне вариабельными клиническими фенотипами, которые частично связаны с возрастом, этнической принадлежностью и тяжестью заболевания [6]. В целом АД характеризуется острыми эпизодами возникновения экзематозных, мокнущих и зудящих элементов на сухой коже. Хронические поражения выглядят как красные или коричневатые участки сухой, потрескавшейся или шелушащейся кожи с лихенизацией. Зуд кожи, особенно по ночам, приводит к усталости и стойким нарушениям сна, а также негативно влияет на психическое здоровье.
Не существует специфического диагностического теста или патогномоничных лабораторных биомаркеров для диагностики атопического дерматита: диагноз устанавливается по характерным клиническим признакам и личному и/или семейному анамнезу. Наиболее типичный признак — повышение уровней общего или аллерген-специфического IgE в сыворотке крови, что, однако, наблюдается не у всех людей, и позволяет различать две формы заболевания: не-IgE-ассоциированный («эндогенный») и IgE-ассоциированный АД («экзогенный»). Биопсия кожи может помочь исключить другие распространенные заболевания, которые имитируют, осложняют АД, или же сосуществуют с ним: кожная лимфома или (особенно в детском возрасте) другие редкие состояния, проявляющиеся при первичном иммунодефиците или недостатке питания.
Роль кожного микробиома в развитии атопического дерматита
Кожные покровы обильно населены разнообразной микрофлорой. Несмотря на доказательства того, что эти микроорганизмы важны для нормальной жизнедеятельности, многие свойства резидентной микробиоты остаются все еще недостаточно изученными. Можно с достоверностью утверждать, что АД связан с измененной микробиотой кожи, с высокой распространенностью колонизации золотистым стафилококком (S. aureus) и вторичными инфекциями, что было выявлено задолго до применения подходов к секвенированию ДНК [7]. Эпидемиологические, метагеномные и функциональные исследования показали, что взаимоотношения между организмом-хозяином и S. aureus и его влияние на развитие АД представляет собой сложное взаимодействие между соответствующими факторами хозяина и патогена [8]. К факторам организма-хозяина относят микросреду c определенными физическими, химическими и антимикробными свойствами здоровой кожи, многие из которых изменены при АД. Патоген-специфические факторы включают высокоразвитые механизмы, способствующие адгезии, инвазии и эпидермолизу и провоспалительные механизмы, которые непосредственно управляют Th2- и Тh17-лимфоцитами и врожденным иммунитетом кожи. Это усугубляет воспалительный компонент АД. S. aureus приобрел множество механизмов, позволяющих ему проникнуть во враждебную для себя среду — здоровую и неповрежденную кожу человека. В отличие от здоровой кожи, кожа при АД не препятствует колонизации S. aureus. Антимикробные пептиды LL-37, β-дефенсины и дермицидин на коже с АД присутствуют в гораздо более низких количествах, чем на здоровой коже. Один из механизмов данного эффекта — ингибирование интерлейкинами IL-4 и IL-13 экспрессии генов β-дефензина 2 и 3 [9]. S. aureus плохо растет в кислой и подкисленной среде, которая наблюдается в здоровом роговом слое эпидермиса — гораздо лучше этот микроорганизм чувствует себя в условиях более высокого pH, часто встречающегося у пациентов с АД. S. aureus, выделенный от пациентов с АД, сильнее связывался с интактной кожей, чем S. aureus, выделенный от здоровых носителей, что, как было выяснено, модулируется уровнями филаггрина (естественный увлажняющий фактор) в корнеоцитах. У пациентов с АД наблюдается либо генетический, либо приобретенный дефицит филаггрина, который приводит к деформации корнеоцитов и различным биохимическим нарушениям в роговом слое эпидермиса [10]. Изоляты S. aureus от пациентов с АД сильнее связываются с корнеоцитами, в отличие от изолятов от здоровых пациентов в зависимости от конфигурации фактора агрегации-В [11]. Помимо чрезвычайно развитых механизмов адгезии и уклонения от иммунного ответа, S. aureus легко проникает и разрушает кожный барьер [12].
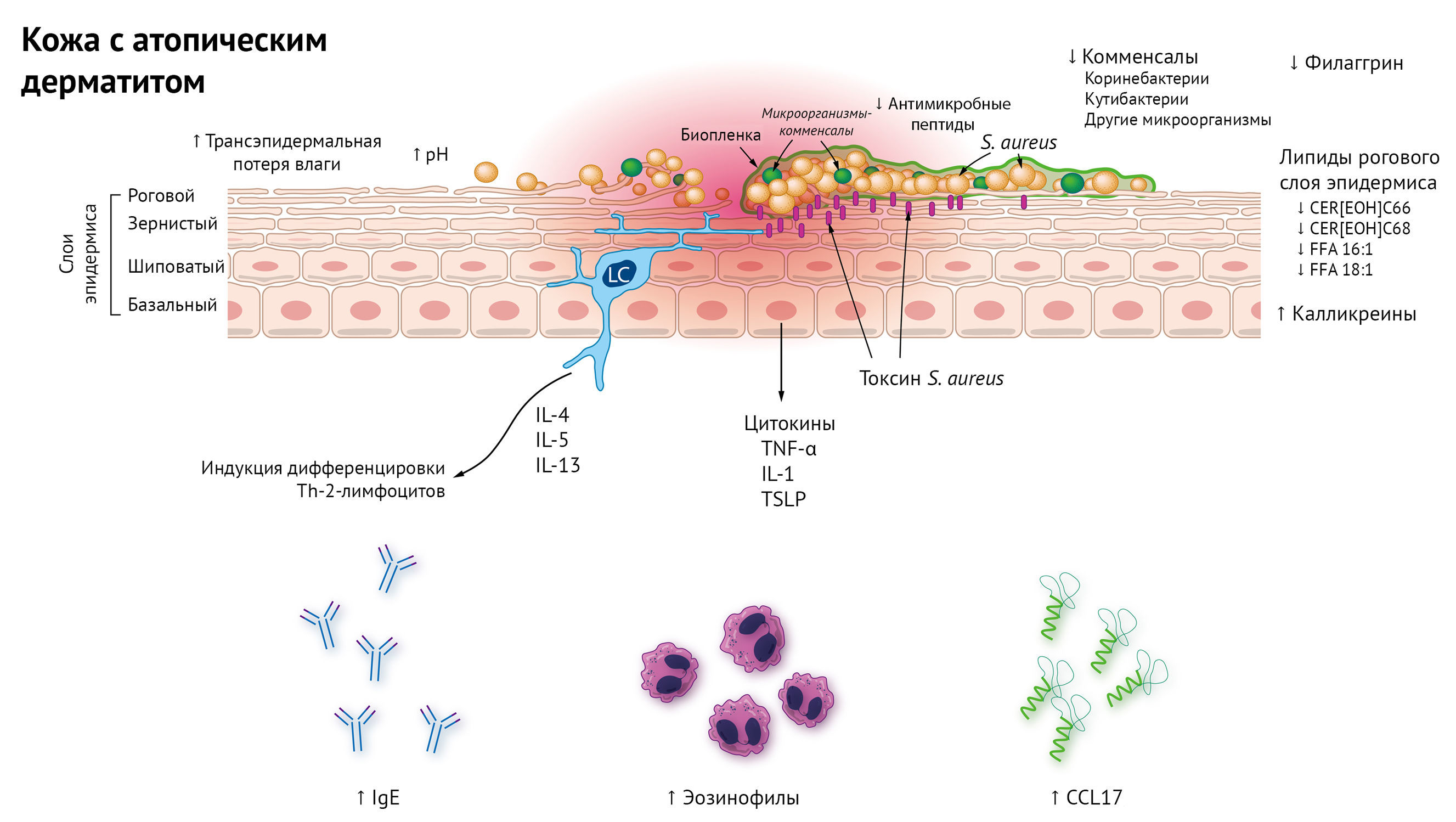
Рисунок 2 | Нарушения эпидермального барьера в патогенезе атопического дерматита
Сопутствующая патология при атопическом дерматите
Достоверно подтверждена связь между АД и пищевой аллергией, бронхиальной астмой, аллергическим ринитом в рамках «атопического марша». АД также связан с повышенным риском аллергического контактного дерматита [14].
У пациентов с атопическим дерматитом может развиться вторичная бактериальная инфекция, вызываемая кожной флорой (в частности стафилококками и стрептококками). Такие пациенты, кроме того, подвержены риску развития инфекции, вызванной вирусом простого герпеса, известной как герпетическая экзема Капоши: экзематозная кожа позволяет локализованной вспышке герпеса распространяться по телу и вызывать болезненную папуло-везикулярную сыпь. Другие осложнения АД включают рубцы от расчесов, хронические поствоспалительные изменения и атрофию кожи в результате длительной терапии топическими кортикостероидами.
Примечательно, что у детей нарушения сна, которые происходят в результате дискомфорта, связанного с зудом и болью при АД, могут спровоцировать задержку роста, низкую успеваемостью в школе, дефицит внимания и гиперактивность [15].
Причины этих взаимосвязей в значительной степени неизвестны, как и не определена абсолютная величина рисков [13]. Многие из этих коморбидных состояний напрямую связаны с тяжестью АД и неадекватным контролем заболевания. Большинство сопутствующих заболеваний поражают детей, в то время как другие появляются во взрослом возрасте у пациентов с длительно текущим заболеванием — это подтверждает системный характер возникновения АД, что дает основания предполагать, что меры, принимаемые в детстве для снижения тяжести заболевания, в будущем могут снизить вероятность развития сопутствующей патологии у человека [15].
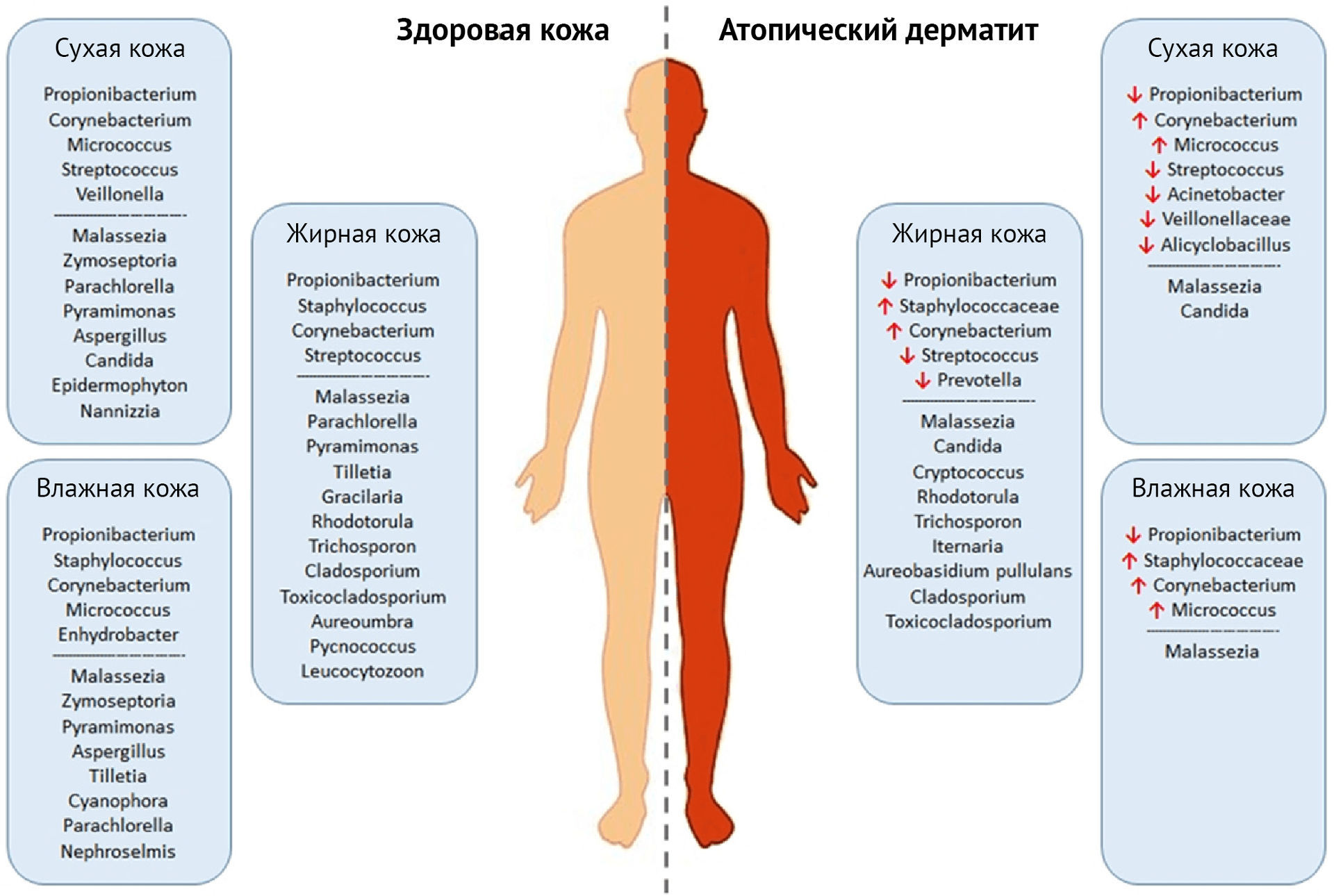
Рисунок 3 | Различия в составе кожной микрофлоры в норме и при атопическом дерматите
Лечение атопического дерматита
Эмоленты
Ксероз (сухость кожи) — распространенное явление при АД. Многие пациенты подтверждают, что степень сухости их кожи отражает контроль их заболевания в целом. Следовательно, пациентам с АД необходимо обильно наносить смягчающие средства (эмоленты) на все тело независимо от наличия активных симптомов [16]. Рандомизированное контролируемое исследование среди младенцев с АД средней и тяжелой степени показало, что регулярное использование эмолентов снижает потребность в применении топических кортикостероидов и улучшает общее состояние кожи [17].
Увлажняющие средства помогают удерживать эпидермальную влагу и восполнять ее запасы в глубоких слоях кожи. Однако не все эмоленты одинаковы.
Рекомендуются смягчающие средства с высоким содержанием масла и низким содержанием воды. Густые кремы с низким содержанием воды восстанавливают кожный барьер, интегрируя в эпидермис липиды, и увлажняют кожу (например, средства серии Cicaplast B5, которые могут применяться как для лица, так и для кожи тела, рук или губ и подходят для применения с первых дней жизни).

Помимо действия на липидный барьер кожи, средства восстанавливают баланс микробиома, не содержат отдушек и красителей.
Чтобы предотвратить ксероз, врачи рекомендуют пациентам принимать душ теплой, а не горячей водой, избегать растирания и применения щеток и жестких мочалок, а также использовать смягчающие средства во время душа (такие как липидовосполняющие смягчающие масла или кремы для ванны и душа для детей и взрослых серии Lipikar). После купания лосьоны и бальзамы этой серии помогут дополнительно успокоить кожу и дольше воздействовать на нее, восстанавливая липидный барьер и усиливая защитные свойства.

Применение глюкокортикостероидов
Топические кортикостероиды являются первой линией терапии при обострениях атопического дерматита [16,18,19]. Их эффективность варьируется от группы I, которая считается наиболее эффективной (например, клобетазол [темоват]), до группы VII, которая является наименее эффективной (например, гидрокортизон 1 %). Как правило, группа средства должна соответствовать тяжести заболевания. Людям с лихенифицированными бляшками, которые характерны для хронической экземы (например, простой хронический лишай), часто необходимы более сильные кортикостероиды в течение более длительного периода времени; кроме того, может быть полезной окклюзионная терапия. Форма средства c кортикостероидами также влияет на его активность: мазь часто более эффективна, чем крем, а крем обычно более эффективен, чем лосьон. Однако пациенты могут предпочитать разные формы: например, некоторые не применяют плотные, маслянистые мази из-за неприятных ощущений на коже, несмотря на их высокую эффективность.
После того, как острые симптомы купированы, пациент обычно возвращается к использованию только эмолентов. Однако для пациентов с рецидивирующим атопическим дерматитом средней и тяжелой степени рассматривают возможность постоянной поддерживающей терапии. В рандомизированном двойном слепом контролируемом исследовании взрослых с АД средней и тяжелой степени поддерживающая терапия с применением кортикостероидов два раза в неделю вместе c применением эмолентов значительно снижала частоту рецидивов по сравнению с монотерапией исключительно смягчающими средствами [20].
Во избежание атрофии эпидермиса рекомендуются кортикостероиды слабой активности для лица, шеи, подмышечных впадин, паха и сгибательных поверхностей. Перед применением сильнодействующих кортикостероидов пациентами детского возраста рекомендуется консультация с дерматологом. Кроме того, кортикостероиды следует наносить только на пораженные участки кожи.
Топические ингибиторы кальциневрина
Местные ингибиторы кальциневрина, пимекролимус и такролимус, являются иммуномодуляторами и считаются терапией второй линии [16]. Как правило, они предназначены для краткосрочной или курсовой долгосрочной терапии у лиц с атопическим дерматитом от умеренной до тяжелой степени, особенно когда есть опасения, что постоянное использование местных кортикостероидов вызывает побочные эффекты (например, атрофию кожи) [21]. Поскольку эти препараты не приводят к атрофии, они особенно рекомендованы к применению для участков с более тонкой кожей (лицо или шея). Еще одним преимуществом является то, что они не вызывают тахифилаксии — снижения ответа на терапию при повторном применении лекарства, — даже после длительного лечения [22].
Другие методы лечения
Как обсуждалось ранее, кожа пациентов с атопическим дерматитом сильно колонизирована S. aureus, хотя колонизация именно его метициллин-резистентным штаммом встречается относительно редко [23]. Исследования не продемонстрировали каких-либо преимуществ лечения антибиотиками в уменьшении обострений АД [24].
Пациентам с состояниями, рефрактерными к лечению топическими препаратами или с тяжелым распространенным атопическим дерматитом, могут быть назначены такие варианты, как ультрафиолетовая фототерапия и системные иммуномодулирующие средства (например, циклоспорин, интерферон гамма-1b и т. д.) [16]. В редких случаях для лечения тяжелых обострений АД могут прибегать к краткосрочным курсам пероральных или внутримышечных инъекций кортикостероидов.
Лечение микроорганизмами-комменсалами
Ряд исследований продемонстрировал терапевтический эффект применения микроорганизмов-комменсалов в лечении атопического дерматита. Исследование группы новорожденных показало, что присутствие стафилококков, отличных от S. aureus, в возрасте двух месяцев помогало уберечь младенцев от развития АД в более старшем возрасте [25]. Кроме того, некоторые виды микроорганизмов-комменсалов способны самостоятельно бороться с рядом патогенов [26]. Было обнаружено, что некоторые ранее неизвестные и мощные молекулярные механизмы против S. aureus продуцируются кожными микроорганизмами-комменсалами (S. epidermidis, S. hominis и S. lugdunensis) [27]. Интересно, что подобные противомикробные свойства демонстрируют только определенные штаммы микроорганизмов-комменсалов. Более того, поскольку противомикробные препараты, продуцируемые такими микроорганизмами, взаимодействуют с противомикробным пептидом LL-37, пациенты с АД, по-видимому, имеют дефицит врожденной противомикробной защиты против S. aureus [28]. Помимо этого, было продемонстрировано, что S. epidermidis подавляет реакции воспаления в коже [29].
В попытке устранить дефицит антимикробной активности микробиома при атопическом дерматите было проведено двойное слепое плацебо-контролируемое исследование видов микроорганизмов-комменсалов с антимикробной активностью. Результаты показали, что топическое нанесение микроорганизмов-комменсалов было эффективным при исследовании АД на мышах [30]. Вместе c тем нанесение микроорганизмов-комменсалов с активностью против S. aureus на кожу пациентов с АД уменьшало колонизацию кожных покровов патогенным S. aureus [30]. Подобное применение микроорганизмов может значительно улучшить эффект от топического лечения [30].
Таким образом, появляется все больше свидетельств ключевой роли микробиома в патогенезе атопического дерматита, как в результате преобладания S. aureus, так и относительного уменьшения количества комменсальных организмов, которые могут контролировать размножение S. aureus.
Источники
- Consensus-Based European Guidelines for Treatment of Atopic Eczema (Atopic Dermatitis) in Adults and Children: Part I - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 16 January 2023).
- Atopic Dermatitis | Nature Reviews Disease Primers Available online: https://www.nature.com/article... (accessed on 16 January 2023).
- Barbarot, S.; Auziere, S.; Gadkari, A.; Girolomoni, G.; Puig, L.; Simpson, E.L.; Margolis, D.J.; de Bruin-Weller, M.; Eckert, L. Epidemiology of Atopic Dermatitis in Adults: Results from an International Survey. Allergy 2018, 73, 1284–1293, doi:10.1111/all.13401.
- Wolff, K.; Johnson, R.A.; Saavedra, A.P.; Roh, E.K. ECZEMA/DERMATITIS. In Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology; McGraw-Hill Education: New York, NY, 2017.
- Lewis-Jones, S. Quality of Life and Childhood Atopic Dermatitis: The Misery of Living with Childhood Eczema. Int. J. Clin. Pract. 2006, 60, 984–992, doi:10.1111/j.1742-1241.2006.01047.x.
- Tsakok, T.; Woolf, R.; Smith, C. h.; Weidinger, S.; Flohr, C. Atopic Dermatitis: The Skin Barrier and Beyond. Br. J. Dermatol. 2019, 180, 464–474, doi:10.1111/bjd.16934.
- Leyden, J.J.; Marples, R.R.; Kligman, A.M. Staphylococcus Aureus in the Lesions of Atopic Dermatitis. Br. J. Dermatol. 1974, 90, 525–530, doi:10.1111/j.1365-2133.1974.tb06447.x.
- Geoghegan, J.A.; Irvine, A.D.; Foster, T.J. Staphylococcus Aureus and Atopic Dermatitis: A Complex and Evolving Relationship. Trends Microbiol. 2018, 26, 484–497, doi:10.1016/j.tim.2017.11.008.
- Hata, T.R.; Kotol, P.; Boguniewicz, M.; Taylor, P.; Paik, A.; Jackson, M.; Nguyen, M.; Kabigting, F.; Miller, J.; Gerber, M.; et al. History of Eczema Herpeticum Is Associated with the Inability to Induce Human β-Defensin (HBD)-2, HBD-3 and Cathelicidin in the Skin of Patients with Atopic Dermatitis. Br. J. Dermatol. 2010, 163, 659–661, doi:10.1111/j.1365-2133.2010.09892.x.
- Feuillie, C.; Vitry, P.; McAleer, M.A.; Kezic, S.; Irvine, A.D.; Geoghegan, J.A.; Dufrêne, Y.F. Adhesion of Staphylococcus Aureus to Corneocytes from Atopic Dermatitis Patients Is Controlled by Natural Moisturizing Factor Levels. mBio 2018, 9, e01184-18, doi:10.1128/mBio.01184-18.
- Fleury, O.M.; McAleer, M.A.; Feuillie, C.; Formosa-Dague, C.; Sansevere, E.; Bennett, D.E.; Towell, A.M.; McLean, W.H.I.; Kezic, S.; Robinson, D.A.; et al. Clumping Factor B Promotes Adherence of Staphylococcus Aureus to Corneocytes in Atopic Dermatitis. Infect. Immun. 2017, 85, e00994-16, doi:10.1128/IAI.00994-16.
- Berube, B.J.; Bubeck Wardenburg, J. Staphylococcus Aureus α-Toxin: Nearly a Century of Intrigue. Toxins 2013, 5, 1140–1166, doi:10.3390/toxins5061140.
- Paller, A.; Jaworski, J.C.; Simpson, E.L.; Boguniewicz, M.; Russell, J.J.; Block, J.K.; Tofte, S.; Dunn, J.D.; Feldman, S.R.; Clark, A.R.; et al. Major Comorbidities of Atopic Dermatitis: Beyond Allergic Disorders. Am. J. Clin. Dermatol. 2018, 19, 821–838, doi:10.1007/s40257-018-0383-4.
- Brar, K.K.; Nicol, N.H.; Boguniewicz, M. Strategies for Successful Management of Severe Atopic Dermatitis. J. Allergy Clin. Immunol. Pract. 2019, 7, 1–16, doi:10.1016/j.jaip.2018.10.021.
- Silverberg, J.I. Associations between Atopic Dermatitis and Other Disorders. F1000Research 2018, 7, 303, doi:10.12688/f1000research.12975.1.
- Guidelines of Care for Atopic Dermatitis, Developed in Accordance with the American Academy of Dermatology (AAD)/American Academy of Dermatology Association “Administrative Regulations for Evidence-Based Clinical Practice Guidelines” - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 18 January 2023).
- Grimalt, R.; Mengeaud, V.; Cambazard, F.; Study Investigators’ Group The Steroid-Sparing Effect of an Emollient Therapy in Infants with Atopic Dermatitis: A Randomized Controlled Study. Dermatol. Basel Switz. 2007, 214, 61–67, doi:10.1159/000096915.
- Wollenberg, A.; Kinberger, M.; Arents, B.; Aszodi, N.; Avila Valle, G.; Barbarot, S.; Bieber, T.; Brough, H. a.; Calzavara Pinton, P.; Christen-Zäch, S.; et al. European Guideline (EuroGuiDerm) on Atopic Eczema: Part I – Systemic Therapy. J. Eur. Acad. Dermatol. Venereol. 2022, 36, 1409–1431, doi:10.1111/jdv.18345.
- Атопический Дерматит: Клинические Рекомендации МЗ РФ, 2021
- Berth-Jones, J.; Damstra, R.J.; Golsch, S.; Livden, J.K.; Van Hooteghem, O.; Allegra, F.; Parker, C.A.; Multinational Study Group Twice Weekly Fluticasone Propionate Added to Emollient Maintenance Treatment to Reduce Risk of Relapse in Atopic Dermatitis: Randomised, Double Blind, Parallel Group Study. BMJ 2003, 326, 1367, doi:10.1136/bmj.326.7403.1367.
- Berger, T.G.; Duvic, M.; Van Voorhees, A.S.; VanBeek, M.J.; Frieden, I.J.; American Academy of Dermatology Association Task Force The Use of Topical Calcineurin Inhibitors in Dermatology: Safety Concerns. Report of the American Academy of Dermatology Association Task Force. J. Am. Acad. Dermatol. 2006, 54, 818–823, doi:10.1016/j.jaad.2006.01.054.
- Werfel, T. Topical Use of Pimecrolimus in Atopic Dermatitis: Update on the Safety and Efficacy. J. Dtsch. Dermatol. Ges. J. Ger. Soc. Dermatol. JDDG 2009, 7, 739–742, doi:10.1111/j.1610-0387.2009.07141.x.
- Methicillin-Resistant Staphylococcus Aureus Colonization in Children with Atopic Dermatitis - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 18 January 2023).
- Bath-Hextall, F.J.; Birnie, A.J.; Ravenscroft, J.C.; Williams, H.C. Interventions to Reduce Staphylococcus Aureus in the Management of Atopic Eczema: An Updated Cochrane Review. Br. J. Dermatol. 2010, 163, 12–26, doi:10.1111/j.1365-2133.2010.09743.x.
- Kennedy, E.A.; Connolly, J.; Hourihane, J.O.; Fallon, P.G.; McLean, W.H.I.; Murray, D.; Jo, J.-H.; Segre, J.A.; Kong, H.H.; Irvine, A.D. Skin Microbiome before Development of Atopic Dermatitis: Early Colonization with Commensal Staphylococci at 2 Months Is Associated with a Lower Risk of Atopic Dermatitis at 1 Year. J. Allergy Clin. Immunol. 2017, 139, 166–172, doi:10.1016/j.jaci.2016.07.029.
- Cogen, A.L.; Nizet, V.; Gallo, R.L. Skin Microbiota: A Source of Disease or Defence? Br. J. Dermatol. 2008, 158, 442–455, doi:10.1111/j.1365-2133.2008.08437.x.
- Zipperer, A.; Konnerth, M.C.; Laux, C.; Berscheid, A.; Janek, D.; Weidenmaier, C.; Burian, M.; Schilling, N.A.; Slavetinsky, C.; Marschal, M.; et al. Human Commensals Producing a Novel Antibiotic Impair Pathogen Colonization. Nature 2016, 535, 511–516, doi:10.1038/nature18634.
- Paharik, A.E.; Parlet, C.P.; Chung, N.; Todd, D.A.; Rodriguez, E.I.; Van Dyke, M.J.; Cech, N.B.; Horswill, A.R. Coagulase-Negative Staphylococcal Strain Prevents Staphylococcus Aureus Colonization and Skin Infection by Blocking Quorum Sensing. Cell Host Microbe 2017, 22, 746-756.e5, doi:10.1016/j.chom.2017.11.001.
- Lai, Y.; Di Nardo, A.; Nakatsuji, T.; Leichtle, A.; Yang, Y.; Cogen, A.L.; Wu, Z.-R.; Hooper, L.V.; Schmidt, R.R.; von Aulock, S.; et al. Commensal Bacteria Regulate Toll-like Receptor 3-Dependent Inflammation after Skin Injury. Nat. Med. 2009, 15, 1377–1382, doi:10.1038/nm.2062.
- Nakatsuji, T.; Chen, T.H.; Narala, S.; Chun, K.A.; Two, A.M.; Yun, T.; Shafiq, F.; Kotol, P.F.; Bouslimani, A.; Melnik, A.V.; et al. Antimicrobials from Human Skin Commensal Bacteria Protect against Staphylococcus Aureus and Are Deficient in Atopic Dermatitis. Sci. Transl. Med. 2017, 9, eaah4680, doi:10.1126/scitranslmed.aah4680.
