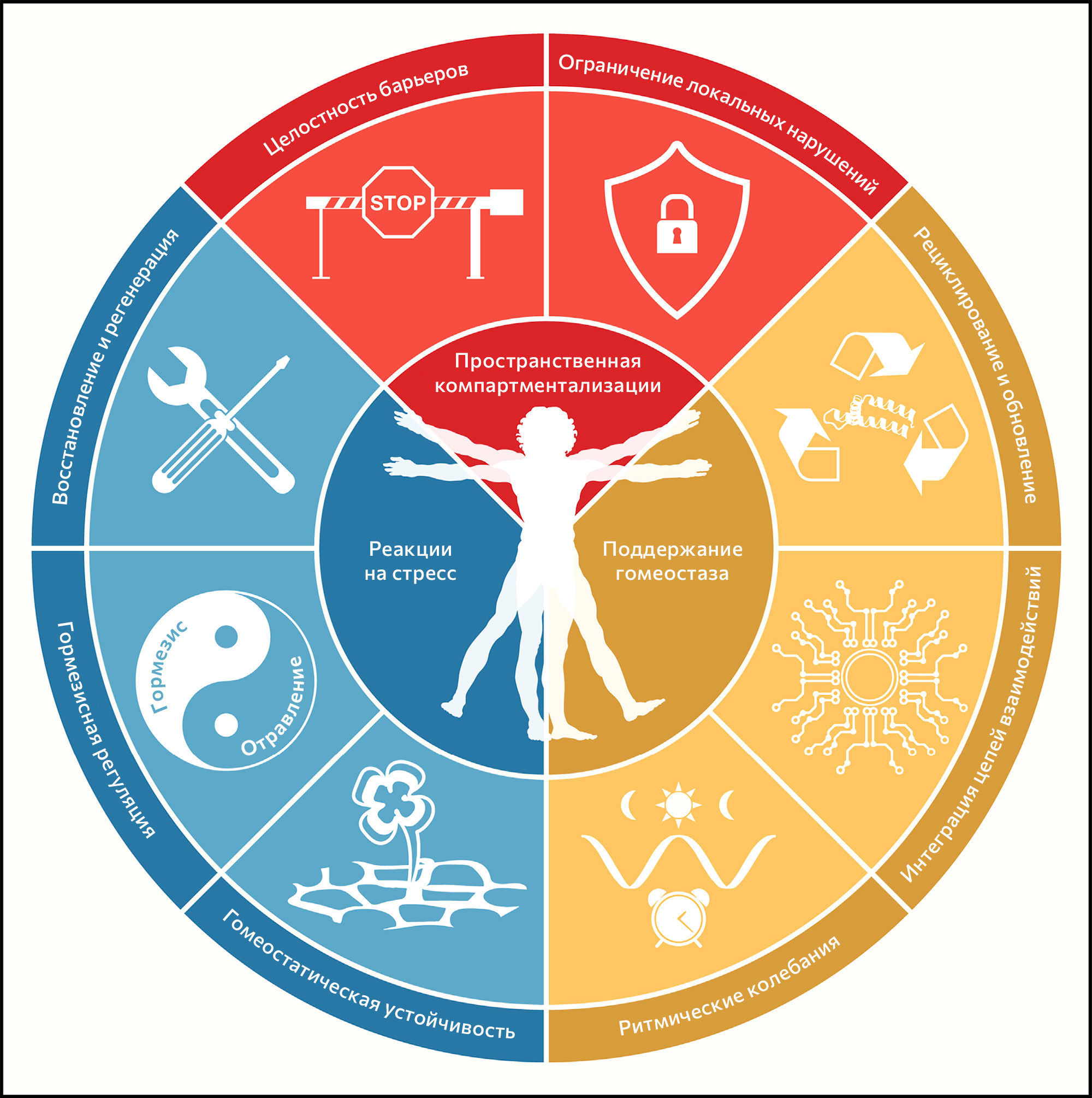
Ключевые признаки здоровья

Аннотация
Здоровье обычно определяют как отсутствие патологии. Авторы этой статьи сделали попытку дать определение здоровья как перечня организационных и динамичных характеристик, которые поддерживают физиологию. Биологические основы признаков здоровья включают черты пространственной компартментализации (целостность барьеров и ограничение нарушений), поддержание гомеостаза с течением времени (рециклирование и обновление, интеграция цепей взаимодействий и колебания ритмов) и набор адекватных реакций на стресс (устойчивость гомеостаза, регуляция гормезиса, репарация и регенерация). Разобщение любых из этих тесно связанных характеристик имеет обширный патогенный эффект, вызывающий острое или прогрессирующее разобщение системы, связанное с потерей многочисленных признаков здоровья.
Введение
Патология и патофизиология обычно фокусируются на выявлении этиологических агентов и прояснении механизмов патогенеза, которые сопровождают переход от здоровья к болезни, в то время как биотехнология и фармакология занимаются поиском средств для замедления процесса или его обращения вспять. Поэтому в биомедицинских исследованиях здоровье обычно определяется через отрицание: как отсутствие болезни (Conti, 2018). Учитывая огромное множество условий, вызывающих заболевания, и путей их протекания, такое негативное определение здоровья в качестве «не-патологии» непрактично (Ayres, 2020). Альтернативное (описательное) определение здоровья может рассматривать признаки физического и психического благополучия, сопряженные с нормальной функцией всех органов, которую возможно измерить с помощью специфических медицинских исследований. В настоящей статье авторы попытались определить здоровье в положительных терминах, нумеруя лежащие в их основе биологические причины или «признаки» в дидактической манере.
Ранее в журнале Cell были опубликованы статьи, посвященные признакам рака и старения и обобщающие свойства злокачественных клеток (Hanahan and Weinberg, 2000), их взаимодействие с доброкачественным окружением (Hanahan and Weinberg, 2011), а также молекулярные и клеточные пути, объясняющие ухудшение состояния живых организмов с течением времени (López-Otín et al., 2013). В попытке выявить и категоризировать молекулярные и клеточные признаки здоровья авторы настоящей статьи пришли к выводу, что эти признаки не просто противоположны таковым при злокачественных опухолях (которые в рамках парадигмы зависят от возраста частично) или старении (которое неразрывно связано с течением времени), но также их следует воспринимать фундаментально другим образом. С точки зрения авторов статьи, признаки здоровья лежат в «организации» организма и, таким образом, не ограничиваются отдельным классом молекул (такими как ДНК, РНК, белки и метаболиты), органеллами (такими как ядра, митохондрии и лизосомы), типами клеток (такими как клетки паренхимы, вспомогательные/стромальные и воспалительные/иммунные клетки), суборганными структурами, формирующими минимальные функциональные единицы органа (такими как ворсинки и крипты кишечника, печеночные дольки, ацинусы и островки Лангерганса в поджелудочной железе, фолликулы щитовидной железы, нефроны в почке), целыми органами в их анатомических границах, системами органов (такими как сердечно-сосудистая или нервная системы и желудочно-кишечный, респираторный или мочеполовой тракты), системами циркуляции (такими как эндокринная система, нервные или иммунные связи) или метаорганизмом (который объединяет хозяина и микробиоту). Будучи «организационными», признаки здоровья отражают серии динамических характеристик, которые поддерживают хрупкое равновесие, предшествующее развитию болезни и ослабления среди упомянутых выше микроскопических и макроскопических уровней организации.
Так же, как и в предыдущих статьях о признаках рака и старения (Hanahan and Weinberg, 2000, Hanahan and Weinberg, 2011; López-Otín et al., 2013), авторы предполагают, что «признаки здоровья» — это не просто индикаторы жизненной активности: скорее, они причинным образом участвуют в ее гомеостатическом поддержании. Таким образом, каждый признак здоровья должен в идеале отвечать следующим требованиям:
- он должен быть связан с состоянием здоровья;
- нарушение его в эксперименте или в течение обычной жизни должно быть сильно патогенным;
- его экспериментальное или медицинское поддержание или восстановление должно иметь обширный оздоравливающий эффект.
Восемь предложенных характеристик в разной степени отвечают этому набору идеальных критериев — в особенности третьему (рисунок 1). По этой причине пока еще не все признаки полностью поддерживаются вмешательствами, улучшающими здоровье. Это предостережение смягчается тесной взаимосвязью между признаками здоровья, которая указывает на то, что экспериментальное усиление отдельного признака может повлиять и на другие.
Признак 1: целостность барьеров
Все живые существа должны отгораживаться от своего окружения с помощью избирательных барьеров, позволяющих сохранять их идентичность (в качестве границы между внутренним и внешним миром) и снижать энтропию (что требует компартментализации) (Marín et al., 2009). Никакие субклеточные, клеточные и суборганные компартменты не будут существовать и функционировать без внутренних барьеров организма, обеспечивающих их целостность и позволяющих устанавливать жизненно необходимые электрофизиологические и химические градиенты, усиливать их проницаемость для обмена газами и осмолитами, поставлять субстраты для метаболических путей, обеспечивать коммуникацию/координацию между компартментами, а также детоксикацию. В этом разделе авторы иллюстрируют важность целостности селективных барьеров для поддержания здоровья, обращаясь к небольшому числу репрезентативных примеров на уровне органелл (митохондрии и ядра), клеточных мембран, внутренних барьеров (гематоэнцефалический) и барьеров между внутренней и внешней средой (кишечный, респираторный и кожный) (рисунок 2A).
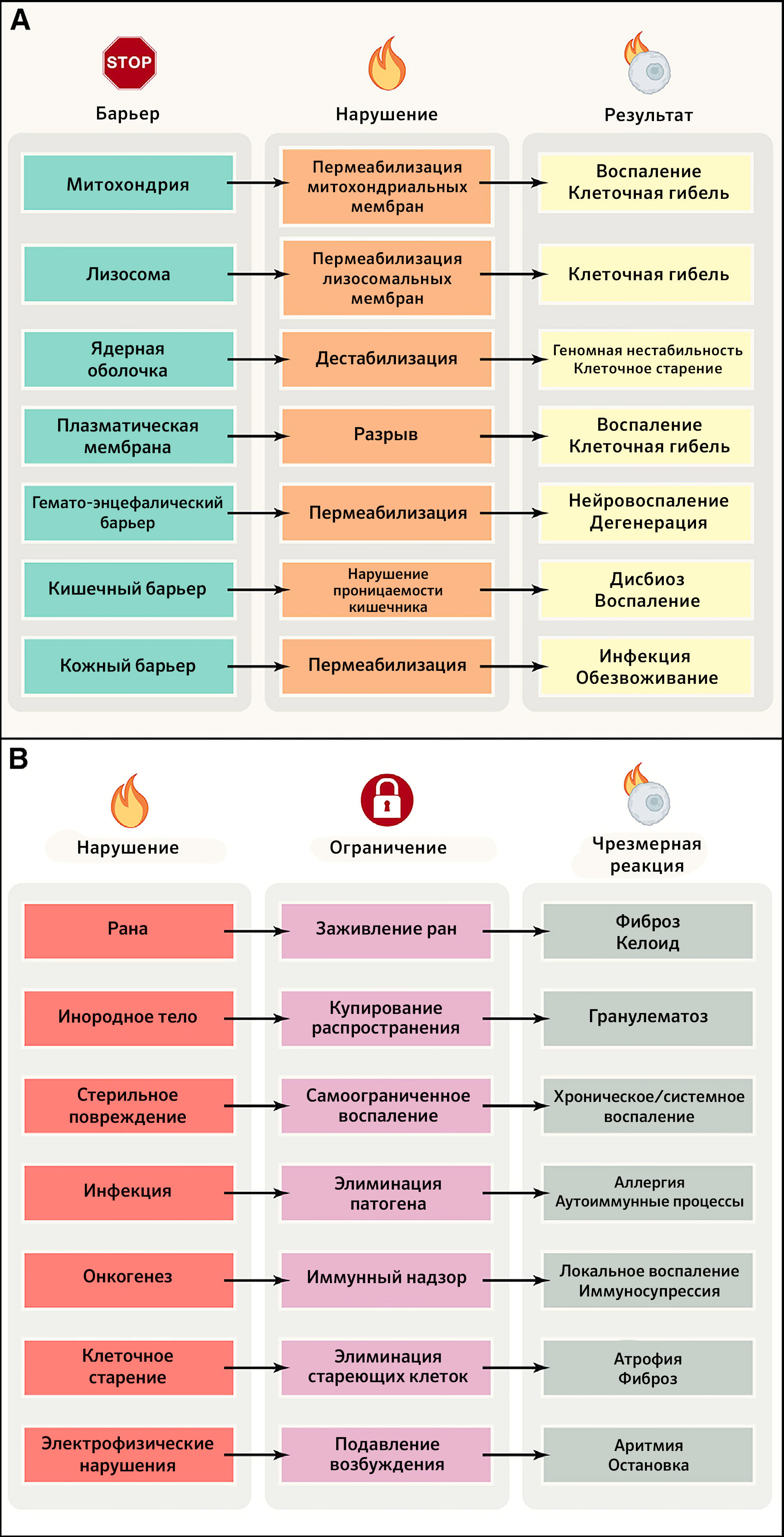
B) Механизмы ограничения локальных нарушений и последствия их чрезмерной активации. ПЛМ — пермеабилизация лизосомных мембран, ПММ — пермеабилизация митохондриальных мембран.
Целостность митохондриальной мембраны
Внутренняя мембрана митохондрий должна быть почти непроницаемой, чтобы поддерживать электрохимический градиент для окислительного фосфорилирования, и в то же время она должна обеспечивать транспорт ионов и метаболитов. Это достигается с помощью специфического липидного бислоя, лишенного холестерина и содержащего кардиолипин, а также специфические каналы транспортеры (в том числе антипортеры), и также путем транзиторного нарушения проницаемости митохондрий, которое возникает импульсно, сопровождается образованием активных форм кислорода (АФК) и усиливает транспорт молекул массой < 1500 Дa (Kuznetsov et al., 2017). Наружная митохондриальная мембрана должна удерживать потенциально опасные молекулы, такие как цитохром c, который активирует апоптосому (цитозольный комплекс активации каспаз), и фактор, индуцирующий апоптоз, который при транслокации в цитозоль или в ядро запускает каспазо-независимую клеточную гибель (Bock and Tait, 2020).
Пермеабилизация митохондриальной мембраны (MMP), которая может дифференциально затрагивать внешнюю (MOMP) и внутреннюю (MIMP) мембраны, составляет центральное координирующее событие внутреннего пути апоптоза и многих случаев некротической клеточной гибели (например, при нейрональной эксайтотоксичности и повреждении при ишемии-реперфузии) (Kroemer et al., 2007). Апоптоз связывают с преимущественной MOMP, опосредованной проапоптозными белками семейства BCL2, такими как BAX (Kalkavan and Green, 2018), в то время как некроз связывают с MIMP, вызываемой открытием поры PTP (permeability transition pore), которая, по-видимому, содержит некоторые компоненты ATФ-синтасомы и регуляторный белок циклофилин D/ PPIF (Karch et al., 2019). MOMP и MIMP — стрессовые и часто летальные события, которые могут запускаться множеством стимулов: дефицитом ионов, нарушением биоэнергетического или окислительно-восстановительного баланса, действием токсинов и активацией чувствительных к повреждениям путей в органеллах, отличных от митохондрий (Galluzzi et al., 2012). Необратимое открытие PTP с последующей потерей электрохимического градиента стимулирует митофагию (аутофагическое устранение деполяризованных митохондрий) и нарушает биоэнергетический и окислительно-восстановительный метаболизм (Youle, 2019). Полномасштабная MOMP приводит к высвобождению белков, индуцирующих клеточную гибель, в то время как частичная MOMP может вызвать сублетальную активацию каспаз, результатом которой становится повреждение ДНК и геномная нестабильность (Ichim et al., 2015). Комбинация MIMP и MOMP усиливает протрузию или высвобождение митохондриальной ДНК (обычно расположенной в матриксе), в результате чего активируется цитозольная синтаза циклических ГМФ-АМФ (cGAS) и путь стимулятора генов интерферона (STING), что запускает провоспалительный ответ и потенциально способствует клеточному старению (Riley et al., 2018). Нокаут индуктора MOMP (BAX) обеспечивает защиту в мышиных моделях инсульта, инфаркта, нейродегенеративных и других заболеваний, связанных с нежелательной гибелью клеток (Walensky, 2019). Нокаут PPIF — усилителя MIMP — снижает тяжесть ишемии-реперфузии во множестве органов (Briston et al., 2019) и предотвращает индуцируемую оксалатом острую почечную недостаточность, ослабление когнитивных функций, вызванное высоким уровнем глюкозы, гепатостеатоз, остеопороз, миопатию и острый панкреатит. Это стимулирует разработку ингибиторов, направленных на циклофилин D/PPIF и другие компоненты PTP (Panel et al., 2019).
В целом, представляется, что отсутствие чрезмерной MMP необходимо для поддержания здоровья на клеточном и организменном уровнях. Сходную, но хуже охарактеризованную роль можно приписать отсутствию пермеабилизации мембран лизосом (LMP) (Papadopoulos et al., 2020), которая служит событием, запускающим развитие лизосомных болезней накопления, а также может способствовать нейродегенерации, индуцируемой агрегатами α-синуклеина (Jiang et al., 2017) или черепно-мозговой травмой (Sarkar et al., 2020).
Целостность ядерной оболочки
В отличие от прочих внутриклеточных мембран или плазматической мембраны, ядерная оболочка содержит поры, которые позволяют молекулам избирательно перемещаться через нее. Через поры может происходить свободная диффузия метаболитов и белков массой до 30–60 кДа, активный импорт и экспорт более крупных белков, экспорт РНК, транскрибируемой с ДНК; при этом обеспечивается удержание ДНК в ядре (Beck and Hurt, 2017). Нарушение работы ядерных поровых комплексов, участвующих в ядерно-цитоплазматическом транспорте, связано со старением и широким спектром заболеваний — в частности, нейродегенеративных состояний (Sakuma and D’Angelo, 2017). Еще одна особенность ядерной оболочки — ее периодическая разборка в ходе каждого митоза при компактизации хромосом (Carlton et al., 2020). Утечка геномной ДНК может происходить в результате аберрантных митозов или при образовании грыжеподобных выростов ядерной оболочки в течение интерфазы. При контакте ядерной ДНК с цитоплазмой она может быть «спутана» с ДНК внедрившегося патогена и таким образом воспринята цитозольными паттерн-распознающими рецепторами, что запускает путь cGAS/STING и активирует пути, отвечающие за воспаление и старение (Lan et al., 2019). С этим согласуется и то, что мутации, затрагивающие ядерные поры или компоненты ядерной ламины, приводят к фенотипу с ускоренным старением, которое обусловлено геномной и эпигеномной нестабильностью, пониженной способностью к пролиферации и регенерации и усиленным воспалением (Gordon et al., 2014).
Целостность плазматической мембраны
Барьерная функция плазматической мембраны необходима для поддержания жизнеспособности клеток, а также для предотвращения попадания внутриклеточного материала во внеклеточное пространство, которое потенциально может приводить к провоспалительным последствиям. Разрыв плазматической мембраны происходит пассивно при нарушении ионного гомеостаза (например, в контексте биоэнергетический катастрофы или при действии на клетки токсинов, которые ингибируют ионные насосы) или может быть результатом активации порообразующих белков. В качестве примера можно привести порообразующий белок гасдермин E, который протеолитически активируется каспазой 3 на конечных этапах апоптоза и опосредует постапоптотический некроз, а также гасдермин D, активирующийся провоспалительными каспазами в контексте воспалительной клеточной гибели (пироптоза). Еще один пример — псевдокиназа MLKL (mixed lineage kinase domain like pseudokinase), которая может активироваться киназой RIP3 (receptor-interacting protein 3) и пермеабилизовать плазматическую мембрану при некроптозе. Несмотря на то, что эти пути (апоптоз, пироптоз и некроптоз) могут быть важны для устранения инфицированных или злокачественных клеток, они также могут играть роль в нежелательной потере клеток (Tang et al., 2019). Примечательно, что нарушение пироптозного каскада защищает от неалкогольного стеатогепатита (Xu et al., 2018a), острой почечной недостаточности, вызванной цисплатином (Miao et al., 2019), и диссеминированного внутрисосудистого свертывания крови, индуцированного бактериальным липополисахаридом (Yang et al., 2019). Сходным образом, ингибирование некроптоза имеет широкий оздоравливающий эффект в случае инсульта, острой почечной недостаточности и ишемии-реперфузии сердца, что позволяет предположить его пользу для подавления воспалительных и дегенеративных заболеваний (Martens et al., 2020).
Целостность гематоэнцефалического барьера
Гематоэнцефалический барьер (ГЭБ) поддерживается множеством типов клеток внутри так называемых нейроваскулярных единиц, включающих микроваскулярные эндотелиальные клетки мозга (МЭКМ, BMVECs), перициты, астроциты и другие типы клеток глии, нейроны и внеклеточный матрикс (ВКM). МЭКМ формируют сложные плотные контакты, которые способствуют трансцитозу как единственному механизму, который позволяет траспортировать молекулы из кровотока через стенку капилляров в ЦНС и наоборот. Более того, МЭКМ экспрессируют широкий спектр насосов, которые активно выкачивают многие липофильные малые молекулы, предотвращая их пассивную диффузию через ГЭБ, а также выводят ненужные продукты метаболизма и β-амилоид из интерстициальной мозговой жидкости в кровь. Нарушение функции ГЭБ связано со множеством неврологических заболеваний (Zhao et al., 2015). Оно может быть результатом аберрантной передачи сигналов между астроцитами и перицитами и/или эндотелием и перицитами, что вызывает локальное накопление железа или нейротоксичных белков из крови и снижение клиренса белков, связанных с нейродегенеративными процессами, внутри сложной самовоспроизводящейся системы, на которую влияют генетические факторы риска (например, в случае болезни Альцгеймера — аллель E4 гена APOE), факторы среды и образа жизни, а также артериальная гипертензия (Montagne et al., 2020; Zhao et al., 2015).
Целостность кишечного барьера
Кишечный барьер образован слизью, эпителиальным слоем и эпителиально-мезенхимным барьером. Слизь вырабатывается бокаловидными клетками и служит резервуаром для антимикробных пептидов и иммуноглобулина A (IgA), поскольку представляет собой первую структуру, которую должны преодолеть патогены для начала инфицирования (Johansson and Hansson, 2016). Другой барьер составляет кишечный эпителий, который состоит из множества различных специализированных клеток, ведущих свое начало от локализованных в крипте стволовых клеток: энтероцитов (для трансэпителиального переноса питательных веществ), бокаловидных клеток (для продуцирования слизи), клеток Панета (которые вырабатывают антимикробные пептиды), M-клеток (захватывающих образцы антигенов из полости кишечника), хеморецепторных щелочных клеток и энтероэндокринных клеток. Все эти клетки соединены плотными контактами, которые образуют избирательный полупроницаемый барьер между апикальным и базолатеральным компартментами, что обеспечивает возможность параклеточного транспорта (Kurashima and Kiyono, 2017). Еще один барьер — эпителиально-мезенхимный (обнаруженный не только в кишечном, но и в любом другом эпителии) — играет важную роль в передаче сигнала о нарушении эпителия иммунным клеткам кишечника, которые образуют скопления в ассоциированной с кишечником лимфоидной ткани или рассеяны по собственной пластинке кишечника и вышележащему эпителиальному пласту; они продуцируют факторы, необходимые для защиты от патогенов и восстановления эпителия (Nowarski et al., 2017).
Дисбаланс или отклонения в составе кишечной микробиоты («дисбиоз») могут нарушать барьерную функцию в кишечнике; возможна и обратная ситуация. Оба явления тесно связаны со множеством патологий, включая воспалительные заболевания кишечника (Fasano, 2020), целиакию (Odenwald and Turner, 2017), диабет первого типа (при котором нарушение проницаемости кишечника может запустить иммуноопосредованное разрушение β-клеток поджелудочной железы) (Sorini et al., 2019), диабет второго типа (при котором гипергликемия повреждает плотные контакты в эпителии кишечника) (Thaiss et al., 2018) и синдром Кавасаки (при котором провоспалительный цитокинов интерлейкин [IL]-1β вызывает нарушение проницаемости кишечника, приводящее, в свою очередь, к усилению сердечно-сосудистого воспаления) (Noval Rivas et al., 2019). На кишечную микробиоту в большой степени влияет состав рациона: он также напрямую воздействует на физиологию в целом, гомеостаз кишечника и общее состояние здоровья. Диета, лишенная растительных волокон, способствует эрозии слизистого барьера в толстом кишечнике со стороны микробиоты, что усиливает восприимчивость к бактериальному колиту, а также нарушает иммунную функцию в целом (Xavier et al., 2020). Синдром проницаемого кишечника позволяет бактериям и продуктам их жизнедеятельности достигать печени через систему воротной вены, что вызывает локальные повреждения; они вносят вклад в развитие часто встречающейся неалкогольной жировой болезни печени (НАЖБП) или системного воспаления и инфекции (Tilg et al., 2020). Хотя существует немало данных, которые позволяют предположить, что нарушение проницаемости кишечника участвует в развитии заболеваний у человека, а повреждение цепочек взаимодействий, которые приводят к этим состояниям, предотвращают или останавливают патогенез, ни одну из таких болезней нельзя вылечить простой нормализацией барьерной функции. Однако восстановление барьера может быть незаменимо для эффективности других терапевтических мер (Camilleri, 2019).
Барьерная функция респираторного тракта
Эпителий слизистой оболочки дыхательной системы, состоящий из реснитчатых клеток; клеток, вырабатывающих слизь и недифференцированных базальных клеток, разделяет просвет воздухоносных путей и паренхиму от носовой полости до альвеол, где альвеолярно-капиллярный барьер толщиной ~1 мкм образован альвеолярный эпителием и эндотелиальными клетками. Он делает возможным обмен O2 и CO2 между воздухом и кровью, в то же время обеспечивая нужную толщину и состав слоя поверхностной жидкости. Острый респираторный дистресс-синдром в первую очередь характеризуется усиленной экссудацией и нарушенным клиренсом альвеолярной и интерстициальной жидкостей. Дефекты мукоцилиарного аппарата, секретируемых антимикробных веществ и межклеточных контактов, а также изменения местной микробиоты вовлечены в широкий спектр патологий — от наследственного муковисцидоза и синдрома неподвижности ресничек до острой пневмонии и вызываемой сигаретным дымом хронической обструктивной болезни легких (Bhattacharya and Matthay, 2013).
Целостность кожи
Кожа — крупнейший орган тела; он покрывает всю его поверхность и выполняет множество функций, необходимых для поддержания здоровья. Кожа образует многослойный анатомический барьер, защищающий от микробных патогенов, физического или химического повреждения и чрезмерной потери воды, при этом обеспечивая терморегуляцию и селективно поглощая ультрафиолетовое излучение определенной длины волны для синтеза витамина D. Этот высокоадаптивный орган также играет ключевую роль в восприятии ощущений и иммунном надзоре и содержит множество видов бактерий, приносящих пользу здоровью за счет усиления многих аспектов барьерной функции кожи. Тем не менее, резидентные микроорганизмы кожи могут также вызывать повреждения и способствовать развитию ряда кожных патологий. Дефицит различных регуляторных и структурных компонентов сложной молекулярной сети — в том числе микроРНК (миРНК), филаггрина, коллагенов и протеолитических ферментов, — которые участвуют в становлении и поддержании архитектоники кожи, приводит к тяжелым патологиям. Помимо дерматологических заболеваний, начинающихся в самой коже, к характерным изменениям морфологии и функции кожного покрова приводят также старение и большинство системных патологий.
Подводя итог, можно сказать, что целостность барьеров — общий признак здоровья (рисунок 2A). Есть множество примеров обширных благоприятных для здоровья эффектов поддержания барьерной функции, в то время как повреждение этих внутренних или внешних барьеров по своей природе патогенно (тaблица 1).
Признак 2: ограничение локальных нарушений
Организм человека постоянно испытывает скрытые или явные локальные воздействия, которые могут быть результатом внутренних «аварий», возникающих, среди прочего, в ходе неполного или асимметричного деления клеток, вследствие нарушения репарации ДНК, потери клетками (эпи)генетической идентичности и накопления неработающих органелл или белков. Более того, местные нарушения и повреждение барьеров часто вызывают внешние агенты, такие как внедряющиеся патогены; механическая, химическая или физическая травма. Во всех этих случаях для поддержания здорового состояния требуется ограничить область повреждения, чтобы избежать его распространения на системном уровне, которое может вызвать необратимую утрату функциональных единиц и неспособность организма восстановить повреждения. Такая ситуация приводит к развитию заболеваний и, в конце концов, смерти от системного воспаления, неконтролируемой инфекции или злокачественных новообразований (рисунок 2B).
Восстановление барьеров
Разрывы ядерной оболочки внутри клеток способны самовосстанавливаться (Lan et al., 2019). Представляется вероятным, что мутации как BANF1, так и ламина A, вызывающие синдромы прогерии Нестора — Гильермо и Хатчинсона — Гилфорда, нарушают этот процесс (Halfmann et al., 2019). Это объясняет, почему эти два синдрома затрагивают преимущественно органы, подверженные механическим воздействиям. Ограниченное повреждение лизосом и точечная пермеабилизация плазматической мембраны устраняются в ходе процесса, в котором участвуют эндосомные сортирующие комплексы, необходимые для транспорта (ESCRT) (Papadopoulos et al., 2020). Так, комплекс ESCRT-III может предотвратить чрезмерную гибель клеток путем некроптоза (при котором происходит пермеабилизация плазматической мембраны) в контексте трансплантации почки (Gong et al., 2017). На тканевом уровне потеря одной эпителиальной клетки в кишечном или респираторном тракте активирует немедленное закрытие бреши соседними эпителиальными клетками (Gagliardi and Primo, 2019), в то время как удаление роговых чешуек с наружного слоя эпидермиса кожи запускает быструю компенсаторную пролиферацию клеток в базальном слое, сопряженную с выделением микробицидной жидкости. На суборганном уровне повреждение вследствие местной травмы (такой как порезы, обморожения или ожоги) запускает быструю реакцию ранозаживления для устранения разрыва; при этом пошагово активируется серия ответов, включающая местное воспаление с быстрым привлечением нейтрофилов и макрофагов, капиллярный ангиогенез и компенсаторную пролиферацию фибробластов и эпителиальных клеток. Сниженная способность к ранозаживлению, характерная для пожилого возраста, повышает восприимчивость к хроническим и системным осложнениям (Willyard, 2018). Чрезмерное заживление раны может привести к фиброзу и образованию келоидных рубцов с помощью процесса, в котором участвует локальная гиперпродукция трансформирующего фактора роста β.
Устранение инородных тел
Инородные тела, в том числе внедряющиеся патогены, которые преодолевают кожные или слизистые барьеры, запускают множество реакций, которые изолируют их от окружающих тканей и ограничивают их распространение, особенно в случае, если они не могут элиминироваться путем фагоцитоза. Один из наиболее быстрых механизмов включает в себя внеклеточные ловушки: нейтрофилы и прочие иммунные клетки создают внеклеточные сети, выбрасывая ДНК и антимикробные белки — явление, полезное для локального контроля внедряющихся патогенов и опасное для организма хозяина в том случае, если оно происходит на системном уровне (Daniel et al., 2019; Silvestre-Roig et al., 2019). Местная вазоконстрикция и формирование тромба не только способствуют остановке кровотечения, но способны также помогать предотвращать распространение внедрившихся патогенов и диффузию токсинов (Berling and Isbister, 2015). Инкапсуляция — более медленный процесс, при котором чужеродный объект окружается фибробластами и коллагеном для изоляции его от здоровых тканей путем развития реакции на инородное тело. Она происходит в контексте заноз и внедрения паразитов, но имеет место также и при супрессии опухолевого роста (Qin et al., 2002). В том случае, когда образование гранулемы не локальное, может происходить системное гранулематозное воспаление, что случается при ряде инфекционных заболеваний, болезнях Бека и Крона и ревматоидном артрите и иллюстрирует дезадаптивный воспалительный ответ (Brooks et al., 2019).
Самоограничивающееся воспаление
В физиологическом контексте воспаление ограничивается в пространстве и во времени множеством механизмов (Furman et al., 2019). Пространственное ограничение обеспечивается местным действием воспалительных медиаторов: таким образом можно избегать системных реакций, вторичных по отношению к цитокиновым штормам, которые обычно вызывают лихорадку и действуют на системные взаимосвязи с последующим перераспределением ресурсов в контексте поведения, вызванного болезнью (Wang et al., 2019a). Например, когда компоненты и регуляторы инфламмосом, необходимые для протеолитического созревания IL-1β, мутируют или становятся аномально чувствительными к активации (или нечувствительными к инактивации), системное воспаление вызывает повторяющиеся эпизоды лихорадки в ответ на ситуацию, которая обычно вызывает локализованное, несистемное воспаление (Kesavardhana et al., 2020). Временное ограничение или разрешение воспаления достигаются при устранении его первичной причины (например, удалении патогена или заживлении раны), а также с помощью множества петель отрицательной обратной связи, которые действуют локально (как следствие снижения количества воспалительных клеток и факторов или путем выработки противовоспалительных медиаторов) или системно (например, глюкокортикоиды) (Basil and Levy, 2016). Разрешение воспаления необходимо для предотвращения повреждения ткани и развития фиброза, который неизбежно ведет к перманентной дисфункции органа, что видно на примере келоидных рубцов в случае кожи, эмфиземы и фиброза легкого, цирроза печени, гломерулосклероза почки или глиоза мозга (Weiskirchen et al., 2019). Хроническое системное воспаление может стать результатом невозможности устранить патогенный агент — как инфекционный (например, при малярии и туберкулезе), так и неинфекционный (например, кристаллы солей мочевой кислоты при подагре). Такой тип неограниченного воспаления широко распространен и вносит вклад в процесс старения (inflammaging). Для лечения хронических воспалительных заболеваний используются противовоспалительные средства, в том числе аспирин и ингибиторы провоспалительных цитокинов; они также могут иметь относительно широкие благоприятные для здоровья эффекты, как видно на примере факта того, что ингибирование IL-1β улучшает состояние при атеросклерозе и предотвращает сердечную недостаточность, при этом снижая частоту рака легких в клинических испытаниях (Everett et al., 2019; Ridker et al., 2017).
Врожденные и приобретенные иммунные реакции
Самые примитивные врожденные иммунные реакции происходят на клеточном уровне, позволяя клеткам уменьшать трансляцию мРНК, кодирующих вирусные белки, — это достигается за счет активации комплексной реакции на стресс (КРС/ISR), которая заключается в фосфорилировании эукариотического фактора инициации (eIF2α) с помощью активирующихся в ответ на стресс каналов и дальнейшей детекции, изоляции и разрушения внутриклеточных патогенов под действием аппарата аутофагии (Costa-Mattioli and Walter, 2020). Интерфероны (IFN) первого типа, которые секретируются инфицированными клетками, оказывают паракринное воздействие на соседние клетки, как индуцируя IFN-зависимые гены, так и стимулируя КРС (Schoggins, 2019). Эффекторы врожденного иммунитета быстро активируются молекулярными паттернами, ассоциированными с микробами (MAMP), которые вырабатываются различными вирусами, бактериями, грибами и другими паразитами. В области повреждения ткани такие врожденные эффекторы также запускаются молекулярными паттернами, ассоциированными с опасностью (DAMP), которые обычно представляют собой эндогенные метаболиты и многочисленные белки, в норме заключенные во внутриклеточном пространстве, но при повреждении экспонирующиеся на поверхности клетки или попадающие во внеклеточное пространство. Интересно, что экспонирование DAMP кальретикулина (который запускает фагоцитоз клеток в состоянии стресса макрофагами и дендритными клетками) и секреция DAMP ATФ (действующего на пуринергические рецепторы для привлечения и активации подвижных эффекторов иммунитета) зависят от КРС и аутофагии, соответственно (Galluzzi et al., 2017). DAMP и MAMP действуют на пересекающиеся множества рецепторов распознавания патогенов (PRR), которые преимущественно экспрессируются миелоидными клетками, и работают как адъюванты (Gong et al., 2020). В результате вблизи повреждения формируются третичные лимфоидные органы или усиливается транспорт антигенного материала ко вторичным лимфоидным органам, в том числе к лимфатическим узлам. Эти лимфоидные органы обеспечивают подходящую среду для начала иммунного ответа со стороны В- и Т-лимфоцитов (Kabashima et al., 2019). В идеальных условиях эти ответы настолько быстры, что патоген нейтрализуется до того, как он распространится по телу, — так происходит при наличии иммунной памяти об успешной защите от микробов со сходными антигенами (Le Bert et al., 2020). Неспособность к быстрому и эффективному иммунному ответу — вследствие патогенности инфекционного агента или в результате генетического или приобретенного иммунодефицита — приводит к системной инфекции, несущей потенциальную угрозу для жизни (Casanova and Abel, 2018). Более того, неспособность ограничить воспалительный иммунный ответ на локальном уровне приводит к системным аутовоспалительным и аутоиммунным заболеваниям (Savic et al., 2020).
Противоопухолевый иммунный надзор
Онкогенная трансформация клеток, вызванная накоплением генетических и эпигенетических изменений, приводит к развитию злокачественной опухоли только в случае избегания иммунного надзора. В соответствии с «гипотезой трех "Е"», зарождающиеся опухолевые клетки обычно элиминируются иммунными эффекторами (elimination), затем устанавливается равновесие (equilibrium) между пролиферацией и иммунным клиренсом в области вялотекущего нарушения и, наконец, клетки ускользают (escape) от иммунного надзора, чтобы локально инфильтрировать ткани и распространяться в виде метастазов в отдаленные участки организма (Dunn et al., 2004). Многие механизмы, позволяющие сдерживать инфекции микробными патогенами, также могут использоваться в противоопухолевых иммунных реакциях, которые зависят от IFN и DAMP, передающих вспомогательные сигналы, а также от экспрессии ассоциированных с опухолью антигенов, которые отличаются от нормальных и в идеале имеют кросс-реактивность с микробными антигенами (Fluckiger et al., 2020; Galluzzi et al., 2017). Эти иммунные механизмы эффективны, если они приводят к ответу цитотоксических Т-лимфоцитов, часто в контексте внутриопухолевых третичных лимфоидных структур (Sautès-Fridman et al., 2019). Напротив, реакции сдерживания, такие как ранозаживление или инкапсуляция, дезадаптивны, поскольку они благоприятствуют пролиферации опухолевых клеток и препятствуют миграции Т-лимфоцитов в лимфатические узлы (Jerby-Arnon et al., 2018). Опухолевые клетки подвержены генетическому или эпигенетическому отбору во враждебном опухолевом микроокружении, и этот отбор направлен на активное подавление противоопухолевых иммунных реакций или на устранение вспомогательных сигналов (DAMP) и «сокрытие» антигенов, ассоциированных с опухолью (Burr et al., 2019). Отчасти по этой причине, даже после фазы начального успеха, противоопухолевая иммунотерапия обычно неэффективна, если применяется на поздних стадиях заболевания. Напротив, превентивная стимуляция иммунного надзора может снижать частоту злокачественных новообразований (Buqué et al., 2020).
Клеточное старение и его клиренс
Генотоксические агенты, воспалительные факторы и метаболические сигналы могут индуцировать клеточное старение, которое состоит в практически необратимой остановке клеточного цикла и приобретении секреторного фенотипа, ассоциированного со старением (SASP). Этот фенотип может мобилизировать иммунные эффекторы и запускать воспаление, таким образом обеспечивая распространение старения клеток. Хотя стареющие клетки, которые образуются после местного повреждения, могут иметь положительные эффекты в том смысле, что они стимулируют ранозаживление и участвуют в супрессии опухолей, их накопление на уровне тканей и всего организма способствует нарушению функции органов и старению (Xu et al., 2018b). Действительно, с возрастом внутренние повреждения пролиферирующих клеток приводят к их старению, которое сопровождается снижением клиренса стареющих клеток макрофагами (He and Sharpless, 2017).
Ограничение прочих нарушений
Многие нейротоксические белки действуют как прионы (белковые инфекционные частицы) и передают свою трехмерную структуру с неправильной укладкой близлежащим белкам, в результате чего и они приобретают подобную форму. Неспособность удерживать такие белки в определенных областях, таким образом, способствует развитию заболеваний (Iadanza et al., 2018). Другими примерами патологий, связанных с невозможностью ограничить нарушения, служат эпилепсия и нарушения сердечного ритма: в этом случае не ограниченное в пространстве и времени распространение возмущений имеет патогенный эффект и требует терапевтических мер, состоящих в устранении фокуса или ингибировании возбуждающих цепочек взаимодействий. Примечательно, что генетические манипуляции, ведущие к снижению возбудимости в нервной системе, могут увеличить продолжительность жизни у нематод и мышей (Zullo et al., 2019), что указывает на еще плохо изученную возможность более общего применения этих результатов.
Подводя итог, можно сказать, что существует множество механизмов ограничения физического или химического повреждения и воспаления, элиминации патогенов, возникающих злокачественных опухолей и стареющих клеток и преодоления других нарушений. Невозможность изолировать или пространственно ограничить такие повреждения и разрешить их в течение времени приводит к развитию системных заболеваний (таблица 1). Парадоксально, что неспособность сдерживать ограниченные реакции также патогенна: это означает, что чрезмерное ранозаживление или реакции на инородное тело, равно как избыточный или персистирующий воспалительный или иммунный ответ, выходящий за пределы локального контекста, несовместимы с человеческим здоровьем (рисунок 2B). Широкий благоприятный эффект на состояние здоровья оказывают меры по улучшению ранозаживления, ограничению воспаления, усилению иммунных реакций на инфекционные агенты, улучшению иммунного надзора и предотвращению распространения клеточного старения.
Признак 3: рециклирование и обновление
Даже в контексте близкой к идеальной пространственной компартментализации вследствие поддержания барьерных функций и работающих должным образом ограничительных механизмов каждая из субклеточных, клеточных и суборганных единиц, составляющих организм, претерпевает модификации, становящиеся результатом эндогенных повреждений (таких как окислительные модификации белков, липидов и нуклеиновых кислот или спонтанная денатурации и деградация макромолекул, которые теряют свою нативную конформацию) или экзогенного стресса (приводящего к ускорению повреждения). Таким образом, чтобы избежать дегенерации, большинство клеточных компонентов и типов клеток должны постоянно рециклировать. Это означает, что они должны подвергаться активному разрушению, за которым следует замена новыми элементами, не содержащими ошибок (рисунок 3).
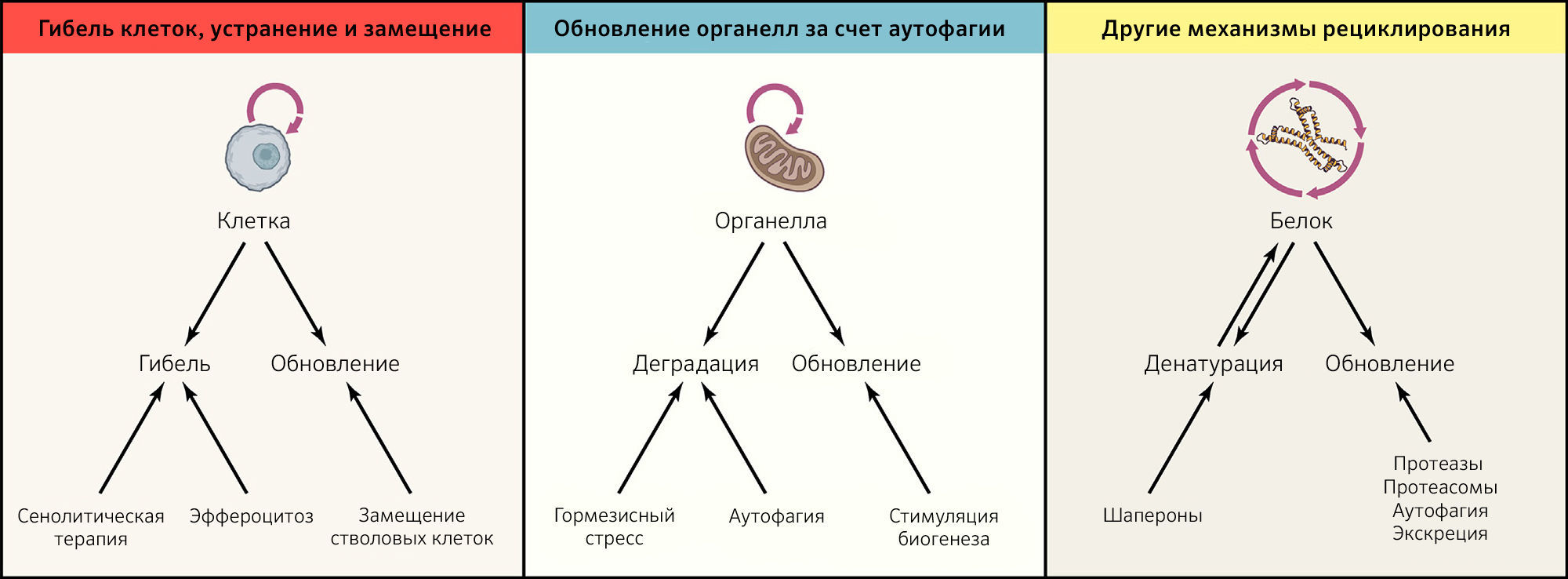
Гибель клеток, их устранение и замена
Роговые чешуйки, расположенные на поверхности кожи, подвергаются десквамации по мере того, как они замещаются за счет пролиферирующих клеток базального слоя, которые продвигаются вверх, претерпевая терминальную дифференцировку и ороговение. Клетки на поверхности слизистых оболочек могут отслаиваться, будучи живыми, или подвергаться опосредованной апоптозом экструзии, при которой соседние клетки используют актомиозиновый цитоскелет, чтобы создать сократительное (контрактильное) кольцо, сжимающееся, когда апоптотическая клетка вытесняется в полость органа (Gagliardi and Primo, 2019). После гибели клетки в составе внутренних органов должны спокойно устраняться путем фагоцитоза — этот процесс известен как эффероцитоз (Morioka et al., 2019). Для этого гибнущие клетки должны выделять растворимые сигналы «find-me», которые привлекают фагоциты, мембраносвязанные сигналы «eat-me», которые усиливают их узнавание и поглощение фагоцитами, а также противовоспалительные сигналы, позволяющие избежать нежелательной и чрезмерной реакции (Medina et al., 2020). Нарушения клиренса приводят к накоплению погибших клеток, попаданию их содержимого в ткани, воспалению и аутоиммунным реакциям (Morioka et al., 2019). Неопластические клетки склонны к снижению экспрессии сигналов «eat-me» и повышению экспрессии сигналов «do not eat-me» (таких как CD47) на своей поверхности для избежания фагоптоза (программируемая гибель путем фагоцитоза). По этой причине клинически полезными в роли противоопухолевых агентов могут быть антитела, нейтрализующие сигналы «do not eat-me» (Feng et al., 2019). Кроме того, экспрессия CD47 повышается в ходе ангиогенеза, и его блокирование может предотвратить развитие атеросклероза у мышей (Kojima et al., 2016), что иллюстрирует еще один пример благоприятных для здоровья эффектов эффероцитоза.
Сложность обновления клеток основывается на необходимости сохранять равновесие между потерей клеток, их устранением и пролиферацией (рисунок 3). Для замещения погибших клеток пул стволовых клеток должен поддерживать свой размер, целостность генома и эпигенетическую идентичность — три характеристики, которые склонны теряться с возрастом. Для поддержания тканевого гомеостаза и при некоторых заболеваниях, таких как злокачественные опухоли, также важна клеточная конкуренция между различными клонами клеток (Baker, 2020). Экспансия (эпи)генетически измененных клеток — как при клональном гемопоэзе — сопровождает старение и предрасполагает к развитию воспалительных и злокачественных заболеваний (Cheung et al., 2018; Yokoyama et al., 2019). Скорость обновления очень различается среди определенных типов клеток и тканей: она высокая в случае нейтрофильных гранулоцитов и энтероцитов, очень низкая — для нейронов в ЦНС и еще ниже — для кардиомиоцитов после неонатальной фазы. Этим может объясняться специфичность кратковременной токсичности химиотерапии и облучения всего тела, а также тот факт, что среди всех органов именно сердце и ЦНС наиболее часто демонстрируют фенотип с медленной дегенерацией после химиотерапии и в ходе старения (Baar et al., 2017).
Для улучшения обновления клеток существует две общие терапевтические стратегии. В первом случае дифференцированные соматические клетки репрограммируются в плюрипотентное состояние — например, с помощью транзиторной и циклической экспрессии транскрипционных факторов Яманаки (Oct4, Sox2, Klf4 и c-Myc). Это уменьшает проявление фенотипов, связанных с возрастом, и повышает устойчивость мышей к диабету первого типа, индуцируемому токсинами, или мышечным повреждениям, предположительно, благоприятствуя замещению поврежденных или погибших клеток (Ocampo et al., 2016). Во втором случае апоптотическая клеточная гибель преимущественно индуцируется в стареющих клетках, которые накапливаются в стареющих тканях и должны замещаться молодыми функциональными клетками, возникающими за счет компенсаторной пролиферации (He and Sharpless, 2017). Такую «сенолитическую» терапию можно осуществлять путем экспрессии «генов самоубийства» под контролем индуцибельных промоторов (как у p16Ink4); это вызывает уменьшение признаков старения у мышей (Baker et al., 2011). Более того, «сенолитические лекарства», которые противодействуют устойчивости стареющих клеток к запуску апоптоза по внутреннему пути (такие как антагонист BCL2 навитоклакс), препятствуют старению мышей, а также предотвращают развитие диабета, вызванное диетой с высоким содержанием жиров (Aguayo-Mazzucato et al., 2019). Для других сенолитических агентов (таких как дазатиниб плюс кверцетин) показаны широкие полезные для здоровья эффекты на мышиных моделях атеросклероза, повреждения сердца, нейродегенеративных состояний, гепатостеатоза и диабета второго типа, а также у человека при идиопатическом фиброзе легких (Khosla et al., 2020).
Aутофагия
В пролиферирующих клетках каждый клеточный цикл приводит к разведению цитоплазмы в два раза, что усиливает ее обновление. Следовательно, в неделящихся или медленно пролиферирующих клетках цитоплазма должна обновляться за счет альтернативных механизмов. Один из этих механизмов — макроаутофагия (обычно называемая «аутофагией»), при которой крупные белковые агрегаты и целые органеллы могут секвестрироваться в двумембранных везикулах — аутофагосомах, — которые затем сливаются с лизосомами для переваривания их люминального содержимого гидролазами, работающими при низком pH (рисунок 3). Аутофагия может быть неселективной — в случае, когда она индуцируется в ответ на голодание после активации энергетических сенсоров или снижения уровня трофических факторов, но может происходить и селективно для элиминации карго с маркерами на деградацию, например, в виде убиквитинирования и/или связывания со специфическими рецепторами аутофагии (Levine and Kroemer, 2019).
Aутофагия работает на низком базовом уровне, и ее нарушение путем нокаута специфических генов аутофагии (ATG) приводит к накоплению внутриклеточных телец (состоящих из агрегатов неправильно уложенных белков) и дегенерирующих органелл — в частности, митохондрии имеют тенденцию к снижению эффективности окислительного фосфорилирования и гиперпродукции АФК (Levine and Kroemer, 2019). Поэтому генетическое ингибирование аутофагии приводит к нарушению функции и гибели большинства типов клеток, в которых не экспрессируются гены ATG. У мышей после индуцибельного нокаута Atg7 все изученные органы претерпевали дегенеративные изменения, и животные погибали от генерализованной нейродегенерации в течение 2–3 месяцев (Karsli-Uzunbas et al., 2014). Восстановление базальной аутофагии после ее транзиторного ингибирования частично снимает такой фенотип с преждевременным старением, однако при этом выявляется заметное увеличение частоты возникновения злокачественных новообразований, что подтверждает идею о роли аутофагии в опухолевой супрессии (Cassidy et al., 2020). Существует множество генетических заболеваний человека, при которых центральная часть аутофагического аппарата практически не затрагивается, но нарушается работа регуляторов и рецепторов аутофагии; такие частичные нарушения аутофагических путей ведут к развитию злокачественных опухолей, органоспецифичных заболеваний (чаще всего это нарушения развития нервной ткани и нейродегенеративные заболевания) или полиорганных синдромов (часто сопровождающихся воспалением) (Levine and Kroemer, 2019). Более того, ожирение с лежащим в его основе избытком питательных веществ и трофических факторов может ускорять старение и служить ранним проявлением связанных с возрастом заболеваний — частично вследствие ингибирования аутофагии (López-Otín et al., 2016).
Aутофагию можно рассматривать как важнейший цитоплазматический механизм обновления, что объясняет, почему прямая стимуляция аутофагии генетическими манипуляциями, ограничением потребления калорий, циклами голодания, кетогенной диетой, ингибированием сигнальных путей инсулина/IGF1 или фармакологические воздействия на сенсоры питательных веществ (например, с помощью рапалогов или спермидина) увеличивают общую продолжительность жизни и продолжительность здоровой жизни у модельных организмов (Madeo et al., 2019). У мышей, помимо эффекта предотвращения старения в целом (Eisenberg et al., 2016; Harrison et al., 2009), фармакологическое усиление аутофагии оказывает широкое воздействие на зависящее от времени проявление мажорных заболеваний, включая наследственные митохондриальные болезни, метаболический синдром, атеросклероз, гепатостеатоз, сердечную недостаточность, вызванную гипертензией, и многочисленные нейродегенеративные заболевания. Действительно, аутофагия защищает клетки от преждевременной гибели, снижает воспаление и улучшает противоопухолевый надзор. С точки зрения механизмов цитопротекция достигается аутофагической секвестрацией поврежденных митохондрий, устранением потенциально токсичных агрегатов неправильно уложенных белков и разрушением белков, способствующих некроптозу, в том числе RIP3 (Xie et al., 2020). Воспаление уменьшается в силу того, что аутофагия препятствует выходу ДНК из поврежденных митохондрий, секвестрирует микроядра, снижает содержание компонентов инфламмасом и противодействует пути cGAS/STING (Hopfner and Hornung, 2020). Иммунный надзор усиливается вследствие благоприятного влияния на иммуногенную гибель опухолевых клеток (Pietrocola et al., 2016), а также на обновление Т-клеток, предотвращая истощение Т-лимфоцитов, инфильтрирующих опухоль (Vodnala et al., 2019).
Mитофагия, которая представляет собой аутофагию, специфично направленную на митохондрии, выделяется среди специфических путей аутофагии, поскольку ее генетические дефекты участвуют в нейродегенеративных состояниях, таких как болезнь Паркинсона. Более того, активация аутофагии предшественниками никотинамидадениндинуклеотида (NAD+) обладает широкими эффектами улучшения здоровья в моделях старения сосудов и дилатационной кардиомиопатии у грызунов (Das et al., 2018; Katsyuba et al., 2018), а также препятствует связанному с возрастом повышению количества провоспалительных цитокинов у пациентов (Elhassan et al., 2019).
Прочие механизмы обновления, затрагивающие белки
Внутриклеточные белки, которые неправильно свернулись или утратили свои функции вследствие посттрансляционных модификаций, могут разрушаться с помощью дополнительных механизмов в зависимости от их структуры и внутриклеточной локализации (Boland et al., 2018). Ряд возрастных нейродегенеративных заболеваний, включая болезни Альцгеймера, Паркинсона и Хантингтона, латеральный амиотрофический склероз и лобно-височную деменцию, представляют собой «протеинопатии» и характеризуются накоплением аномально процессированных и неправильно уложенных белков (таких как β-амилоид, α-синуклеин, мутантный Хантингтон, тау и TDP-43). В обновлении этих белков задействовано множество механизмов. В нейронах и глиальных клетках удаление нейротоксичных белков преимущественно осуществляется убиквитино-протеасомной системой (UPS) (см. также признак 8) или путем аутофагии; такие белки также могут выбрасываться во внеклеточное пространство экзосомами в процессе с участием аппарата аутофагии. Лимфатическая система и ГЭБ выделяют нейротоксичные белки из интерстициальной и цереброспинальной жидкостей, где они также могут деградировать под действием протеаз или фагоцитироваться микроглией и астроцитами (рисунок 3). Нарушение всех этих механизмов напрямую участвует в патогенезе возрастных нейродегенеративных состояний, в то время как их восстановление изучается в качестве потенциальной терапевтической стратегии (Boland et al., 2018).
Подводя итог, можно сказать, что для поддержания здорового статуса необходимы сбалансированные деградация и обновление различных компонентов организма (рисунок 3; таблица 1). Искусственная стимуляция рециклирования растягивает биологическое время, снижает энтропию и таким образом замедляет старение и задерживает развитие связанных с возрастом заболеваний.
Признак 4: интеграция цепей взаимодействий
Организмы построены так, чтобы облегчать объединение цепей взаимодействий внутри и между различными уровнями организации, что придает им способность к поддержанию стабильности всей системы с течением времени (рисунок 4).
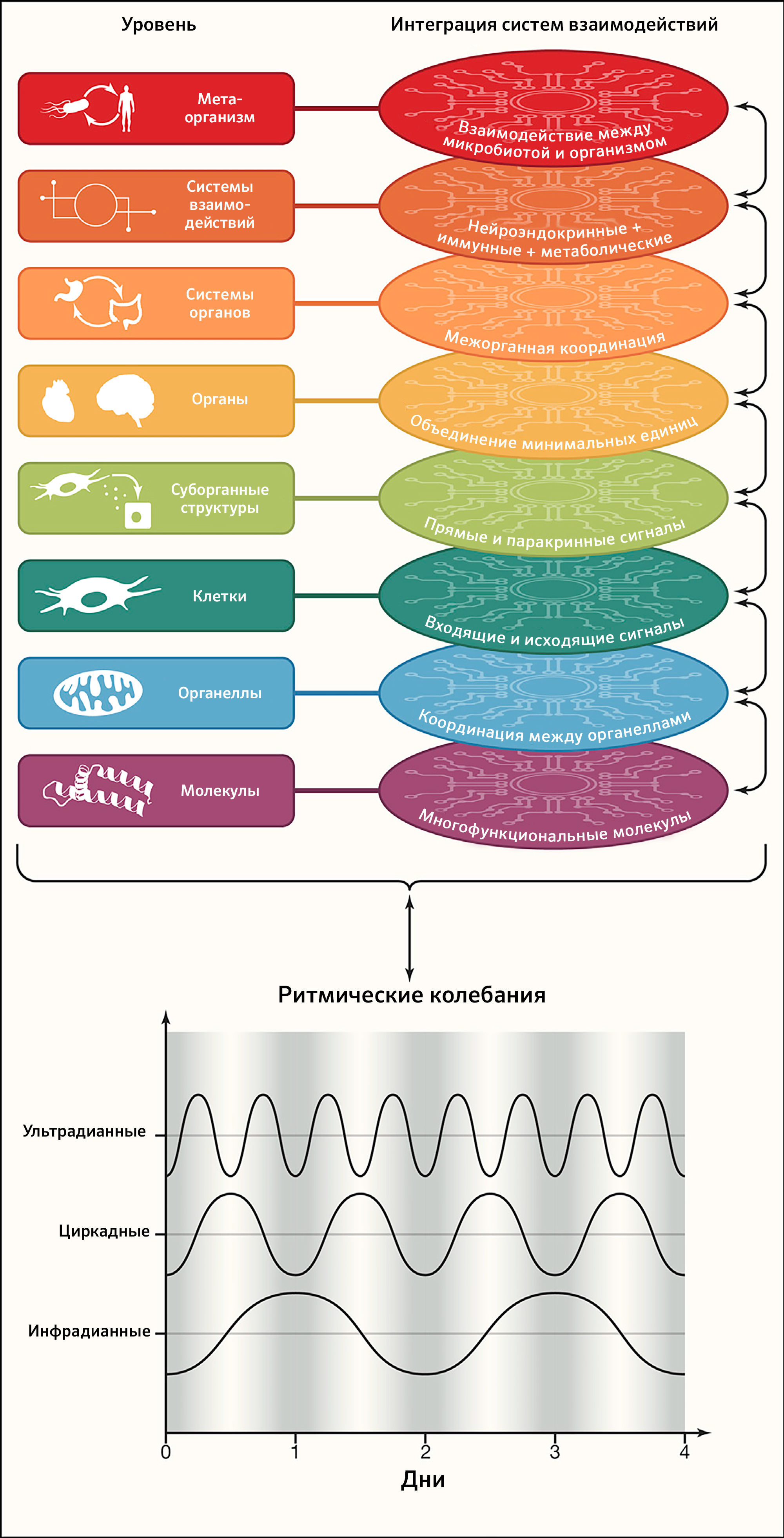
Внутриклеточные взаимодействия
Каждая молекула, молекулярный комплекс или органелла могут участвовать в нескольких функциональных путях. Например, метаболиты, помимо участия в анаболических и катаболических реакциях, могут передавать информацию. Внутриклеточные метаболиты выступают в качестве вторичных мессенджеров — примером служит АМФ, который активирует энергетический сенсор, АМФ-зависимую киназу (Steinberg and Carling, 2019), или ацетил-кофермент A, который влияет на ацетилирование ферментов обмена веществ, белков, участвующих в аутофагии, и гистонов (Pietrocola et al., 2015). Сходным образом, в резком контрасте с изначальными предположениями (подобно гипотезе «Один ген — один белок — одна функция»), каждый белок многофункционален. Так, ферменты обычно регулируются и другими факторами, помимо их субстратов и продуктов; у ионных каналов, таких как муковисцидозный трансмембранный рецептор (CFTR), ключевые функции могут влиять на протеостаз (Strub and McCray, 2020); а рецепторы распознавания паттернов собирают как информацию от патогенов, так и внутренние сигналы опасности хозяина (Fitzgerald and Kagan, 2020) — это лишь некоторые примеры. Внутриклеточные белки подвергаются множеству посттрансляционных модификаций, которые, подобно коду из комбинации цифр, влияют на их локализацию в клетке, активность и физические взаимодействия, таким образом связывая их с многочисленными регуляторными системами (Conradi and Shiu, 2018). На транскрипцию генов влияет сложное взаимодействие эпигенетических модификаторов и транскрипционных факторов, каждый из которых регулируется посттрансляционными модификациями и часто — аллостерическими модуляторами. Кодирующие и некодирующие РНК влияют друг на друга в плане их стабильности, создавая сеть, которая может подавлять случайные флуктуации и повышать устойчивость биологических процессов (Ebert and Sharp, 2012). Центральные органеллы взаимосвязаны определенными микроанатомическими структурами, например, такими как мембраны, ассоциированные с митохондриями (MAM), которые связаны с эндоплазматическим ретикулумом (ЭПР); внешняя митохондриальная мембрана координирует липидный метаболизм или передает сигналы с участием Ca2+, стимулирующие респиратор или открывающие PTP (Perrone et al., 2020). Все эти свойства позволяют клеткам справляться с изменяющимися и часто стрессовыми внутренними или внешними условиями.
Коммуникация изнутри кнаружи
Внутриклеточный стресс может передаваться во внеклеточное пространство, чтобы способствовать системным адаптивным реакциям (Galluzzi et al., 2018). В крайнем случае, при клеточной гибели, клетки изменяют свойства своей поверхности и выделяют ряд определенных DAMP. Точная природа таких изменений клеточной поверхности и DAMP зависит от активации предсмертных стрессовых путей и типа клеточной гибели, создавая таким образом комбинаторный код, определяющий судьбу погибшей клетки, ее поглощение тем или иным типом фагоцитов и функциональные последствия (воспаление или его подавление, иммунитет или толерантность) (Morioka et al., 2019). Также передается информация и о сублетальном стрессе. Так, повреждение ДНК обычно стимулирует продукцию IFN, а также усиливает распознавание таких клеток Т-лимфоцитами и натуральными киллерами (NK-клетками) благодаря повышению экспрессии молекул MHC I класса и NK-aктивирующих лигандов, соответственно. Сходным образом, наружу передаются сигналы о стрессе митохондрий и ЭПР. Например митохондриальный стресс в мышцах приводит к секреции фактора роста и дифференцировки 15 (GDF15) и фактора роста фибробластов 21 (FGF21) в системный кровоток, что позже изменяет пищевое поведение и обмен липидов в адипоцитах (Galluzzi et al., 2018). Аутофагия, индуцированная голоданием, вызывает выделение белка, связывающего ацил-кофермент A (ACBP), во внеклеточное пространство, таким образом активируя механизмы обратной связи, ингибирующие аутофагию и стимулирующие аппетит для усиления поглощения питательных веществ (Bravo-San Pedro et al., 2019).
Коммуникация снаружи вовнутрь
Специализированные клетки, функционирующие в органах чувств (такие как фоторецепторные клетки сетчатки или волосковые клетки внутреннего уха), воспринимают специфические входящие сигналы (такие как свет или звук). Однако даже неспециализированные клетки должны постоянно собирать информацию из внешнего мира. Она может быть физической (например, температура, механическое раздражение, артериальное давление и деформация) или химической (изменения pH, парциальное давление кислорода и двуокиси углерода, oсмолярность и внеклеточные метаболиты, которые действуют на транспортеры питательных веществ и специфические рецепторы). Более того, клетки получают входящие сигналы от межклеточных контактов, в том числе при прямом соединении с участием щелевых контактов и микроканалов, а также в виде нейроэндокринных сигналов в форме аминов, пептидов, белков, эйкозаноидов и стероидов (Lee et al., 2019). Малое время полужизни многих из этих медиаторов, а также существование связывающих белков, которые ограничивают их биодоступность, позволяют создавать локальные градиенты, обеспечивающих преимущественно местные и паракринные эффекты, а не системные и эндокринные. Более того, многие клетки связаны с синаптическими окончаниями вегетативной нервной системы; это обеспечивает получение ими сигналов определенным пространственным образом.
Функциональные единицы органов
Органы образованы паренхиматозными (специфичными) и соединительными или поддерживающими (неспецифическими) типами клеток. Макрофаги и фибробласты — два типа клеток, которые встречаются в большинстве человеческих тканей, формируют прямые межклеточные контакты и обмениваются факторами роста, создавая стабильные и устойчивые взаимодействия, включающие в себя механизмы обратной связи, которые усиливают стойкость в контексте изменения окружающей среды (Zhou et al., 2018). Представляется правдоподобным, что взаимодействия на основе клеточных контактов и цитокинов также усиливают функциональную организацию мельчайших функциональных единиц органов, которые характеризуются стереотипной геометрией расположенных близко друг к другу непаренхиматозных (стромальных) и паренхиматозных клеток; последние обычно происходят из общей популяции стволовых клеток. Каждая из таких функциональных единиц подобна микроэкосистеме, которая непрерывно адаптируется к изменяющейся внешней среде.
Органы, тракты и системные взаимодействия
Гормоны, цитокины, факторы роста, алармины и иммуноглобулины связывают органы по всему телу. Большинство клеточных типов способно секретировать множество цитокинов и нейроэндокринных факторов и несет десятки и сотни определенных рецепторов для каждого внеклеточного медиатора. Это означает, что традиционное разделение на эндокринные и неэндокринные органы и типы клеток размывается. Более того, большинство клеточных типов экспрессируют рецепторы нейромедиаторов: таким образом, они могут отвечать на входящие сигналы от вегетативной нервной системы и принимать участие во множестве нейроэндокринных взаимодействий и реакций на стресс — так же, как желудок, тонкая и толстая кишка, печень или скелетная мышца выполняют эндокринные функции, регулируя аппетит, поведение и метаболизм всего тела. Теперь факты, что толстая кишка может синтезировать кортикостероиды (Bouguen et al., 2015) или что миелоидные клетки вырабатывают катехоламины (Staedtke et al., 2018), иллюстрируют существование во многом неизученных взаимосвязей, с помощью которых множество органов участвуют в местных и системных гормональных ответах на стресс.
Метаорганизм
Многоклеточные организмы представляют собой метаорганизмы, состоящие из хозяина и бактерий, архей, грибов, фагов и других вирусов и паразитов, его населяющих. Кишечная микробиота влияет на пищеварение и всасывание питательных веществ, местный синтез витаминов, подвижность кишечника, устранение патогенов и ксенобиотиков, воспаление и канцерогенез в толстой кишке (Walter et al., 2020). Кроме того, она обладает дистантными эффектами, взаимодействуя с нейроэндокринной системой (Valles-Colomer et al., 2019), определяя тонус воспаления и иммунной системы (Arpaia et al., 2013) или «оттачивая» элементы иммунного репертуара (Fluckiger et al., 2020) для предотвращения выраженного воспаления, аутоиммунных реакций, аллергии и канцерогенеза. Мажорные заболевания, такие как ожирение, кардиоревматологические нарушения, злокачественные опухоли и психические расстройства связывают со сдвигами в составе кишечной микробиоты (Gilbert et al., 2018). В соответствии с этим общую продолжительность жизни и продолжительность здоровой жизни генно-модифицированных мышей с ускоренным старением можно увеличить путем трансплантации фекальной микробиоты (ТФМ) от молодых здоровых мышей (Bárcena et al., 2019). Это подчеркивает, что микробиота может быть как источником болезни, так и источником здоровья.
В конечном счете, функциональность отдельных строительных блоков от субклеточных структур до систем органов и взаимодействий между организмом и его микробиотой объединяется мириадами коммуникационных систем (рисунок 4). Интеграция усиливается тем, что большинство из этих элементов взаимодействуют на нескольких уровнях, одновременно играя несколько ролей. Таким образом, мысленную репрезентацию упрощенных линейных путей (элемент 1 → элемент 2 → элемент 3 и т. д.) следует заменить многомерными сетями, в которых каждый элемент интегрирован во множество переплетающихся цепочек взаимосвязей (Topol, 2019). Кульминацией многофункциональности каждого субклеточного, клеточного и суборганного строительного блока организма становится успешное объединение ритмических колебаний, гомеостатических взаимодействий, гермезизных реакций на стресс и путей восстановления (см. дальнейшие признаки 5–8), что повышает устойчивость системы. В основе здоровья лежит постоянно успешная интеграция множества взаимодействий. Обратная сторона такого взгляда — в том, что не существует «локализованного» заболевания; это подразумевает, например, что психические расстройства обычно связаны с соматическими нарушениями (и наоборот), и крупная патология любого типа будет изменять микробиоту (и наоборот). Действительно, существуют обширные свидетельства, что распространенные ментальные заболевания, такие как резистентная депрессия и устойчивая к терапии шизофрения, связаны с метаболическим синдромом и таким образом ассоциированы с повышенным риском смерти (Godin et al., 2019). Более того, психические или метаболические заболевания, а также злокачественные опухоли связаны со сдвигами в составе кишечной микробиоты (Gentile and Weir, 2018) (таблица 1).
Интеграция взаимодействий может быть потеряна в результате множества нарушений, включая недостаток необходимых элементов (например, вследствие генетического дефицита, утраты специфических типов чувствительных, нейральных или эндокринных типов клеток или развития дисбиоза), дефицит в системах коммуникации (например, вследствие денервации или нейроэндокринной дерегуляции) или насыщение сигнальных систем (например, вследствие избытка метаболитов, таких как глюкоза при диабете, или цитокинового шторма, парализующего в норме локализованную координацию воспалительных реакций), которые несовместимы со здоровьем организма. После прохождения точки невозврата, которая определяет необратимую потерю здоровья, восстановление взаимодействий, вероятно, невозможно — как это происходит на поздних стадиях возрастной саркопении, при ассоциированной с онкозаболеваниями кахексии, септическом шоке или недостаточности жизненно важных органов. Таким образом, восстановление объединенной системы взаимодействий является трудной задачей, требующей своевременных и довольно сложных вмешательств, как видно на примере заместительной терапии гормонов и ферментов, системной нейтрализации чрезмерной выработки цитокинов, трансплантации органов и стволовых клеток или ТФМ.
Признак 5: ритмические колебания
Для жизни необходимы точный порядок, временной контроль и координация во времени молекулярных и клеточных событий (например, при эмбриональном развитии или регенерации). Кроме того, ультрадианные, циркадианные и инфрадианные колебания обеспечивают ритмичность физиологических функций и участвуют в поддержания гомеостаза организма. Примерами ультрадианных ритмов (с периодичностью менее 24 ч) может служить работа жизненно важных органов (например, электрическая активность мозга, частота сердцебиений, дыхание и перистальтика), ~ 90-минутный период секреции кортизола и АКТГ как часть реакции на стресс (Russell and Lightman, 2019), ~ 5-часовой колебательный паттерн активации опухолевого супрессора TP53 после повреждения ДНК (Stewart-Ornstein and Lahav, 2017) или клеточный цикл с его стереотипной чередой фаз и чекпоинтов. Инфрадианные ритмы (с периодичностью свыше одного дня) можно проиллюстрировать менструальным циклом или сезонной вариацией биологических параметров. Однако наиболее изученными ритмическими колебаниями являются эволюционно консервативные циркадианные часы (Cederroth et al., 2019) (Рисунок 4).
Механика циркадианных часов
Центральным компонентом циркадианной системы синхронизации служит «тактовый генератор», образованный ~ 20 000 нейронами супрахиазмального ядра (СХЯ) гипоталамуса. СХЯ получает информацию о свете или темноте во внешней среде от фоторецепторных клеток сетчатки и затем передает циркадианную ритмичность периферическим «часам», присутствующим практически в каждой клетке тела, через автономную иннервацию и регуляцию системных сигналов, таких как эндокринные, а также температура тела и потребление пищи (Chaix et al., 2016). Недавние работы с мышами со тканеспецифичными мутациями позволили пересмотреть иерархическую модель циркадианных часов, заместив ее сетью периферических часов (Ray et al., 2020; Welz et al., 2019). Молекулярные механизмы, управляющие этими суточными колебаниями, основаны на сложных транскрипционно-трансляционных петлях обратной связи, взаимодействие которых индуцирует ритмическую экспрессию генов, контролируемых часами, и вызывает дальнейшие колебания клеточного протеома (Trott and Menet, 2018). Главная циркадианная петля обратной связи состоит из серии центральных часовых элементов, таких как транскрипционные факторы BMAL1 и CLOCK, которые осуществляют трансактивацию генов, кодирующих криптохромы (CRY1 и CRY2), и транскрипционных репрессоров PER1, PER2 и PER3, а они, в свою очередь, ингибируют экспрессию BMAL1 и CLOCK (Greco and Sassone-Corsi, 2019). Мутации в центральных часовых генах разобщают циркадианные ритмы и вызывают наследственные нарушения сна (Kurien et al., 2019). Более половины генов человека демонстрируют суточные колебания паттернов экспрессии по крайней мере в одной ткани или органе тела (Ruben et al., 2018). Суточные изменения транскрипции влияют на основные механизмы гомеостаза, сходящиеся на регуляции стволовых клеток, функций митохондрий, иммунных реакций и контроле микробиоты.
Регуляция стволовых клеток
Посредством воздействия на функции стволовых клеток циркадианные часы влияют на разнообразные процессы, такие как миграция кроветворных клеток, ремоделирование костной ткани, адипогенез, цикл волосяных фолликулов, миогенез и нейрогенез (Sato et al., 2017; Solanas et al., 2017). Циркадианные часы в стволовых клетках могут участвовать в уменьшении повреждения ДНК, вызванного УФ-светом в течение дня, благоприятствуют прохождению через S-фазу клеточного цикла в ночное время, когда вероятность повреждения генома снижается. Выявление суточных колебаний в стволовых клетках может обеспечить новое понимание механизмов их биологической роли, а также может внести вклад в оптимизацию терапии с применением стволовых клеток. Помимо этого, можно сделать более эффективной трансплантацию кроветворных стволовых клеток, наилучшим образом подобрав время как забора этих клеток у доноров, так и их последующего введения пациентам (Weger et al., 2017).
Функционирование митохондрий
Митохондрии лежат в центре пересечения множества метаболических путей, которые состоят в тесных двунаправленных взаимодействиях с циркадианными часами (Chaix et al., 2016). Суточная ритмичность биогенеза митохондрий преимущественно представляет собой результат взаимного влияния PGC1α — главного регулятора этого процесса — и центрального компонента часов BMAL1. PGC1α контролирует экспрессию BMAL, а у мышей с мутацией Pgc1α изменяются суточные колебания локомоторной активности, температуры тела и скорости обмена веществ (Liu et al., 2007). Сходным образом, генетическое нарушение Bmal1 у мышей снижает уровень PGC1α, нивелирует суточные изменения архитектуры митохондрий и вызывает изменения количества этих органелл и их морфологии. Под циркадианным контролем находятся и другие белки митохондрий, участвующие в их фрагментации (FIS1) и слиянии (DRP1) (Schmitt et al., 2018). Активность ферментов окисления жирных кислот и флавопротеинов, участвующих в транспорте электронов, необходимых для β-окисления и окислительного фосфорилирования, соответственно, также подвержена суточным флуктуациям (Peek et al., 2017). То же вредно и для экспрессии фактора 1α, индуцируемого гипоксией (HIF1α); его уровень возрастает при истощении BMAL в ответ на гипоксию. Ряд белков, участвующих в поддержании окислительно-восстановительного гомеостаза, таких как митохондриальная супероксиддисмутаза 2 (SOD2) и некоторые пероксиредоксины, проявляют циркадианную активность в печени мышей. И наоборот, окислительно-восстановительный статус влияет на ритмическую функцию тактового генератора, а такие факторы, как HIF1α, связываются с промоторами генов часов и усиливают адаптацию к гипоксии. NAD+-зависимая SIRT1 деацитилирует PER2, снижает его активность и изменяет циркадианную ритмичность центрального часового аппарата. Суточные колебания никотинамидфосфорибозилтрансферазы (NAMPT) — фермента, лимитирующего скорость реакции при биосинтезе NAD+, — затрагивают NAD+-зависимые метаболические реакции в митохондриях и создают механизм обратной связи для регуляции активности SIRT1 и, таким образом, транскрипции генов тактового генератора (Nakahata et al., 2009). Следовательно, молекулярные часы руководят окислительными ритмами митохондрий в связи с циклами питания и голодания для максимизации выработки энергии в течение периода покоя. SIRT1 также участвует в суточной регуляции митофагии — процесса, который происходит преимущественно в ходе активной фазы светового цикла (Ramsey et al., 2009).
Иммунный ответ
Циркадианные часы передают ритмичность на иммунитет как в нормальных условиях, так и в ответ на воспалительные изменения (Man et al., 2016). Эти суточные колебания обеспечивают соответствующий трафик иммунных клеток, влияют на восприимчивость к микробным инфекциям, определяют временную экспрессию паттерн-распознающих рецепторов и компонентов их сигнальных путей и устанавливают время синтеза и секреции хемокинов, цитокинов, белков комплемента, факторов свертывания крови, гранзимов и перфоринов. Такая опосредованная часами регуляция иммунных функций может быть частью стратегии предсказания изменений среды и обеспечения оптимизированной защиты для каждого времени суток. Ритмичность иммунных реакций может также участвовать во временном разделении взаимно несовместимых программ — толерантности и иммунитета — или для избегания кооперативных взаимодействий, которые способны вызвать патологическую гиперактивацию иммунных реакций (Downton et al., 2020). У мутантных мышей с дефицитом центральных часовых белков теряется временной баланс между иммунными и воспалительными реакциями и развиваются тяжелые заболевания (Scheiermann et al., 2018).
Контроль микробиоты
Состав бактериальных сообществ в кишечнике варьирует в течение суток, и колебания задают циркадианные ритмы хозяина. И наоборот, кишечная микробиота влияет на биологическую функцию кишечного осциллятора. Разобщение такой двунаправленной коммуникации между бактериями и хозяином приводит к дисбиозу и вызывает язвенный колит и метаболические заболевания. Мозг и кишечный микробиом связаны несколькими системами коммуникации, включая блуждающий нерв, гормоны, иммунные факторы, нейромедиаторы и микробные метаболиты, такие как желчные кислоты и короткоцепочечные жирные кислоты (Cryan et al., 2019). Изменения в этой оси коммуникации, связанные с генетическим полиморфизмом, повреждениями со стороны окружающей среды, изменением рациона, желудочно-кишечными нарушениями или старением, могут вносить вклад в развитие неврологических и психических патологий, таких как болезнь Паркинсона, болезнь Альцгеймера, тревожность, большое депрессивное расстройство и расстройства аутистического спектра (Walker et al., 2020).
Изменения циркадианного ритма, вызванные посменной работой, нерегулярными циклами сна и бодрствования, плохим качеством сна, частой сменой часовых поясов, социальным джетлагом, а также изменения времени приема пищи связаны с повышением риска многих патологий у человека — от злокачественных опухолей и депрессии до диабета и дисбиоза (таблица 1) (Roenneberg and Merrow, 2016). Инфаркт миокарда чаще случается утром и имеет более плохой клинический исход, поскольку в начале дня снижается толерантность к ишемии. Такие заболевания, как злокачественные опухоли, воспалительные процессы, психические расстройства, диабет, астма или аллергия обычно демонстрируют суточные колебания в проявлении симптомов и ответов на действие лекарственных препаратов. Вредные пищевые привычки и нарушение расписания приема пищи нарушают связь циклов питания и циркадианных ритмов, вызывая метаболические нарушения. Корректировка питания, такая как ограничение приема пищи по времени, интервальное голодание и кетогенная диета, регулирует экспрессию осциллирующих генов — главным образом, через путь mTOR — и улучшает метаболическое здоровье, отчасти восстанавливая согласованность во времени между главным и периферическим генераторами ритмов (Ramanathan et al., 2018). В этом контексте для предотвращения дисфункций и улучшения циркадианного цикла могут быть полезны хронофармакологические методы, напрямую воздействующие на циркадианные часы, или хронодиетические и хронотерапевтические стратегии.
Признак 6: устойчивость гомеостаза
Система гомеостатических цепочек взаимодействий поддерживает мириады биологических параметров (таких как pH крови, осмолярность сыворотки, содержание кислорода и диоксида углерода в артериальной крови, гликемия, кровяное давление, температура и масса тела или концентрации гормонов) на почти постоянных уровнях до тех пор, пока не изменятся ключевые регуляторные установки, что приводит к развитию хронического заболевания. Огромную важность регуляции гомеостаза иллюстрирует нарушение регуляции эндокринных петель обратной связи, которые повреждаются вследствие недостатка или избытка специфических гормонов. Термин «гомеодинамика» описывает тот факт, что равновесие основано не на статическом поддержании уникального состояния, а, скорее, постепенно изменяется в череде адаптивных взаимодействий между компонентами системы (Lloyd et al., 2001). «Гомеодинамическое пространство» определяет буферную емкость (устойчивость) биологических систем и, таким образом, способность выживать и поддерживать здоровье благодаря контролю повреждений, адекватным реакциям на стресс, снижению биологического шума и постоянной перестройке (Eling et al., 2019; Rattan, 2014). Гомеостатическая устойчивость включает в себя генетический, нейральный, метаболический, иммунный и основанный на микробиоме механизмы (рисунки 5A and 5B).
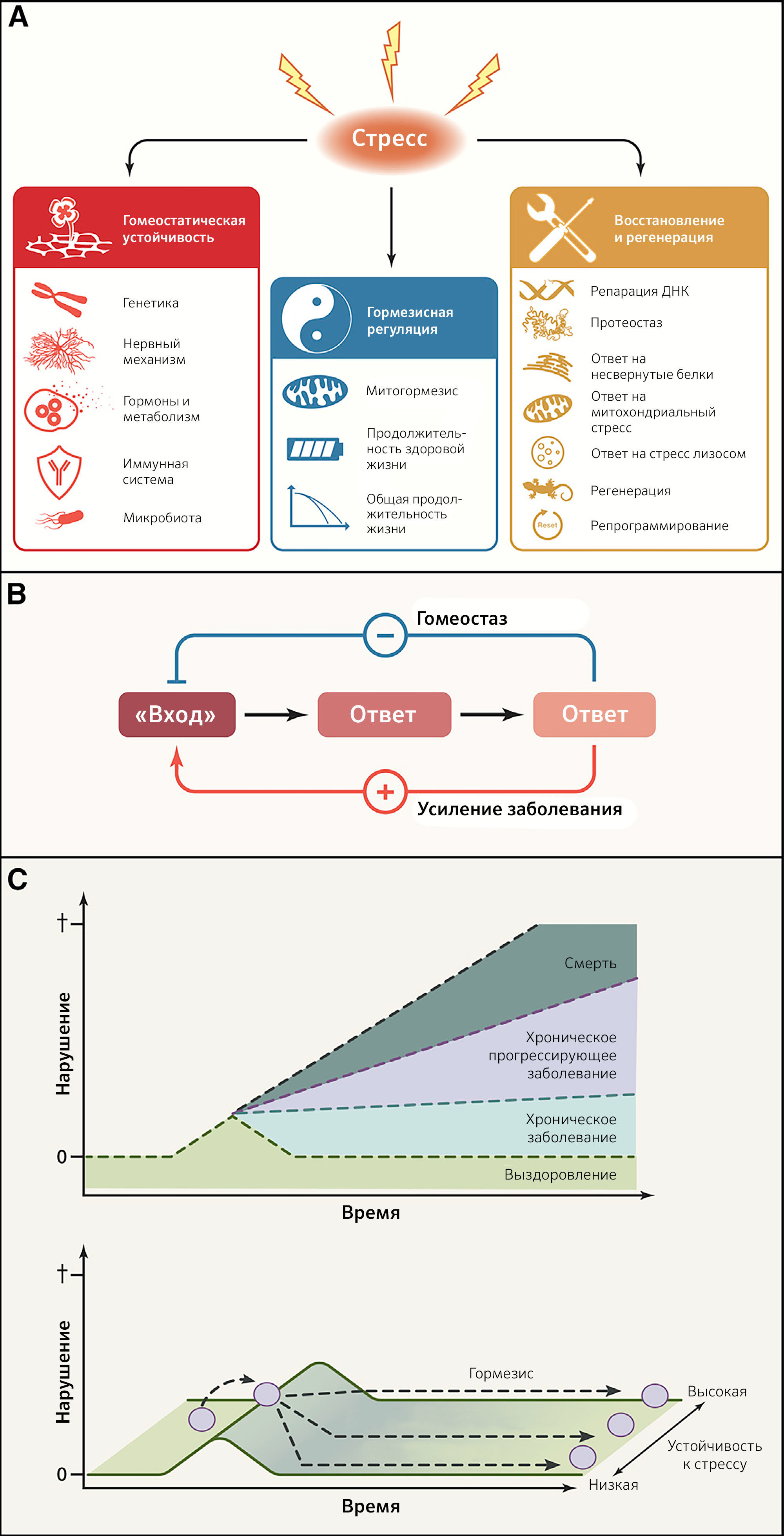
B) Сравнение гомеостатического эффекта и эффектов, усиливающих заболевания. Петли отрицательной обратной связи позволяют корректировать последствия нарушений («вход»), в то время как петли положительной обратной связи вносят вклад в усиление болезни.
C) Гормезисная регуляция. В ответ на сублетальный стресс может быть восстановлено существовавшее ранее состояние. В идеале такой ответ приводит к повышению устойчивости к стрессу (гормезис) и создает у организма «память».
Нейральные механизмы
Устойчивость в значительной степени опосредуется адаптивными изменениями функции множества взаимодействий в мозге, которые регулируют психобиологические реакции на стресс («бей и беги» или «отдыхай и переваривай»). В этих изменениях принимают участие мириады нейромедиаторов, нейропептидов, гормонов, рецепторов и связанных с ними сигнальных путей, которые все вместе определяют гомеостатические ответы на острые или хронические стрессоры. Симпатико-адренало-медуллярная (СAM) и гипоталамо-гипофизарно-адреналовая (ГГA) оси составляют два основных варианта ответа на стресс, которые постепенно приводят к образованию хрестоматийных «гормонов стресса» — катехоламинов (адреналин и норадреналин) и глюкокортикоидов (ГК), соответственно. За мгновенной (но транзиторной) реакцией оси САМ следует более отложенная активация ГГА, которая инициирует каскадоподобный биосинтез кортиколиберина (КЛ) нейронами гипоталамуса, адренокортикотропного гормона (АКТГ) — гипофизом и, наконец, ГК — надпочечниками. Если реакции САМ ограничена, активируется процесс гомеостатической устойчивости, но при гиперактивации системы запускается развитие сердечно-сосудистых нарушений и проблем с ментальным здоровьем. Острое действие ГК имеет защитный эффект и способствует адаптивным реакциям, в то время как хроническое действие высоких уровней ГК вызывает ряд патологических состояний, таких как повреждения нейронов, гипертензия, сердечно-сосудистые заболевания, иммуносупрессия и дисбиоз (Rothman and Mattson, 2013).
Действуя в тесной координации с ГК, нейротрофины, такие как мозговой нейротрофический фактор (BDNF), также служат частью нейтральных регуляторных цепей устойчивости к стрессу. Хронические стрессоры снижают экспрессию BDNF в гиппокампе и вызывают депрессивноподобные состояния, которые можно устранить с помощью антидепрессантов и физических упражнений. Серотонин участвует во взаимодействиях, которые опосредуют регуляцию настроения и эмоций и может оказывать анксиогенный или анксиолитический эффект. Острый стресс усиливает оборот этого нейромедиатора и вызывает депрессию. Дофаминовые сигнальные пути двунаправленно модулируют поощрение и отвращение, вносят вклад в исчезновение страха и играют ключевую роль в восприимчивости и устойчивости к стрессу. В условиях стресса эффекты, сходные с анксиолитическими, имеет нейропептид Y (NPY); он противодействует анксиогенным эффектам КЛ в различных областях мозга (Cathomas et al., 2019).
Нейробиологические механизмы, способствующие устойчивости, включают как физические, так и молекулярные адаптации всех этих нейральных цепей взаимодействий. Выделение ГК, индуцируемое стрессом, снижает нейрогенез в гиппокампе. Пролонгированный стресс вызывает атрофию структур мозга, потерю глиальных клеток и значительное сжатие апикального дендритного дерева, что препятствует адаптивной пластичности и нарушает устойчивость. Примечательно, что применение ингибиторов обратного захвата серотонина увеличивает объем гиппокампа (Maller et al., 2018), в то время как терапия литием увеличивает объем серого вещества (Anand et al., 2020). С точки зрения механизмов, транскрипционные факторы, эпигенетические модуляторы и шапероны представляют собой фундаментальные медиаторы адаптивного ответа в системе взаимодействий внутри мозга.
Генетические факторы
Анализы и метаанализы биологических и эмоциональных факторов, проведенные Ассоциацией общегеномных исследований (GWAS), показали умеренное влияние генетических факторов на наследование устойчивости. Способствующие устойчивости варианты выявлены в генах, кодирующих нейротрофические факторы или модуляторы норадреналинового ответа на стресс. В соответствии с этим дефицит устойчивости в силу присутствия вариантов COMT (катехол-O-метилтрансферазы), BDNF, SLC6A4 (транспортера серотонина) и NPY повышает риск ментальных расстройств (Zhou et al., 2008). Сходным образом, исследования связанного со стрессом гена FKBP5, который модулирует ответы рецепторов ГК, выявили специфические взаимодействия гена и среды в контексте детских травм (Qi et al., 2020). Стоит отметить, что те же генетические полиморфизмы, которые обеспечивают повышенный риск патологических реакций на неблагоприятные события, могут также приносить существенную пользу в благоприятной среде; возможно, это иллюстрирует антагонистическую плейотропию (Reiss et al., 2013).
Гормоны и метаболизм
Гомеостатическая устойчивость контролируется не только мозгом — в ней также участвуют метаболические и эндокринные пути регуляции. При остром стрессе, таком как повреждение, катехоламины транзиторно усиливают термогенез путем активации митохондриальных разобщающих белков в бурой жировой ткани (БЖT) (Townsend and Tseng, 2014). Хронический стресс, напротив, индуцирует независимый от БЖТ адаптивный механизм или может приводить к дефициту энергии (Turkson et al., 2019). При этом сценарии ГК способствуют мобилизации макромолекул посредством активации глюконеогенеза и гликогенолиза, протеолиза и липолиза и усилению метаболического переключения с анаболических на катаболические реакции, обеспечивая таким образом источники энергии и строительные блоки (глюкоза, аминокислоты и жирные кислоты) для ответа на стресс. Кроме того, ГК повышают кровяное давление, подавляют иммунные реакции и влияют на физиологию митохондрий (Machiela et al., 2020).
Метаболическое действие ГК модулируется другими гормонами, такими как лептин и грелин (Tomiyama, 2019). Лептин продуцируется преимущественно адипоцитами, подавляет аппетит и информирует мозг о статусе энергетических резервов. Грелин вырабатывается клетками желудочно-кишечного тракта и действует на гипоталамус, стимулируя аппетит, а также опосредует нейропротекторные эффекты (Yanagi et al., 2018). Другими гормонами гипоталамуса с важными функциями метаболического контроля являются окситоцин, который защищает кардиомиоциты, и аргинин-вазопрессин — антидиуретический пептид. Соматостатин вносит вклад в устойчивость, угнетая выделение КЛ в условиях хронического стресса. Половые гормоны обладают сильным влиянием на гомеостатическую устойчивость и объясняют межполовые различия в ответе на действие хронических стрессорных факторов (Hodes and Epperson, 2019). Примечательно, что пациенты с нейропсихическими заболеваниями, вызванными стрессом, демонстрируют метаболические фенотипы, которые существенно перекрываются с метаболическим синдромом (Raue et al., 2019).
Иммунная система
Системы как врожденного, так и приобретенного иммунитета представляют собой ключевые компоненты гомеостатического ответа (Cathomas et al., 2019). Хроническое стрессовое воздействие вызывает значительные изменения в иммунной системе, и во многих исследованиях удалось связать устойчивость к стрессу и развитие аффективных расстройств с иммунными изменениями. Важно отметить, что лечение с применением противовоспалительных препаратов может проявлять антидепрессивные эффекты, в то время как у пациентов на антидепрессантной терапии проявляется снижение уровней классических провоспалительных цитокинов, таких как IL-1β и IL-6. Симпатическая и парасимпатическая системы, соответственно, индуцируют и ингибируют выработку провоспалительных цитокинов. После того, как мышей подвергали стрессу, вызывающему боль, у более чувствительных животных выявлялись более высокие уровни IL-6, чем у устойчивых мышей. Генетический нокаут IL-6 или его нейтрализация с помощью антител способствует возникновению устойчивого фенотипа (Hodes et al., 2014). Высокие уровни провоспалительных цитокинов, вызванные стрессом, стимулируют ось ГГА (и, следовательно, продукцию ГК), но воздействуют на функцию глюкокортикоидных рецепторов (ГР). Возникающая резистентность к ГК препятствует снижению синтеза цитокинов, опосредованному ГГА/ГР, разобщая таким образом гомеостатическую петлю обратной связи и создавая порочный круг (Quax et al., 2013). Интересно, что провоспалительные цитокины также индуцируют резистентность к ГК у пациентов с большим депрессивным расстройством; это позволяет предположить, что воспаление и ГК-сигналинг действуют на одни и те же же процессы, вызывая кумулятивное повреждение. Вклад в модуляцию иммунных ответов на стресс вносят и эпигенетические механизмы. Ряд миРНК, таких как miR-25-3p (которая принадлежит к кластеру miR-106b-25), индуцируются в моноцитах мышей, испытывающих стресс поражения. Избирательная элиминация этого кластера периферических лейкоцитов обеспечивает поведенческую устойчивость к этому типу стресса (Pfau et al., 2019).
Если говорить об адаптивной иммунной системе, то в нескольких исследованиях были изменены количества B- и T-лимфоцитов и их функции при нормальной и патологической реакции на стресс (Miller and Raison, 2016). У пациентов с большим депрессивным расстройством (fLMDD) выявляется T-клеточная лимфопения, что указывает на нейропротекторный эффект этих клеток и их способность повышать устойчивость. Иммунизация крыс основным белком миелина перед помещением их в условия хронического стресса низкой интенсивности вызывает образование аутореактивных T-клеток и уменьшает поведение, ассоциированное с депрессией. Рекрутирование T-клеток в ЦНС положительно коррелирует с устойчивостью к стрессу. Более того, по некоторым данным, лимфоциты мышей, испытывавших хронический стресс, у наивных мышей снижают уровни провоспалительных цитокинов и обеспечивают поведенческую устойчивость и антидепрессантные эффекты (Brachman et al., 2015).
Кишечная микробиота
Поддержание стабильной кишечной микробиоты необходимо для стабильности иммунной системы хозяина и когнитивного/эмоционального баланса; в нем участвует выработка биологически активных метаболитов, что создает ось «микробиота — кишечник — мозг» (Teichman et al., 2020). Кишечная микробиота широко варьирует между индивидуумами. Однако, после того, как бактериальное разнообразие и функциональная избыточность устанавливаются в детстве, они проявляют значительную устойчивость: другими словами, по существу состав и активность кишечной микробиоты остаются стабильными. Устойчивость здоровой микробиоты защищает от ряда патологий, связанных с дисбиозом, таких как воспалительное заболевание кишечника, метаболический синдром, нарушение функций сердечно-сосудистой системы, депрессия, астма, ревматоидный артрит, рак толстой кишки и расстройства аутистического спектра.
Пероральный прием разнообразных пребиотиков, пробиотиков и постбиотиков может усиливать устойчивость бактериальных сообществ кишечника, хотя для большинства таких продуктов, доступных в настоящее время, отсутствуют четкие доказательства положительного влияния на здоровье человека. ТФМ оказалось успешной при лечении рецидивирующих инфекций Clostridium difficile, что также подтолкнуло к оценке его содержания при других патологических состояниях, связанных с кишечным дисбиозом (Allegretti et al., 2019). ТФМ может влиять на множество фенотипических проявлений — от поведения до старения. Например, перенос микробиоты от пациентов с большим депрессивным расстройством к безмикробным мышам вызывает у них поведение, сходное с депрессией (Cheung et al., 2019). О похожих результатах сообщалось и в контексте метаболического синдрома (Zhang et al., 2019), а также способности онкологических пациентов отвечать на иммунотерапию (Routy et al., 2018). Для определения механизма, с помощью которого некоторые виды бактерий и их метаболиты оказывают такие эффекты, необходимы дальнейшие исследования.
Таким образом, локальные внутриорганные и внутриорганизменные системы коммуникации построены таким образом, что они могут отвечать на воздействия путем быстрой адаптации и противодействующей регуляции, достигая гомеостатической устойчивости благодаря активации петель обратной связи, преимущественно отрицательной. Нарушение такого механизма устойчивости вследствие чрезмерного стресса или ослабления резервных способностей в конечном счете приводит к старению и развитию заболеваний (таблица 1). Терапия, направленная на усиление гомеостатической устойчивости, представляет собой многообещающую стратегию для обеспечения и поддержания здоровья.
Признак 7: гормезисная регуляция
В основе гормезиса лежат биологические процессы, при которых низкие дозы токсинов вызывают защитную реакцию, которая защищает организм от вреда при действии более высоких доз тех же токсинов (Gems and Partridge, 2008). В настоящее время термин «гормезис» широко используется для описания ситуации, при которой низкие дозы стрессорных факторов индуцируют адаптивный ответ в клетках и организмах для поддержания гомеостаза, при этом повышая биологическую пластичность (рисунки 5A и 5C) посредством действия факторов, названных горметинами (Calabrese, 2018).
Митогормезис
Этот термин описывает ситуацию, при которой небольшой и транзиторный митохондриальный стресс вызывает благоприятные реакции в клетке, ткани или организме (Tapia, 2006) — например, в контексте физических упражнений, ограничения калорий, интервального голодания и пищевых фотохимических соединений, которые стимулируют продукцию АФК в дыхательной цепи (Ristow and Zarse, 2010). Низкие уровни митохондриальных АФК (мтАФК) снижают восприимчивость к повреждению, вызванному аноксией/реоксигенацией, в кардиомиоцитах желудочков крыс и вызывают сильные защитные реакции в моделях ишемии/реперфузии (Granger and Kvietys, 2015). мтАФК могут также в некоторой мере объяснять так называемый эффект «прекондиционирования сердца», при котором короткие периоды ишемии (например, при физических упражнениях) перед длительной закупоркой коронарных артерий обладают кардиопротективностью, поскольку снижают последующий размер повреждения миокарда или риск фибрилляции желудочков (Thijssen et al., 2018). Эффекты прекондиционирования сердца также включают активацию направленных на выживание киназ, улучшение способности митохондрий удерживать кальций и индукцию белков теплового шока в миокарде. Низкие уровни мтАФК активируют гормезисные реакции в нейронах в условиях стресса путем стимуляции экспрессии защитных генов, включая BCL2 и SOD2 (Sivandzade et al., 2019). Tакой адаптивный ответ защищает нейроны от более тяжелого окислительного стресса и снижает риск окислительных и ишемических повреждений. Широкие возможности АФК запускать благоприятные митогормезисные реакции могут объяснять неэффективность клинических испытаний, направленных на выявление полезного для здоровья эффекта антиоксидантов (Ristow, 2014). При этом ряд соединений, рутинно применяющихся в клинике — метформин при диабете и статины для снижения уровня холестерина — умеренно повышают уровни мтАФК (Piskovatska et al., 2020).
Вслед за АФК для запуска эффективных цитопротекторных механизмов, долговременных метаболических изменений и усиления устойчивости к стрессу может активироваться ряд транскрипционных факторов (Merry and Ristow, 2016). У мышей транзиторный нокдаун митохондриальной SOD индуцирует митогормезисный ответ, зависящий от активации антиоксиданта NRF2 и митохондриальных сигнальных путей PPARγ/PGC-1a (Cox et al., 2018). Сходным образом, эндогенный метаболит N-aцетил-L-тирозин (NAT) запускает митогормезисные реакции, которые не только включают выработку мтАФК, но и активируют FoxO, который в свою очередь трансактивирует антиоксидантные гены и KEAP1 для обеспечения цитопротекторного ответа. NAT также подавляет опухолевый рост — по-видимому, через активацию KEAP1 (Matsumura et al., 2020). Дальнейшее прояснение вопроса о путях, стимулирующих митогормезис, может помочь разработать стратегии для увеличения продолжительности здоровой жизни и общей продолжительности жизни (таблица 1).
Продолжительность здоровой жизни
Гормезис может влиять на продолжительность здоровой жизни — период, в течение которого индивидуум пребывает в практически здоровом состоянии — например, в контексте адекватного рациона питания и физической активности. Эти подходы, основанные на гормезисе, также обеспечивают умеренную, но значимую защиту от острого нарушения мозгового кровообращения, инфаркта миокарда и нервной дегенерации. Такое благоприятное действие может быть следствием близкодействующей цитопротекции благодаря индукции АФК, белков теплового шока, сиртуинов и тиоредоксинов (Calabrese et al., 2011). В качестве альтернативного варианта они могут включать системы межклеточных коммуникаций на значительных расстояниях с помощью метаболических путей, нервной регуляции, эндокринных сигналов и иммунных ответов, таких как поляризация макрофагов с фенотипом M1 в сторону M2, что усиливает репаративные и противовоспалительные реакции (Calabrese et al., 2018).
Примечательно, что стволовые клетки проявляют гормезисные реакции в ответ на низкие дозы ионизирующего излучения, гипоксию и действие химических соединений (Gopi and Rattan, 2019); это может помочь улучшить их терапевтический потенциал для восстановления сердечно-сосудистых и неврологических повреждений. Концепция гормезиса может также предложить новый аппарат для доклинической оценки и клинической разработки новых лекарств от нейродегенеративных заболеваний или улучшения работы организма и укрепления здоровья (Leri et al., 2020). Низкие дозы химических канцерогенов могут защищать от генотоксического и цитотоксического повреждения, вызываемого дальнейшим воздействием более высоких доз (Nohmi, 2018). Сходным образом, противоопухолевые препараты могут вызывать в культуре опухолевых клеток ответы, подобные гормезису (Cho et al., 2018). Таким образом, теория гормезиса может способствовать исследованиям по подбору нужных доз и помочь оптимизировать режим приема лекарств для оптимизации полезного эффекта.
Продолжительность жизни
Первые эксперименты на насекомых моделях показали, что хроническое воздействие низких доз ионизирующего излучения увеличивало продолжительность жизни (Shibamoto and Nakamura, 2018). Сходным образом, у мышей, облученных низкими дозами, продолжительность жизни возрастала на ~ 20 %, что сопровождалось характерными чертами здорового старения, такими как поддержание веса, мышечная сила, количество и качество меха (Shibamoto and Nakamura, 2018). Фибробласты человека, подверженные действию низких доз радиации, демонстрировали гормезисные ответы в виде стабильности генома и замедления репликативного старения. Более того, существуют отдельные сообщения, что у людей после низкодозового облучения снижалась частота возникновения злокачественных новообразований и увеличивалась продолжительность жизни (Sutou, 2018), но крупномасштабных эпидемиологических данных в пользу этого явления практически нет.
Эти результаты, основанные на гормезисе, индуцированном радиацией, были расширены с учетом ряда увеличивающих срок жизни соединений, примерами которых служат синтетические химические горметины и пищевые фитогорметики, которые в изобилии встречаются в овощах, фруктах, специях и семенах (Rattan, 2012). Такой частный случай гормезиса был назван ксеногормезисом, чтобы подчеркнуть мутуалистические отношения между видами растений и животных (Howitz and Sinclair, 2008). Ксеногорметины включают в себя ряд растительных соединений, таких как флавоноиды, сероорганические соединения, диферулоилметаны и производные стилбена. При высоких концентрациях эти вещества напрямую подавляют свободные радикалы, но при низких концентрациях, в которых они присутствуют в рационе, они обладают прооксидантными и электрофильными свойствами, которые индуцируют адаптивную клеточную реакцию на стресс с помощью механизма с участием сигнального пути KEAP1-NRF2. Более того, многие ксеногорметины индуцируют аутофагию, которая поддерживает гомеостаз и способствует поддержанию здоровья за счет устранения поврежденных органелл и макромолекулярных структур (Menendez et al., 2013). Паттерны гормезисного ответа также были обнаружены после использования миметиков ограничения калорий, которые демонстрируют геропротекторное действие — по-видимому, путем индукции аутофагии (Madeo et al., 2019). Небольшие изменения рациона улучшают протеостаз и увеличивают продолжительность жизни благодаря гормезису ЭПР. В этом процессе участвует путь IRE1-XBP1, являющийся частью ответа на несвернутые белки (UPR) в ЭПР (UPR-ER), что приводит к усилению ассоциированной с ЭПР деградации неправильно уложенных белков (Matai et al., 2019).
У стареющих модельных организмов гормезисные реакции часто снижены. Например, прекондиционирование различными стрессами снижает повреждение сердца, вызванное ишемией и реперфузией, у молодых взрослых мышей и крыс, но у стареющих грызунов этот защитный эффект теряется (Calabrese, 2018). Также обнаружено снижение с возрастом UPR-ER (Ferguson and Bridge, 2016). Кроме того, в пожилом возрасте притупляется гормезисный ответ на постоянное присутствие органических загрязнителей у пациентов с диабетом (Lee, 2011). Эти результаты согласуются с идеей, что пути гормезисного прекондиционирования со временем ослабевают, таким образом разрушая возможность стареющего организма адаптироваться к эндогенным и экзогенным стрессорам.
Таким образом, гормезисный ответ на низкие дозы широкого спектра химических, физических, фармакологических и связанных с питанием стрессоров способен защитить от дальнейших угроз. Гормезисные реакции эволюционно консервативны и были хорошо изучены на животных моделях, однако их применение в патофизиологии человека все еще сталкивается с серьезными ограничениями (Thayer et al., 2005). К сожалению, гормезисные эффекты в результате действия любых из упомянутых стрессоров умеренные и трудно поддаются измерениям — по крайней мере, для этого в клинических испытаниях необходимо наличие четко определенных количественных конечных точек и возможности их анализа.
Признак 8: репарация и регенерация
Здоровью организма постоянно угрожает множество источников внешних и внутренних повреждений. Эти повреждения должны быть по возможности устранены, потерянные функциональные элементы должны регенерировать до достижения полного восстановления (reconstitutio ad integrum). В отличие от обновления (см. признак 3), которое происходит без специфической стимуляции, репарация и регенерация — это активируемые реакции, которые специфическим образом возникают в ответ на определенный тип повреждения, нанесенного организму. В соответствии с этим у клеток развились сложные сигнальные сети, которые систематически воспринимают и реагируют на специфические типы повреждений на всех уровнях организации (рисунок 5A) (таблица 1).
Повреждения и репарация ДНК
Целостности и стабильности ДНК постоянно угрожают экзогенные химические, физические и биологические воздействия, а также эндогенная опасность в виде ошибок репликации ДНК или спонтанных реакций гидролиза и окисления. Такой генотоксический стресс вызывает разнообразные изменения в ДНК, включая точечные мутации, вставки и делеции, транслокации, хромосомную анеуплоидию, укорачивание теломер, образование аддуктов и сшивок между ДНК и белками, а также генные нарушения вследствие встраивания вирусов или транспозонов. Такие геномные повреждения могут дать начало множеству хронических заболеваний, а также быть причиной физиологического и патологического старения. Клетки обладают значительной сетью конститутивных и индуцибельных систем репарации ДНК — в совокупности они образуют ответ на повреждение ДНК (ОПД/DDR) — для ликвидации разнообразных повреждений, нанесенных ядерному и митохондриальному геномам (Colombo et al., 2020). Мутации в генах ОПД вызывают ряд наследственных заболеваний, которые обычно связаны с ускоренным старением и злокачественными опухолями, что подтверждает важность репарации ДНК для здоровой жизни (Keijzers et al., 2017). Аппарат ОПД также напрямую участвует в определении судьбы клеток, имеющих не поддающиеся восстановлению генетические повреждения. Эффекторы ОПД, такие как TP53, участвуют в клеточном старении и апоптозе и вносят вклад в поддержание гомеостаза. Иммунные эффекторы задействованы в элиминации клеток с повреждениями ДНК путем индукции высоких уровней экспрессии молекул MHC класса I на клеточных мембранах, что усиливает таким образом их разрушение цитотоксическими Т-лимфоцитами (Galluzzi et al., 2018). Повреждение ДНК также повышает экспрессию лигандов для NK-клеток, что благоприятствует устранению поврежденных клеток. Цитозольная ДНК, накапливающаяся в ходе ОПД, активирует путь cGAS/STING и стимулирует локальный ответ, который может усиливать тканевый гомеостаз. Однако нерегулируемое или чрезмерное выделение IFN вызывает неконтролируемое воспаление и повреждение тканей, что приводит к аутоиммунным заболеваниям и патологическому нарушению адаптации к стрессовым ситуациям, таким как инфаркт миокарда (Burdette et al., 2011). Подводя итог, можно сказать, что клетки реагируют на повреждение ДНК активацией серии взаимосвязанных механизмов, которые обеспечивают местный и системный гомеостаз.
Повреждение белков и протеостаз
Белки накапливают множество типов повреждений, включая образование конечных продуктов гликирования, дезамидирование остатков Asn и Gln, нарушение образования дисульфидных связей, укорочение N- или C-концов, внутреннее расщепление, карбонилирование и образование неправильных агрегатов. Агрегация белков типична для нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Хантингтона, а также других возрастных патологий (Kaushik and Cuervo, 2015). В силу этого клетки используют ряд сложных и энергоемких стратегий для поддержания белкового гомеостаза («протеостаза») и обеспечения оптимального белкового синтеза, укладки (фолдинга), модификации, транспорта, локализации, концентрации и обновления. Протеостаз включает в себя сеть факторов, которые либо обеспечивают рефолдинг и стабилизацию неправильно уложенных белков, либо направляют их на деградацию (Morimoto, 2020). (Ре)фолдинг и стабильность белков опосредуются большим набором цитозольных и специфичных для органелл молекулярных шаперонов, в том числе белков теплового шока (Hipp et al., 2019). Фармакологическая индукция ответа на тепловой шок и гиперэкспрессия молекулярных шаперонов проявляют защитный эффект в моделях ряда заболеваний. Например, доставка фрагмента шаперонина TRiC усиливает протеостаз и улучшает клеточный фенотип при болезни Хантингтона (Sontag et al., 2013). Две главные системы протеолиза, участвующие в контроле качества белков, — убиквитино-протеасомная и аутофаго-лизосомная системы (Pohl and Dikic, 2019). Нарушения в любой из них приводят к коллапсу протеостаза и ускоряют развитие связанных с возрастом заболеваний, в то время как генетические или фармакологические вмешательства, которые усиливают протеостаз, улучшают возрастные фенотипы у животных моделей. Примечательно, что ингибирование деубиквитиназ, повышение экспрессии субъединиц протеасом и применение индукторов аутофагии способствуют увеличению продолжительности здоровой жизни и общей продолжительности жизни у мышей (Madeo et al., 2019).
Реакции на стресс ЭПР
В процессе синтеза на рибосомах большинство секретируемых или мембранных белков оказываются в ЭПР, где они сворачиваются и приобретают свою третичную и четвертичную структуру. Для правильной укладки белков и предотвращения накопления неправильно свернутых белков в люмене ЭПР клетки выработали адаптивные реакции, включающие активацию ряда сигнальных путей, обобщенно называемых ответом на стресс ЭПР, или ответом на неправильно уложенные белки (UPR) (Walter and Ron, 2011). Существует три механических модуля UPR, которые совместно поддерживают гомеостаз в ЭПР или запускают апоптоз для устранения клеток, которые оказались неспособны восстановить протеостаз. Эти модули основаны на работе трех сенсоров стресса (PERK, ATF6 и IRE1), которые оценивают протеом в люмене ЭПР и индуцируют транскрипционные регуляторы bZIP, которые в свою очередь активируют транскрипцию генов-мишеней UPR. Окончательным итогом такой транскрипционной активности становится снижение потока входящих в ЭПР белков и повышение способности этой органеллы к сворачиванию белков. Молекулярные компоненты UPR регулируются на уровне транскрипции самим UPR: это подчеркивает, что такой протеостатический ответ повторяет стратегию петель обратной связи, используемой в большинстве механизмов, участвующих в функциональном поддержании всего организма в условиях стресса. Реакция на стресс ЭПР значительно влияет на здоровье, и дефицит различных компонентов этой системы лежит в основе многочисленных заболеваний. Недостаточность или насыщение ответа на стресс ЭПР не только нарушает протеостаз, но и запускает массивную клеточную гибель и воспалительные реакции; если последние не разрешаются, то вносят вклад в хроническую дезадаптацию, метаболические нарушения и ускорение старения (Hetz et al., 2020).
Митохондриальные реакции на стресс
МитоUPR связан с метаболическим переключением на гликолиз, которое благоприятно для восстановления митохондрий (Costa-Mattioli and Walter, 2020). Подобно UPR-ЭПР, митоUPR включает в себя ряд сенсоров стресса, передатчиков и регуляторов транскрипции, таких как ATF4, ATF5, CHOP и C/EBPβ4, и передается через плазматическую мембрану для модуляции локальных и системных адаптаций к митохондриальному стрессу. Например, в подверженных митохондриальному стрессу миоцитах индуцируется транскрипционный ответ, в конечном итоге приводящий к выделению митокинов, таких как GDF15 и FGF21, в системный кровоток. При связывании с членами семейства GFRAL на поверхности нейронов ствола мозга GDF15 контролирует аппетит и пищевое поведение, в то время как FGF21 связывается со своим рецептором FGFR1 и регулирует липидный метаболизм в жировой ткани. Такие пути адаптивных реакций на стресс в конечном счете оказывают благоприятные эффекты на системном уровне с помощью эндокринной передачи сигналов (Klaus and Ost, 2020).
Реакция на повреждение лизосом
Нарушение проницаемости (пермеабилизация) лизосомных мембран (ПЛМ/LMP) и полный разрыв поздних лизосом представляют собой тяжелые условия клеточного стресса, которые играют важную роль в контексте нейродегенеративных заболеваний, микробных инфекций и прогрессии опухолей. ПЛМ либо летальна для клетки, либо запускает механизм защиты и восстановления, известный как ответ на эндолизосомное повреждение (ELDR) (Papadopoulos et al., 2020). Шаперон HSP70 связывается с липидами на поврежденной лизосомной мембране и рекрутирует аппарат ESCRT для восстановления перфорированной органеллы. Приток цитозольных галектинов в поврежденные органеллы, за которым следует массовое убиквитинирование лизосомных белков, регулируемое убиквитинконъюгирующим ферментом UBE2QL, может инициировать лизофагию и окончательное секвестирование лизосомы в аутофагосоме (Koerver et al., 2019). Параллельно локальное повреждение стимулируют биогенез лизосом через сигнальный каскад, в котором участвует диссоциация комплекса mTORC1 от лизосом, дефосфорилирование TFEB в цитоплазме, его транслокация в ядро и трансактивация индуцируемых им генов.
Регенерация на уровне тканей
Регенерация представляет собой полное восстановление потерянных или поврежденных элементов. Стволовые клетки и клетки-предшественницы, имеющиеся у грызунов и людей, обладают способностью восстанавливать поврежденные ткани и благоприятствовать адаптивным и компенсаторным реакциям (Wu and Izpisua Belmonte, 2016). Такие стволовые клетки представлены даже во взрослом мозге — органе, который долго считался не способным к восстановлению. Нейральные стволовые клетки могут самообновляться и производить терминально дифференцированные нейроны и глиальные клетки. Тем не менее, тканеспецифичные стволовые клетки не могут создавать целые органы (которые построены из множества типов клеток с широким структурным и функциональным разнообразием) — возможно, за исключением печени, которая может регенерировать полностью функциональные печеночные доли. Хотя в ходе своего филогенеза млекопитающие потеряли большую часть своего регенеративного потенциала, они продолжают демонстрировать удивительные способности в этом отношении в течение эмбрионального периода и в раннем периоде жизни. Например, сердце новорожденного мышонка проявляет существенную способность к регенерации, а регенерация фаланг пальцев была описана как у новорожденных мышат, так и у детей в раннем возрасте (Miller et al., 2019). Более того, существуют надежные доказательства того, что способность стволовых клеток восстанавливать или обновлять взрослые ткани снижается с возрастом (López-Otín et al., 2013). Таким образом, люди обладают латентной способностью к регенерации, которая прогрессирующе заглушается эволюцией, онтогенезом и старением.
Репрограммирование клеток
Стволовые клетки составляют важный биологический инструмент, который регенеративная медицина предлагает для восстановления тканей и органов при заболеваниях и старении как альтернативу трансплантации клеток и органов. Такахаши и Яманака в 2006 году продемонстрировали, что индукция четырех транскрипционных факторов (Oct3/4, Sox2, Klf4 и c-Myc) в соматических клетках достаточна для их репрограммирования в индуцированные плюрипотентные стволовые клетки (иПСК/iPSCs). С этого момента стратегии репрограммирования применялись на мышиных моделях in vivo для омоложения и активизации специфических тканей (Abad et al., 2013; Kurita et al., 2018; Ocampo et al., 2016) или — в комбинации с геномным редактированием при помощи CRISPR-Cas9 — для коррекции врожденных генетических дефектов (Giacalone et al., 2018). Первое успешное применение аутологичных репрограммированных клеток у людей связано с течением возрастной дегенерации желтого пятна (Mandai et al., 2017). Дифференцировка клинических ИПСК в прогениторные или соматические клетки может лечь в основу новой клеточной терапии для широкого спектра заболеваний, включая диабет, инфаркт миокарда, болезнь Паркинсона и повреждение спинного мозга. Этот список быстро пополняется благодаря технологическим достижениям в данной области, включая возможность использования методов клеточной трансдифференцировки: она помогает избежать перехода в плюрипотентное состояние, минимизируя туморогенный потенциал таких клеток (Karagiannis et al., 2019). ИПСК также применяются для создания ксеноорганов и человеческих органов у животных, которые в дальнейшем могут использоваться для трансплантации при условии решения технических и этических вопросов (Wu et al., 2017).
Объединение признаков
Текущие характеристики здоровья включают в себя черты пространственной компартментализации (признаки 1 и 2), поддержание гомеостаза с течением времени (признаки 3, 4 и 5) и набор адекватных реакций на стресс (признаки 6, 7 и 8). Нарушение любых из этих характеристик высокопатогенно и вызывает острые или прогрессирующие повреждения в организме; это означает, что проявление заболеваний обычно связано с потерей более одного признака здоровья. Очевидно, что эти признаки не существуют в изоляции, поскольку они тесно переплетены на множестве уровней. Так, каждый из уровней организации (молекулы, органеллы, клетки, суборганные единицы, органы, системы органов, цепочки взаимодействий между ними и метаорганизм) человеческого тела взаимосвязан с теми или иными признаками здоровья (рисунок 6A), как будет показано ниже.
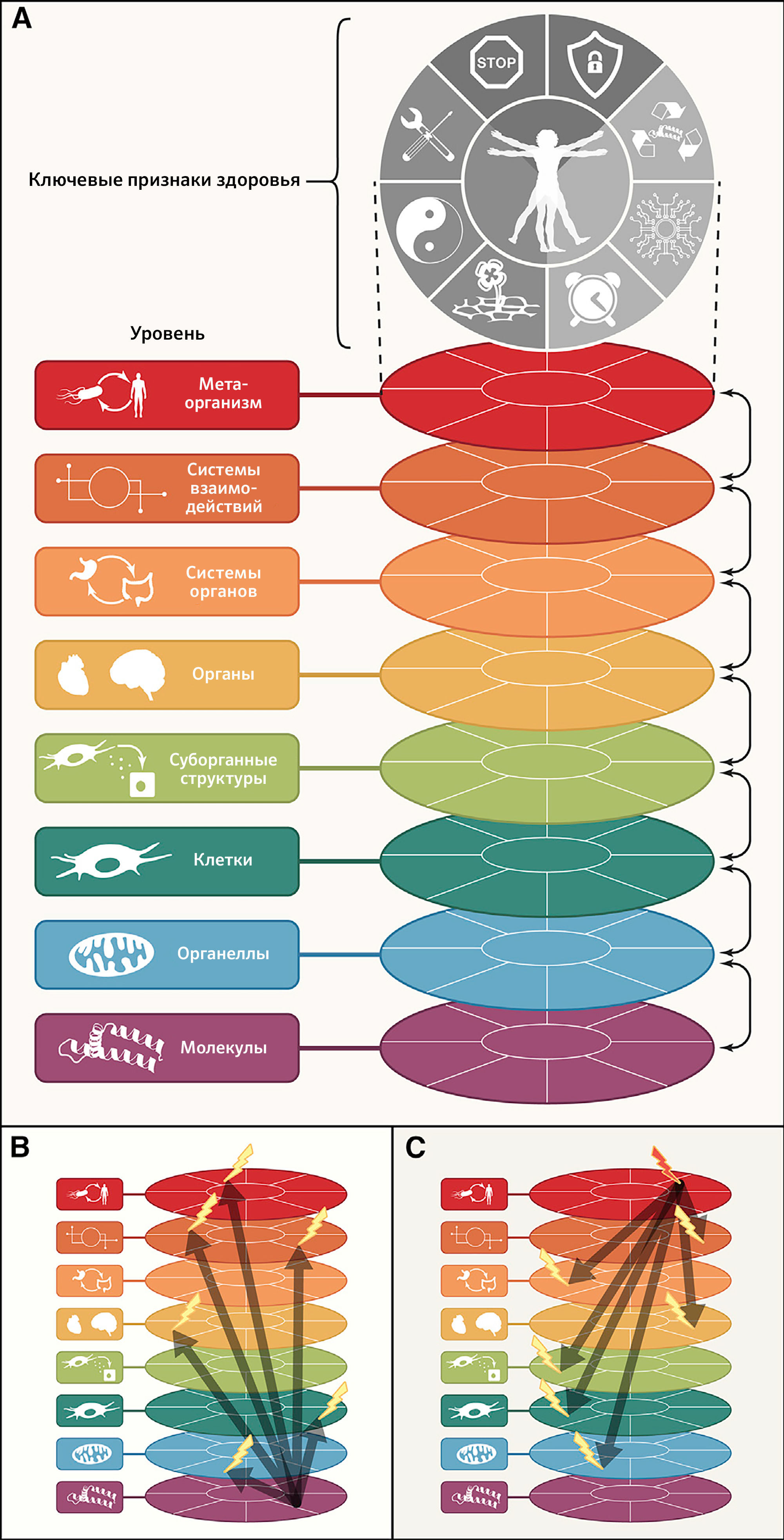
B) Примеры траекторий, берущих начало в единичном молекулярном нарушении. Мутации CFTR напрямую влияют на обновление белков, и они распространяются через несколько уровней организации, влияя на несколько признаков, включая микробиоту кишечника и дыхательные пути на верхнем уровне.
C) Примеры траекторий, берущих начало в чрезмерном размножении единичной вырабатывающей токсин бактерии в кишечнике, что приводит к насыщению организма токсинами вплоть до уровня органелл или клеток, преодолению гомеостатической и гормезисной регуляции и длительному повреждению клеток и органов. CFTR — муковисцидозный трансмембранный рецептор.
Макромолекулярная интеграция
На макромолекулы, такие как белки, одновременно воздействуют многие — если не все восемь сразу — признаки здоровья, что хорошо иллюстрируется патологическими процессами. Например, такие белки, как CFTR, участвуют в контроле респираторной и кишечной барьерных функций (признак 1), а также являются локальными ограничителями нарушения хлоридного баланса (признак 2). CFTR, представленный в плазматической мембране, должен постоянно рециклировать, и варианты гена этого рецептора CFTR с потерей функции вызывают муковисцидоз и влияют на общий протеостаз, включая аутофагию (признак 3). CFTR участвует во множестве регуляторных взаимодействий (признак 4), а его мутации могут даже нарушать циркадианный ритм (признак 5). Мутации CFTR, связанные с муковисцидозом, запускают преимущественно патогенный, а не гомеостатический механизм обратной связи (признак 6), вызывая самоподдерживающееся повреждение тканей (признак 7), не способное к полному восстановлению (признак 8), что в конечном счете приводит к перманентному нарушению функции дыхательной системы и желудочно-кишечного тракта, которое может даже запустить колоректальный канцерогенез (Scott et al., 2020) (рисунок 6B). Похожую логику можно применить к белкам, накапливающимся при нейродегенеративных заболеваниях, которые нарушают гематоэнцефалический барьер (признак 1), подобно прионам, распространяют свое состояние неправильной укладки (признак 2), нарушают протеостаз и избегают его (признак 3), разобщают нейроглиальную и синаптическую коммуникацию (признак 4), разрушают циркадианные ритмы (признак 5), участвуют в порочном круге преобладания петель положительной обратной связи над гомеостатическими механизмами отрицательной обратной связи (признак 6), не способны запускать гормезис (признак 7) и повреждают нейроны и нейронные взаимосвязи, которые невозможно восстановить (признак 8).
Интеграция органелл
Органеллы — элементарные строительные блоки клеток — участвуют в каждом из признаков. Например, митохондрии для выполнения своей функции должны поддерживать целостность внутренней и внешней мембран (признак 1) и избегать нежелательной клеточной гибели, а также неадекватной активации воспалительных путей. Нарушение проницаемости немногих митохондрий может быть пространственно ограничено (признак 2) циклами слияния и фрагментации, которые влияют на митохондриальную сеть, связанную с митофагией, а также нарушением механизмов обратной связи, которые в противном случае могли бы вызвать клеточную гибель. В отсутствие постоянного обновления путем митофагии/аутофагии митохондрии теряют свою функцию (признак 3). Митохондрии участвуют во многих метаболических, сигнальных и стрессовых путях, что обеспечивает их интеграцию в систему внутриклеточных взаимодействий (признак 4). Будучи частью множества физиологических сетей, которые вносят вклад в гомеостаз метаболизма (признак 5), они участвуют в циркадианных ритмах и регулируются ими (признак 5). Митохондрии воспроизводят и опосредуют адаптацию к разнообразному набору стрессовых сигналов в контексте митогормезиса (признак 7). Наконец, митохондрии могут осуществлять репарацию своей ДНК или подвергаться действию механизма обновления, благоприятствующему избирательной замене поврежденных органелл (признак 8). Сходные обширные заключения, касающиеся всех признаков здоровья, можно вывести для большинства — если не всех — органелл, включая аутофагосомы, лизосомы, ЭПР или ядро. Это подразумевает, что изменения в специфических для органеллы ферментах/путях или структурах (например, митохондриальной ДНК, ядерной ламине или порах) могут влиять на все аспекты нормальной физиологии, что приводит к развитию широкого спектра патологических нарушений.
Клеточная интеграция
Нормальные эпителиальные стволовые клетки вносят вклад в гомеостаз путем поддержания целостности плазматической мембраны во избежание гибели (признак 1), восстановления нарушений в их мембранах или замены потерянных клеток в находящихся под угрозой барьерах (признак 2), постоянного обновления (признак 3), участвуют в создании более крупных функциональных единиц (признак 4), отвечают на ритмические колебания (признак 5) и задействованы в обеспечении гомеостатической/гормезисной устойчивости — например, вызывая локальные изменения в коже, чтобы опосредовать ускоренную реакцию ранозаживления при повторном повреждении (признаки 6–8) (Naik et al., 2017). Стареющие и злокачественные клетки служат контрпримерами, которые нарушают здоровье на многих уровнях. Стареющие клетки склонны терять целостность ядерной оболочки (признак 1), передавать стареющий фенотип другим клеткам (признак 2), не способны обновляться вследствие перманентного блока клеточного цикла (признак 3), теряют свои нормальные функции и интеграцию в ткани (признак 4), не реагируют на циркадианные колебания (признак 5), участвуют в провоспалительных петлях положительной обратной связи (признак 6), преодолевают порог гормезисной регуляции (признак 7) и не могут принимать активного участия в регенерации тканей (признак 8), хотя они могут испускать сигналы, способствующие заживлению ран. Опухоли, возникающие из злокачественных клеток, нарушают целостность эпителиальных барьеров (признак 1), преодолевают локальные ограничения, создаваемые иммунным надзором (признак 2), обширно пролиферируют за пределами простого обновления (признак 3), нарушают систему взаимодействий на уровне кровеносной и вегетативной нервной системы (признак 4), нарушают циркадианные ритмы или избегают их (признак 5) и «эгоистично» противостоят терапевтическим воздействиям с помощью гомеостатических, гормезисных и регенеративных путей (признаки 6–8) за счет цепей взаимосвязей, направленных на сохранение здоровья всего организма. Tаким образом, автономные клеточные изменения способны создавать опасность на более высоких уровнях организации и нарушать здоровье организма.
Интеграция суборганных единиц
Тканевые макрофаги совместно с фибробластами входят в состав стромы всех органов, воспринимают изменения во внешних и внутренних барьерах (признак 1), поглощают и устраняют погибшие клетки (признак 2), подают сигналы для их замещения (признак 3), осуществляют и регулируют воспалительные и иммунные реакции (признак 4), следуют ритмическим колебаниям (признак 5), предвзаимодействуют с лигандами TLR4 для ослабления дальнейшего ответа (признак 6), но усиливают такую вызванную TLR4-активацию после предварительного воздействия вирусных агонистов (признак 7) (Wang et al., 2019b), и играют важную роль в восстановлении тканей (признак 8). Кишечные крипты служат примером минимальных единиц органа, поддерживающих целостность локального барьера (признак 1), ограничивают местные нарушения (признак 2), постоянно обновляются (признак 3), взаимодействуют с микробиотой и иммунной системой, продуцируют гормоны, влияющие на обмен веществ (признак 4), образуют периферические часы (признак 5), адаптируются к переменчивому поступлению питательных веществ и микроорганизмов (признаки 6 и 7) и обладают способностями к регенерации (признак 8). Напротив, кишечный дисбиоз очень патогенен, поскольку он может нарушить барьерную функцию подвздошной и толстой кишки (признак 1) с системным влиянием на метаболизм, выходящим за пределы локального окружения (признак 2), влияет на обновление стволовых клеток кишечника (признак 3), насыщает цепочки нейроэндокринных взаимодействий бактериальными метаболитами и токсинами (признак 4), нарушает перистальтику, рассинхронизируя желудочно-кишечный тракт с суточными ритмами (признак 5), в течение продолжительного времени разобщает микробную экосистему (признак 6) и активирует системные воспалительные ответы, при этом ослабляя иммунный тонус (признак 7), что оказывает дальнодействующие эффекты по отношению к восстановлению тканей и старению (признак 8) (рисунок 6C). Сходным образом, ожирение с метаболическим синдромом подрывает здоровье на многих уровнях, поскольку воздействует на целостность кишечного барьера (признак 1), нарушает противоопухолевый иммунный надзор (признак 2), блокирует аутофагию (признак 3), нарушает метаболические и гормональные взаимодействия вследствие чрезмерных уровней глюкозы и инсулина (признак 4), рассинхронизирует циркадианные ритмы (признак 5), нарушает контроль аппетита (признак 6) и гормезисные пути, обеспечивающие долголетие (признак 7) и препятствует ранозаживлению (признак 8). Эти примеры иллюстрируют некоторые связи регуляции на суборганном уровне и признаков здоровья.
Интеграция между уровнями организации
В приведенных выше примерах перечислены нарушения, влияющие на различные уровни организации строительных блоков организма (от молекул до метаорганизма). Однако признаки здоровья также могут предоставить теоретическую основу для объяснения вертикальных взаимодействий («скачков») между различными уровнями (дез)oрганизации (рисунки 6B и 6C). Таким образом, моногенное заболевание, затрагивающее структуру/функцию единичного белка, может разрушать признаки здоровья на протяжении всех уровней организации, далеко за пределами молекулярного уровня, как уже обсуждалось в случае муковисцидоза. Так, мутация CFTR в конечном счете даже нарушает тонкое равновесие метаорганизма, воздействуя не только на дыхательную систему, но и на кишечную микробиоту. Сходным образом, болезнь Вильсона (вызываемая мутацией в гене ATP7B, который кодирует фермент, связывающий и выводящий медь), не только усиливает чувствительность гепатоцитов к токсичности меди, но также вызывает характерный спектр психических и поведенческих аномалий (Członkowska et al., 2018). Ранний признак болезни Паркинсона — теоретически молекулярного и клеточного заболевания дофаминергических нейронов полосатого тела — запор (Hustad and Aasly, 2020), в то время как болезнь Альцгеймера — другое нейродегенеративное состояние — связана с предшествующими изменениями в метаболизме всего организма, вызывающими повышение расхода энергии и последующую потерю веса (Pratley et al., 2000). Нейродегенеративные и психические заболевания тесно коррелируют с изменениями микробиоты, что иллюстрирует еще одно последствие близких взаимосвязей между всеми уровнями организации. Текущее понимание таких взаимосвязей находится лишь на начальных стадиях, и необходимы дальнейшие попытки изучения «скачков» при проявлениях заболеваний на протяжении всех уровней организации.
Потеря здоровья и распространение заболеваний
Главные характеристики здоровья, приведенные в настоящей статье, обычно не теряются один за другим. Чаще коллапс организационных элементов, которые в норме поддерживают здоровое состояние, происходит по принципу домино. По этой причине за крупным «событием», таким как инсульт, инфаркт миокарда или рак, обычно ускоренно следует другое «событие», если сравнивать с соответствующими по возрасту контрольными группами (Narayan et al., 2020). Существует ряд неэксклюзивных гипотез для объяснения распространения нарушений здоровья за пределы нозологических сущностей и анатомических границ. Во-первых, манифестация крупного, угрожающего жизни заболевания может отражать общее и часто связанное с возрастом ухудшение здоровья по нисходящей траектории. Например, злокачественные опухоли и атеросклероз имеют общие факторы риска, а также механизмы развития, включая хроническое воспаление и недостаточный клиренс аномальных клеток. Во-вторых, катастрофическое событие, отмечающее клиническое проявление болезни, может само по себе запускать дальнейшее разрешение здоровья — как предполагается в случае чрезмерной провоспалительной активации симпатической системы после инфаркта миокарда, которая ускоряет развитие атеросклероза (Dutta et al., 2012). Таким образом, нарушение организации сохраняющих здоровье взаимодействий , подразумевает общие паттерны в патогенезе заболеваний и взаимосвязей между заболеваниями, что объясняет ряд их общих черт, а также эпидемиологические связи между разными болезнями, которые склонны прогрессировать от моно- до олиго- или полипатологических состояний.
Таким образом, здоровье можно рассматривать как целостное свойство многомерной системы различных вертикальных/иерархических уровней, которые организованы в горизонтальные признаки (рисунок 6). Разрушение здоровья следует сквозь эти уровни и признаки по пространственно-временной траектории, приводя к патологическим нарушениям, которые обычно распространяются по организму, когда какие-либо уровни/признаки теряют способность восстанавливать свою функцию. Это имеет прямые последствия для медицинского вмешательства, которое может быть полностью эффективным только в том случае, если удается восстановить или поддерживать все признаки здоровья.
Итоговое обсуждение
Впереди лежат многочисленные трудности, связанные с окончательным определением и взаимосвязанностью предложенных биологических признаков здоровья, а также их дальнейшего внедрения в организацию систем здравоохранения и социоэкономические аспекты (Berwick and Cassel, 2020; Snyder-Mackler et al., 2020). Создание перспективных и интегративных омиксных профилей — от уровня единичной клетки и далее по возрастанию — открывает клинически значимые состояния, а также новые молекулярные пути, связанные с онкологической, сердечно-сосудистой и метаболической патофизиологией (Schüssler-Fiorenza Rose et al., 2019). Tаким образом, крупномасштабные эпигеномные, метаболомные и метагеномные исследования предоставляют ценную информацию об эпигенетических маркерах, специфичных метаболитах и компонентах микробиоты, ассоциированных со здоровьем человека (Bell et al., 2019; The Integrative, 2019; Koh and Bäckhed, 2020). Обширное и глубокое омиксное профилирование здоровых лиц выявило различные типы паттернов старения («эйджиотипы») в зависимости от специфических молекулярных путей, которые изменялись с течением времени у каждого индивидуума (Ahadi et al., 2020). Всеобъемлющий протеомный анализ 16 894 человек позволил определить паттерны белков плазмы крови для 11 различных индикаторов здоровья: жир в печени, почечная фильтрация, процент жира в теле, масса висцерального жира, сухая мышечная масса, состояние сердца и легких, физическая активность, употребление алкоголя, курение, риск диабета и риск первичных сердечно-сосудистых событий. Такой подход открывает возможность применения анализа протеома крови для так называемых «жидких проверок здоровья» (Williams et al., 2019). Более того, сочетание многомерной информации, предоставляемой связанными объектами и более сложными сенсорами, науки, управляемой данными, а также искусственного и человеческого интеллекта (Topol, 2019) трансформирует наш взгляд на здоровье в модель с высоким разрешением, сходную с той, которая была недавно предложена для медицины высокого разрешения (Torkamani et al., 2017).
Вероятно, будущая «медицина здоровья» сможет детектировать опасные траектории и перехватывать их с помощью прицельного вмешательства задолго до того, как в действие вступит традиционная «медицина болезней». В этом контексте концептуализация признаков здоровья может установить основу для будущих исследований механизмов, для программирования алгоритмов, которые интегрируют биомедицинские параметры и для разработки подходов, позволяющих увеличить продолжительность человеческой жизни и ее здорового периода.
