Клетки без онкогенных мутаций тоже умеют метастазировать
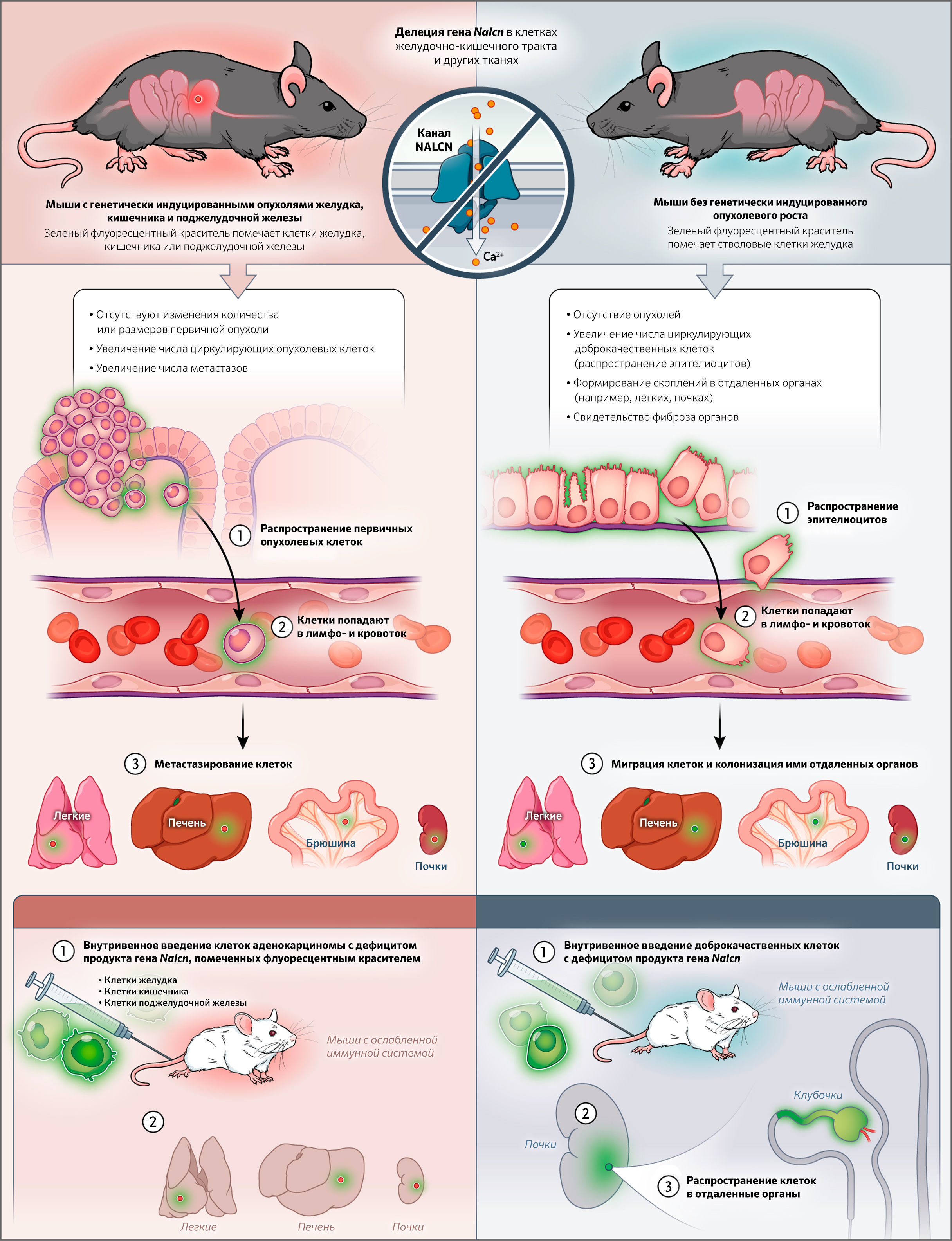
Считается, что прогрессия рака происходит по строгому и последовательному пути событий: онкогенные мутации в нормальных клетках вызывают избыточную пролиферацию и инициацию опухолевого роста, за чем следует инвазия через базальную мембрану, диссеминация по лимфатическим сосудам и, наконец, метастатическая колонизация отдаленных органов [1]. Гипотеза, описывающая этот каскад процессов от инвазии до метастазирования заключается в том, что последнее — это свойство, исключительное для клеток, которые приобрели онкогенные мутации. Недавнее исследование Rahrmann с соавт. бросает вызов этому представлению, предоставляя доказательства того, что нетрансформированные эпителиальные клетки без онкогенных мутаций также могут покидать органы и распространяться по кровотоку, колонизируя отдаленные участки организма (рис. 1) [2].
Авторы показали на модели рака желудка у мышей, что экспрессия неселективного канала утечки натрия (NALCN) при аденокарциноме желудка снижена, по сравнению с базальными стволовыми клетками антрального отдела желудка. Анализ более чем 10 000 геномов раковых клеток человека показал, что несинонимичные мутации в NALCN при раке желудка и колоректальном раке встречаются чаще, а структурный прогноз предполагает, что 75 % этих мутаций способны блокировать функцию натриевых каналов. Делеция гена Nalcn (экспрессирующий аналог NALCN у мышей) аденомы желудка, кишечника и поджелудочной железы приводила к увеличению числа циркулирующих опухолевых клеток и метастазов, не изменяя количество или же размер первичных опухолей. А анализ уровня экспрессии генов в циркулирующих опухолевых клетках мышей с дефицитом Nalcn выявил молекулярные сигнатуры, сходные с таковыми в таких же клетках у человека. Эти сведения подтверждают роль NALCN в подавлении распространения метастазов без влияния на опухолевую инициацию.
Удивительно, но делеция гена белка NALCN в клетках, экспрессирующих флуоресцентный белок, также приводила к увеличению количества циркулирующих доброкачественных клеток. Флуоресцентные клетки и их скопления с дефицитом Nalcn обнаруживались в легких и почках старых мышей. Такие циркулирующие доброкачественные клетки, которые вводили внутривенно мышам-реципиентам, могли не только перемещаться и колонизировать паренхиму многих органов, но, что примечательно, даже формировать морфологически нормальные структуры в органах-реципиентах, например почечные клубочки и почечные канальцы.
Такие провокационные данные свидетельствуют, что эпителиальные клетки могут диссеминировать по кровотоку и дифференцироваться в ответ на локальные сигналы микроокружения для колонизации отдаленных органов в отсутствии онкогенных драйверных мутаций. Тем самым, процесс метастазирования отделяется от онкогенеза. Циркулирующие опухолевые и доброкачественные клетки с дефицитом Nalcn у мышей имеют сходные профили транскрипции с циркулирующими опухолевыми клетками у людей. Однако, что касается стимуляции метастазирования, в ходе исследований не удалось выявить те же функции несинонимичных мутаций в гене NALCN, которые наблюдались в процессе клинического секвенирования опухолей. Степень диссеминации нетрансформированных эпителиальных клеток у пациентов неизвестна. Механизмы, с помощью которых делеция NALCN делает эпителиальную диссеминацию возможной, и степень, в которой эпителиальные клетки с NALCN дикого типа могут диссеминировать (возможно, путем блокирования его функции), также остаются неясными. В предыдущих исследований выяснилось, что метастазы могут возникать уже на ранних стадиях онкогенеза, но Rahrmann с соавт. предоставляют непосредственные доказательства эпителиальной диссеминации in vivo даже в отсутствие онкогенных мутаций. Разграничение таких процессов, как инициация опухолевого роста и метастазирования обладает важными последствиями для понимания опухолевой прогрессии и, возможно, для разработки методов лечения рака в будущем.
Многие противораковые лекарственные средства прицельно воздействуют на драйверные мутации, которые, как считается, инициируют и поддерживают опухолевый рост. Однако такие препараты не способствуют устранению диссеминации нетрансформированных клеток. Если в ходе экспериментов подтвердится, что диссеминация нетрансформированных клеток действительно окажется источником метастатических злокачественных опухолей, потребуются новые методы терапии. Изначальная диссеминация и метастазирование в отдаленные органы нетрансформированными эпителиальными клетками с последующим приобретением онкогенных мутаций может лежать в основе клинического феномена опухолей (в т.ч. метастатических) невыявленной первичной локализации, на долю которого приходится примерно 5 % случаев рака во всем мире [3]. Эти виды рака обычно имеют неблагоприятное течение, потенциальным объяснением чему может быть происхождение вышеупомянутых клеток и их свойства (крайне выраженная пластичность и миграция). Как правило, определение молекулярного профиля рака с невыявленной первичной локализацией ограничивалось целевым секвенированием экзонов определенных генов, связь с развитием рака которых не вызывает сомнений; данная методика лишь незначительно открывает все их отличительные клинические особенности. Будущие работы станут базисом для выработки новых терапевтических методик этих агрессивных видов рака. Они будут основываться на исследовании Rahrmann с соавт. и направляться на выявление мутаций NALCN или других изменений фенотипа, характеризующегося диссеминацией (в первую очередь) и опухолевым ростом (во вторую).
Было показано, что нормальные эпителиальные клетки способны мигрировать, особенно в условиях заживления ран. Ранее удалось продемонстрировать, что такая эпителиальная миграция и трансдифференцировка происходят в пределах непосредственно прилежащей базальной мембраны, однако, согласно текущему исследованию, возможна более широкая эпителиальная диссеминация по кровотоку, что может служить физиологическим механизмом повторного метастазирования и восстановления тканей. Было показано, что в основе регенерации и метастазирования лежат общие молекулярные механизмы, отличающиеся от инициации первичного опухолевого роста [4]. Многие виды рака возникают в контексте хронического повреждения и восстановления тканей, как например, колит-ассоциированный колоректальный рак, гепатоцеллюлярный рак, плоскоклеточный рак головы и шеи и др. Возникновение онкогенных мутаций в эпителиальных клетках в состоянии регенерации может привести к ускоренному метастазированию, по сравнению с такой же мутацией в нерегенеративном эпителии. Действительно, колоректальный рак, связан с худшим прогнозом, чем спорадический рак толстой кишки [5].
В свою очередь, существует необходимость применения различных методов лечения опухолей, возникающих в регенеративной среде, а также профилактической терапии, специфичной для метастазирования у пациентов с хроническими воспалительными состояниями, для устранения диссеминированных клеток до того, как они приобретут онкогенные мутации. И наоборот, усиление эпителиальной диссеминации может повысить эффективность терапии стволовыми клетками для стимуляции регенерации тканей, что ныне находится в разработке. Однако у старых мышей с дефицитом NALCN развивается фиброз почек и кожи; также нельзя не учитывать сведения, указывающие на сложные взаимодействия между электрической активностью эпителия, молекулярными программами регенерации, старением и прогрессированием опухоли. Эти вопросы заслуживают дальнейшего изучения. Обобщая, исследование Rahrmann с соавт. обеспечивает концептуальную и молекулярную основу для планирования работ, в которых будет дополнительно изучаться связь диссеминации клеток с онкогенезом и регенерацией тканей.