Персонализированная терапия воспалительных заболеваний кишечника

Продуманное взаимодействие эффективности и безопасности тактик лечения воспалительных заболеваний кишечника с учетом рисков заболевания пациентов, осложнений терапии и предпочтений в ней — всё это необходимо для обоснованного выбора лечения в клинической практике. Прецизионная терапия может стать лучшим способом подбора конкретного препарата для конкретного пациента.
За последнее десятилетие возможности лечения воспалительных заболеваний кишечника (ВЗК) претерпели значительные изменения. После одобрения регулирующими структурами в 1998 г. инфликсимаба, воздействующего на фактор некроза опухоли (ФНО), в 2014 г. последовало одобрение ведолизумаба (анти-α4β7-интегрин). Исключением стал натализумаб — анти-α4-интегрина для лечения болезни Крона (2005 г.), который не получил широкого применения из-за риска развития прогрессирующей многоочаговой лейкоэнцефалопатии [1]. С 2014 г. для лечения ВЗК были одобрены еще три класса биологических и низкомолекулярных препаратов (для перорального приема) с уникальными механизмами действия и различными профилями эффективности и безопасности:
- антагонисты ИЛ-12 и ИЛ-23 (устекинумаб — антагонист IL-12р40 и IL-23p40 был одобрен в 2016 г.; рисанкизумаб — антагонист IL-23p19 был одобрен в 2022 г.; оба препарата для лечения болезни Крона);
- ингибиторы янус-тирозинкиназы (JAK) (ингибитор пан-JAK — тофацитиниб — был одобрен в 2019 г.; селективные ингибиторы JAK1, упадацитиниб и филготиниб — в 2022 г.. Оба препарата для лечения язвенного колита);
- модулятор сфингозин-1-фосфатных рецепторов (озанимод — был одобрен в 2021 г. как средство для лечения язвенного колита) [2].
Эти достижения привлекли внимание к аспектам сравнительной эффективности и безопасности различных методов прецизионной терапии, чтобы выбрать правильный лекарственный препарат для конкретного пациента в конкретный промежуток времени. Целью данного клинического обзора является освещение современного подхода к выбору терапии для лечения ВЗК средней и тяжелой степени, основываясь на тесной интеграции эффективности и безопасности лекарств с учетом риска развития осложнений (связанных как с самим заболеванием, так и с применяемым лечением), а также предпочтений врача и пациента. Кроме того, в работе дается представление о том, как прецизионная терапия может способствовать выбору оптимального метода лечения для конкретного пациента.
Монотерапия устекинумабом не имеет преимуществ перед монотерапией адалимумабом у пациентов с болезнью Крона средней и тяжелой степени, что удалось показать в ходе исследования SEAVUE. Сравнивая данные этого прямого сравнительного исследования с результатами испытаний одобренных препаратов II и III фазы, сетевой метаанализ показал, что инфликсимаб, в сочетании с иммуномодуляторами (или же без них), а также адалимумаб являются наиболее эффективными препаратами для индукции ремиссии у пациентов, ранее не получавших лечение [3]. Для пациентов, ранее уже принимавших антагонисты ФНО, рисанкизумаб и устекинумаб являются наиболее эффективными препаратами (по сравнению с ведолизумабом) [3]. Альтернативные антагонисты ФНО могут стать подходящим вариантом для пациентов, прекративших прием стандартного антагониста ФНО (который назначается в первую очередь) по причине непереносимости или иммуногенности [3].
Учитывая хронический характер ВЗК, долгосрочная безопасность различных иммунодепрессантов является еще одним важным фактором при выборе терапии. Безопасность стратегии лечения пациентов с ВЗК определяют два ключевых фактора:
- непосредственно системный иммуносупрессивный потенциал препарата;
- его эффективность в плане контроля заболевания, достижения ремиссии без использования кортикостероидов и улучшения функционального состояния организма.
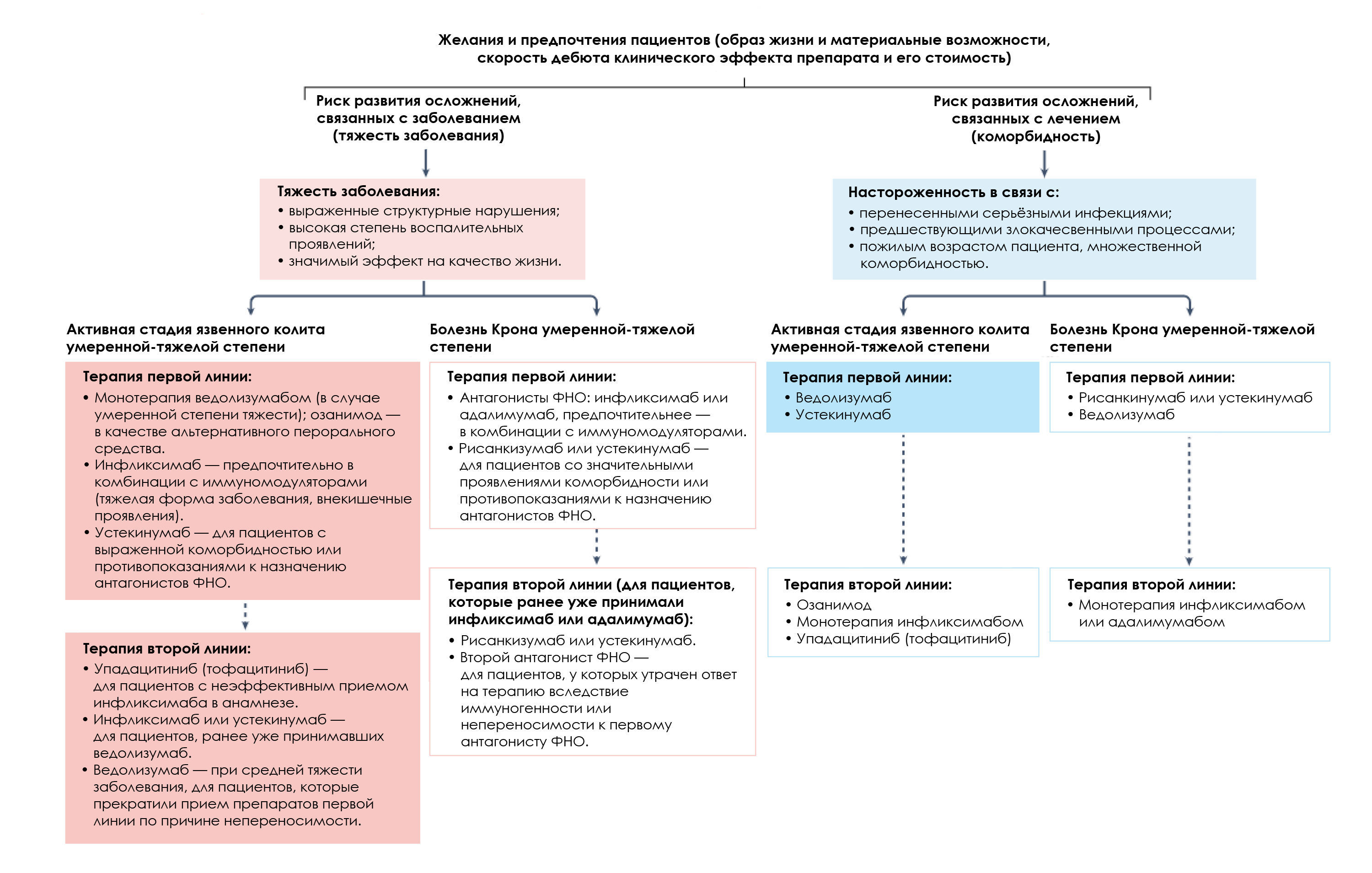
Согласно мета-анализу прямых сравнительных обсервационных исследований, прием устекинумаба может быть связан с более низким риском развития серьезных инфекционных осложнений, по сравнению с антагонистом ФНО и ведолизумабом у пациентов с болезнью Крона [4]. Хотя ведолизумаб специфичен для кишечника с меньшим потенциалом системной иммуносупрессии, между ним и антагонистами ФНО нет различий в риске развития инфекционных осложнений (возможно, из-за более низких показателей достижения контроля над заболеванием в случае приема ведолизумаба). В принятии совместного решения врачом и пациентом задействованы и другие факторы: наличие сопутствующих заболеваний, скорость начала действия препарата, а также предпочтения пациента, такие как способ введения, стоимость и доступность препарата. В большинстве компетентных структур, опасения относительно стоимости препаратов в корне меняют подобные дискуссии, при этом предпочтение отдается биопрепаратам антагонистов ФНО, а также классическим иммунодепрессантам, таким как, тиопуринам и метотрексату, особенно в условиях ограничения ресурсов (рис. 1).
Как и в случае с болезнью Крона, прямых сравнительных испытаний современных иммуносупрессивных препаратов среди пациентов с язвенным колитом средней и тяжелой степени проведено крайне мало.
Исследователи сравнили исследования VARSITY (сравнение ведолизумаба и адалимумаба) с данными испытаний II и III фазы одобренных для лечения препаратов. Сетевой метаанализ показал, что у пациентов, ранее не получавших лечение, упадацитиниб, инфликсимаб и ведолизумаб наиболее эффективно вызывают индукцию ремиссии.
Также вышеперечисленные препараты значительно эффективнее, чем адалимумаб [5]. Упадацитиниб наиболее эффективен для пациентов, ранее получавших антагонисты ФНО, в сравнении со всеми другими одобренными препаратами, кроме устекинумаба. Сравнительные исследования по безопасности свидетельствуют о более низком риске развития серьезных инфекций при применении ведолизумаба, по сравнению с антагонистами ФНО [4]. FDA выпустило рекомендацию, согласно которой использование всех ингибиторов [по всем показаниям] ограничивается только пациентами, стандартное лечение у которых не принесло результата (или же, у которых непереносимость препаратов-антагонистов ФНО) [6] (рис. 1). Агентство основывалось на мониторинговом исследовании ORAL по сравнительной безопасности тофацитиниба и антагонистов ФНО у 4362 пожилых пациентов с ревматоидным артритом.
Эти непрямые подходы, основанные на сетевом мета-анализе и обсервационных исследованиях, легли в основу клинических руководств, целью которых является массовое применение персонализированной терапии в рутинной клинической практике. Однако использование такой терапии на индивидуальном уровне поднимает множество вопросов практического характера. Например, какому пациенту в большей степени угрожает высокий риск развития осложнений, связанных с заболеванием и лечением, какой иммунодепрессант (из группы «нового поколения») выбрать и в каком порядке применять эти препараты? Новые прогностические биомаркеры и клинические признаки позволяют предсказать течение заболевания и помогут найти баланс между мощной иммуносупрессией и риском неконтролируемого воспаления. Однако в настоящее время в клинической практике подобные биомаркеры не используются. Одним из них является PredictSUREIBD — маркер, основанный на машинном обучении и проверенный в ходе испытаний. Это количественный ПЦР-классификатор цельной крови, способный выявлять 17 генов для дифференцировки пациентов с ВЗК легкого и агрессивного течения на момент постановки диагноза [7]. В настоящее время он проходит испытания в рамках исследования «Прогнозирование исходов болезни Крона, основываясь на молекулярном биомаркере» (PROFILE). Биомаркеры, предсказывающие терапевтическую эффективность, также важны для выявления потенциально эффективных специфических лекарственных средств. Транскриптомные маркеры одиночных генов оказались связаны с высокой вероятностью отсутствия эффективности антагонистов ФНО, включая IL-13Rα2 и пристеночный онкостатин [8]. Однако эти биомаркеры еще не готовы к своему дебюту. HLADQA1*05 — генетический вариант, связанный с высоким риском иммуногенности по отношению к антагонистам ФНО. Это коммерчески доступный фармакогеномный биомаркер, используемый в клинической практике для принятия решений относительно применения комбинаций иммуномодуляторов с антагонистами ФНО [9]. Модели клинического прогнозирования, основанные на тех клинических признаках, которые врачи применяют на практике, обладают скромными прогностическими возможностями (особенно при выборе между различными видами терапии). Однако благодаря ним можно выявить пациентов с большей или меньшей вероятностью развития ответа на лечение.
Таким образом, расширение возможностей лечения ВЗК помогут в интегрировании баланса риска и выгоды на основании различных источников данных. Это могут быть прямые сравнительные испытания, доказательства из рутинной практики, желания и предпочтения пациентов. Всё это может стать основой оптимального выбора терапии для улучшения результатов лечения. В будущем прогностические биомаркеры, а также их сочетание с клиническими параметрами могут помочь в принятии точных решений.
