Ингибиторы чекпоинтов в качестве сенолитиков
Сенолиз — т.е., устранение стареющих клеток (СК) — являет собой новую терапевтическую концепцию лечения старения и возрастных заболеваний, которая принесла первые успехи в клинике лечения диабетического макулярного отека (на примере препарата UBX1325). В своей недавней статье в Nature Ван с соавт. сообщают, что некоторые популяции СК экспрессируют PD-L1 (лиганд 1 запрограммированной клеточной гибели, от англ. Programmed cell death-ligand 1 — прим. перев.). Авторы описывают новый способ достижения сенолиза посредством клиренса этих клеток при помощи ингибиторов иммунных контрольных точек.
Клеточное старение — это запрограммированная гибель, которая формирует защиту организма млекопитающих от развития рака и способствует восстановлению и регенерации тканей. Однако у процесса имеется и темная сторона: стареющие клетки (СК), которые накапливаются в тканях и органах, могут стать причиной их дегенерации и дисфункции. СК несут как полезные, так и нежелательные биологические эффекты, что выражается в секреторном фенотипе, ассоциированном со старением (СФАС) — сложном гетерогенном секретоме, состав которого варьируется в зависимости от типа клеток, индуктора старения и стадии старения [2].
Предварительные исследования клинической эффективности на мышах показали, что сенолиз способствует замедлению старения и развития возрастных заболеваний [3]. Это положило начало «гонке» за препаратами, которые избирательно и безопасно способны устранять вредоносные СК, участвующие в развитии таких заболеваний, как атеросклероз, остеоартрит, легочный фиброз, дегенерация желтого пятна, деменция и других патологических состояний. Выяснилось, что жизнеспособность СК, вызывающих патологию, часто зависит от функционирования генов, экспрессирующих регуляторы апоптоза из семейства BCL: в частности, BCL2 и BCL2L1 [4] (способствуют выживанию клеток), а также синтетических низкомолекулярных ингибиторов этих белков. Эти два фактора оказывают значимый терапевтический эффект в доклинических моделях большинства вышеуказанных заболеваний. Хотя вышеупомянутые ингибиторы не подходят для системного применения у людей из-за неблагоприятного воздействия на нейтрофилы и тромбоциты, было доказано, что они безопасны и высокоэффективны при интраорбитальном введении у пациентов с дегенерацией желтого пятна (NCT04857996) [5].
Также широко тестировались в доклинических моделях встречающиеся в природе флавоноиды с сенолитическими свойствами, такие как кверцетин (обычно используется в сочетании с ингибитором тирозинкиназы дазатинибом) и физетин [6]. Благодаря обнадеживающим результатам этих исследований и отсутствию явных побочных эффектов эти соединения быстро стали объектами двух десятков клинических испытаний для широкого спектра старческих патологий, при которых требуется системное введение лекарства. Здесь требуется одно ключевое замечание: биологические свойства физетина, кверцетина и дазатиниба крайне разнообразны, что усложняет интерпретацию любых клинических эффектов с точки зрения сенолиза. Кроме того, СК — довольно гетерогенная группа, и поэтому для получения препаратов и применения их в будущем могут потребоваться несколько способов их очистки. Для дальнейшего продвижения сенолиза в качестве терапевтической концепции Ван и с соавт. выдвинули гипотезу о том, что иммунные контрольные точки могут играть центральную роль в выживании СК. Следовательно, если это так, то ингибиторы контрольных точек могут оказаться потенциальными терапевтическими средствами для лечения возрастных фенотипов (рис. 1) [7].
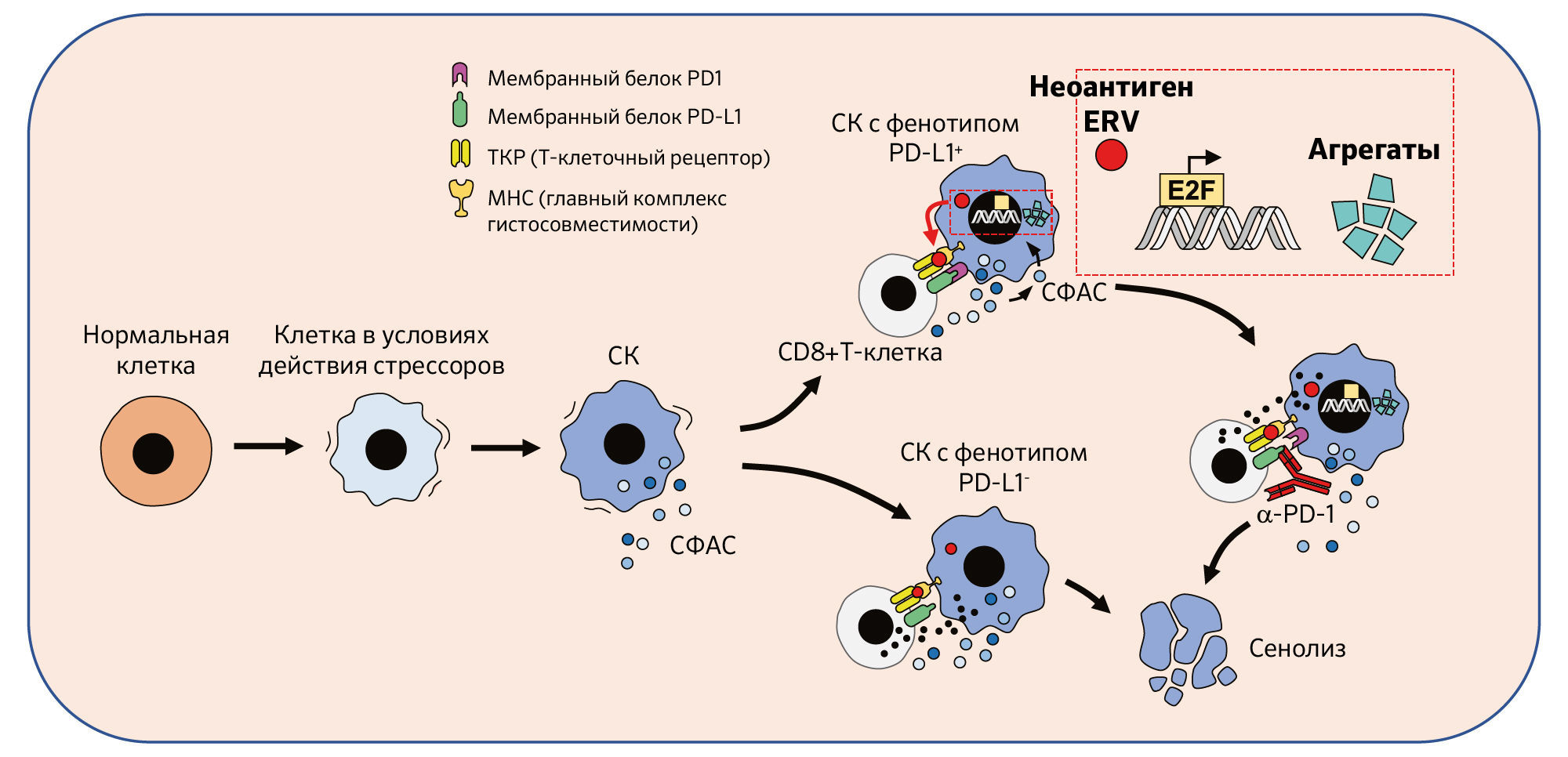
Гипотеза авторов состоит в том, что патологические СК способны накапливаться в течение длительного периода в тканях и органах, «уклоняясь» от иммунного клиренса [8]. Один потенциальный механизм этого «уклонения», который изучался в нескольких лабораториях, заключается в экспрессии белков иммунных контрольных точек стареющими клетками. Действительно, недавно Онорати с соавт. сообщили, что в СК, полученных в условиях in vitro, наблюдается высокая экспрессия CD274 — гена, кодирующего белок контрольной точки PD-L1, независимо от типа клеток или стрессора, вызывающего старение [9]. Ученые обнаружили, что активация PD-L1 является поздним событием в программе старения и зависит от провоспалительных элементов СФАС. Новое исследование Вана с соавт. добавляет в эту систему зависимость от низкого уровня транскрипционной активности E2F и нарушение активности протеасом (рис. 1) [7]. Авторы показывают, что активация PD-L1 защищает СК в условиях in vitro от совместно культивируемых активированных Т-клеток. Анти-PD1 антитела нивелируют этот защитный эффект, запуская элиминацию PD-L1+ СК посредством СФАС- и антиген-зависимым образом (рис. 1).
Используя ранее установленный репортерный штамм на основе tdTomato для маркировки СК p16+ в тканях и органах мыши [10] Ван с соавт. предоставляют доказательства того, что их результаты in vitro, актуальны и для in vivo, и что ингибирование иммунных контрольных точек может иметь терапевтическое применение помимо лечения рака. Ученые обнаружили, что ~ 50 % СК Tom+ в старой печени имеют фенотип PD-L1+, при этом более низкий процент этих клеток (~ 10 %) также наблюдается в стареющих тканях легких и почек. Эти соотношения в значительной степени снижаются в зависимости от CD8+ Т-клеток, когда вводили анти-PD1 антитела. Важно отметить, что лечение старых мышей анти-PD1 антителами смягчало некоторые симптомы и синдромы старения, как например, жировую дистрофию печени, выраженную астенизацию и снижение двигательных навыков, а также повышало альвеолярный объем. Кроме того, в мышиной модели неалкогольного стеатогепатита (НАСГ), ингибирование иммунных контрольных точек замедляло прогрессирование заболевания, что напоминало элиминацию СК с помощью препарата-сенолитика ABT263. В совокупности эти данные указывают на то, что устранение СК с фенотипом PD-L1+ посредством ингибирования иммунных контрольных точек может быть многообещающей терапевтической стратегией против старения.
Однако представленные данные также поднимают ряд вопросов, требующих дальнейшего анализа. В то время как анти-PD1 антитела уничтожают большую часть клеток с фенотипом PD-L1+Tom+, также исчезает чуть меньшее, но значимое количество популяции клеток PD-L1-Tom+. Поскольку последние являют собой доминирующую группу среди Tom+ клеток во всех проанализированных тканях, абсолютное количество клеток PD-L1-Tom+, которые могут элиминироваться при анти-PD1-лечении, по-видимому, намного больше, чем количество клеток фенотипа PD-L1+Tom+. Возникают новые интересные вопросы о механизме клиренса клеток PD-L1-Tom+ и их роли в развитии терапевтических эффектов, наблюдаемых при лечении анти-PD1. Эти эксперименты не исключают важности клеток Tom-, которые также могут быть мишенями для воздействия лечения анти-PD1. Более того, поскольку только популяция СК представляет собой фенотип p16+, еще предстоит изучить, в какой степени p16- СК активируют PD-L1 и влияют на терапевтические преимущества анти-PD1.
Также важно дополнительно изучить, как при лечении изменяется (улучшается) течение синдромов или симптомов, связанных со старением. Например, что касается силы захвата (показатель физической силы): есть ли корреляция между объективным улучшением состояния человека после лечения с изменениями в мышечной ткани, соответствующими уменьшению выраженности саркопении? Кроме того, включая исходные значения проанализированных фенотипов, связанных со старением, можно было бы оценить, представляют ли терапевтические эффекты снижение скорости прогрессирования или регрессирование данных фенотипов. И, наконец, лечение анти-PD1 может не устранять риск побочных эффектов при системном введении препаратов-сенолитиков из-за элиминации жизненно важных популяций СК, участвующих в восстановлении или естественном «омоложении» тканей.
