Оптическая когерентная томография: от изобретения — к стандарту диагностики

Оптическая когерентная томография (ОКТ) — неинвазивный, не требующий приема или введения контрастирующих препаратов, быстрый и безболезненный метод послойной визуализации тканей глаза на гистологическом уровне. В 1991 году в журнале Science была опубликована статья исследователей из Массачусетского технологического университета [1]. Уже через пять лет фирмой Carl Zeiss была создана первая серийная ОКТ-система для врачебной практики [2,3]. На рисунке 1 мы видим изображение сетчатки здорового человека, полученное с помощью ОКТ [4]. Чтобы правильно трактовать изображения, получаемые с помощью ОКТ, необходимо хорошо знать гистологическое строение структур глаза, хотя томографические и гистологические структуры не всегда удается точно сопоставить.
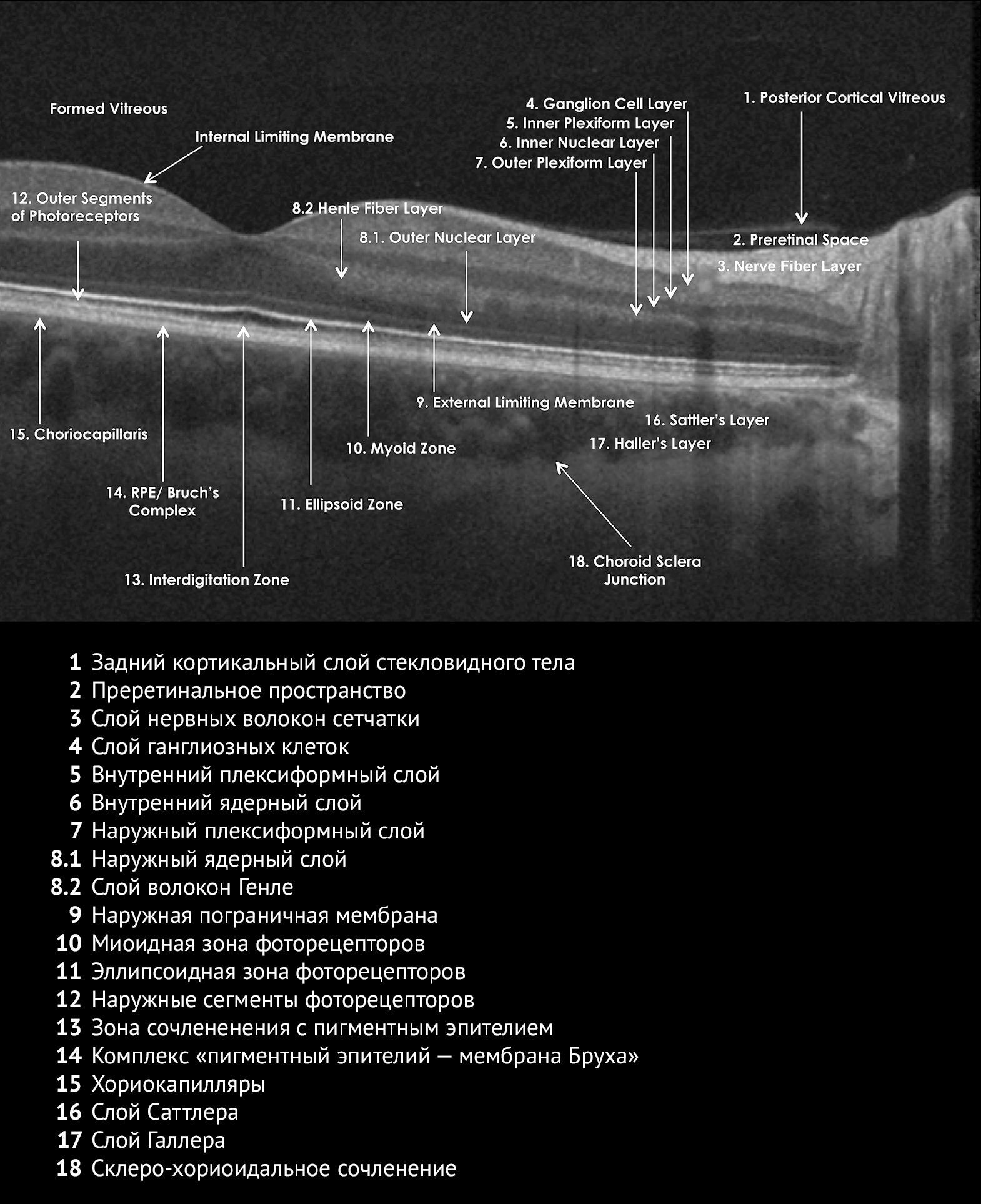
Рисунок 1 | Изображение сетчатки глаза без патологических изменений, полученное с помощью ОКТ
Клиническое значение
Анастасия Николаевна, расскажите, пожалуйста, при каких заболеваниях ОКТ является критически важной?
При возрастной макулярной дегенерации (ВМД) ОКТ является стандартом диагностики, на котором основаны современное описание и номенклатура [6,7].
ОКТ позволяет:
- определить форму заболевания, тип макулярной неоваскуляризации и позволяет прогнозировать ответ на лечение;
- вовремя выявить дебют перехода из одной формы в другую при мониторинге: в большинстве случаев это невозможно при самоконтроле или офтальмоскопии.
- оценить ответ на лечение, поскольку только ОКТ позволяет оценить все типы жидкостей, которые свидетельствуют об активности макулярной неоваскуляризации, что будет влиять на выбор режима и интервалов лечения.
Таблица 1 | Обновленная номенклатура неоваскулярной формы возрастной макулярной дегенерации [8,9]

При диабетических и постокклюзионных отеках диагностика и оценка ответа на лечения на сегодняшний день также невозможны без ОКТ. В зависимости от вовлечения центра макулы в отек, пациенту могут быть предложены разные виды лечения (при отсутствии вовлечения центра может быть предложено лазерное лечение, при вовлечении — интравитреальные инъекции ингибиторов ангиогенеза). Также оценивая структуру сетчатки на ОКТ при этих заболеваниях, можно прогнозировать возможность улучшения зрения на фоне лечения.
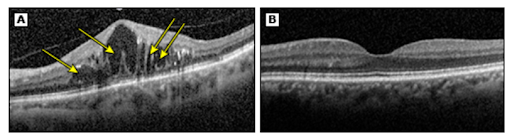
(B) Для сравнения: ОКТ-изображение макулярной зоны сетчатки без патологических изменений.
При миопической макулопатии только ОКТ позволяет адекватно оценивать неоваскулярный компонент и тракционные изменения [11,12]. Также ОКТ стала стандартом диагностики и наблюдения за глаукомой. О преимуществе этого метода в сравнении с другими (поляриметрией, конфокальной сканирующей лазерной томографией) заявлено еще в 2016 г., в 10-ой публикации Консенсуса Всемирной ассоциации глаукомы [13].
Расскажите, пожалуйста, про курс по ОКТ от клиники «Зрение» (промокод ZRENIEMEDACH для подписчиков). Как он может быть полезен для врачей-офтальмологов?
Сегодня навыком выполнения исследования и интерпретации ОКТ следует обладать любому офтальмологу, особенно если речь идет о ретинальной патологии. Поэтому наш курс направлен на подробное ознакомление с основами и принципами метода, функциональными возможностями приборов, обучение работе на приборе, детальный разбор основных патологий, в диагностике которых используется метод оптической когерентной томографии.
Анастасия Николаевна, можете, пожалуйста, дать несколько советов по тому, как правильно выполнять ОКТ-исследование?
Как правило, технически само исследование выполнить несложно, и его может делать обученный помощник врача — оптометрист или медицинская сестра. Важно выполнять исследование качественно: с достаточной силой сигнала, без артефактов, в полном объеме оценивать патологический очаг и не оставлять его части за пределами сканирования, выбирать в каждой ситуации наиболее подходящий тип скана. Проблемы с вышеперечисленными пунктами могут свести качество интерпретации на нет даже в банальных случаях.
Отметим, что для получения качественного изображения необходима прозрачность оптических сред и нормальная слезная пленка (или искусственная слеза). Исследование может быть затруднено при миопии высокой степени, помутнении оптических сред на любом уровне [14].
Какие заболевания позволяет диагностировать ОКТ переднего отрезка? Можно ли так исследовать и другие структуры, кроме роговицы? Известно ли Вам про использование такого подхода для визуализации структур придаточного аппарата глаза, например, век?
ОКТ переднего отрезка используется на сегодняшний день достаточно широко и не только для оценки роговицы, но и для оценки передней камеры и анатомии угла, морфологического анализа фильтрационной подушечки после оперативного лечения, оценки положения хрусталика.
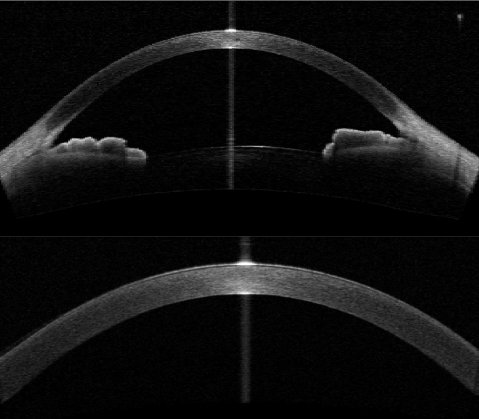
Рисунок 3 | Сверху: снимок переднего отрезка. Снизу: снимок роговицы в высоком разрешении [15]
Описаны ОКТ-признаки различных поражений конъюнктивы (например, конъюнктивальной меланомы, лимфомы, невуса, амилоидоза). Есть публикации по использованию ОКТ для оценки новообразований кожи век (например, при базальноклеточкой карциноме, где ОКТ позволяет визуализировать измененную архитектуру кожи с хорошей гистопатологической корреляцией). А недавнее появление возможности оценки переднего отрезка в ангио-режиме, вероятно, может расширить диагностические возможности.
Алгоритм интерпретации результатов
При анализе данных, полученных с помощью ОКТ, рекомендуется соблюдать последовательность в оценке качественных и количественных изменений [14]:
Сначала оцениваются качественные изменения:
- Морфологический анализ. Предполагает анализ формы среза, витреоретинального и ретинохориоидального профиля, а также хориосклерального профиля.
- Структурное исследование (сегментация). Сетчатка и хориоидея — это многослойные структуры с параллельно расположенными слоями и чашеобразным изгибом. Сетчатка также включает поперечные структуры, соединяющие различные слои.
- Анализ рефлективности (гипер- и гипорефлективность).
- Исследование аномальных образований.
- Анализ теневых областей.
Затем оцениваются количественные показатели при патологическом состоянии, для выводах о результатах консервативного, лазерного или хирургического лечения. Всегда следует помнить о том, что адекватная оценка количественных показателей, возможна только после качественного морфологического и структурного анализа томограмм. Ошибки сегментации программным обеспечением по умолчанию могут дать неправильные количественные данные, что, например, критически важно при оценке и мониторинге глаукомы.
Эволюция технологии
ОКТ является оптическим аналогом ультразвука, обладая меньшей глубиной визуализации при значительно более высоком разрешении. Благодаря глубине визуализации до 15 мм и осевому разрешению более 5 микрометров, ОКТ занимает нишу между ультразвуковой и конфокальной микроскопией. Получаемое путем суммирования нескольких А-сканов двумерное изображение, по аналогии с ультразвуковым исследованием, называется В-сканом. Расстояние между точками А-скана определяет продольное (аксиальное) разрешение, между соседними В-сканами — поперечное [16].
Расскажите, пожалуйста, как изменилась технология ОКТ за последние тридцать лет?
Технология стала доступна с 1996 г., когда появилась первая ОКТ-система, работающая во временной области (Time-Domain OCT, TD-OCT) — это был настоящий прорыв в визуализации сетчатки, без которого сегодня в ряде случаев невозможна постановка диагноза, адекватное наблюдение, выбор лечения и оценка его результатов. Главным ограничением этой системы была низкая скорость сканирования, поэтому на качество исследования существенно влияли ограниченное разрешение и большое количество артефактов, связанных с движением глаз и морганием.
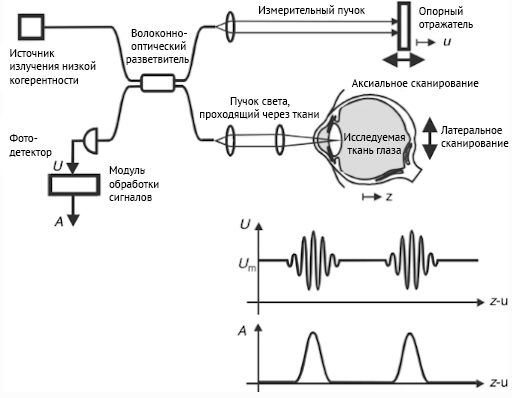
Прорыв произошел с появлением ОКТ-систем, работающих в спектральной области (Spectral-Domain OCT, SD-OCT). Такие ОКТ системы стали коммерчески доступными в 2006 г., и сегодня полностью заменили приборы, работающие во временной области. Скорость сканирования увеличилась с 400 до 120 тыс А-сканов в секунду, а количество артефактов значительно уменьшилось, что многократно улучшило качество изображения. Теперь мы можем визуализировать анатомические структуры наружной сетчатки, которые мы не могли увидеть на временной ОКТ. Поэтому в 2014 г. международной группой специалистов была разработана и согласована новая номенклатура ОКТ, чтобы ретинологи со всего мира понимали друг друга (International Nomenclature for Optical Coherence Tomography Panel, [5]).
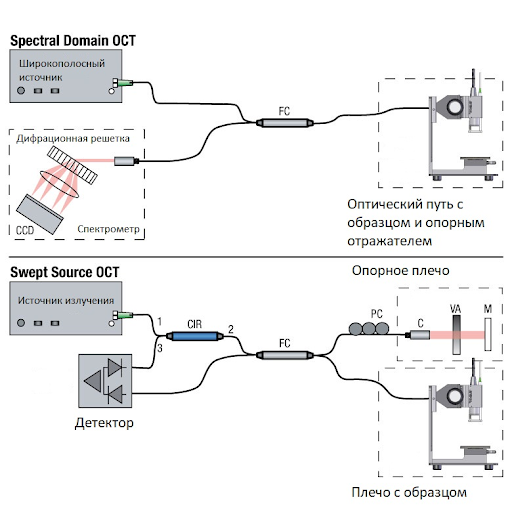
В 2012 г., преодолевая проблему глубины проникновения световых лучей, появилась ОКТ-система, работающая по принципу спектральной ОКТ, но со сложным источником света с переменной длиной волны (перестраиваемый источник света, Swept Source OCT, SS-OCT). Эта технология позволяет одномоментно визуализировать детали витриума, ретинальных структур и сосудистую оболочку до склеры. Следует сказать, что такая детальная визуализация среза на всю глубину возможна на современных ОКТ-приборах и без перестраиваемого источника света. Например, есть алгоритм анализа полученных изображений с улучшением визуализации глубины (Enhanced Depth Imaging, EDI), однако это доступно не на всех приборах; либо можно выполнить исследование в растровом режиме сканирования с высоким разрешением, что доступно на любом современном ОКТ-приборе.
Мультимодальная визуализация и будущее технологии
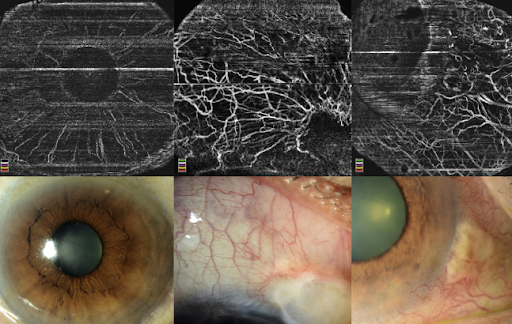
В 2014 г. на основе SD-OCT за счет специальных алгоритмов получения и анализа полученных изображений появилась возможность визуализировать ретинальный кровоток на различных уровнях сетчатки – ОКТ-ангиография.
Последние годы развитие технологии нацелено на продолжение преодоление ограничений по глубине и площади сканирования, усовершенствование визуализации и анализа переднего отрезка в том числе и в ангиорежиме, продолжение усовершенствования программного обеспечения по отсечению артефактов (таких как проекции, движения). По сей день проблема артефактов является существенным ограничением для ОКТ-ангиографии и преодолеть ее по ряду причин непросто (например, на фоне хронических процессов существенно изменяется структура, что приводит к грубым ошибкам сегментации, которая лежит в основе визуализации кровотока на различных уровнях; артефакты движения и затенения приводят к значительному снижению ангио-сигнала и сводят на нет интерпретацию). Так же важное значение имеет продолжение улучшения и разработки новых программ для проведения клинических анализов полученных данных (например, глаукомный анализ, анализ хориоидеи).
Появилась новая концепция оценки ретинальной патологии — мультимодальная визуализация. Она подразумевает под собой необходимость интеграции и анализа нескольких исследований. Например, сопоставление структурной, ангио-ОКТ или ОКТ в анфас-режиме со снимками аутофлюоресценции, фундус-фото, инфракрасными снимками или ангиографией с красителями. Все эти методы визуализации дополняют друг друга и позволяют поставить точный диагноз. ОКТ в рамках мультимодального подхода к визуализации привела к необходимости пересмотра классификаций для целого ряда заболеваний. Например, для возрастной макулярной дегенерации, центральной серозной хориоретинопатии, миопической макулопатии.
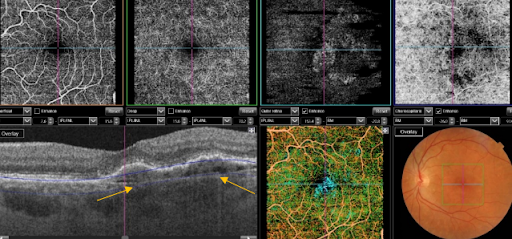
Сможет ли ОКТ-ангиография быть полноценной заменой флюоресцентной ангиографии? Несмотря на значительный прогресс, многие офтальмологи относятся скептически к данной технологии.
Полноценной заменой флюоресцентной ангиографии (ФАГ) ОКТ-ангиография (ОКТА) не станет. ОКТА позволяет визуализировать структуру кровотока, улавливая разницу отраженного сигнала при движении форменных элементов в просвете сосуда, сканирую одну и ту же область несколько раз. Однако ОКТА не позволяет визуализировать саму сосудистую стенку и, тем более, нарушение ее проницаемости.
В тех ситуациях, где необходима оценка именно феномена просачивания, ОКТА не показательна. Например, при васкулитах картина на ОКТА может выглядеть нормальной, при этом на флюоресцентной ангиографии будет наблюдаться экстравазальное просачивание красителя различной степени выраженности и из разных сосудов (венозных или артериальных), что будет иметь значение в дифференциальной диагностике. Другой пример — центральная серозная хориоретинопатия. Несмотря на наличие характерных признаков на структурной ОКТ для активных «точек просачивания» и преимущества ОКТА в визуализации хориоидальной неоваскуляризации, не во всех случаях все столь очевидно, особенно при хронической форме, и флюоресцентная ангиография остается актуальной, хотя используется значительно реже.
Следует сказать, что при ряде заболевания ОКТА на сегодняшний день стала полноценной заменой ФАГ. Например, при возрастной макулярной дегенерации выполнение ФАГ может потребоваться, пожалуй, только в случае сочетания с другой патологией для проведения дифференциальной диагностики, данные структурной ОКТ и ОКТА позволяют точно определиться с формой заболевания и типом макулярной неоваскуляризации; при диабетической и постокклюзионной ретинопатиях в рутинной практике ОКТА позволяет в достаточной мере провести оценку зон ретинальной ишемии (особенно при наличии функции ангиомонтажа) и дифференциальную диагностику неоваскуляризации сетчатки и диска в неоднозначных случаях.
Интраоперационная ОКТ
Традиционно ОКТ использовалась для пред- и послеоперационной диагностики. Теперь стало возможно использование ОКТ-технологии, интегрированной в хирургический микроскоп. ОКТ стала отличным помощником при фемтолазерной хирургии для оценки границ катаракты, определения места разрезов на роговице, исследования глубины передней камеры при факоэмульсификации. Сегодня возможно проведение операций по пересадке роговицы, и интраоперационная ОКТ позволяет добиться прецизионной пересадки ее слоев [15].
Источники
- Huang, D.; Swanson, E.A.; Lin, C.P.; Schuman, J.S.; Stinson, W.G.; Chang, W.; Hee, M.R.; Flotte, T.; Gregory, K.; Puliafito, C.A.; et al. Optical Coherence Tomography. Science 1991, 254, 1178–1181, doi:10.1126/science.1957169.
- Захарова М.А.; Куроедов А.В. Оптическая Когерентная Томография: Технология, Ставшая Реальностью. РМЖ. Клиническая офтальмология. 2015.
- ZEISS OCT Systems: OCT Solutions Designed for the Way You Work Available online: https://www.zeiss.com/meditec/... (accessed on 15 December 2022).
- Keane, P.A.; Patel, P.J.; Liakopoulos, S.; Heussen, F.M.; Sadda, S.R.; Tufail, A. Evaluation of Age-Related Macular Degeneration With Optical Coherence Tomography. Surv. Ophthalmol. 2012, 57, 389–414, doi:10.1016/j.survophthal.2012.01.006.
- Staurenghi, G.; Sadda, S.; Chakravarthy, U.; Spaide, R.F. Proposed Lexicon for Anatomic Landmarks in Normal Posterior Segment Spectral-Domain Optical Coherence Tomography: The IN•OCT Consensus. Ophthalmology 2014, 121, 1572–1578, doi:10.1016/j.ophtha.2014.02.023.
- Макулярная Дегенерация Возрастная: Клинические Рекомендации МЗ РФ, 2021 Available online: https://cr.minzdrav.gov.ru/rec... (accessed on 15 December 2022).
- The Age-Related Eye Disease Study (AREDS). Control. Clin. Trials 1999, 20, 573–600, doi:10.1016/S0197-2456(99)00031-8.
- Spaide, R.F.; Jaffe, G.J.; Sarraf, D.; Freund, K.B.; Sadda, S.R.; Staurenghi, G.; Waheed, N.K.; Chakravarthy, U.; Rosenfeld, P.J.; Holz, F.G.; et al. Consensus Nomenclature for Reporting Neovascular Age-Related Macular Degeneration Data: Consensus on Neovascular Age-Related Macular Degeneration Nomenclature Study Group. Ophthalmology 2020, 127, 616–636, doi:10.1016/j.ophtha.2019.11.004.
- Обновленная номенклатура неоваскулярной формы возрастной макулярной дегенерации Available online: https://eyepress.ru (accessed on 20 December 2022).
- Diabetic Retinopathy: Classification and Clinical Features - UpToDate Available online: https://www.uptodate.com/conte... (accessed on 15 December 2022).
- Fang, Y. OCT-Based Classification of Myopic Maculopathy. In Atlas of Pathologic Myopia; Ohno-Matsui, K., Ed.; Springer: Singapore, 2020; pp. 101–108 ISBN 9789811542619.
- Ruiz-Medrano, J.; Montero, J.A.; Flores-Moreno, I.; Arias, L.; García-Layana, A.; Ruiz-Moreno, J.M. Myopic Maculopathy: Current Status and Proposal for a New Classification and Grading System (ATN). Prog. Retin. Eye Res. 2019, 69, 80–115, doi:10.1016/j.preteyeres.2018.10.005.
- World Glaucoma Association Consensus 10 Available online: https://wga.one/wga/consensus-... (accessed on 13 December 2022).
- Ламброзо Б.; Рисполи М. ОКТ Сетчатки. Метод Анализа и Интерпретации; Апрель: Москва, 2012;
- Ang, M.; Baskaran, M.; Werkmeister, R.M.; Chua, J.; Schmidl, D.; Aranha dos Santos, V.; Garhöfer, G.; Mehta, J.S.; Schmetterer, L. Anterior Segment Optical Coherence Tomography. Prog. Retin. Eye Res. 2018, 66, 132–156, doi:10.1016/j.preteyeres.2018.04.002.
- Основы оптической когерентной томографии - azimp-micro.ru Available online: https://azimp-micro.ru/info/ar... (accessed on 15 December 2022).
- Aumann, S.; Donner, S.; Fischer, J.; Müller, F. Optical Coherence Tomography (OCT): Principle and Technical Realization. In High Resolution Imaging in Microscopy and Ophthalmology: New Frontiers in Biomedical Optics; Bille, J.F., Ed.; Springer International Publishing: Cham, 2019; pp. 59–85 ISBN 978-3-030-16638-0.
- Optical Coherence Tomography in Age-Related Macular Degeneration Available online: https://amdbook.org/content/op... (accessed on 15 December 2022).
