Хемокин нейрегулин 4 способствует разрешению атеросклеротического процесса

Жировая ткань — специализированная соединительная ткань, а также крупный эндокринный орган. Бурая жировая ткань (БЖТ) секретирует факторы, которые модулируют метаболический гомеостаз всего организма и могут воздействовать на отдаленные органы. Открытие того, что нейрегулин 4, секретируемый БЖТ, влияет на прогрессирование атеросклероза, создает новые возможности для лечения этого патологического состояния.
Сердечно-сосудистые заболевания (ССЗ) служат основной причиной смерти во всем мире. Среди них преобладает атеросклероз — воспалительное состояние, вызванное накоплением липидов и воспалением в стенке артерий [1]. Эндотелий формирует самый внутренний слой всех кровеносных сосудов; в физиологических условиях он предотвращает развитие атеросклероза, точно регулируя поглощение липидов и инфильтрацию иммунных клеток в адвентицию сосуда. Несмотря на недавние клинические и фармакологические успехи в разработке гиполипидемических и противовоспалительных препаратов, появления способа лечения этого состояния в ближайшее время ожидать не стоит. Проблемы с поиском лекарств в этой области связаны со сложной этиологией атеросклероза, в которую вовлечено несколько типов клеток и клеточных процессов.
Наличие и степень активности БЖТ, состоящей из адипоцитов, интенсивно осуществляющих термогенез, связаны с меньшей распространенностью кардиометаболических заболеваний [2]. Было показано, что повышенная активность БЖТ у мышей снижает степень гиперлипидемии и защищает от атеросклероза [3], что подтверждается корреляцией между высокой активностью БЖТ и улучшением маркеров субклинического атеросклероза у людей [4]. Помимо роли в модуляции расхода энергии, БЖТ секретирует множество цитокинов, называемых батокинами (от англ. BAT cytokines — цитокины бурой жировой ткани, — прим. перев.), которые опосредуют взаимодействие между разными органами посредством эндокринной регуляции [5]. Однако молекулярные механизмы, с помощью которых батокины влияют на функцию сосудов и развитие сердечно-сосудистых заболеваний, изучены недостаточно.
В недавнем выпуске Nature Metabolism Ши с соавт. сообщают о ранее неизвестной антиатеросклеротической роли батокина нейрегулина 4 (NRG4) [6], члена семейства внеклеточных лигандов эпидермального фактора роста (ЭФР) [7]. В жировой ткани у тучных грызунов и людей экспрессия NRG4 подавляется [6, 7]. Ши с соавт. показывают, что по сравнению со здоровыми участниками контрольной группы у мышей с атеросклерозом и гиперлипидемией, которых кормили пищей, соответствующей «западной диете», наблюдались более низкие концентрации циркулирующего NRG4 (рис. 1). Есть также обратная корреляция между уровнем циркулирующего NRG4 и протеканием субклинического атеросклероза у взрослых с ожирением [8]. Это указывает на то, что циркулирующий NRG4 связан либо с патогенезом, либо с разрешением процесса атеросклероза [6].
Ши с соавт. демонстрируют, что более низкие значения NRG4 в плазме коррелируют с процессами выраженного воспаления у мышей с атеросклерозом и ожирением. Кроме того, отсутствие NRG4 у мышей усиливает нарушение функции эндотелиальных клеток и апоптоз, а также усугубляет воспаление (рис. 1). Более того, у мышей с дефицитом NRG4 чаще, чем у мышей дикого типа, наблюдалась метаболическая дисфункция, особенно после питания пищей, аналогичной западной диете. Эти наблюдения были воспроизведены на дополнительной модели на мышах с гиперлипидемией и с дефицитом NRG4 [6] (Apoe–/– Nrg4–/–) (рис. 1).
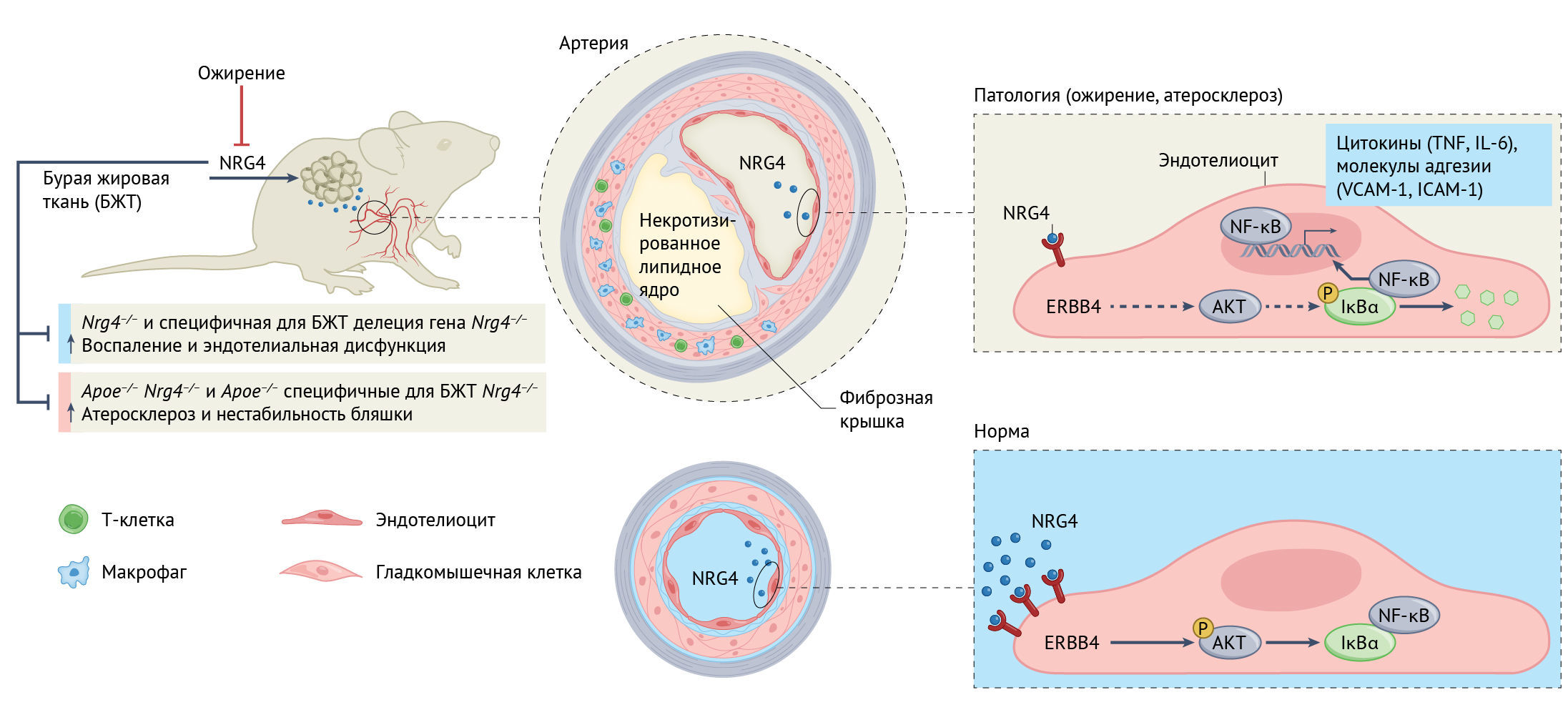
Хотя NRG4 преимущественно экспрессируется в БЖТ, его экспрессия наблюдается и в некоторых других тканях, характеризующихся высоким метаболизмом, таких как скелетные мышцы, печень, мозг, сердце и почки [7]. Интересно, что BAT-специфическая делеция Nrg4 значительно снижает уровень циркулирующего NRG4. Более того, специфическая для БЖТ делеция гена Nrg4 выражается в ускоренной эндотелиальной дисфункции и развитии атеросклероза, наблюдаемых у мышей с полным нокаутом гена Nrg4 (рис. 1). Напротив, гиперэкспрессия гена Nrg4 (в составе аденовирусного вектора) в БЖТ как у мышей с дефицитом NRG4, так и у мышей с дефицитом NRG4 и с гиперлипидемией приводила к ослаблению эндотелиальной дисфункции, уменьшала выраженность воспаления и увеличивала расход энергии. Повторное введение NRG4 тормозило развитие атеросклероза и уменьшило нестабильность атеросклеротических бляшек в обеих моделях. Атеропротекция была продемонстрирована после трансплантации БЖТ от мышей дикого типа мышам с гиперлипидемией и дефицитом NRG4. Повышенная экспрессия Nrg4 у мышей с гиперлипидемией и дефицитом NRG4 ингибировала хоминг лейкоцитов в аорту и развитие воспаления. Таким образом, введения NRG4 оказалось достаточно для ослабления атеросклеротических проявлений (рис. 1).
Пытаясь раскрыть молекулярные основы противовоспалительного и антиатеросклеротического действия NRG4, Ши с соавт. показали, что адипоциты ослабляют эндотелиальную дисфункцию, вызванную окисленными ЛПНП (оксЛПНП) контактно-независимым способом в условиях in vitro. Стойкие эффекты наблюдались после введения рекомбинантного NRG4 в эндотелиальные клетки. Кроме того, воздействие NRG4 на культивируемые макрофаги приводило к ингибированию воспаления, вызванного оксЛПНП. Это согласуется с ранее полученными данными, демонстрирующими, что экзогенный NRG4 способствует альтернативной активации макрофагов и сдерживает активацию провоспалительных сигнальных путей посредством связывания с тирозинкиназным рецептором ErbB4 [9]. Авторы четко продемонстрировали, что на уровне молекулярного взаимодействия антиатеросклеротический эффект NRG4 является нижележащим по отношению к сигнальному пути ERBB4–AKT (протеинкиназа В)–NF-kB в эндотелии. Авторы фактически показали, что NRG4 репрессирует транскрипционную активность NF-kB за счет предшествующей активации AKT [6] (рис. 1). Следовательно, оказывается, что сигнальный путь, опосредованный NRG4, противодействует развитию ключевых воспалительных механизмов при атеросклерозе. Хотя ожирение и воспаление жировой ткани связаны со снижением экспрессии NRG4 [6, 7], молекулярный механизм, который регулирует экспрессию и секрецию NRG4, требует дальнейшего изучения. Таким образом, было бы особенно важно продолжить изучение этих путей в БЖТ, чтобы в полной мере использовать потенциал этой работы для практического применения.
В совокупности эти результаты демонстрируют важную функцию вырабатываемого в БЖТ NRG4 в поддержании сосудистого гомеостаза посредством межклеточной коммуникации. Поскольку в биологии жировой ткани сеть сосудов служит важной детерминантой микроокружения [10], было бы интересно исследовать, модулирует ли NRG4 биологию эндотелиальных клеток в различных сосудах в условиях нормы и при патологии, и каким образом это происходит. Уже известна связь NRG4 с регуляцией нейроваскулярного ремоделирования в жировой ткани [11]. NRG4 способствует разветвлению симпатических аксонов и появлению проангиогенной сигнатуры в адипоцитах, усиливая приобретение жировой тканью свойств БЖТ [11]. В соответствии с этим, у животных с дефицитом NRG4 наблюдается нарушение термогенеза, запускаемого низкими температурами [12]. Таким образом, дальнейшее исследование опосредованных NRG4 ангиокринных путей, которые модулируют сосудистый рельеф, а также соответствующих метаболических последствий принесло бы немалую пользу.
Помимо недавно описанной опосредованной NRG4 сигнальной оси между БЖТ и артериями накапливаются данные, чтох NRG4 также способствует коммуникации между адипоцитами и гепатоцитами [7, 13, 14]. Гиперэкспрессия NRG4 путем ослабления печеночного липогенеза способствует защите организма мышей от алиментарного ожирения, резистентности к инсулину и неалкогольной жировой болезни печени [7, 13]. Также NRG4 препятствует прогрессированию стеатоза печени в неалкогольный стеатогепатит и гепатоцеллюлярную карциному у мышей, модулируя цитопротекторные пути гепатоцитов и иммунное микроокружение печени [14, 15]. Дальнейшие исследования должны помочь разобраться в благотворном влиянии NRG4 на отдельные метаболически значимые ткани и их специфической роли в модуляции метаболизма всего организма. В свете этих новых и захватывающих представлений о роли NRG4 как защитного соединения против атеросклероза [6] и до начала использования NRG4 в качестве терапевтической мишени для остановки развития заболевания необходимо дополнительно описать все регуляторы сигнальных путей с участием NRG4 — как выше-, так и нижестоящие.
