CAR-T-клетки как краеугольный камень в терапии рака простаты
Aрмированные CAR-T-клетки демонстрируют ранние признаки клинической активности у пациентов с кастрационно-резистентным раком, что открывает путь для дальнейшей разработки и оптимизации.
Прогрессии злокачественных опухолей часто способствуют генетические аберрации, такие как мутации, амплификации генов и их несогласованная экспрессия. Это может приводить к синтезу новых пептидов (известных как опухолеспецифичные антигены или неоантигены), которые полностью отсутствуют в нормальных (неопухолевых) тканях человека, или к более высоким уровням экспрессии тех пептидов, которые в других тканях экспрессируются слабее, — последние также известны как антигены, ассоциированные с опухолью.
Иммунологи, специализирующиеся на опухолях, достигли огромного успеха, научившись воздействовать на антигены, ассоциированные с опухолями крови, с помощью Т-клеток с химерными рецепторами антигена (CAR — chimeric antigen receptor), которые представляют собой аутологичные (собственные) Т-клетки, нацеленные с помощью генной инженерии на специфический антиген. К сожалению, в случае солидных опухолей у этого подхода нет сравнимой клинической эффективности. В свежем номере Nature Medicine Narayan с соавт. приводят результаты фазы I первого клинического испытания CAR-T-клеток, направленных против кастрационно-резистентного рака предстательной железы (или, если говорить точнее, — против мембранного антигена, специфичного для простаты [PSMA]), на людях. Эти клетки также снабжены доминантно-негативным рецептором иммуносупрессорного цитокина TGF-β для предотвращения локализованной иммуносупрессии [1].
В исследовании участвовали 18 пациентов с метастазирующим кастрационно-резистентным раком предстательной железы, 13 из которых получали терапию в четырех дозах. Примечательно, что у пяти пациентов из этих 13 развился синдром высвобождения цитокинов (СВЦ) второй степени и выше, в то время как у четырех произошло снижение на ≥ 30 % простатспецифического антигена (ПСА). Один пациент, у которого развилась значительная экспансия клональных CAR-Т-клеток, а также снижение уровня ПСА > 98 %, впоследствии умер от энтерококкового сепсиса через 30 дней после инфузии в условиях мультимодальной иммуносупрессии и, как следствие, полиорганной дисфункции. В целом, у этого исследования есть несколько примечательных итогов. Во-первых, по крайней мере у одного пациента наблюдалась значительная эффективность терапии, и у трех других пациентов с метастатическим кастрационно-резистентным раком простаты, для которого, как считается, характерно «холодное» микроокружение опухоли, обнаружена дополнительная активность. Во-вторых, есть данные, что «армирование» CAR-T-клеток TGF-β ослабляет TGF-β-сигналинг в опухолях. Наконец, исследование улучшает понимание профиля безопасности таких армированных, направленных на PSMA CAR-лимфоцитов.
Результаты исследования Narayan с соавт. [1] отражают полученные ранее (еще не подвергшиеся рецензии) результаты исследования P-PSMA-101 — другого CAR, нацеленного на PSMA [2]. В этом текущем испытании с участием девяти пациентов у троих уровень снижения ПСА был > 50 %, и наблюдалось соответствующее улучшение PSMA при оценке с помощью позитронно-эмиссионной томографии; у трех пациентов был СВЦ 1–2 степени и у одного — полное исчезновение детектируемого заболевания на протяжении более пяти месяцев. Важно отметить, что у одного пациента в этом исследовании развился СВЦ пятой степени, связанный с печеночной недостаточностью, и синдром активации макрофагов, который, как было установлено, потенциально связан с P-PSMA-101 CAR.
Хотя оба этих исследования позволяют предположить, что адоптивные стратегии использования Т-клеток при раке простаты, направленные на PSMA, могут показывать значительную клиническую эффективность у некоторых пациентов, стоит отметить ряд важных различий между исследованиями. Во-первых, в работе Нарайана с соавт. только 6 из 13 пациентов подвергались лимфодеплеции [1], в то время как в испытании P-PSMA-101 все девять пациентов получали лимфодеплетную терапию [2]. Хотя в ряде исследований сравнивались различные режимы лимфодеплеции, хорошо известно, что лимфодеплеция усиливает распространение, сохранение и хоминг вводимых терапевтически Т-клеток и таким образом усиливает эффективность лечения [3, 4]. Так или иначе, лимфодеплеция связана с рядом токсических эффектов, включая цитопению и — в некоторых случаях применения CAR-T-клеточной терапии — более тяжелый СВЦ. Усиленная лимфодеплеция создает риски повышения гематологической и системной токсичности, особенно для пациентов с солидными опухолями, такими как рак предстательной железы, которые уже получали противоопухолевую терапию нескольких линий, а также пожилых пациентов с сопутствующими заболеваниями [5].
Другим источником различий между этими двумя исследованиями служит применение подхода «армирования» вместо обогащения. Исследование Нарайяна с соавт. включало армирование TGF-β при заболевании, для которого хорошо известно наличие иммуносупрессорного микроокружения, нагруженного TGF-β [1]. Учитывая важную роль TGF-β в распространении иммуносупрессорного микроокружения опухоли и в содействии опухолевой пролиферации, ангиогенезу и метастазированию, включение доминантно-негативной ловушки TGF-β может поддержать этот подход, о чем свидетельствует нарушение сигнального пути TGF-β и усиленная пролиферация продукта CAR [1, 6] (рис. 1). Напротив, продукт P-PSMA-101 был обогащен стволовыми Т-клетками памяти [2], которые, как было показано в исследованиях CAR-T-клеток, нацеленных на рецептор передачи сигнала CD19, повышают персистенцию Т-клеток и снижают их истощение [7]. Вопрос, приведет ли такой оптимизированный подход к более длительному существованию адоптивных клеток и улучшению надзора за опухолями, остается открытым. Однако сообщения об отсутствии детектируемого заболевания на протяжении более пяти месяцев подтверждают эту гипотезу [2].
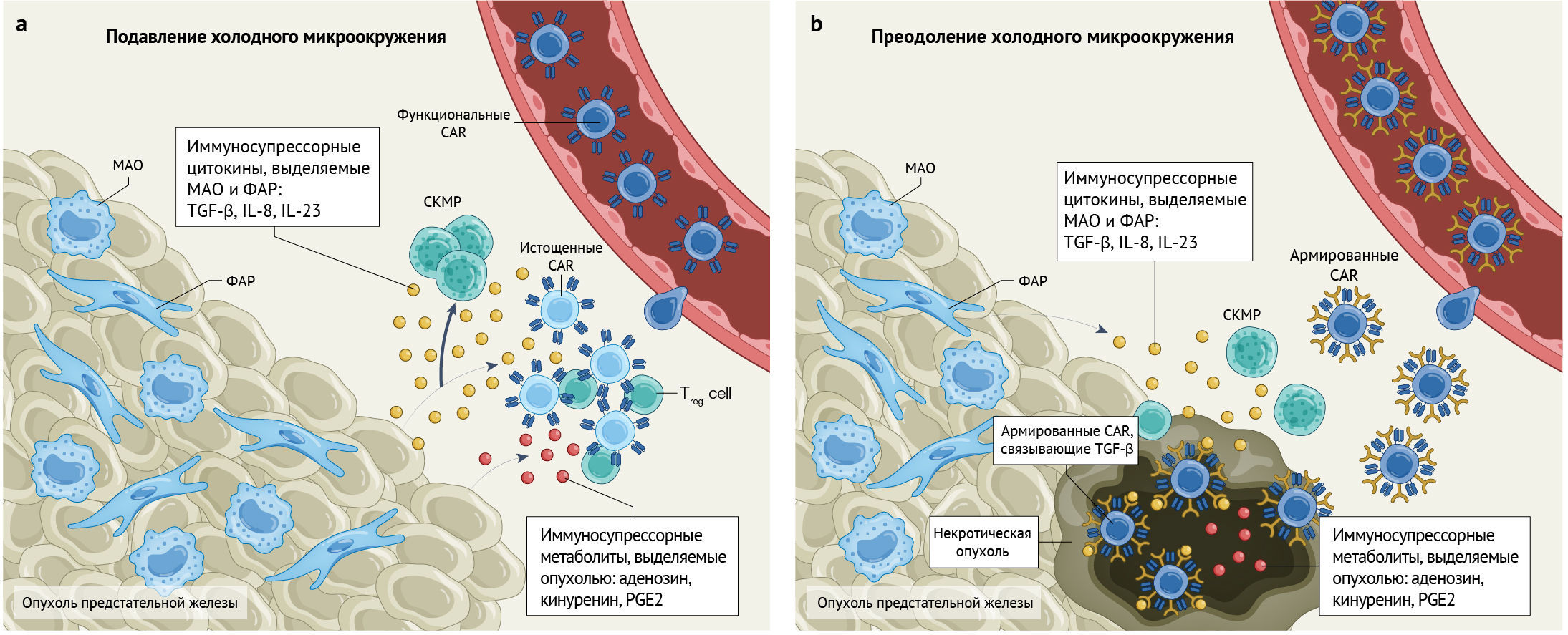
b. Нацеленные на PSMA CAR-T-клетки, армированные доминантно-негативным рецептором TGF-β, после переноса в опухоль предстательной железы способны действовать как поглотители TGF-β, таким образом снижая влияние одного ключевого иммуносупрессорного элемента в локальном окружении и способствуя опосредованному CAR лизису опухоли.
В исследовании Нарайяна с соавт., описанном здесь [1], и текущем исследовании P-PSMA-101 [2] также использовались разные дозы клеток. В работе Нарайяна о средних дозах не сообщалось, и приводится только общий диапазон [1], однако пациенты получали дозу, сопоставимую с той дозой CAR-T-клеточных препаратов, которая одобрена Управлением по надзору за качеством пищевых продуктов и медикаментов США для лечения рецидивирующих и рефрактерных диффузных крупноклеточных B-лимфом; она более чем в восемь раз превышает дозу клеток в исследовании P-PSMA-101 [2, 8, 9]. Важно отметить, что в исследовании Нарайяна с соавт. отмечаются дозозависимое увеличение экспансии CAR-T-клеток в периферической крови и экспрессии воспалительных цитокинов, клинический СВУ и пониженный ПСА [1], что может служить ориентиром для будущего дозирования. Поскольку клеточная терапия постоянно усложняется, необходимо решить такие вопросы, как количество вводимых клеток, расчет дозы (например, в соответствии с площадью поверхности тела, весом числом жизнеспособных Т-клеток и т. д.) и потребуются ли последовательные инфузии для устранения больших опухолевых масс. Это будет особенно актуально в свете поиска исследователями способов оптимизировать шарнирные регионы CAR, линкеры или костимулирующие домены и применения «встроенной» цитокиновой поддержки, такой как Т-клетки, перенаправленные на уничтожение, не ограниченное антигенами (известное как TRUCK — T-cells redirected for antigen-unrestricted cytokine-initiated killing) и сопоставления их с рисками СВЦ и нейротоксичного синдрома, ассоциированного с иммунными клетками [10].
Хотя результаты исследования Нарайяна с соавт. [1] (и предварительные данные P-PSMA-101) обнадеживают, следует отметить, что PSMA также экспрессируется в нормальных тканях простаты, периферической и центральной нервной системе, тонком кишечнике и слюнных железах [11]. Несмотря на то, что широкое распространение PSMA в здоровых тканях может вносить вклад в СВЦ, о фокальной токсичности, связанной с возможными повреждениями вне опухоли, в вышеуказанных исследованиях не сообщалось [1, 2]. Однако по мере продвижения клинических исследований этих продуктов вопрос остается открытым.
Помимо PSMA в качестве потенциальных мишеней адоптивных Т-клеточных препаратов для пациентов с раком предстательной железы также рассматривается ряд других ассоциированных с опухолью антигенов. В настоящее время в двух испытаниях оцениваются клеточные препараты, нацеленные на антиген стволовых клеток простаты (NCT03873805 и NCT02744287). Хотя этот антиген является привлекательной мишенью, экспрессируясь в 94 % первичных опухолей предстательной железы и более чем в 87 % метастазов рака простаты, ученые не должны забывать, что он также присутствует в нормальных тканях мочевого пузыря, почек, кожи, пищевода, мозга и желудка [5], а это факт, который будет влиять на подходы в терапии.
У пациентов с раком простаты подходы с применением ингибиторов чекпоинтов, которые используются в терапии других злокачественных опухолей, оказались неэффективны. Хотя первая иммунотерапия рака простаты, сипулейцел-Т, была новаторским подходом, в котором применялась аутологичная вакцина против белка антигена предстательной железы, у большого числа получавших лечение пациентов не наблюдалось снижение уровня ПСА или рентгенологический ответ [12]. Результаты первого испытания CAR-T-клеточной терапии на людях, которое провели Нарайян с соавт., многообещающий; однако они подчеркивают множество трудностей в деле преодоления иммуносупрессии при раке простаты. По мере развития этих терапевтических подходов потребуется более глубокое понимание биологических причин редких ответов, которые наблюдались в обсуждаемых здесь исследованиях [1, 2], а также иммунобиологии тех пациентов, которые остаются рефрактерными к этим методам лечения.
