Опубликованы первые данные по инактивированной вакцине против COVID-19 «КовиВак»
Вступление
Продолжающаяся в настоящее время пандемия новой коронавирусной инфекции 2019 года (COVID-19), вызванная коронавирусом 2 тяжелого острого респираторного синдрома SARS-CoV-2, унесла более 4 миллионов жизней (по данным на март 2021 года [1, 2]), и необходимость быстрого внедрения безопасных и эффективных вакцин против данного вируса остается очень высокой. Беспрецедентное в новейшей истории повсеместное распространение пандемии требует применения всех существующих вакцинных платформ, чтобы в конечном счете обеспечить доступность вакцин против SARS-CoV-2 для жителей каждой страны мира.
SARS-CoV-2 относится к подроду Sarbecovirus рода Betacoronavirus и семейству Coronaviridae [3]; в качестве основного рецептора для проникновения в клетки человека вирус использует ангиотензинпревращающий фермент 2 (АПФ2) [4, 5]. Диаметр заключенного в оболочку вириона SARS-CoV-2 составляет 100–150 нм; сам вирион имеет сферическую форму. В нем содержится несколько структурных белков: шипиковый гликопротеин (S), мембранный белок (M), белок оболочки (E), расположенный на поверхности, и белок нуклеокапсида (N), который связан с РНК внутри вирусной частицы. S-белок представляет собой трансмембранный белок слияния I типа, который во время синтеза подвергается значительному гликозилированию; протеаза хозяина расщепляет его на два фрагмента — S1 и S2. Фрагмент S1 содержит рецептор-связывающий домен (РСД), который взаимодействует с рецептором клетки хозяина (т.е. АПФ2). Фрагмент S2 необходим для слияния мембран после еще одного расщепления протеазами клетки хозяина и дальнейших структурных перестроек [6]. Благодаря этим свойствам шипиковый белок и его РСД являются основными мишенями для нейтрализующих антител организма хозяина (НАт) в процессе развития иммунного ответа [7].
Иммунный ответ на инфекцию SARS-CoV-2 активно изучается с целью разработки и улучшения как диагностики заболевания, так и создания и совершенствования вакцин. Как было выявлено в ходе экспериментов, титры НАт являются одними из основных маркеров защиты от SARS-CoV-2, поскольку адоптивный перенос очищенных IgG, которые были получены от выздоравливающих макак-резусов, дозозависимо способствовал формированию иммунной защиты от заражения SARS-CoV-2 у наивных макак-реципиентов [8]. Легкая или средняя степень тяжести течения COVID-19 приводит к выработке НАт, концентрация которых коррелирует с титрами IgG к РСД, определенными методом ELISA; данные титры НАт сохраняются примерно от двух-трех [9, 10] до пяти месяцев [11]. Учитывая возможность снижения концентраций антител после заражения, пристально исследуется более трудный для изучения клеточный компонент иммунитета.
Для разработки вакцин против COVID-19 тестируются многочисленные методы. В настоящее время наиболее часто применяются инактивированные вирусные векторные вакцины, вакцины на основе нуклеиновых кислот (РНК, ДНК) и белковые (субъединичные, вирусоподобные (ВПВ)) вакцины [12]. В качестве основных антигенов, вызывающих синтез НАт, в большинстве вакцин используются S-белок и РСД. Различные передовые технологии разработки вакцин уже продемонстрировали свой потенциал в плане предотвращения развития COVID-19, и несколько таких препаратов, таких как вакцины на основе мРНК и аденовирусные векторные вакцины, после успешного завершения клинических испытаний были одобрены для использования по всему миру [13, 14]. Тем не менее, разработка инактивированных вакцин как более традиционный метод является надежным и экономичным способом, имеющим долгую и успешную историю применения [15, 16]. В Центре Чумакова на культуре клеток Vero были успешно разработаны две инактивированные вакцины против клещевого энцефалита и полиомиелита [22, 23]. Таким образом, вакцина против COVID-19 создавалась на основе ранее отработанной платформы для культивирования клеток с использованием уже отлаженных методов.
Во всем мире разрабатывается несколько инактивированных вакцин против инфекции SARS-CoV-2, и по крайней мере пять из них успешно прошли доклинические и клинические испытания, и их применение было одобрено [17–20]. Тем не менее, несмотря на множество высококачественных публикаций о клинических испытаниях различных вакцин, подробных сведений об общей токсичности, репродуктивной токсичности, профилактической эффективности, иммуногенности и устойчивости иммунного ответа на животных моделях крайне мало.
В данной работе авторы провели оценку безопасности, иммуногенности и устойчивости иммунного ответа на вакцину «КовиВак», созданную на основе цельного вириона, инактивированного β-пропиолактоном, у грызунов и нечеловеческих приматов. У исследованных видов животных не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности, тератогенного действия, а также аллергенных свойств. Вакцина привела к формированию стабильного и сильного гуморального иммунного ответа как в виде специфических IgG к SARS-CoV-2, так и НАт у мышей линии BALB/c, сирийских хомячков и обыкновенных игрунок. В течение года титры НАт существенно не снизились. Профилактическая эффективность вакцины изучалась на сирийских хомячках. Надежность производственного процесса была продемонстрирована путем оценки четырех партий вакцины и сравнения их иммуногенных свойств на мышах.
Результаты
Производство и описание вакцины
Ранее был представлен процесс выделения и генетического описания вакцинного штамма AYDAR-1 [21]. Вирус удалось профильтровать на третьем пассаже и дополнительно очистить путем разбавления. Были созданы первичные, основные и рабочие посевные серии штамма (а именно пассажи под номерами 7, 8 и 9), которые были охарактеризованы в соответствии с национальными руководствами по производству вакцин.
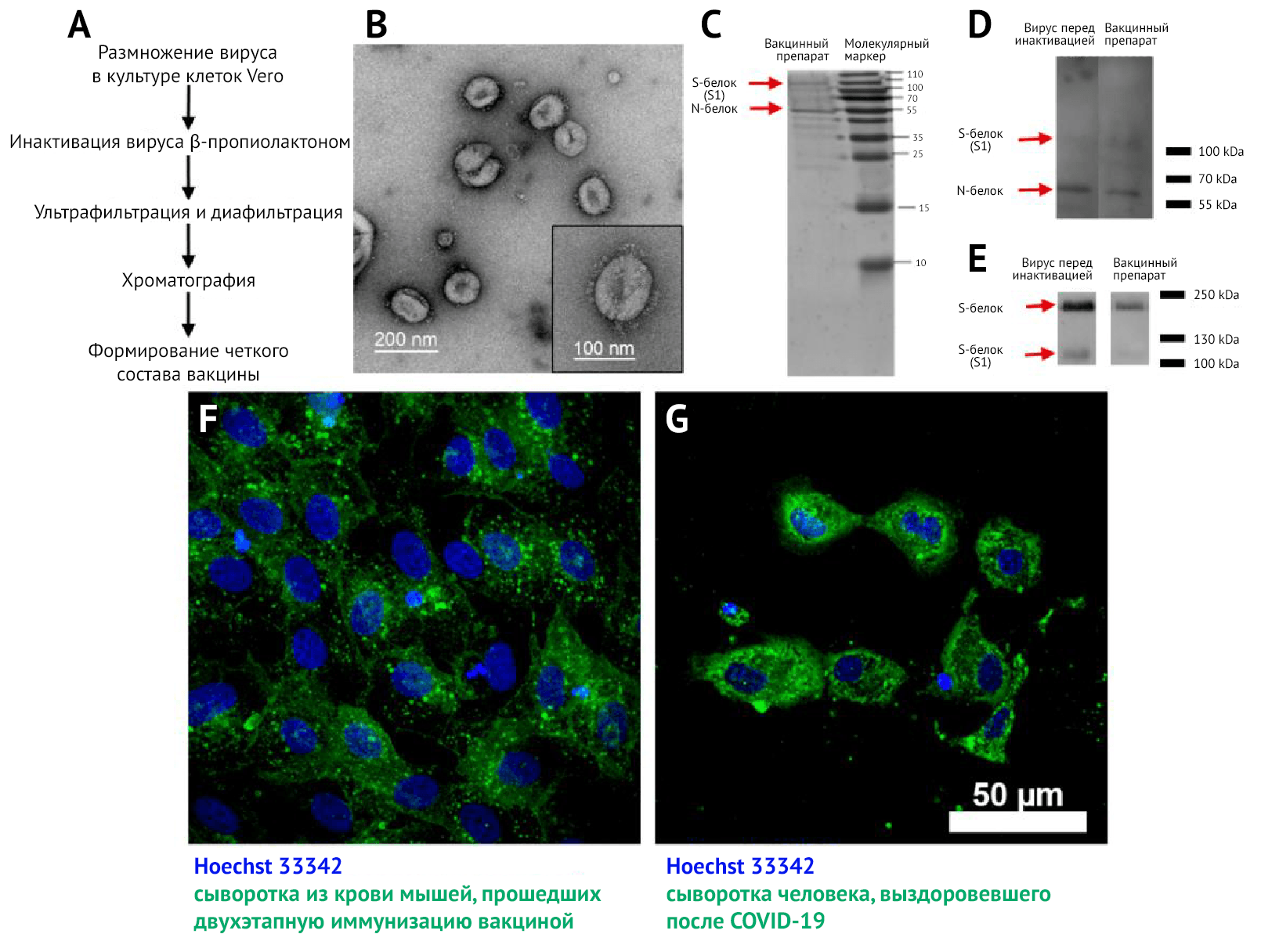
B — Трансмиссионная электронная микроскопия (ТЭМ) с негативным контрастированием концентрата инактивированной вакцины после хроматографической очистки; выделенная частица (внизу справа);
C — Электрофорез (SDS-PAGE) вакцинного препарата (очищенный инактивированный вирусный препарат после хроматографии), окрашенный кумасси синим;
D — Вестерн-блоттинг вирусного препарата перед инактивацией и вакцинный препарат (очищенный инактивированный вирусный препарат после хроматографии), окрашенный сывороткой человека-реконвалесцента после COVID-19;
E — Вестерн-блоттинг препарата вируса перед инактивацией и приготовлением вакцины (очищенный препарат инактивированного вируса после хроматографии), окрашенный анти-S-белковой сывороткой кролика;
F — культура клеток Vero, инфицированных SARS-CoV-2 и окрашенных сывороткой мыши, иммунизированной вакциной «КовиВак» (зеленое окрашивание на микрофотографии) и Hoechst 33342 (синее окрашивание на микрофотографии);
G — клетки Vero, инфицированные SARS-CoV-2 и окрашенные сывороткой человека-реконвалесцента после COVID-19 (зеленое окрашивание) и Hoechst 33342 (синее окрашивание).
Благодаря трансмиссионной электронной микроскопии (ТЭМ) (рис. 1B) с негативным контрастированием концентратов были обнаружены плеоморфные сферические вирусные частицы диаметром около 120 нм, покрытые шиповидными структурами длиной 16–20 нм.
Методом ТЭМ (рис. 1B) были подтверждены гомогенность и чистота вакцинного препарата и выявлены вирионы с шипиковыми белками, соотносящиеся по форме и размеру с таковыми, выявляемыми в других исследованиях [26, 27].
В ходе электрофореза SDS-PAGE и вестерн-блоттинга (ВБ) концентратов вакцин перед инактивацией и после хроматографии, окрашенных сыворотками реконвалесцентов после COVID-19 (рис. 1 C и D), были выявлены два основных белка в концентратах: N и S, которые должны содержаться и в препарате вириона. С помощью окрашивания сывороткой анти-S-белка (рис. 1E) были обнаружены две формы S-белка в вирусных препаратах до и после инактивации: S1 и полноразмерный S-белок. Это свидетельствует о том, что в вакцинном препарате присутствует антиген-мишень для индукции синтеза НАт.
Специфичность реактивности антител подтверждается отсутствием свечения (флуоресценции) в неинфицированных клетках культуры Vero.
Изучение эмбрио-, фетотоксичности и тератогенных эффектов в антенатальном и постнатальном периодах развития
Беременные крысы линии Wistar (N = 60) были случайным образом распределены в три группы и иммунизированы внутримышечно на 2, 9 и 16 дни беременности. Крысам из первой исследуемой группы вводили одну дозу вакцины (6 мкг/доза; 0,5 мл), из второй — двойную дозу (12 мкг/доза; 1,0 мл), а из третьей контрольной группы — двойную дозу плацебо (1,0 мл). Ежедневно проводилось измерение массы тела и общего физического состояния животных; на поздних сроках беременности с помощью теста «открытое поле» оценивалась исследовательская активность и состояние самок. Прибавка в весе у самок проходила нормально; летальных исходов или признаков интоксикации не наблюдалось. Ни в одной из исследуемых групп не было признаков преждевременных или трудных родов. В тесте «открытое поле» на 18-е сутки беременности все самки крыс продемонстрировали преимущественно сбалансированный тип поведения с умеренной двигательной и поисковой активностью без признаков беспокойства.
Половину (N = 10 из каждой группы) животных в каждой группе умерщвляли на 20-й день беременности. Статистически значимых различий между исследуемыми группами по количеству желтых тел в яичниках, местах имплантации в матке, живым и мертвым плодам не было. Плоды сформировались нормально, топография всех исследованных органов была в пределах анатомической нормы, гистологическое строение соответствовало возрасту эмбрионов, развитие костей было нормальным. Патологических изменений органов и тканей обнаружено не было.
Другая половина (N = 10 из каждой группы) животных в каждой из трех групп вакцинированных была использована для выявления возможных нарушений эмбрионального развития, проявляющихся в постнатальном периоде. За потомством наблюдали в течение 60 дней после рождения. Проводилась оценка общего состояния потомства крыс, выживаемость, прибавка в весе, физическое развитие, сформированность сенсомоторных рефлексов, эмоционально-произвольного поведения и способности точно координировать движения. Соотношение самцов и самок в потомстве во всех группах было практически одинаковым (примерно 1: 1). Во всех исследуемых группах за весь период наблюдения (от рождения до двухмесячного возраста) смертность детенышей не превышала 4 % и достоверно не различалась между группами. В группах не было различий в физическом и неврологическом развитии детенышей крыс, а индивидуально обусловленные значения исследуемых показателей находились в пределах физиологической нормы.
Таким образом, вакцина «КовиВак» не оказала отрицательного влияния на общее состояние беременных крыс. Эмбриотоксических, фетотоксических или тератогенных эффектов обнаружено не было. Вакцинация не привела к увеличению смертности потомства и не повлияла на физическое и психологическое развитие детенышей крыс.
Обсуждение результатов
Безопасность
Существует множество тестов для оценки различных параметров безопасности разрабатываемых вакцин на животных моделях. Авторы выбрали классические модельные объекты для исследования безопасности (мыши, морские свинки, крысы и приматы). Для вакцины «КовиВак» проводилась оценка общей острой токсичности у трех видов (мышей, морских свинок и игрунок), хронической токсичности у двух видов (мышей и морских свинок) и гиперчувствительности у морских свинок. По сравнению с группой плацебо никаких изменений выявлено не было. Все показатели были в пределах физиологической нормы.
Существовали предположения о возможной репродуктивной токсичности вакцинных препаратов, содержащих S-белок SARS-CoV-2. Исходя из данных экспериментов авторов на крысах линии Wistar, был сделан вывод о том, что многократная иммунизация вакциной «КовиВак» до или во время беременности не оказывает отрицательного эффекта на внутриутробное или постнатальное развитие потомства.
Таким образом, вакцина «КовиВак» безопасна и может быть использована в клинических испытаниях на людях.
Иммунитет и его стойкость
Краткосрочная иммуногенность вакцины «КовиВак» была оценена на трех животных моделях (двух генетических линиях мышей, сирийских хомячках и обыкновенных игрунках), иммунизированных разными дозами. Вакцина индуцировала синтез НАт у всех изученных видов. Более того, у мышей были обнаружены антитела к двум основным структурным белкам вируса (S и N). В течение первых 2–4 недель не наблюдалось значительных различий между титрами НАт, синтез которых был вызван различными дозами антигена. Различия проявились начиная с пятой недели после первой иммунизации.
Как было отмечено выше, синтез НАт является одним из основных маркеров защиты от SARS-CoV-2 [8]. Следовательно, длительность антительного ответа (НАт) коррелирует с длительностью защиты. После естественного заражения, особенно в случае легкого течения инфекции, ответ в виде НАт довольно слабый и непродолжительный [11].
Сведений об устойчивости иммунитета, вызванного вакциной, очень мало. Хотя в опубликованных доклинических исследованиях показана индукция титров IgG и НАт к SARS-CoV-2 IgG вследствие введения различных вакцин, лишь в немногих работах содержатся данные о продолжительности иммунного ответа. Например, для препарата PiCoVacc (инактивированная вакцина), опубликованы результаты доклинических испытаний, согласно которым титр антител после вакцинации мышей и крыс сохраняется в течение шести недель, а у макак-резусов — до трех недель [25]. В работе, опубликованной Wang с соавт., анализ иммуногенности у животных был ограничен четырьмя неделями [27].
В случае вакцины-кандидата BBV152 измерение иммуногенности при трехдозовом режиме введения проводилось до 25-го дня [29]. Авторы провели оценку долгосрочной иммуногенности у мышей и игрунок в течение одного года. За этот период значительного снижения титров НАт обнаружено не было. Более низкие дозы вводимого антигена приводили к формированию более низкого титра НАт в течение длительного периода наблюдения. Хотя очевидно, что окончательные сведения о длительности иммунитета, обеспечиваемого вакцинами против COVID-19, будут получены в ходе длительных клинических исследований, в данной ситуации животные модели могут служить в качестве удобных суррогатных индикаторов на ранних этапах процесса разработки вакцины. В недавней работе, посвященной клиническому исследованию вакцины на основе мРНК компании Moderna, сообщается о существовании повышенного титра специфических антител в течение как минимум трех месяцев [30]. Согласно экспериментальным данным авторов статьи, вакцина «КовиВак» обеспечивала формирование стабильного длительного иммунитета у мышей и игрунок после двухкомпонентного режима введения препарата.
Профилактическая эффективность
В большинстве недавних исследований в качестве удобной и достоверно нелетальной животной модели профилактической эффективности вакцин против COVID-19 используется золотистый (сирийский) хомячок. У сирийских хомячков инфекция SARS-CoV-2 вызывает значительные патологические изменения в легких и, таким образом, поддерживает развитие стабильного постинфекционного гуморального иммунного ответа в экспериментах с пассивным переносом [35]. Более того, наблюдаемые иммуногистохимические изменения и характер потери массы тела у хомячков сходны с легкой формой инфекции SARS-CoV-2 у человека [36]. В ряде работ продемонстрирована пригодность сирийского хомячка в качестве модели для изучения профилактической эффективности НАт и вакцин против SARS-CoV-2 [37–46], хотя симптомы пневмонии у животного развиваются быстро и протекают тяжело.
Сирийский хомячок в качестве модельного объекта был использован для оценки профилактической эффективности нескольких инактивированных вакцин [47–48], в том числе одобренных для клинического применения [29]. К основным параметрам оценки относят вес животного и присутствие вируса и/или вирусной РНК в мазках из носа, легких и других органов в разные сроки после инфицирования.
В исследовании авторов животные из группы контроля теряли вес до пятого — седьмого дня с момента заражения, тогда как вакцинированные набирали вес с начиная с третьего дня после заражения, что соотносится с данными о BBV152 [29]. Однако потеря веса у контрольных животных в экспериментах авторов была более выраженной — 15 % против 2–10 % в исследовании BBV152. Скорость выведения вирусной РНК из верхних дыхательных путей также была сходной: начиная с седьмого дня после инфицирования в большинстве мазков из носа вирусная РНК не содержалась. Уровень вирусной РНК в легких контрольных животных был одинаковым в обоих исследованиях; по данным авторов, в органах всех контрольных животных содержалась вирусная РНК на четвертые, седьмые и 14-е сутки. Ткани легких вакцинированных животных в основном не содержали вируса: только у одного из пяти хомячков на четвертый и седьмой дни можно было выявить РНК вируса в легких; однако к 14-му дню ткань легких очищалась от вируса. Вирусная РНК была обнаружена в иных тканях (помимо легочной) у животных контрольной группы только на третий день после заражения. Аналогичные результаты были получены для вакцинного препарата BBV152 [29]. Таким образом, представленные результаты демонстрируют профилактическую эффективность вакцины «КовиВак» на модели сирийского хомячка.
Таким образом, для вакцины «КовиВак» не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности или тератогенного влияния в антенатальном и постнатальном периодах развития, а также признаков гиперчувствительности у исследованных видов животных. Вакцина способствовала формированию стабильного и устойчивого гуморального иммунного ответа — как в виде специфических IgG к SARS-CoV-2, так и НАт у грызунов и обезьян. Значительного снижения титров НАт в течение одного года не наблюдалось. «КовиВак» продемонстрировала профилактический эффект по отношению к инфекции SARS-CoV-2 у сирийских хомячков. Эти данные стимулируют дальнейшее изучение вакцины «КовиВак» в клинических испытаниях.
