Связь метаболических и когнитивных сигналов в головном мозге

Остроконечные пульсирующие волны, фиксируемые на осциллограмме при снятии биопотенциалов с гиппокампа, свидетельствующие об «автономном» режиме работы данной структуры мозга, являются предикторами снижения концентрации глюкозы в крови.
Для регуляции адаптивного поведения мозг полагается на непрерывный поток когнитивных процессов и процессов, связанных с памятью, поддержание функционирования которых требует постоянного энергоснабжения. При среднем весе около 1200 граммов у женщин и 1300 граммов у мужчин головной мозг потребляет около 90 граммов (или порядка 340 килокалорий) глюкозы в день, что составляет около половины суточной потребности организма в глюкозе [1, 2]. Тесная интеграция метаболических и когнитивных сигналов может способствовать согласованию энергоснабжения мозговой ткани с ее энергетическими потребностями за счет оптимизации пищевого поведения и ограничения расхода энергии. До сих пор синхронизация обеспечения тканей глюкозой с активностью мозга считалась функцией структуры, называемой гипоталамус, расположенной в основании мозга. В своей статье в «Nature» Тингли с соавт. [3] приводят доказательства роли другой области мозга крыс, называемой гиппокампом (считается, что в первую очередь он ответственен за процессы памяти и ориентации в пространстве), в поддержании этого баланса (рис. 1).
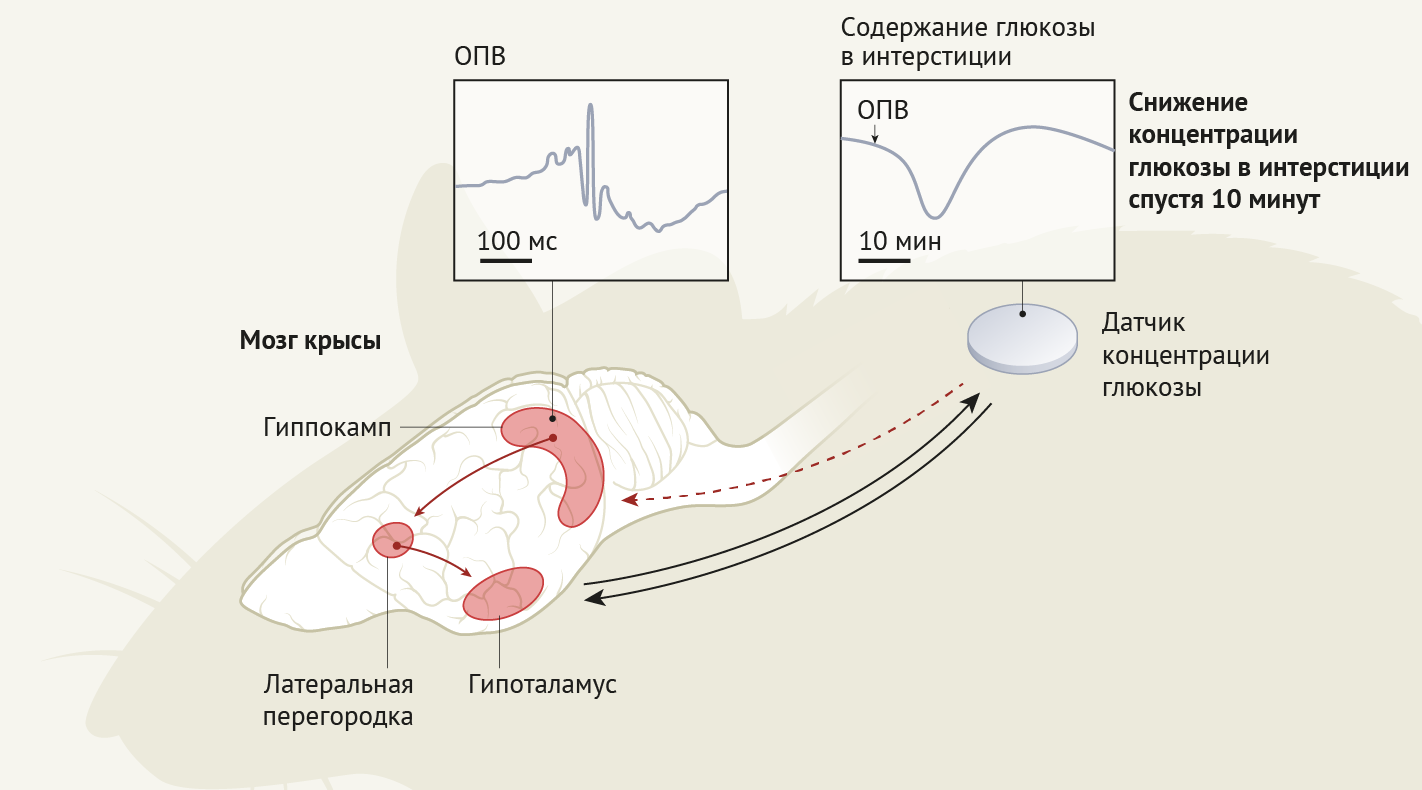
Гиппокамп получает множество типов сенсорной и метаболической информации, а проекции нейронов гиппокампа распространяются на различные части мозга, в том числе и на гипоталамус. Таким образом, гиппокамп действительно может являться центром интеграции метаболических сигналов и когнитивных процессов [3]. Чтобы изучить эту возможность, Тингли с коллегами зарегистрировали паттерны колебаний на осциллограмме, называемые остроконечными пульсирующими волнами (ОПВ), отражающие изменения электрических потенциалов на клеточных мембранах нейронных ансамблей в гиппокампе крыс. Авторам удалось это осуществить благодаря применению датчика для непрерывного определения уровня глюкозы в интерстициальной жидкости; устройство было имплантировано под кожу спины животным.
ОПВ состоят из острых волн, исходящих от нейронов в гиппокампальной области CA3 (один из слоев собственно гиппокампа в гиппокамповой формации — прим. перев.), которые приводят к быстрым, но локализованным колебаниям на осциллограмме, похожим на рябь, в CA1, а также связанных с ней областях. Важно отметить, что ОПВ связаны с синхронными всплесками возбуждения нейронов и представляют собой отличительную черту когнитивной, специфически связанной с памятью, обработки полученного опыта [4].
Авторы продемонстрировали, что кластеры ОПВ, записанные в области гиппокампа, называемой дорсальным CA1, сопровождаются четко выраженным падением концентрации глюкозы в крови примерно через 10 минут. Хотя частота возникновения ОПВ, которая в среднем составляла почти 10 в минуту, значительно различалась в течение 24-часового цикла, авторы показывают, что при каждом появлении ОПВ наблюдалось снижение концентрации глюкозы примерно на 0,33 миллиграмма на децилитр. ОПВ с большей амплитудой, но краткие по длительности и сгруппированные в кластеры во времени, свидетельствовали о наиболее выраженном снижении содержания глюкозы.
Согласно данному поразительному наблюдению, можно использовать ОПВ в качестве сигнала сброса фазы для контроля уровня глюкозы в организме животного. Некоторые аспекты этой теории требуют доработок, например, время развития фиксируемого в эксперименте снижения глюкозы. Объяснением задержки в 10 минут между ОПВ и падением уровня глюкозы могут быть такие факторы, как низкая скорость диффузии глюкозы в интерстиций и техническая задержка в работе имплантированного датчика (время на регистрацию концентрации глюкозы). Следовательно, связь гиппокампа и уровня глюкозы в средах организма, выражающаяся в ОПВ, может оказаться еще более тесной.
Другой аспект, который следует учитывать, — это динамика изменения уровня глюкозы после ОПВ-импульса. Эти паттерны колебаний связаны с повышенной активностью возбуждения в гиппокампе, а также в различных зонах коры головного мозга, которые получают сигналы от гиппокампа. Следовательно, учитывая это увеличение возбуждения и повышенные энергетические потребности мозга, можно было бы ожидать, что сигнализация из гиппокампа приведет к увеличению, а не к снижению поступления глюкозы в биологические среды. В стрессовых ситуациях мозг может быстро передать сигнал по нейронам симпатической нервной системы различным областям тела, чтобы увеличить концентрацию глюкозы в периферическом кровотоке. Однако при генерации ОПВ, по-видимому, происходит деактивация тех областей мозга, которые обеспечивают активацию симпатической нервной системы [5]. Не может ли оказаться, что снижение уровня глюкозы после регистрации ОПВ отражает всего лишь повышенное потребление мозгом и «приток» глюкозы из крови к нейронам во время непосредственной генерации ОПВ-импульсов?
Тингли с соавт. своими четкими контрольными экспериментами демонстрируют, что это не так. Исследователи обнаружили, что искусственное подавление активности латеральной перегородки, основного передатчика сигналов от гиппокампа к гипоталамусу, устраняет связь ОПВ-импульсации с колебаниями уровня глюкозы в периферическом кровотоке. Данное открытие и наблюдение того, что искусственно стимулированные ОПВ в гиппокампе также сопровождались снижением уровня глюкозы, подтверждают идею о том, что сигнализация, специфически связанная с возникновением ОПВ и передающаяся через гипоталамус, приводит к снижению концентрации доступной глюкозы в периферическом кровотоке.
Эти результаты приведут к новым гипотезам о том, как регулирование поступления глюкозы в мозг интегрировано с гомеостатической регуляцией обмена глюкозы во всем организме животного. Более того, поскольку связь между ОПВ и содержанием глюкозы оказалась такой же, как при голодании животных, так и при обилии у них доступной пищи, эти результаты проливают новый свет на предположение о том, что мозг контролирует уровень глюкозы в крови в нормальных условиях [6], а не только в условиях стресса и других метаболических нарушений. В будущем следует выяснить, происходят ли падения уровня глюкозы, связанные с импульсами ОПВ, во всем организме животного, или же это отражение перераспределения энергии, являющегося приоритетным для мозга [7]. Также крайне необходимо выявить механизмы, лежащие в основе данных процессов.
ОПВ не просто сопровождают значительное усиление возбуждения нейронов: во время этой импульсации в упорядоченном во времени виде гиппокампом воспроизводятся те воспоминания и такие паттерны активности, которые были запечатлены в памяти ранее. ОПВ не возникают, когда крыса активно исследует лабиринт. Они возникают во время коротких перерывов между эпизодами передвижения, когда, как нам кажется, крыса «планирует», куда идти дальше. Они также возникают во время эпизодов медленноволнового сна (сна, характеризующегося низкочастотной электрической импульсацией) после исследовательского поведения, когда необходимо надолго запечатлеть в памяти воспоминания об определенном событии. Во время ОПВ-импульсации ранее существующие образцы информации объединяются, и, таким образом, могут влиять на принятие решений [4]. Следовательно, ОПВ можно охарактеризовать как «автономный» режим работы, во время которого гиппокамп и связанные с ним области мозга вовлекаются в «мыслительную» активность.
В этом свете выводы Tingley с соавт. связывают четко определенные периоды мыслительной обработки полученного опыта с непосредственной регуляцией метаболизма. Учитывая, что ОПВ также координируют активность гиппокампа с активностью нейронных ансамблей в тех областях коры, куда поступают сигналы из гиппокампа, они могут служить даже для осуществления автоматического когнитивного контроля метаболизма в периферических тканях организма некоторыми областями мозга. Согласно недавним открытиям, предполагается, что мыслительная деятельность, связанная с памятью, отражением которой являются ОПВ, обычно возникает в те моменты, когда отсутствует острый стресс; также предполагают, что кратковременный дефицит энергии может быть полезен для функционирования такой мыслительной деятельности [8]. В действительности, это может быть первым объяснением того, почему ОПВ в гиппокампе снижают, а не повышают концентрации глюкозы в периферическом кровотоке.
Таким образом, интересные результаты Тингли с соавт. свидетельствуют о существовании ранее неизвестной сигнальной петли в гиппокампе, лежащей в основе когнитивного контроля регуляции уровня глюкозы в крови. Выводы авторов не только открывают новые перспективы для фундаментальных исследований, но и вынуждают пересмотреть различные клинические явления. К числу таковых относятся:
- oдновременное развитие когнитивной дисфункции и ухудшение состояния гиппокампа с нарушением регуляции глюкозы, например, при сахарном диабете второго типа [9];
- связь между нарушениями медленного сна и развитием инсулинорезистентности [10];
- нарушение регуляции пищевого поведения у людей с поражениями гиппокампа и связанными с этим нарушениями памяти [11].
Можно предположить, что причина исчезновения контроля метаболизма при данных патологиях может лежать в одной плоскости с нарушением ОПВ-импульсации в гиппокампе.
