Активация HIF, индуцированная гипоксией и фармакологическим путем, подавляет проникновение SARS-CoV-2 в эпителиоциты легочной ткани
Пандемия COVID-19, вызванная новым коронавирусом SARS-CoV-2, — общемировая проблема общественного здравоохранения. Хотя для сдерживания пандемии необходимы различные подходы общественного здравоохранения, включая массовую вакцинацию и социальное дистанцирование, огромное значение играют профилактические мероприятия или раннее лечение применительно к уязвимым контингентам населения. Это приобретает особенную значимость с учетом возникновения различных вариантов вируса SARS-CoV-2 и неопределенность эффективности вакцин в будущем. В первую очередь, SARS-CoV-2 поражает дыхательные пути, а развитие инфекции начинается со связывания шипикового белка (S) с ангиотензин-превращающим ферментом 2 (АПФ2), после чего трансмембранная сериновая протеаза 2 (TMPRSS2) запускает слияние вирусной и клеточной мембран. Высокая степень экспрессии АПФ2 наблюдается в эпителиальных клетках дыхательных путей, а также в эпителиоцитах почек и кишечника. Хотя в большинстве случаев COVID-19 протекает в легкой форме, отличительной чертой тяжелой формы заболевания является низкое содержание кислорода в системном кровотоке (гипоксемия), что часто непропорционально степени повреждения легких. Существуют сведения, позволяющие предположить, что такая значительная гипоксемия может изменять способность SARS-CoV-2 инфицировать клетки макроорганизма. Также есть сообщения о том, что гипоксия регулирует репликацию ряда вирусов, усиливая репликацию вируса Эпштейна-Барр, но подавляя репликацию ВИЧ и вируса гриппа. Таким образом, взаимодействие между путями сигнализации, обусловленной гипоксией, и вирусной инфекцией крайне специфично и зависит как от клеток макроорганизма, так и от вида вируса. Кроме того, есть сообщения, что гипоксия либо индуцирует, либо в некоторых случаях подавляет экспрессию АПФ2 в гладкомышечных клетках легочных артерий (ГМКЛА), стволовых клетках-предшественниках гемопоэза и клетках гепатокарциномы. Поскольку влияние низкого содержания кислорода на экспрессию АПФ2 и репликацию SARS-CoV-2, вероятно, зависит от особенностей клеток, ученые провели оценку того, влияет ли гипоксия на заражение и репликацию SARS-CoV-2 в эпителиальных клетках легких.
Клетки млекопитающих адаптируются к низкому содержанию кислорода через четко отрегулированный транскрипционный ответ, который регулируется фактором, индуцируемым гипоксией (HIF). Это гетеродимерный фактор транскрипции, включающий субъединицы HIF-1α или HIF-2α, регуляция активности которого осуществляется посредством кислородозависимой и независимой стресс-опосредованной сигнализации. Когда кислород содержится в достаточном количестве, происходит быстрое гидроксилирование вновь синтезированных субъединиц HIFα ферментами HIF пролилгидроксилазного домена (PHD), и они становятся мишенями для полиубиквитинирования и протеасомной деградации. Напротив, когда кислорода недостаточно, субъединицы HIFα перемещаются в ядро, димеризуются с HIF-1β и активируют транскрипцию генов, участвующих в клеточном метаболизме, пролиферации, контроле тонуса сосудов легких и регуляции иммунного ответа. Определение того, как гипоксия или активация HIF влияет на жизненный цикл SARS-CoV-2 в эпителиоцитах легких, будет способствовать углублению понимания патогенеза заболевания и предоставит материал для выработки терапевтических стратегий. В частности, это имеет значение для особенностей фармакологического воздействия, поскольку препараты, которые ингибируют ферменты PHD для стабилизации HIF, либо находятся на этапе клинических испытаний для лечения анемии почечного генеза, либо лицензированы для клинического использования (Roxadustat в Китае и Daprodustat в Японии).
В своем исследовании авторы описывают удивительное ингибирующее воздействие гипоксии и лечения препаратом FG-4592 (Roxadustat) на степень проникновения SARS-CoV-2 в клетку (включая спайковые варианты), репликацию и секрецию вирусных частиц в эпителиоцитах легких. Эти эффекты были опосредованы подавлением репликации SARS-CoV-2, зависимой от HIF-1α, а также сниженной экспрессией АПФ2 в некоторых клетках и легочной ткани мышей. Следует отметить, что имеются сообщения о гипоксической индукции экспрессии гена АПФ2 в других типах клеток, хотя данное явление не отличается постоянством. Несмотря на то, что последнее противоречит результатам ученых-авторов данной работы, такое различие может оказаться отражением минимальной степени экспрессии АПФ2, что было выявлено во многих исследованных учеными группах клеток. В этом же исследовании внимание авторов было сосредоточено на клетках, степень экспрессии АПФ2 у которых значительно повышена, и которые относятся к клиническим очагам инфекции. С другой стороны, отмеченные различия в регуляции транскрипции АПФ2 могут отражать метаболические фенотипы, специфичные для клеток, которые модулируют сигнализацию посредством HIF или экспрессию ко-регуляторов, опосредующих косвенные эффекты экспрессии HIF. Например, исследование гипоксической регуляции АПФ2 в ГМКЛА предполагает наличие опосредованного механизма — с помощью HIF-1α-опосредованной индукции сигнализации АПФ1 и ангиотензина-II / ATR1; однако гипоксия или FG-4592 в клетках Calu-3 не оказывают влияния на экспрессию гена АПФ1. Интересно, что в недавних работах описана HIF-1α-зависимая индукция микроРНК LET7b, которая напрямую воздействует на кодирующую последовательность гена АПФ2 для подавления ее экспрессии в ГМКЛА, подвергнутых гипоксии. Хотя точный механизм, с помощью которого HIF-1α подавляет мРНК гена АПФ2 в эпителиоцитах легких, неясен, обратимая природа этой репрессии в сочетании с присутствием компонента, реагирующего на гипоксию, в промоторе гена АПФ2 может согласовываться с прямой репрессией, опосредованной HIF.
Помимо воздействия на АПФ2-опосредованное проникновение вируса, было обнаружено значительное подавление непосредственно РНК SARS-CoV-2 и сборки вирусных частиц посредством гипоксии или псевдогипоксии. Примечательно, что дополнительное применение ингибиторов пролилгидроксилазы, дапродустата и молидустата, привело к определенной степени противовирусной активности, что свидетельствует об эффекте, выходящем за рамки известного о роксадустате. Было показано, что HIF регулирует репликацию других РНК-вирусов посредством воздействия на метаболизм клеток макроорганизма. Например, известно, что HIF подавляет репликацию вируса гепатита С в печени посредством активации сигнального пути аутотаксин-лизофосфатидной кислоты для регулирования сборки вирусных частиц. Более того, понимание того, как HIF регулирует активность респираторных вирусов, иллюстрируется на примере вируса гриппа A, репликация которого была искусственно усилена у мышей, у которых инактивация HIF-1α была ограничена альвеолярными эпителиоцитами II типа, что подчеркивает роль HIF-1α в подавлении этого респираторного патогена. Результаты авторов работы противоречат сведениям Codo с соавт. 2020 года о том, что обработка моноцитов ингибитором пролилгидроксилазы HIF BAY 85-3934 (Молидустат) увеличивала концентрации РНК SARS-CoV-2 в зависимости от HIF-1α. Это может быть связано с различиями, специфичными для разных типов клеток; например, репликация SARS-CoV-2 в моноцитах крайне ограничена, а содержание вирусной РНК в них оказалось значительно ниже, чем в зараженных эпителиоцитах легких. В будущем важно описать HIF-1α-зависимые механизмы репрессии SARS-CoV-2, которые, вероятно, опосредуются факторами регуляции HIF-1α макроорганизма, необходимыми для репликации и/или стабильности вирусной РНК.
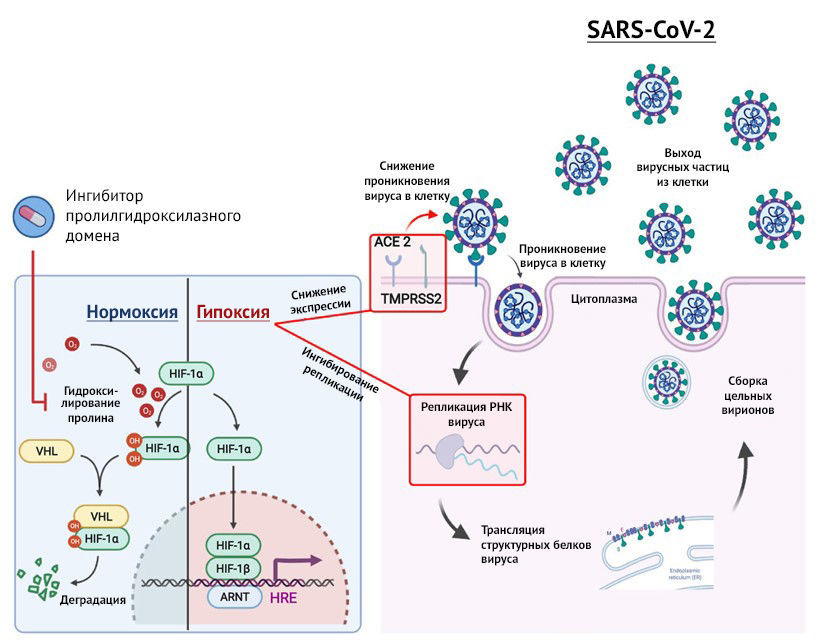
Рисунок 1
Наблюдения авторов поднимают четкие вопросы о том, как клеточная гипоксия отражается на состоянии человека: как с точки зрения восприимчивости к SARS-CoV-2, так и с точки зрения клинического прогрессирования COVID-19. Предполагается, что хроническая гипоксия может обладать защитным действием. Это основывается на факте снижения заболеваемости COVID-19 среди людей, проживающих в высокогорных районах (хотя эти наблюдения осложняются географическими и социально-экономическими факторами). Некоторые клинические исследования показывают, что среди пациентов, госпитализируемых с COVID-19, курильщиков и больных с хроническими респираторными заболеваниями (например, астмой и ХОБЛ) крайне мало. Однако эти состояния также связаны с более высоким риском развития неблагоприятных исходов при иных известных респираторных инфекциях. В итоге гипоксемия является негативным прогностическим индикатором тяжелой формы COVID-19. Хотя это, по всей вероятности, и расходится с выводами авторов статьи, клиническая гипоксемия представляет собой сложное состояние, которое отражает множество патологических процессов, включая сосудистое воспаление, коагулопатию и микротромботическое заболевание, что может обесценивать любые защитные эффекты гипоксии на развитие инфекции SARS-CoV-2.
Ключевым выводом исследования является потенциальное терапевтическое применение роксадустата и других ингибиторов пролилгидроксилазы HIF при COVID-19, что обусловлено их действием на нескольких этапах жизненного цикла вируса (нарушение проникновения и репликации). Как таковые, они могут быть эффективными против вновь возникающих вариантов SARS-CoV-2. Эти препараты были разработаны в качестве средств, стимулирующих эритропоэз, у пациентов с анемией и хронической болезнью почек, и в настоящее время используются перед гемодиализом и во время него. Таким образом, вероятно, что значительное число пациентов, которые подвержены риску развития тяжелой формы COVID-19, будут получать эти препараты. В работе ученых подчеркивается настоятельная необходимость наблюдения за этими пациентами на предмет выявления любых доказательств того, что ингибиторы PHD обнаруживают профилактическую и/или терапевтическую активность против COVID-19. Однако клиническое приложение роксадустата может оказаться сложным, поскольку HIF обладает множественными системными эффектами, которые могут повлиять на прогрессирование течения COVID-19. Более того, АПФ2 является защитным в моделях повреждения легких, поэтому неясно, принесет ли снижение экспрессии АПФ2 выгоду при тяжелой форме респираторной инфекции. Несмотря на потенциальную сложность, заметные эффекты роксадустата по защите нативных клеток от проникновения SARS-CoV-2 и относительно ингибирования репликации вируса в инфицированных клетках заслуживают дальнейшего изучения на животных моделях. Также необходимо рассмотреть возможность клинических испытаний на людях.
Ключевые моменты:
- Гипоксия снижает экспрессию рецепторов SARS-CoV-2 АПФ2 и трансмембранной сериновой протеазы 2, а также ингибирует проникновение вируса в клетку.
- Гипоксическая сигнализация ингибирует репликацию SARS-CoV-2 и сборку вирусных частиц посредством HIF-1α.
- HIF-ингибиторы пролилгидроксилазы необходимо рассматривать как потенциальную терапию при COVID-19.
Коротко о главном
Wing с соавт. продемонстрировали, что ключевые аспекты жизненного цикла SARS-CoV-2 зависят от содержания кислорода в клетке. Активация внутриклеточного пути чувствительности к кислороду подавляет инфекцию SARS-CoV-2, выделяя основной клеточный путь, который может быть использован в качестве потенциального терапевтического воздействия на возбудитель COVID-19.
