Перегруппировка микробов кишечника для защиты от инфекций

Резидентная микрофлора кишечника может помочь останавливать развитие инфекций, однако механизмы этого явления до конца не изучены. Как удалось выяснить, определенные изменения в микробиоме, происходящие после заражения, способствуют повышению концентрации одного соединения, которое играет ключевую роль в борьбе с вредоносными бактериями.
Сложные взаимодействия между млекопитающим-хозяином и его кишечной микробиотой (сообществом микроорганизмов, обитающих в тонкой и толстой кишке) влияют на здоровье хозяина и степень восприимчивости к заболеваниям. Основная сложность при изучении взаимосвязей, управляющих такими взаимодействиями, заключается в большом разнообразии видов микробиоты, что приводит к возникновению микробного профиля, уникального для каждого человека [1], так же как отпечатки пальцев. Растет понимание того, что микробиота кишечника участвует в формировании устойчивости к колонизации кишечника болезнетворными микроорганизмами (патогенами). Однако многие исследования этого явления в основном носили описательный характер и были сосредоточены только на соотнесении определенного состава микробиоты с состоянием здоровья или наличием заболевания [2]. В своей статье в «Cell» Stacy с соавт. [3] предлагают подробный механизм взаимосвязи изменений микробиоты с устойчивостью к внедрению патогенов.
Принято считать, что микробиота может препятствовать колонизации кишечника патогенами [4], и существуют доказательства, подтверждающие идею о том, что микробиота кишечника может играть роль в ограничении развития патогенов. Например, длительный прием и/или высокие дозы антибиотиков способствуют распространению Clostridium difficile [5], бактерии, вызывающей тяжелую форму диареи и воспаление толстой кишки, что приводит к повышению риска развития тяжелого декомпенсированного состояния и даже летального исхода. Низкое разнообразие видов, присутствующих в микробиоте, — характеристика, обычно наблюдаемая у жителей промышленно развитых стран, — связана с повышенной восприимчивостью к инфекционным заболеваниям [6]. Более того, мыши, которых лечили антибиотиками или выращивали в стерильных условиях (следовательно, они были лишены микробиоты), более восприимчивы к кишечным патогенам, чем мыши с нормальной микрофлорой [7].
Наоборот, отдельные формы микробиомов могут способствовать росту патогенов или высоковирулентной инфекции. Например, различные микробиоты мышей определяют восприимчивость к патогену Citrobacter rodentium, вызывающему аномальный рост эпителиальных тканей в толстой кишке (гиперплазию) [8]. Трансплантация микробиоты восприимчивых мышей особям, не чувствительным к инфекциям, приводит к развитию инфекции C. rodentium, тогда как трансплантация микробиоты от нечувствительных восприимчивым животным приводит к устойчивости к инфекции [8]. Согласно эпидемиологическим данным, восприимчивость к инфекциям, вызываемым пищевым патогеном Campylobacter jejuni, у жителей Швеции зависит от видового состава их микробиоты [9]. Подчеркивается, что определенные кишечные патогены, такие как Salmonella enterica и C. rodentium, используют сигналы микробиома хозяина для точной модуляции своего метаболизма и выработки энергии с помощью процессов клеточного дыхания. Также, воспринимая эти сигналы и отвечая на них, патогены могут повышать или снижать степень экспрессии компонентов своих факторов вирулентности, которые используются для колонизации кишечника организма хозяина [10–12].
Сейчас начаты уникальные исследования о роли микробиоты в развитии инфекций. Такая работа выходит за рамки обычной фиксации корреляции между инфекцией и наличием или отсутствием видов или различий видового состава. Раскрываются механизмы, с помощью которых определенный состав микробиоты обеспечивает устойчивость к инфекции или способствует проникновению патогенов.
Stacy с соавт. сообщают, что после заражения кишечным патогеном Klebsiella pneumoniae у мышей повышается способность противостоять последующему заражению этой бактерией (рис. 1). Чтобы попытаться разобраться в механизме, лежащем в основе вышесказанного, авторы проанализировали микробную ДНК, проводя оценку метагеномов (т. е. всех микробных генов, обнаруженных в сообществе) в постинфекционных и нативных микробиотах (тех, которые ранее не подвергались воздействию бактерии), чтобы определить, как микроорганизмы могут способствовать сопротивлению колонизации. Команда ученых выявила, что гены, кодирующие белки, необходимые для метаболизма серосодержащих молекул, таких как таурин, оказались в значительно большей степени обогащены (имеется в виду обмен генетической информацией между бактериями посредством плазмид — прим. перев.) у постинфекционных микробиот, чем у нативных микробиот.
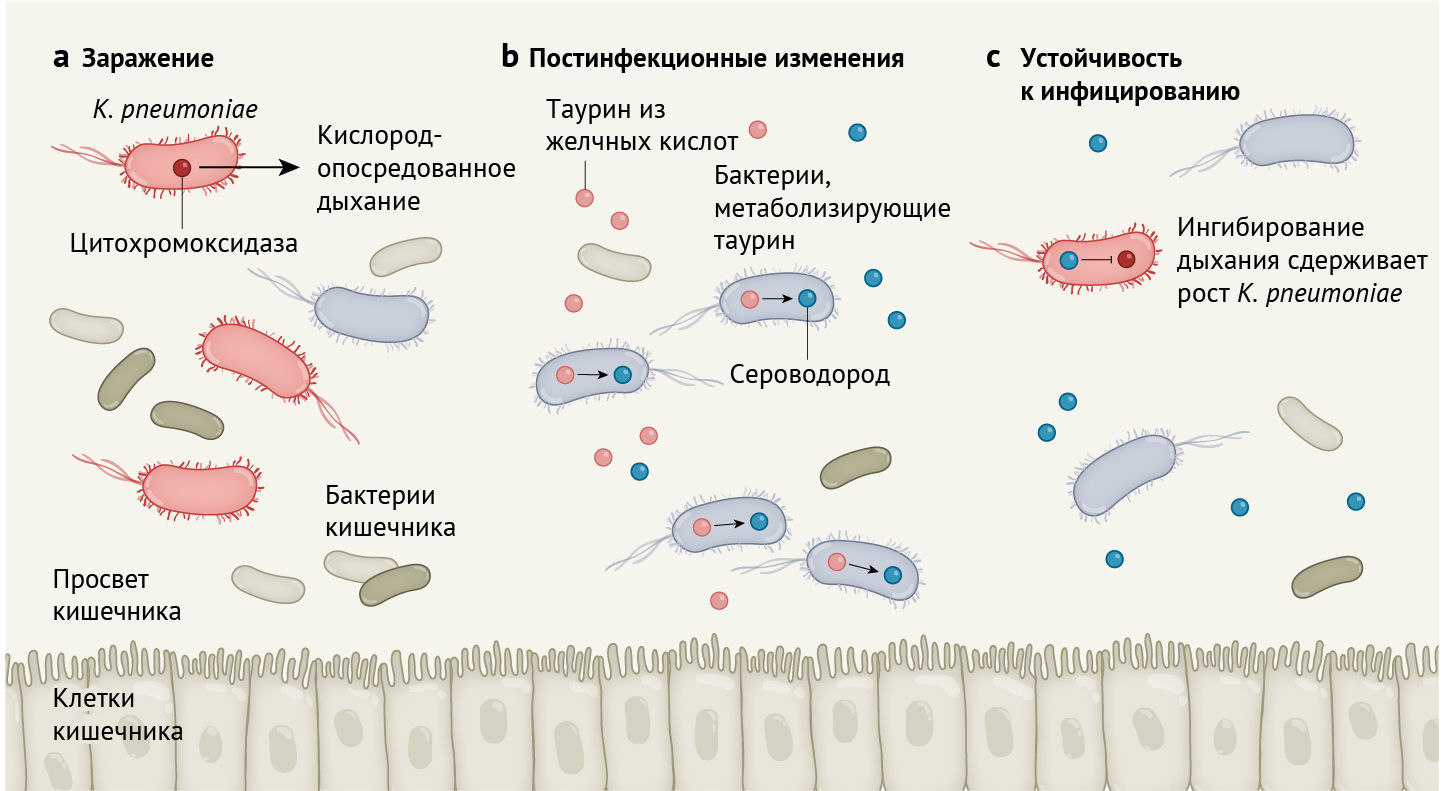
а. Klebsiella pneumoniae размножается и вызывает инфекцию в просвете кишечника млекопитающих благодаря цитохромоксидазе. Этот фермент необходим бактериям для производства энергии путем аэробного дыхания с использованием кислорода в кишечнике хозяина.
b. После заражения K. pneumoniae повышается концентрация таурина в кишечнике. Таурин вырабатывается в результате метаболизма желчных кислот, которые секретируются в кишечник из печени. Stacy c соавт. предоставляют генетические доказательства, указывающие на то, что после заражения резидентные бактерии, которые могут использовать таурин, широко распространяются в кишечнике. В процессе метаболизма таурина бактериями они выделяют сероводород.
с. Сероводород подавляет аэробное дыхание и тем самым может блокировать рост вредных бактерий.
Желчные кислоты вырабатываются в печени и хранятся в желчном пузыре. Они являются основным источником таурина в кишечнике. Они выделяются в кишечник, способствуя перевариванию жиров и масел из пищи. Отдельные представители микробиоты расщепляют желчные кислоты, высвобождая таурин, который может служить источником энергии для других кишечных бактерий. Использование таурина в метаболических путях бактерий приводит к образованию сероводорода как побочного продукта. Высокие концентрации сероводорода могут подавлять активность ферментов цитохромоксидаз, которые катализируют реакции, происходящие во время кислородозависимого (аэробного) дыхания.
Кишечные патогены часто используют кислород, генерируемый хозяином, для получения энергии посредством аэробного дыхания и таким образом закрепляют свою колонизацию организма-хозяина [13]. Stacy с соавт. сообщают о корреляции между таурин-опосредованным синтезом сульфидов (в том числе сероводорода) микробиотой после инфекции и сопутствующим ингибированием дыхания патогена, что в итоге подавляет инфицирование патогеном. Авторы зафиксировали этот эффект у двух патогенов (K. pneumoniae и C. rodentium), что позволяет предположить, что постинфекционный микробиом обеспечивает широкий спектр защиты от последующих контаминаций бактериями. Stacy с соавт. отмечают, что добавление таурина в воду для питья животным способствовало развитию аналогичных эффектов. Таурин — обычный компонент энергетических напитков, и открытие его роли в функционировании микробиома кишечника выглядит захватывающе. Более глубокое понимание таких механизмов могло бы открыть поле для точных манипуляций с микробиотой для борьбы с некоторыми инфекционными заболеваниями.
Исходя из вышесказанного, диетические добавки в виде определенных метаболитов, таких как таурин, могут оказаться способом перепрограммирования «метаметаболизма» микробиоты для повышения устойчивости к патогенам. Это и другие исследования, определяющие механизмы, посредством которых микробиота влияет на метаболизм, дыхание и вирулентность кишечных патогенов, представляют собой ключевой шаг вперед в области взаимодействия между организмом-хозяином, микробиотой и патогеном.
