Уточнен механизм действия противтуберкулезного препарата бедаквилина

Систематизированные данные, раскрывающие механизм действия бедаквилина — относительно нового противотуберкулезного препарата, могут пролить свет на новые возможности терапии этого заболевания. Полученные результаты также раскрывают аспекты того, как функционирует фармакологическая мишень препарата — фермент АТФ-синтаза.
В 2017 году Нобелевская премия по химии была вручена за разработку метода визуализации, называемого криоэлектронная микроскопия. При вручении награды представители Шведской Королевской академии наук заявили, что появление этой методики ознаменовало «новую эпоху в биохимии». Своей статьей в «Nature» Guo с соавт. дают возможность заглянуть в эту новую эпоху.
В работе авторов раскрывается то, как лекарственное средство под названием бедаквилин (которое произвело коренной перелом в лечении лекарственно-устойчивого туберкулеза) взаимодействует со своей мишенью. Препарат связывается с ферментом АТФ-синтазой бактерии Mycobacterium tuberculosis, вызывающей туберкулез. Подробности, выявленные в работе Guo с соавт., дополняют быстро растущий массив сведений, раскрывающих структуру АТФ-синтаз с помощью криоэлектронной микроскопии. Так, видеоролики авторов (см. видеоролики 1 и 2 в Дополнениях ссылки 1), созданные на основе их систематизированных данных, просто захватывают дух, демонстрируя, как работает эта макромолекулярная машина. Более того, учеными показано, как лекарство связывается с ферментом и нарушает синтез им молекулы АТФ. Это предоставляет важную информацию, ускользавшую от обнаружения при работе с другими, более традиционными структурными и биохимическими исследовательскими методиками.
АТФ-синтазы можно найти у всех форм жизни, и их основная структура сохраняется на протяжении эволюции. Эти удивительные белковые комплексы используют градиент протонов, существующий по разные стороны от клеточной мембраны, и движение этих протонов через мембрану для синтеза АТФ — основной единицы энергообмена клеток. У этих макромолекулярных ансамблей общая структура, включающая в себя следующие составляющие: главный участок F1 (см. рис. 1), способный как производить, так и разрушать (путем гидролиза) АТФ, расположенный над скрытым под мембраной «колесом» — вращающимся ротором F0. Головной участок F1 и роторный участок F0 связаны между собой центральным стержнем (субъединица γ фермента), расположенным в центре «колеса», контактирующим с F0 в толще липидной мембраны. Под действием движения протонов периферическая часть стержня вращает вокруг себя «колесо», так что включаются отдельные активные центры фермента в головке F1, и запускается синтез АТФ; если направление вращения меняется на противоположное, происходит гидролиз АТФ.
АТФ-синтаза M. tuberculosis состоит из девяти типов субъединиц (α, β, γ, δ, ε, a, b, b’ и c), из которых составлены «ротор» F0 (содержит по одной а-, b-, b’- и девять субъединиц с) и «головка» F1 (три α, три β, одна γ, одна δ, одна ε). В отличие от других бактериальных АТФ-синтаз, у этой разновидности фермента меньшая активность гидролиза АТФ. Однако молекулярная основа этой отличительной особенности, позволяющей микобактериям сохранять энергию, оставалась неясной.
Guo с соавт. предоставляют ответ на эту загадку своим открытием механизма «крючка и храповика», предотвращающего гидролиз АТФ ферментом. «Крючок» сформирован продолжением α-субъединицы (от головки F1); он может захватывать участок γ-субъединицы в центральной части ротора F0 (рис. 1). Связывание «крючка» с этим «храповиком» предотвращает F0 от вращения в обратном направлении, которое запускает гидролиз АТФ. Если вместо этого F0 вращается в противоположном направлении, приводящем к синтезу АТФ, «крючок» отцепляется от ротора.
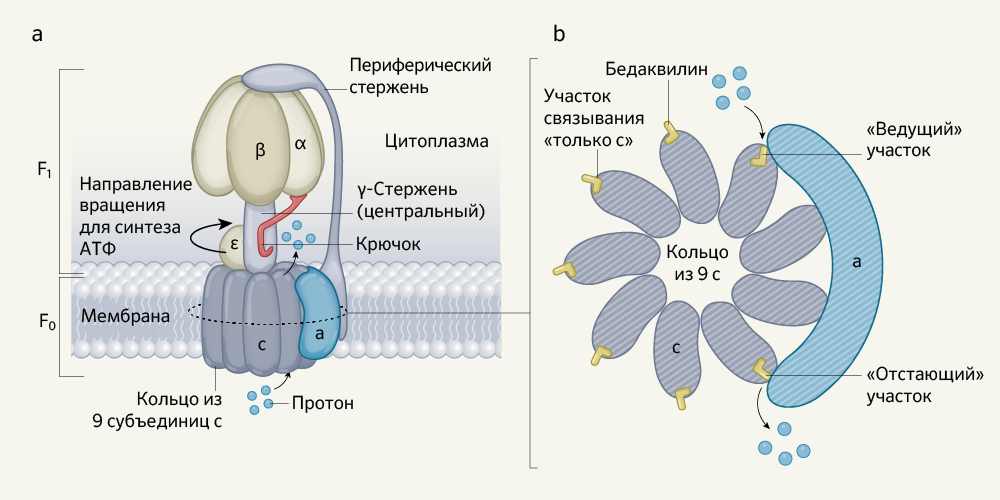
а — молекула АТФ (не показана на рисунке) может быть синтезирована по мере того, как фермент вращается, перенося протоны через липидную мембрану в цитоплазму. Область АТФ-синтазы F1 состоит из периферического стержня, γ-стержня и α-, β-, ε-субъединиц. Область F0 включает в себя кольцо из девяти субъединиц с и субъединицу а. Авторы открыли т. н. «крючок», структуру на субъединице а, которая способна связываться с γ-стержнем и предотвращать вращение в обратном направлении. Это приводит к остановке синтеза АТФ (его гидролизу).
b — авторами определено, как противотуберкулезное лекарственное средство бедаквилин связывается с ферментом, что показано на этой части рисунка в направлении сверху вниз по горизонтальному сечению области F0, обозначенному пунктирной линией на части рисунка a. Guo с соавт. заявляют, что степень связывания препарата с субъединицами с выше в комплексе, когда протоны естественным образом входят или выходят («ведущие» и «отстающие» участки связывания лекарственного средства, соответственно) по сравнению с другими субъединицами с (участки связывания препарата «только с») .
Тем не менее, даже более важным достижением, сделанным в этом исследовании, является понимание того, как именно бедаквилин влияет на функцию ферментов. С помощью генетического анализа уже удалось показать, что субъединица с, формирующая кольцо в сердцевине ротора F0, является мишенью бедаквилина. Путем биохимического анализа удалось обнаружить, что у препарата имеется крайне низкое сродство (миллимолярное) к очищенным выделенным субъединицам с, изучавшимся in vitro. Но сродство бедаквилина к этим структурам оказалось в миллионы раз выше (в наномолярном диапазоне) при проведении исследований на клетках M. tuberculosis. В предыдущем исследовании c-кольца с помощью рентгеновской кристаллографии было показано, что одна молекула бедаквилина связывается с каждой из девяти субъединиц с. Также в ходе исследования были выявлены ключевые особенности того взаимодействия, которое существует между препаратом и участками связывания протонов на кольцах субъединиц с.
Напротив, в своем исследовании Guo с соавт. удалось выявить (рис. 1) семь молекул бедаквилина, связанных с семью из девяти субъединиц с; два других потенциальных участка связывания субъединиц с были блокированы соседней субъединицей а. Пять молекул бедаквилина были связаны с субъединицами с (в т. н. участках «только с») тем же способом, который ранее уже был обнаружен путем рентгенологического анализа, тогда как два других участка субъединиц с, которые связывались с бедаквилином, впоследствии взаимодействовали с субъединицей а. Обозначаемые как «ведущий» и «отстающий» участки, соответственно, они расположены в субъединицах с. В отсутствие препарата, тормозящего функцию фермента, эти участки либо просто захватывали протон на входе в протонный канал с-кольца («ведущий участок»), или же просто перемещали протон к выходу из протонного канала с-кольца («отстающий участок»).
Когда комплекс был очищен от препарата, бедаквилин исчез со снимков пяти участков «только с», но его еще можно было четко различить на «ведущем участке», и некоторое количество препарата также осталось на «отстающем участке». Причина этого стала ясна, когда авторы увидели, где лекарство взаимодействует с белком: «ведущий участок» был сформирован крупными сдвигами некоторых аминокислотных остатков в субъединицах c и а, которые образовывали более глубокий и обширный карман для связывания лекарственного средства по сравнению с участком связывания «только с». В этом различии, вероятно, кроется объяснение разительной разницы между эффективностью препарата in vitro и in vivo. Очень плотно связываясь с «ведущими» и «отстающими» участками (образуются при вращении c-кольца), бедаквилин тем самым блокирует вращение кольца и, как следствие, блокирует транспорт протонов; синтез АТФ останавливается.
Ученым уже известно, что расположение участка связывания относительно периферического стержня должно влиять на возможные конформации в этом участке, но, тем не менее, поразительна та разница, которая наблюдается при связывании с препаратом. Структурные особенности кармана «ведущего участка» связывания предлагают информацию к размышлению для исследователей, разрабатывающих улучшенную версию бедаквилина.
Но внимание большинства людей будет приковано к фильмам, демонстрирующим действие АТФ-синтазы. Появление этих видео стало возможным благодаря криоэлектронной микроскопии. Теперь можно увидеть воочию, насколько сложен этот молекулярный механизм — основа почти всех форм жизни. Одновременно обнаружена уязвимость этого механизма, что и используется бедаквилином. Нобелевский комитет в 2017 году признал, насколько важна визуализация биохимических процессов в трехмерном измерении; авторы выражают надежду, что члены Комитета с гордостью смотрели фильмы к этой статье.
