Ферроптоз: новый подход к иммунотерапии

Т-лимфоциты с фенотипом CD8+ становятся главным звеном современной терапии рака. В недавней статье в «Nature» Wang с соавт. показали, что активированные CD8+ T-лимфоциты могут запускать ферроптоз опухолевых клеток с помощью интерферона γ (IFNγ). Последний ослабляет систему глутамат-цистинового антипортера Xc- и способствует перекисному окислению липидов и ферроптозу. Это новое наблюдение подтверждает, что CD8+ Т-лимфоциты инициируют ферроптоз опухолевой клетки.
Ферроптоз — это железозависимая форма клеточной смерти, которую могут вызывать активные формы кислорода, образовавшиеся в ходе перекисного окисления липидов при участии железосодержащих ферментов, или молекулы малой массы. Ферроптоз отличается от других форм клеточной смерти, например, апоптоза, некроза, аутофагии и пироптоза (выявлены Диксоном с соавт. [1]). Механически ферроптоз запускается при подавлении центрального регулятора — глутатионпероксидазы 4 (GPX4). Это осуществляется прямым ингибированием активности GPX4 или деградацией фермента с помощью иных посредников. С другой стороны, ферроптоз косвенно ингибирует GPX4, блокируя систему Xc (глутамат/цистиновый антипортер, выводящий глутамат из клетки в обмен на внеклеточный цистин для синтеза глутатиона) [2]. Развитие ферроптоза связано с такими опасными состояниями, как дегенеративные заболевания, дистрофия почек и рак [2]. В статье Wang с соавт. [3] в «Nature» показано, что именно путем воздействия на процесс ферроптоза Т-клетки с фенотипом CD8+ могут сыграть значимую роль в иммунотерапии рака.
В своей статье Wang с коллегами прекрасно продемонстрировали, что центральная роль активированных иммунотерапией CD8+ T-лимфоцитов заключается в обеспечении функционирования специфичного для ферроптоза перекисного окисления липидов, что повышает противоопухолевую эффективность иммунотерапии. Исследователи обнаружили, что активированные CD8+ Т-лимфоциты, сосуществуя с опухолевыми клетками, усиливают образование активных форм кислорода в результате перекисного окисления липидов и способствуют ферроптозу опухолевых клеток. Аналогичную активность в отношении опухолевых клеток проявляет и супернатант из активированных CD8+ Т-клеток [3]. Как известно, эта популяция лимфоцитов выделяет IFNγ и фактор некроза опухоли (ФНО). Проведенные исследования антител к IFNγ и ФНО, а также методика CRISPR подтвердили, что IFNγ является основным фактором, опосредующим ферроптоз опухолевых клеток. Более того, анализ секвенированной РНК для идентификации генов SLC7A11 и SLC3A2 выявил сильную положительную корреляцию с резистентностью к ферроптозу. Интересно, что продукты экспрессии этих генов составляют систему Xc, крайне необходимую для ферроптоза. IFNγ может усиливать активность регуляторного фактора интерферона 1 (IRF1) и ингибировать экспрессию как SLC7A11, так и SLC3A2. Это влияет на систему Xc, приводя к ферроптозу опухолевых клеток с помощью янус-киназы (JAK, фермент-тирозинкиназа, необходимый для сигнализации в системах цитокинов и интерферонов) и белка-преобразователя сигнала и фактора транскрипции 1 (STAT1), содержащихся в опухолевых клетках. Исследование представляет собой прорыв в области иммунотерапии опухолей.
Противоопухолевая иммунотерапия достигла больших успехов за последние несколько десятилетий. С одной стороны, применение клеточной терапии усиливает распространение лимфоцитов, проникающих в опухолевую ткань. Это стимулирует противоопухолевую реакцию с помощью Т-клеток. Терапия Т-клетками с химерными антигенными рецепторами (CAR) для устранения гематологических злокачественных опухолей получила многочисленные положительные оценки [4]. С другой стороны, метод терапии под названием «блокировка иммунологических контрольных точек» произвел революцию в лечении рака; при этом с помощью моноклональных антител (мАт) изменяется функция Т-клеток. Методы иммунной таргетной терапии, такие как использование антител к CTLA-4 (гликопротеин цитотоксических Т-лимфоцитов 4), антител к PD-1 (мембранный белок, необходимый для дифференцировки иммунных клеток), антител к PD-L1 (мембранный белок, лиганд к PD-1) ныне являются одними из самых перспективных в клинической онкологии. Однако в данной статье в «Nature» результаты, представленные Wang с соавт., дают комплексное представление о том, как CD8+ Т-лимфоциты оказывают противоопухолевое воздействие при ферроптозе и опосредуют гибель опухолевой клетки.
CD8+ Т-клетки играют центральную роль в противоопухолевом иммунитете, но их активность в микроокружении опухолевых клеток подавляется [5]. Интересно, что предыдущее исследование показало, что опухоль и инфильтрирующие ее опухолеспецифические Т-клетки взаимодействуют с аденовирусной вакциной и могут активировать CD8+ Т-клетки. Это оказывает иммунотерапевтическое воздействие в опухолевых клетках [6]. Напротив, Yang с соавт. продемонстрировали, что холестериновый метаболизм может усиливать иммунный ответ CD8+ Т-клеток мышей при иммунотерапии рака [7]. Что касается особенностей механизма, то Wang с соавт. проиллюстрировали, что активированные CD8+Т-лимфоциты выделяют цитокин IFNγ, а не ФНО (который играет существенную роль в противоопухолевой защите). В своем исследовании Williams с соавт. [8] выявили с помощью методики CRISPR in vitro, что для оптимального воздействия на опухолевые клетки Т-лимфоцитам необходима внутриклеточная сигнализация посредством IFNγ. Этот вывод еще раз подтверждает основополагающую роль сигнального пути IFNγ в иммунотерапии. Интересно, что активированный сигнальный путь IFNγ способствует восстановлению регуляции IRF1, уменьшая экспрессию SLC7A11 и SLC3A2. Это воздействует на систему Xc, приводя к ферроптозу (рис. 1).
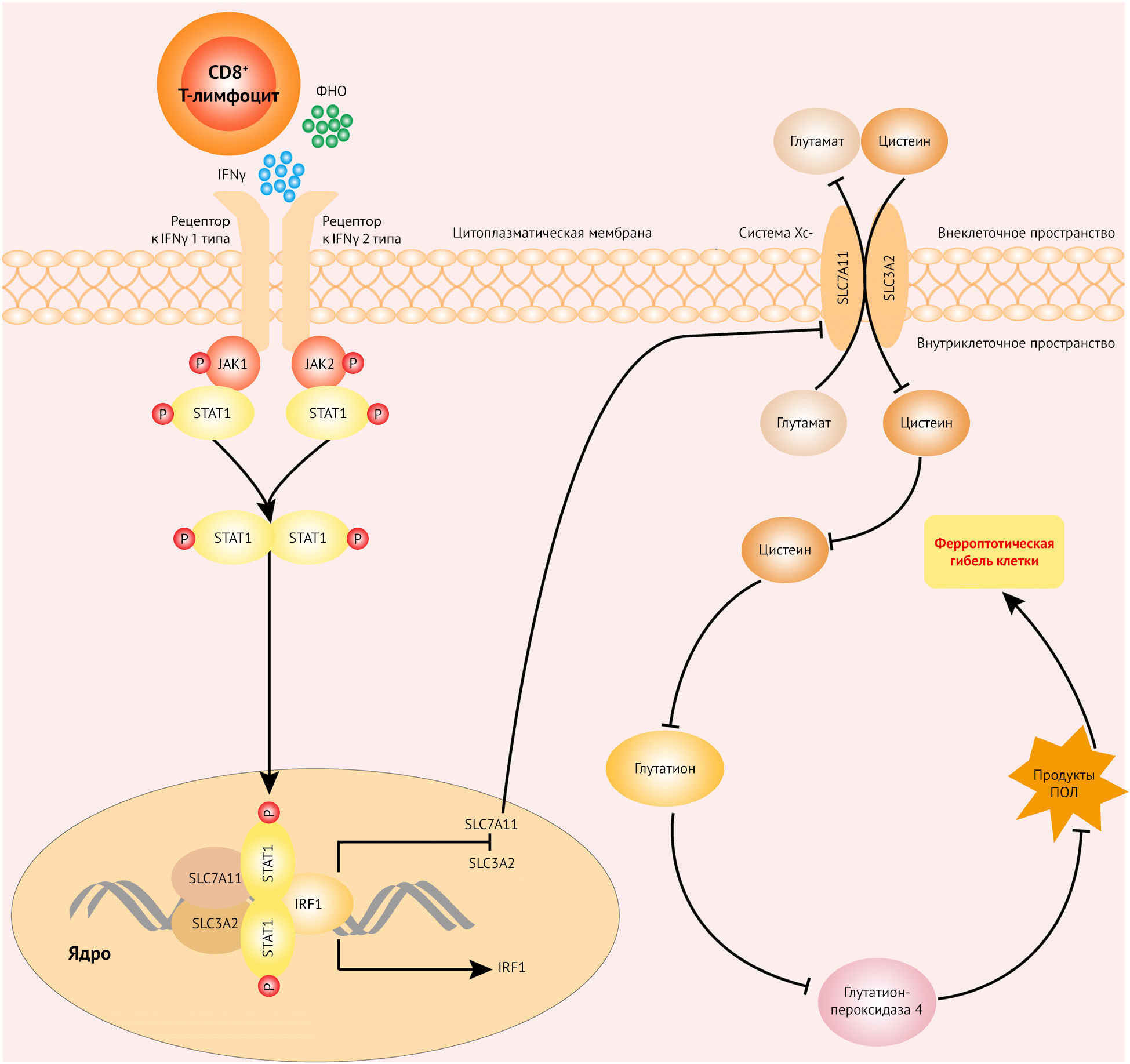
Эти новые открытия не только дают нам возможность понять роль CD8+ T-лимфоцитов в иммунотерапии опухолей, но и раскрывают новый механизм активации ферроптоза опухолевых клеток, что демонстрирует новые возможности терапевтического применения. Явление гибели опухолевых клеток путем ферроптоза, опосредованное CD8+ T-лимфоцитами, поднимает много новых теоретических вопросов. Например, существует много других иммунных клеток или их популяций, которые также могут вызывать ферроптоз. Возможности их применения в иммунотерапии опухолей должны быть изучены в будущем. Таким образом, можно обоснованно предполагать, что определенные иммунные клетки или молекулы-мишени являются потенциальными кандидатами для таргетной иммунотерапии.
