Соединение тканей

Соединение тканей — важный навык, который используется и отрабатывается практически во время каждой операции. Можно сказать, что большую часть любого оперативного вмешательства составляет не разъединение, разрушение структур, а их соединение.
Всякий, кто начинает постигать хирургическую специальность, проходит в операционной классический тест на умение соединять ткани. Это неудивительно: хирург может быть допущен к разъединению тканей только после того, как научится соединять их. Важно понимать, что к понятию «соединение тканей» относится не только восстановление визуальной целостности анатомических структур, но также и восстановление проходимости полых органов: кишки, сосуда и т. д.
В идеале метод соединения тканей и закрытия раны должен быть целесообразным, экономичным по времени, простым в исполнении, давать оптимальный косметический результат и восстанавливать анатомическую целостность и физиологическую проходимость структур в максимальном объеме.
В статье авторы рассказывают про виды соединения тканей и останавливаются подробнее на особенностях каждого способа исполнения.
Виды соединения тканей
Существует два принципиально противоположных метода соединения: при помощи шва и бесшовно.
Соединение тканей при помощи шва
Существуют древнеегипетские свитки, датируемые еще 3500 годом до нашей эры, которые описывают закрытие ран с помощью шовного материала. В прошлые века использовалось множество видов шовного материала: сухожилия животных, конские и человеческие волосы, кожаные полоски, растительные волокна и другие [27].
В 1806 году физик Филипп Синг разработал прочный рассасывающийся шов из кожи оленя, по существу изобретя современный шовник. На данный момент под понятие «шов» попадает не только манипуляция над тканью при помощи нитей и игл, но и скрепление краев раны при помощи металлических скоб — так называемый скрепочный шов.
«Идеальный» шовный материал для восстановления целостности тканей должен обладать следующими параметрами:
- быть инертным в прошиваемой ткани;
- не вызывать реакции инородного тела;
- быть прочным и легким в обращении;
- обладать минимальной травматичностью в результате введения нити;
- обладать «податливостью» для надежного завязывания узлов.
При использовании шовного материала и техники шва при закрытии раны нужно учитывать многие факторы:
- прочность шва;
- риск инфицирования;
- способность удерживать ткань;
- тип разреза и ткани.
Сегодня хирургам доступен широкий выбор шовных материалов. Выбор шва для конкретной процедуры должен основываться на известных физических и биологических свойствах шовного материала, технике наложения швов и регенеративных свойствах сшиваемых тканей. Не менее важную роль при выборе играет и более банальные параметры: наличие шовного материала и личные предпочтения хирурга.
Виды шовного материала
Швы, доступные сегодня, классифицируются на:
- рассасывающиеся и нерассасывающиеся;
- натуральные и синтетические;
- монофиламентные и композитные.
Также отдельно выделяется скрепочный шов, который накладывается при помощи линейного сшивающего аппарата или кожного степлера. Прошивание в данном случае происходит при помощи скрепок и скоб.
Композитный шовник (многониточные плетеные нити) прост в обращении и обладает благоприятными свойствами для завязывания узлов. Тем не менее, бактерии могут проникать в плетеные промежутки и избегать фагоцитоза, что может привести к инфицированию швов. Напротив, монофиламентные нити вызывают значительно меньше тканевых реакций и легко скользят по ткани [14]. Их недостатки включают сохранение формы упаковки («память формы»), трудности в обращении, ненадежность узлов и потенциальное прорезывание ткани [15].
Как правило, плетеные швы потенцируют больше инфекций, чем неплетеные. Загрязнение раны, закрытой плетеной нитью Vicryl ™, приводило к 100%-му инфицированию. Напротив, зараженные раны, закрытые неплетеными швами, демонстрировали значительно меньшую частоту развития раневой инфекции [15].
Многие хирурги предпочитают нерассасывающиеся мононитевые швы из-за их легкого скольжения по ткани, легкости в обращении, минимальной воспалительной реакции и малой вероятности преждевременного разрыва [14]. Другие хирурги предпочитают рассасывающиеся швы, потому что нет необходимости в их удалении, что экономит время и уменьшает дискомфорт пациента [14].
Основным недостатком нерассасывающихся швов является необходимость их удаления между 5 и 10 днями после наложения. Это требует дополнительного посещения врача, что приводит к пропускам работы и более высоким затратам лечения. Лабаньяра в своем обзоре рассасывающихся шовных материалов, используемых в хирургии головы и шеи, отметил, что рассасывающиеся швы просты в обращении, имеют низкую реактивность и превосходную прочность на растяжение, а также стоят дешевле, чем нерассасывающиеся швы [11]. Несколько других исследований, сравнивающих рассасывающиеся и нерассасывающиеся швы, показали, что нет никаких существенных различий в отношении внешнего вида раны и частоты инфицирования, отметив, что чистые раны лица имеют очень низкий уровень инфицирования независимо от метода их сшивания [12]. Luck et al. сообщили об отсутствии клинически значимых различий в косметическом внешнем виде между рассасывающимися и нерассасывающимися швами через три месяца после наложения [12].
В трех из пяти рандомизированных контролируемых исследований, сравнивающих скобы и швы, было обнаружено, что частота осложнений была ниже при использовании швов. При этом два из пяти исследований показали, что швы превосходят скобы и в косметическом отношении [16]. Шетти и др. сообщают о более высокой частоте осложнений при закрытии поверхностных ран металлическими скобами, чем при использовании подкожного викрила [17]. Парелл и его коллеги пришли к выводу, что не было никаких различий в долгосрочных косметических результатах восстановления нерассасывающимися или рассасывающимся шовными материалами у взрослых пациентов с чистыми ранами лица и шеи [13].
Степлер и сшивающие аппараты
В современной хирургии сшивающие аппараты стали стандартным оснащением, особенно после успешного внедрения минимально инвазивных оперативных вмешательств, поэтому получить всесторонние знания о сшивающих аппаратах и научиться безопасному обращению с ними врачу необходимо уже на раннем этапе хирургической специализации.

Эндоскопический линейный сшивающий аппарат от компании Ethicon
На современном этапе существует три основных типа механических сшивателей для клинического применения в открытой и лапароскопической хирургии. Принципы механического соединения тканей:
- сжатие тканей;
- сшивание тканей с помощью металлической проволоки;
- наложение закрытой скобки В-образной формы.
Скобки в шве располагаются в шахматном порядке. Требования к хирургическому механическому шву:
- создание адекватного просвета;
- сохранение адекватной васкуляризации тканей;
- предотвращение натяжения сопоставляемых тканей;
- предотвращение несостоятельности и образования свища;
- надежный гемостаз;
- механическая надежность.
В хирургической практике широко используются сшивающие аппараты трех видов.
1. Аппараты линейного шва или сшиватель TIA (Transverse Anastomosis Stapler/Сшиватель поперечных анастомозов)
Линейные сшивающие аппараты используются преимущественно для закрытия просвета полого органа или сосуда. С помощью этих аппаратов обычно накладывается два ряда скобок, расположенных в шахматном порядке, что обеспечивает максимальное сохранение местного кровообращения. Сосудистыми линейными сшивателями накладывается три линии расположенных в шахматном порядке скобок, обеспечивающих надежное закрытие просвета сосуда. Высота скобки либо фиксирована, либо (у сшивателей некоторых фирм) может регулироваться во время прошивания. В большинстве случаев предпочтительно использовать фиксированную высоту скобки. Поскольку линейные сшиватели в основном используются для ушивания органов с уже вскрытым просветом, они не оснащены режущим устройством. Длина линий скобок колеблется от 30 до 90 мм, а высота отдельных скобок варьирует от 2,5 до 4,8 мм в зависимости от типа прошиваемой ткани (например, высота сосудистых скобок равна 2,5 мм; скобок для неизмененной стенки кишки — 3,5 мм; для желудка или утолщенных тканей — 4,8 мм).
2. Аппарат линейного анастомоза или сшивающий аппарат GIA (Gastrointestinal Anastomosis/Желудочно-кишечный анастомоз)
Сшивающие аппараты этого типа в основном являются линейными сшивателями со встроенным режущим устройством. С их помощью накладывается четыре линии расположенных в шахматном порядке скобок (два ряда); ткань пересекается между двумя внутренними линиями скобок. Основные показания: пересечение с ушиванием обоих концов полого органа (например, кишки, бронха) или сосуда. Помимо этого, можно выполнить анастомоз по типу «бок в бок». Высота скобок фиксирована и должна выбираться в соответствии с типом ткани еще до использования инструмента. Кроме того, одноразовые кассеты различаются диаметром проволоки и размером заряженных в них скобок. В открытой хирургии используются кассеты с длиной линии скобок от 55 до 100 мм. Для минимально инвазивной хирургии были разработаны сшивающие аппараты специальной конструкции. В частности, для компенсации углового отклонения троакаров аппараты были дополнены шарнирными головками.
3. Циркулярные сшивающие аппараты
Этими сшивателями накладывается две линии скобок, расположенных в шахматном порядке (один ряд), а нож пересекает ткань внутри ряда скобок. Высота скобок различна и выбирается в зависимости от толщины ткани. Циркулярные сшиватели используются для создания анастомозов пищевода, желудка и прямой кишки типов «конец в конец» или «конец в бок». Диаметр различных циркулярных сшивателей колеблется от 21 до 33 мм. Следует отметить, что истинный (внутренний) диаметр формируемого анастомоза немного меньше (12,4–24,4 мм). Чтобы избежать разрывов слизистой оболочки, диаметр полого органа определяется с помощью калибровочных приспособлений. Для успешного формирования анастомоза наковальня аппарата фиксируется кисетным швом, накладываемым из просвета органа.
Также отдельно выделяются одноразовые механические степлеры для кожи — быстрый и эффективный метод закрытия длинных разрезов. При использовании скоб для закрытия ран было замечено трех–четырехкратное сокращение времени закрытия кожи, однако для их удаления после операции требуется больше времени [18, 19]. На изображении ниже представлен дермальный степлер Insorb ™ (Incisive Surgical, Inc., Plymouth, MN).
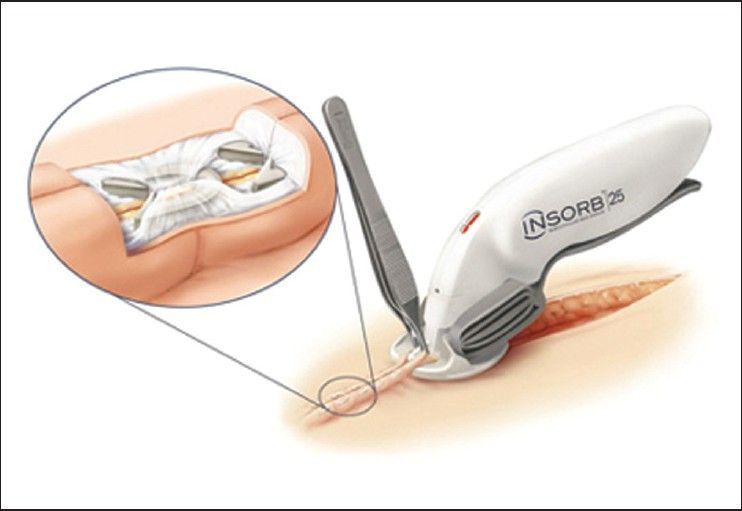
Дермальный степлер Insorb ™ (Incisive Surgical, Inc., Plymouth, MN)
Типы скобок
Наиболее часто используются кассеты, заряженные скобками прямоугольной формы. Открытые скобки проталкиваются сквозь ткани под давлением, создаваемым толкателем при закрытии аппарата; при достижении наковальни скобки сгибаются, принимая окончательную форму буквы В. С одной стороны, В-образная форма скобки позволяет добиться плотного соединения сопоставленных тканей, с другой — сохранить в них достаточное кровоснабжение. Нужно помнить, что высота согнутой скобки меньше, чем открытой. Высота скобки, соответствующая толщине ткани, обеспечивает надежность анастомоза или ушивания и обозначается различными цветами кассет.
Большинство современных сшивателей снабжены скобками фиксированной высоты. Некоторые модели линейных и циркулярных сшивателей, в отличие от линейных рассекателей с фиксированной высотой скобки, заряжаются скобками с изменяемой до некоторой степени высотой, подбираемой соответственно типу ткани во время операции.
Обратимся к некоторым техническим аспектам. Если в начале эры сшивающих аппаратов скобки для них изготавливались из серебра и стали, то в современной сшивающей технологии используется титан, имеющий наилучшую биосовместимость и вызывающий меньшее количество артефактов во время проведения КТ и МРТ. Кроме того, на титан не влияют статические магнитные поля, а его температура во время выполнения МРТ поднимается незначительно. При этом толщина скобок была уменьшена до 0,2–0,3 мм.
Также для кожи были разработаны специальные рассасывающиеся скобы как альтернатива рассасывающимся швам для закрытия хирургических ран. Эти устройства имеют U-образные рассасывающиеся скрепки, состоящие из полимолочного/полигликолевого сополимера, который сохраняет 40 % своей прочности в течение 14 дней и полностью рассасывается в течение нескольких месяцев (период полураспада ткани составляет 10 недель) [44]. Эти кожные степлеры помещаются в субкутикулярную ткань, чтобы удерживать края раны без необходимости прокалывать эпидермис, и предназначены для сочетания косметического результата рассасывающихся швов с быстрым временем закрытия в дополнение к устранению необходимости удаления металлических скоб после операции.
Бесшовные методы соединения тканей
Рассмотрим основные методы бесшовного соединения тканей.
1. Тканевой клей
Еще в 1949 году был разработан тканевой клей — октил-2-цианокрилат (ОЦА), который впервые был использован пластическими хирургами в 1959 году. OЦA обычно начинает функционировать в течение 10 секунд после применения. Стабилизатор нейтрализуется частично ионизированными молекулами воды на поверхности кожи, которые в конечном счете вызывают полимеризацию молекул [3]. Интересно, что разрывная прочность ОЦА примерно в пять раз превышает прочность мононитевых нейлоновых швов [4]. Существует и новая рецептура — модифицированная высоковязкая ОЦА. Более высокая вязкость является преимуществом в снижении риска миграции клея от раны, что улучшает раневой косметический эффект [5]. В течение 5–10 дней клей обычно отслаивается по мере того, как рана эпителизируется [5]. Преждевременное отслаивание клея может быть результатом использования местных мазей и частого очищения ран, обработанных ОЦА [5]. Несколько недавних исследований продемонстрировали эффективность ОЦА при закрытии кожных ран в широком спектре клинических условий и хирургических специализаций. Раны должны быть оценены перед нанесением клея для размещения подкожных швов, чтобы уменьшить натяжение краев, устранить подкожное «мертвое пространство» и максимизировать выворот края кожи [6].
Тканевые клеи уже много лет используются при закрытии ран кожных покровов. Также они широко используются для фиксации имплантатов, закрытия мест утечки спинномозговой жидкости и эмболизации кровеносных сосудов [6]. Кроме того, тканевые клеи в настоящее время используются для лечения поверхностных ран лица, паха, хирургии кисти, блефаропластики, лапароскопических ран, трансплантации волос и закрытия раны после лечения непроходимости слезных путей [1, 7].
Существует много преимуществ тканевых клеев по сравнению с наложением швов и другими методами закрытия ран: более низкая частота инфицирования, меньшее время операции, хорошие косметические результаты, более низкие затраты, простота использования, немедленное закрытие раны, более быстрое возвращение пациента к трудовой деятельности, устранение травм от уколов иглами и отсутствие необходимости в послеоперационном удалении швов [6, 11]. Тканевые клеи также проще и удобнее для использования у детей [6]. Кроме того, ОЦА безопасны с точки зрения побочных эффектов и канцерогенности [4]. Недавнее исследование показало, что использование ОЦА ингибирует рост бактерий и предотвращает развитие раневых инфекций, вызванных грамположительными бактериями [9]. Кроме того, ОЦА может быть хорошим методом закрытия ран у пациентов, подверженных риску образования келоидных или гипертрофических рубцов [9].
Существуют ограничения в использовании ОЦА:
- стоимость, которая может быть более чем в четыре раза выше, чем в случае швов;
- необходимость правильной техники исполнения: не должно быть никакого зазора между краями кожи или кровотечения. Даже при очень небольших зазорах тканевой клей может просачиваться и препятствовать нормальной эпителизации, в конечном счете нарушая заживление раны [10];
- только наружное применение.
Противопоказания к применению тканевых клеев включают наличие инфекции, гангрены или изъязвления, кровотечения из разреза; наличие натяжения тканей; ожоги, укусы животных, участки с высокой влажностью или густым волосяным покровом, а также участки высокого напряжения, например, суставы [2, 8]. Тканевые клеи также противопоказаны пациентам с риском замедленного заживления ран (диабетики или пациенты с коллагеновыми/сосудистыми заболеваниями) и тем, кто страдает аллергией на ОЦА [8].
2. Хирургическая молния
Существует система неинвазивного закрытия кожи при помощи хирургической молнии Medizip. Молния может быть безопасной альтернативой обычному шовному материалу для закрытия кожи. Тем не менее, она бесполезна при высоком натяжении тканей или влажных ранах, ранах с существенными изгибами более 20 градусов, а также у пациентов с ожирением [12].
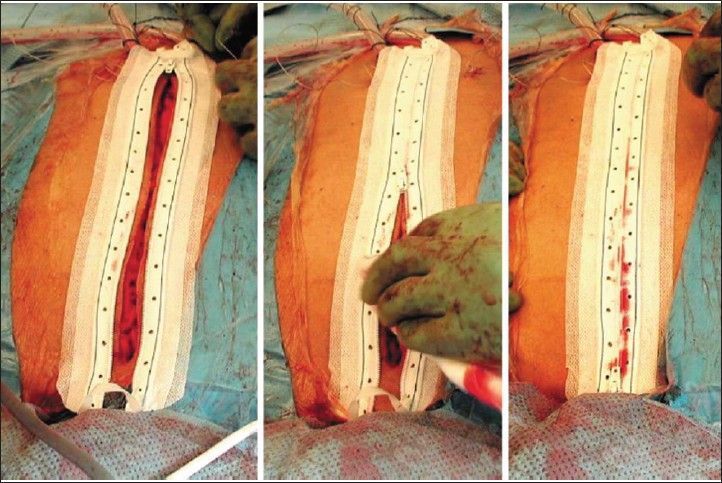
Установка хирургической молнии Medizip
Есть много преимуществ в использовании Medizip, в том числе и то, что такую систему можно открыть для осмотра раны. Кроме того, эта методика удобна для пациента: она сокращает время закрытия кожи в операционной и не требует удаления, а значит, потенциально улучшает косметический результат. Onuminya и его коллеги провели рандомизированное контролируемое проспективное исследование для оценки результатов метода закрытия раны с помощью застежки-молнии Medizip [20]. Они сообщили, что хирургическая молния Medizip предпочтительна при закрытии хирургических ран с точки зрения косметического исхода рубцов и связанных с ними возможных проблем [20]. Рулкер и соавторы пришли к выводу, что Medizip представляет собой безопасный вариант хирургического лечения ран в качестве неинвазивной системы закрытия кожи [44]. Massone et al. показали, что Medizip является эффективной системой закрытия дефектов кожи, поскольку она проста и быстра в обращении, демонстрирует благоприятные косметические результаты и предполагает неинвазивное удаление. Применение этой системы особенно ценно у педиатрических и молодых онкологических больных, получающих комбинированное лечение [21].
3. Лазерное склеивание тканей
Различные виды лазерного склеивания тканей были опробованы для повышения качества заживления кожных разрезов. Использование специфических красителей, таких как индоцианиновый зеленый (ICG), и адгезивных белков, таких как альбумин, в процессе обработки тканей лазером может привести к более быстрому и эффективному закрытию ран, чем традиционная техника наложения швов [22].
Недавно был разработан быстрый и эффективный метод закрытия ран — лазерное связывание тканей (LTB) [23, 24]. Этот метод можно разделить на две основные подфазы:
- фотохимическое связывание тканей (PTB);
- фототермическое связывание тканей.
LTB является быстрым и эффективным методом закрытия разреза, уменьшающим образование рубцов и снижающим вероятность развития осложнений. Накоплены экспериментальные и клинические данные, подтверждающие концепцию выполнения лазерного соединения тканей для улучшения заживления ран после реконструктивных операций [25].
В заключение хочется сказать, что разработки и поиск новых методов соединения тканей и закрытия ран будут бесконечной задачей хирургического направления. С их совершенствованием улучшится и восстановление больных в послеоперационном периоде.
Источники:
- Singer AJ, Hollander JE, Quinn JV. Evaluation and management of traumatic lacerations. N Engl J Med. 1997;337:1142–8.
- Beam JW. Tissue adhesives for simple traumatic lacerations. J Athl Train. 2008;43:222–4.
- Knott PD, Zins JE, Banbury J, Djohan R, Yetman RJ, Papay F. A comparison of dermabond tissue adhesive and sutures in the primary repair of the congenital cleft lip. Ann Plast Surg. 2007;58:121–5.
- Ridgway DM, Mahmood F, Moore L, Bramley D, Moore PJ. A blinded, randomised, controlled trial of stapled versus tissue glue closure of neck surgery incisions. Ann R Coll Surg Engl. 2007;89:242–6.
- Sniezek PJ, Walling HW, DeBloom JR, 3rd, Messingham MJ, VanBeek MJ, Kreiter CD, et al. A randomized controlled trial of high-viscosity 2-octyl cyanoacrylate tissue adhesive versus sutures in repairing facial wounds following Mohs micrographic surgery. Dermatol Surg. 2007;33:966–71.
- Toriumi DM, O’Grady K, Desai D, Bagal A. Use of octyl-2-cyanoacrylate for skin closure in facial plastic surgery. Plast Reconstr Surg. 1998;102:2209–19.
- Sterling JB, Skouge JW. Surgical glue to secure small split-thickness skin grafts: A cost-effective and time-saving technique. Dermatol Surg. 2008;34:246–7.
- Scott GR, Carson CL, Borah GL. Dermabond skin closures for bilateral reduction mammaplasties: A review of 255 consecutive cases. Plast Reconstr Surg. 2007;120:1460–5.
- Lin M, Coates WC, Lewis RJ. Tissue adhesive skills study: The physician learning curve. Pediatr Emerg Care. 2004;20:219–23.
- Shamiyeh A, Schrenk P, Stelzer T, Wayand WU. Prospective randomized blind controlled trial comparing sutures, tape, and octylcyanoacrylate tissue adhesive for skin closure after phlebectomy. Dermatol Surg. 2001;27:877–80.
- LaBagnara J., Jr A review of absorbable suture materials in head and neck surgery and introduction of monocryl: A new absorbable suture. Ear Nose Throat J. 1995;74:409–15.
- Luck RP, Flood R, Eyal D, Saludades J, Hayes C, Gaughan J. Cosmetic outcomes of absorbable versus nonabsorbable sutures in pediatric facial lacerations. Pediatr Emerg Care. 2008;24:137–42.
- Bastian PJ, Haferkamp A, Albers P, Müller SC. A new form of noninvasive wound closure with a surgical zipper. J Urol. 2003;169:1785–6.
- Parell GJ, Becker GD. Comparison of absorbable with nonabsorbable sutures in closure of facial skin wounds. Arch Facial Plast Surg. 2003;5:488–90.
- Piñeros-Fernandez A, Salopek LS, Rodeheaver PF, Drake DB, Edlich RF, Rodeheaver GT. A revolutionary advance in skin closure compared to current methods. J Long Term Eff Med Implants. 2006;16:19–27.
- Sanni A, Dunning J. Staples or sutures for chest and leg wounds following cardiovascular surgery. Interact Cardiovasc Thorac Surg. 2007;6:243–6.
- Shetty AA, Kumar VS, Morgan-Hough C, Georgeu GA, James KD, Nicholl JE. Comparing wound complication rates following closure of hip wounds with metallic skin staples or subcuticular vicryl suture: A prospective randomised trial. J Orthop Surg (Hong Kong) 2004;12:191–3.
- Lubowski D, Hunt D. Abdominal wound closure comparing the proximate stapler with sutures. Aust N Z J Surg. 1985;55:405–6.
- Gatt D, Quick CR, Owen-Smith MS. Staples for wound closure: A controlled trial. Ann R Coll Surg Engl. 1985;67:318–20.
- Onuminya JE, Alufohai E, Onuminya DS. Outcome of surgical zipper technique. J Natl Med Assoc. 2006;98:83–5.
- Brega-Massone PP, Lequaglie C, Magnani B, Cataldo I. A new proposal of skin-closure system for median sternotomy: Usefulness and cosmetic results analysis of MEDIZIP Surgical Zipper in neoplastic immuno-compromised patients. J Surg Oncol. 2003;84:249–54.
- Bleustein CB, Walker CN, Felsen D, Poppas DP. Semisolid albumin solder improved mechanical properties for laser tissue welding. Lasers Surg Med. 2000;27:140–6.
- Bass LS, Treat MR. Laser tissue welding: A comprehensive review of current and future clinical applications. Lasers Surg Med. 1995;17:315–49.
- Shenfeld O, Ophir E, Goldwasser B, Katzir A. Silver halide fiber optic radiometric temperature measurement and control of CO2 laser-irradiated tissues and application to tissue welding. Lasers Surg Med. 1994;14:323–8.
- Oz MC, Johnson JP, Parangi S, Chuck RS, Marboe CC, Bass LS, et al. Tissue soldering by use of indocyanine green dye-enhanced fibrinogen with the near infrared diode laser. J Vasc Surg. 1990;11:718–25.
