Интерфероновый ответ при вирусных пневмониях
Вспышка острого респираторного синдрома, вызванного коронавирусом SARS-CoV-2, в марте 2020 года быстро переросла в пандемию.
В настоящее время противовирусные средства и вакцины против данного заболевания недоступны, и в связи с острой необходимостью многие клинические исследования сфокусировались на скрининге уже существующих лекарственных препаратов на предмет их эффективности против инфекции SARS-CoV-2.
Среди разнообразных терапевтических подходов, применение различных типов интерферона (IFN) в качестве противовирусных средств привлекает внимание исследователей вследствие того, что оно уже показало обнадеживающие результаты при других вызванных коронавирусами патологиях [1].
Воздействуя на различные механизмы и эффекторные белки, интерфероны играют важную роль в ингибировании репликации вирусов [2]. Мэйджор с соавт. [3] и Брогги с соавт. [4] описали механизмы, при помощи которых ответ с участием IFN-λ влияет на патогенез вирусных пневмоний.
С другой стороны, Хаджадж с соавт. в 2019 году [5] изучали реакции периферической крови у группы, состоящей из 50 больных с COVID-19, и обнаружили, что у пациентов с тяжелыми формами заболевания отмечается угнетение интерферонового ответа в сочетании с провоспалительными реакциями.
Интерфероны — важные цитокины врожденной и адаптивной иммунной системы; их разделяют на три главных типа I (α или β), II (γ), и III (λ).
Во время вирусных инфекций паттерн-распознающие рецепторы обнаруживают нуклеиновые кислоты вируса, стимулируя продукцию интерферонов. Экспрессия интерферонов I, II, и III типов не является избыточной у всех интерферон-продуцирующих клеток. В частности, экспрессия IFN-λ является тканеспецифичной: он преимущественно вырабатывается дендритными, эпителиальными клетками и гепатоцитами. У человека IFN-λ включает четыре разновидности (IFN-λ 1–4). Все они связываются и передают сигнал через гетеродимерный рецептор IFN-λ (IFNLR) [6], присутствие которого ограничивается главным образом мембранами эпителиальных клеток, дендритных клеток и нейтрофилов [7, 8].
Передача сигналов через IFNLR запускает внутриклеточный сигнальный путь, который, в свою очередь, индуцирует экспрессию группы генов, стимулируемых интерферонами (ISG) [9]. Сигналы IFNLR также стимулируют экспрессию опухолевого супрессора p53, который ограничивает репликацию вируса, усиливая сигнальный путь интерферона и вызывая остановку клеточного цикла инфицированных клеток [10, 11].
Несмотря на имеющийся противовирусный эффект IFN-λ, в эксперименте на мышах установлено, что IFN-λ, продуцируемый при гриппе, повышает восприимчивость к пневмонии, возникающей при последующем инфицировании метициллин-резистентными Staphylococcus aureus (явление, получившее название суперинфекция) [12]. IFN-λ вызывает распространение и реструктурирование микробиоты носовой полости, а также нарушает барьерную функцию эпителия, что позволяет бактериям проникать в ткани и колонизировать их.
В соответствии с этим наблюдением Брогги с соавт. показали, что количества матричной РНК (мРНК) IFN-λ из жидкости бронхоальвеолярного лаважа и в назофарингеальных образцах коррелировали с тяжестью заболевания у SARS-CoV-2-положительных пациентов.
Они обнаружили, что связь между тяжестью болезни и IFN-λ, наблюдаемая у людей, воспроизводится у мышей, которым интратрахеально вводили полиинозиновую: полицитидиловую кислоту (поли-(I:C)) — синтетическую двухцепочечную РНК. Такая РНК имитирует вирусную и запускает врожденные иммунные реакции. Интратрахеальное введение поли-(I:C) также было связано с нарушением функции эпителиального барьера легких.
SARS-CoV-2 и вирус гриппа инфицируют эпителиальные клетки легочных альвеол. По мере репликации вируса эпителиоциты легких погибают вследствие как цитопатических эффектов, так и в результате повреждений, опосредованных иммунной системой. Последующее восстановление осуществляется путем пролиферации и дифференцировки эпителиальных клеток.
В дальнейшем Мэйджор с соавт. обнаружили, что IFN-λ нарушает дифференцировку эпителиальных клеток-предшественников дыхательных путей на подтипы секреторных и реснитчатых клеток. В соответствии с этим показано, что в обеих группах нарушение пролиферации эпителия зависит от экспрессии IFNLR.
У мышей с удаленным геном Ifnlr1 (Ifnlr1-/-) после воздействия вируса гриппа или поли-(I:C) наблюдалось улучшение пролиферации эпителия. Такой фенотип был опосредован стромальными клетками легких, поскольку у химерных мышей с костным мозгом дикого типа и стромой легкого Ifnlr1-/- обнаруживается такое же усиление пролиферации эпителия, как и у мышей Ifnlr1-/-.
Благодаря усиленному восстановлению эпителия, мыши Ifnlr1-/- демонстрировали лучшую выживаемость в моделях суперинфекций S. aureus и Streptococcus pneumoniae.
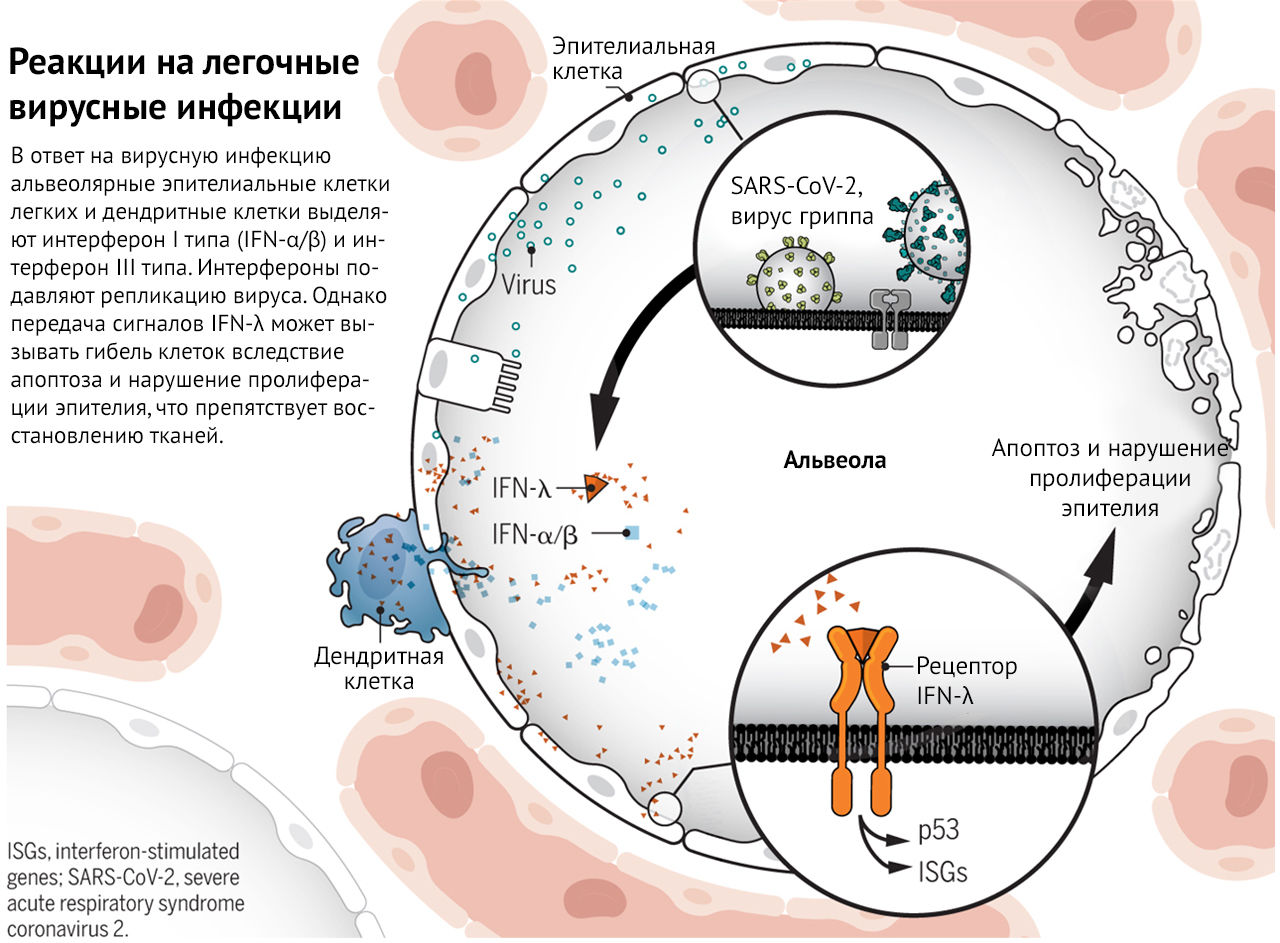
Мэйджор с соавт., а также Брогги с соавт. проанализировали механизм экспрессии генов. Обнаружено, что передача сигналов IFN-λ в эпителиальных клетках легких индуцирует экспрессию ISG и путь p53 (см. рисунок).
Учитывая внутренние противовирусные эффекты IFN-λ и экспрессию IFNLR в эпителии дыхательных путей, IFN-λ изучается как терапевтическое средство при COVID-19. Так или иначе, данные Мэйджор с соавт. и Брогги с соавт. служат предостережением против непредвиденных последствий соответствующих противовирусных реакций при пневмониях, подобных тем, что вызваны SARS-CoV-2.
В других тканях ингибирование клеточного деления и гибель инфицированных клеток может быть подходящей реакцией для предотвращения распространения вируса в живых клетках. Однако, вследствие особенностей вирусных пневмоний и альвеолярных эпителиальных клеток, неспособность к пролиферации приводит к повреждениям барьера, через который осуществляется газообмен, и повышению риска бактериальных суперинфекций.
Реакции на легочные вирусные инфекции
В ответ на вирусную инфекцию альвеолярные эпителиальные клетки и дендритные клетки легких выделяют интерфероны I типа (IFN-α/β) и IFN-λ III типа. Интерфероны ограничивают репликацию вируса; сигнальный путь IFN-λ может вызывать гибель клеток вследствие апоптоза и нарушать пролиферацию эпителия, что препятствует восстановлению ткани.
Из этих результатов вытекает сложная задача для проведения клинических испытаний и разработки схем лечения.
В подобных исследованиях изучается эффект подкожного введения пегилированного IFNL1a в различных группах пациентов с COVID-19. Несмотря на физиологическую роль IFN-λ в обеспечении противовирусного иммунитета в эпителии, в ходе клинических испытаний преимущественно оценивалась его эффективность при вирусных гепатитах, а не при вирусной пневмонии. Остается неясным, какая из схем лечения — пульс-терапия или же длительное постоянное введение препарата — окажет желаемый противовирусный эффект, не вызывая при этом нарушений пролиферации легочного эпителия. Потенциальным альтернативным подходом является блокада IFNLR.
Как показали Мэйджор и Брогги с соавт. в экспериментах на мышах, вероятно, что усиленный пролиферативный ответ, наблюдаемый после IFN-λ-сигналинга, перевешивает положительный эффект недостаточной реакции эпителия легких на IFN-λ при инфицировании SARS-CoV-2.
Исследования Хаджаджа с соавт. были посвящены реакциям с участием интерферона I типа при инфекции SARS-CoV-2 у человека. Подобно IFN-λ, интерферон I типа индуцирует экспрессию ISGs и p53. Однако их противовирусное действие шире, так как рецептор IFN I типа экспрессируется повсеместно.
У тяжелобольных с COVID-19 Хаджадж с соавт. отмечают глубокую супрессию сигнатур IFN типа I в периферической крови. Концентрация IFN-α в плазме крови у этих пациентов была ниже, чем у больных со среднетяжелой и легкой формами заболевания. Это свидетельствует о положительной роли системного интерферонового ответа (IFN типа I).
Мультиплексный генный анализ показал, что у пациентов в критическом состоянии наблюдается снижение экспрессии ISG. Независимо от тяжести заболевания, у SARS-CoV-2-положительных пациентов снижается количество плазмоцитоидных дендритных клеток, которые являются важным клеточным источником интерферонов типа I. У тяжелых и критически больных пациентов вирусная нагрузка плазмы повышена в сравнении с легкими пациентами и пациентами с заболеванием средней тяжести. Такие пациенты также продемонстрировали провоспалительный ответ, управляемый транскрипционным ядерным фактором κB (NF-κB). Данный ответ характеризовался повышенным уровнем интерлейкина-6 (IL-6) и фактора некроза опухоли α (TNF-α).
В противоположность данным, полученным Хаджаджем с соавт. на периферической крови, Брогги с соавт. показали, что у пациентов с SARS-CoV-2 отмечалось повышение количества мРНК IFN I типа в назофарингеальной жидкости, а также в жидкости, полученной при бронхоальвеолярном лаваже. Мэйджор с соавт. попытались выяснить, вызывают ли интерфероны I типа повреждения легочного эпителия, на модели гриппа у мышей. Блокада эндогенной передачи сигналов IFN I типа не усиливала пролиферацию эпителиальных клеток; это позволяет предположить, что IFN I типа не могут быть столь же разрушительными для эпителия легких, как IFN-λ.
Учитывая сложность интерфероновых реакций при инфекции SARS-CoV-2, углубление представлений об их влиянии на это заболевание обосновывает важность продолжения разработки препаратов, влияющих на интерфероновые пути. Необходимы дополнительные исследования, чтобы выяснить, имеют ли IFN-λ и IFN I типа сходные эффекты, или же один из них более полезен или вреден, чем другой. Следует точно установить, усиливаются ли реакции IFN I типа в легких пациентов с COVID-19 в противоположность подавлению ответов IFN I типа, наблюдаемому в их крови.
Необходимы дальнейшие исследования, чтобы определить, является ли подавление выработки IFN I типа у пациентов с COVID-19 в критическом состоянии следствием способности белков SARS-CoV-2 вмешиваться в сигнальный путь IFN. В пользу такой возможности говорят наблюдения Хаджаджа с соавт., показавших, что подавление экспрессии IFN I типа и сигнатуры ISG в периферической крови сочетаются с усиленной экспрессией генов, способствующих передаче сигналов IFN I типа, что свидетельствует о компенсаторном ответе на блокаду сигнального пути IFN. И наоборот: низкий уровень IFN I типа может быть следствием, а не причиной, генерализованной иммуносупрессии, вызванной высокими титрами вируса.
Хотя инфицирование мышей вирусом гриппа является экспериментальной моделью вирусной пневмонии, она не может точно воссоздавать цитопатические и провоспалительные эффекты SARS-CoV-2. Следовательно, необходимо использовать и другие экспериментальные модели для оценки патогенности интерферонов в легких при инфекции SARS-CoV-2, а также проверить возможность применения интерферонов или их блокады в качестве потенциальных вариантов терапии.
