Беременность и кардиоваскулярная патология

Аннотация
Сердечно-сосудистые заболевания осложняют 1–4 % случаев беременности — с более высокой распространенностью расстройств, связанных с гипертонией — и являются ведущей причиной материнской смертности. У женщин с уже выявленной сердечно-сосудистой патологией, такой как врожденный порок сердца, возможны своевременное врачебное консультирование и удовлетворительный результат. В то же время материнская смертность высока у женщин с приобретенными заболеваниями сердца, которые проявляются во время беременности (такими как острый коронарный синдром или диссекция аорты). Тревогу вызывает тот факт, что частота приобретенных сердечно-сосудистых заболеваний во время беременности растет по мере того, как пожилой возраст матери, ожирение, сахарный диабет и гипертония становятся все более распространенными среди популяции беременных. Ведение беременности у пациенток с сердечно-сосудистыми заболеваниями является сложной задачей из-за уникальной материнской физиологии, характеризующейся глубокими полиорганными изменениями. Присутствие плода усугубляет ситуацию, поскольку как само кардиометаболическое заболевание, так и его лечение могут отрицательно повлиять на состояние ребенка. Точно так же отказ от базового лечения из-за потенциального вреда для плода грозит плохим исходом как для матери, так и для ребенка. В этом обзоре авторы рассматривают, как физиологические адаптации во время беременности могут спровоцировать кардиометаболические осложнения или усугубить уже существующее заболевание и, наоборот, как кардиометаболическое заболевание может поставить под угрозу адаптацию организма к беременности и ее целевое назначение: развитие и рост плода.
Ключевые тезисы
- Сердечно-сосудистые заболевания осложняют 1–4 % случаев беременности — с более высокой распространенностью расстройств, связанных с гипертонией — и отвечают за 16 % материнской смертности, что делает сердечно-сосудистые заболевания ведущей причиной смерти беременных женщин в развитых странах.
- Пожилой возраст матери, ожирение, гипертония, курение и сахарный диабет — основные сердечно-сосудистые факторы риска, которые все чаще встречаются у беременных.
- Глубокие гемодинамические изменения, такие как увеличение сердечного выброса на 50 %, создают нагрузку на сердечно-сосудистую систему матери во время беременности и могут спровоцировать впервые выявленное заболевание или обострение уже существующего сердечно-сосудистого заболевания.
- При назначении лекарств следует учитывать изменения фармакокинетики при беременности, а также безопасность для плода; можно рекомендовать регулярный анализ сыворотки крови, поскольку концентрация препарата изменяется со временем.
- Во время беременности оправдана повышенная настороженность врача в отношении выявления кардиометаболической патологии.
Воздействие беременности на сердечно-сосудистую систему может способствовать выявлению ранее не диагностированных сердечно-сосудистых проблем и вызвать болезнь de novo. По оценкам, сердечно-сосудистые заболевания осложняют 1–4 % беременностей во всем мире; более всего распространена артериальная гипертензия, которая усугубляет 10 % беременностей и часто является впервые выявленным заболеванием [1,2]. В развивающихся странах распространенность сердечно-сосудистых заболеваний и уровень смертности среди беременных женщин мало описаны; исключение составляют лишь гипертонические расстройства, которые являются известной основной причиной материнской смертности [3]. В развитых странах сердечно-сосудистые заболевания встречаются нечасто, однако, несмотря на это, они являются ведущей причиной материнской смертности [4–6]. За последние 30 лет в развитых странах доля материнской смертности от сердечно-сосудистых заболеваний выросла с 3 до 15 %, и по прогнозам она будет расти и дальше [6]. Можно выделить несколько причин данной тенденции. Во-первых, в течение последних трех десятилетий неуклонно растет число беременностей у женщин в возрасте > 35 лет, поскольку все чаще женщины выбирают своим образом жизни позднее рождение ребенка [7]. Кроме того, границы детородного возраста были расширены посредством вспомогательных репродуктивных технологий [8]. Это увеличило долю возрастных беременных женщин с множеством приобретенных сопутствующих заболеваний и способствовало повышению показателей материнской заболеваемости, смертности и неблагоприятных акушерских исходов [9].
Во-вторых, увеличивается распространенность сердечно-сосудистых факторов риска, таких как хроническая артериальная гипертензия и сахарный диабет у беременных женщин [10,11], что в первую очередь обусловлено более широким распространением ожирения [12,13], а также является следствием увеличения возраста матери. Несмотря на то, что общие показатели курения снижаются, распространенность курения среди молодых женщин растет [14,15].
В-третьих, медицинские достижения и вспомогательные репродуктивные технологии предоставили возможность забеременеть женщинам с хроническими заболеваниями, которые до сих пор не могли иметь детей. Беременность у женщин с подобными заболеваниями, например, синдромом Тернера, также может оказывать негативное влияние на состояние сердечно-сосудистой системы [16,17]. Наконец, усовершенствование хирургических подходов и медикаментозной терапии для женщин с врожденными пороками сердца привело к тому, что все больше женщин с этими заболеваниями достигли детородного возраста и решили забеременеть. Многие из таких женщин имеют значительные остаточные проблемы, и, хотя успешные операции позволили им жить без каких-либо функциональных ограничений, гемодинамический стресс в ходе беременности может привести к возникновению сердечно-сосудистых осложнений [18]. В заключение следует отметить, что сердечно-сосудистые заболевания во время беременности становятся все более актуальной и важной темой для широкого круга медицинских работников, включая кардиологов, акушеров-гинекологов, анестезиологов, терапевтов, врачей общей практики и других специалистов. Ранняя диагностика и соответствующее лечение имеют важное значение для снижения материнской смертности, особенно при приобретенных сердечно-сосудистых заболеваниях.
Первая цель данного обзора — дать исчерпывающий отчет о физиологических изменениях, протекающих во время беременности, что составляет основу для понимания патологии осложнений. Вторая цель состоит в том, чтобы рассмотреть кардиоваскулярные и кардиометаболические патологии, которые могут присутствовать или стать приобретенными во время беременности. К таким кардиометаболическим заболеваниям относятся гипертоническая болезнь, гестационный сахарный диабет, тромбоэмболические нарушения, ишемическая болезнь сердца, (перипартальная) кардиомиопатия, эндокардит, заболевания аорты и аритмии. Авторы также обсуждают изменение фармакокинетики при беременности. Лечение уже существующих сердечно-сосудистых заболеваний или осложнений у плода в данном обзоре не обсуждается. Большинство имеющихся данных о сердечно-сосудистых заболеваниях во время беременности относятся к западным регионам, что затрудняет экстраполяцию этих знаний на все глобальное медицинское сообщество [3].
Физиология беременности
Беременность затрагивает практически все системы материнских органов. Понимание этих адаптаций имеет решающее значение для того, чтобы можно было отличить патологию от физиологического процесса, лучше предвидеть осложнения и разработать действительно индивидуальный подход. На рис. 1 проиллюстрированы наиболее важные сердечно-сосудистые изменения, которые происходят во время беременности.
Гемодинамика
Значительная адаптация материнской сердечно-сосудистой системы изначально создает способность поддерживать адекватную маточно-плацентарную перфузию в течение всей беременности. К 8-недельному гестационному возрасту системное сосудистое сопротивление матери уже снижается на 10–30 % и достигает низшей отметки между 20 и 26 неделями беременности [19–21]. Это снижение системного сосудистого сопротивления приводит к снижению среднего артериального давления [22], которое меняется с 26–28 недель, достигая значений, имевшихся до беременности, на сроках доношенной беременности [20,22]. Основные механизмы периферической вазодилатации включают повышенную комплаентность сосудов, снижение реакции на сосудосуживающие агенты, такие как ангиотензин II, и повышение уровня сосудосуживающих агентов, таких как оксид азота [23–26]. Снижение системного сосудистого сопротивления снижает постнагрузку и преднагрузку на сердце, что требует увеличения объема для компенсации. Снижение системного сосудистого сопротивления активирует ренин-ангиотензин-альдостероновую систему, вызывая задержку воды и натрия [23,24,26]. Общее объемное расширение, в основном проявляющееся увеличением объема плазмы (на 1100–1600 мл по сравнению с контрольными значениями), может достигать 45 % и пропорционально росту плода [24,27]. Соответственно, создается маточно-плацентарное кровообращение с низким сопротивлением, которое по мере постепенного снижения системного сосудистого сопротивления приводит к прогрессивному увеличению кровотока в плаценте, что соответствует растущим потребностям плода для роста и развития. Частота сердечных сокращений также повышается во время беременности, потому что низкая постнагрузка стимулирует барорецепторы в сердечно-легочной и почечной системах для активации симпатической нервной системы. Инициируется высвобождение катехоламинов, что повышает сократительную способность и частоту сердечных сокращений на 15–25 % в течение всей беременности [20,28]. Эти изменения способствуют увеличению ударного объема на 20–30 % [20].
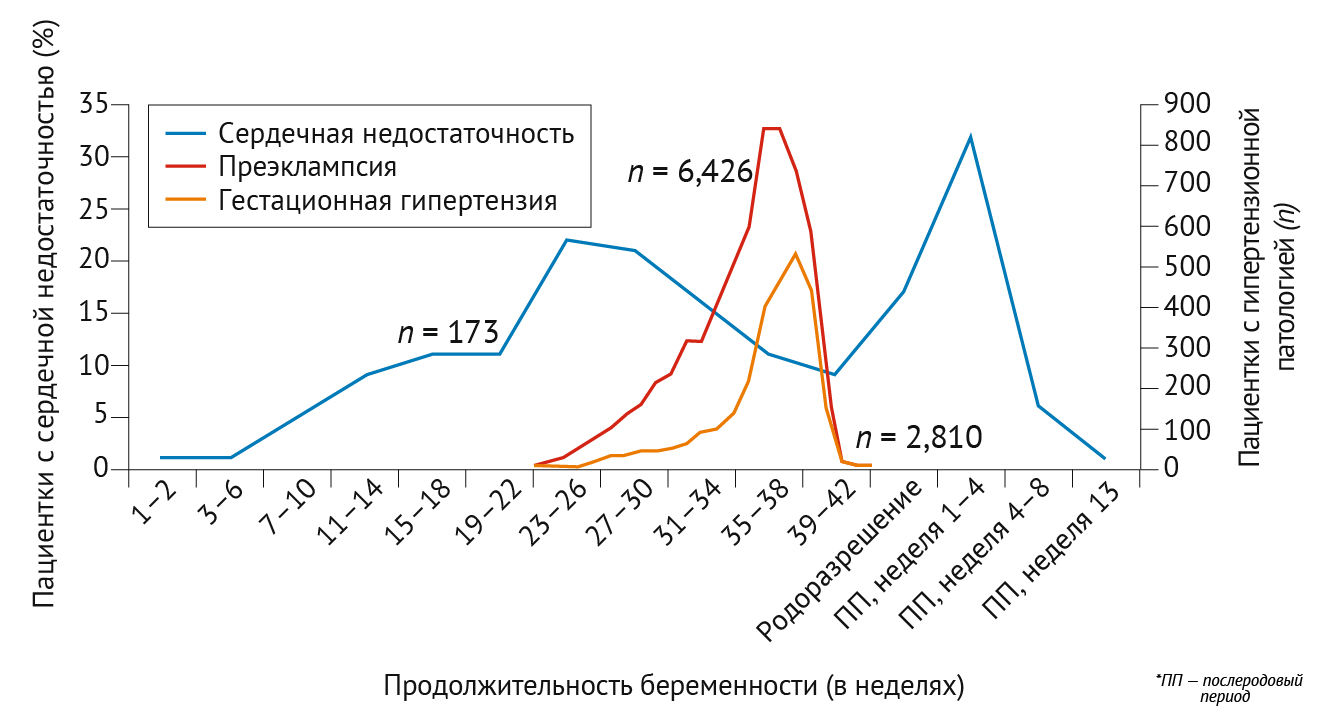
Сердечный выброс повышается как минимум на 30–50 % в первые два триместра беременности, но результаты в третьем триместре противоречивы [20,28–30]. В период 26–30 недель адаптация сердечного выброса, по-видимому, по большей части завершена; по данным некоторых исследований, сердечный выброс остается стабильным, другие группы ученых сообщают о его незначительном увеличении или уменьшении [20, 28–30]. Анатомически увеличение преднагрузки и сократительной способности миокарда проявляется в увеличении массы левого желудочка (24–34 %), увеличении относительной толщины стенки (10 %) и увеличении диаметра левого предсердия (14 %) по сравнению с небеременными женщинами [20,28,31]. В родах многие гемодинамические изменения достигают своего пика. Боль, стресс и физическая нагрузка приводят к повышению артериального давления, частоты сердечных сокращений и сердечного выброса [20,29,32]. Сокращения матки еще более усиливают этот эффект, поскольку при каждом сокращении 300–500 мл крови возвращается из маточно-плацентарного кровообращения в системный кровоток. Сразу после родов ударный объем и сердечный выброс повышаются в результате аутотрансфузии (теперь уже постоянной) из маточно-плацентарного кровообращения и снятия аортокавальной компрессии [20]. Предполагается, что характер этих физиологических изменений связан со сроками развития сердечно-сосудистых осложнений во время беременности (рис. 2). Анализ The Registry of Pregnancy and Cardiac Disease (Всемирного регистра беременностей у женщин с сердечно-сосудистыми заболеваниями) показал, что частота сердечной недостаточности впервые достигает пика при плато сердечного выброса в 26–30 недель [33]. Второй пик как сердечного выброса, так и частоты сердечной недостаточности наступает после родов, когда аутотрансфузия крови из маточно-плацентарного кровообращения создает состояние перегрузки. Определенные пики сердечной недостаточности контрастируют с постепенным увеличением частоты преэклампсии на протяжении всей беременности [34] (рис. 2).
Гематология
Беременность — это гиперкоагуляционное состояние, предназначенное для ограничения кровопотери во время родов. Концентрация всех факторов свертывания крови, за исключением XI и XIII, увеличивается на протяжении всей беременности на 50 % [35,36]. Фибринолиз ингибируется, и уровни антикоагулянтных агентов (таких как антитромбин III и протеин S) снижаются [35,36]. Это гиперкоагуляционное состояние предрасполагает беременную женщину к тромбоэмболическим осложнениям. Эритропоэз стимулируется плацентарными гормонами и повышенным потреблением кислорода почками в результате повышения скорости клубочковой фильтрации (СКФ) [37,38]. Однако количество эритроцитов увеличивается в меньшей степени, чем объем плазмы. Возникающая в результате физиологическая гемодилюция во время беременности в сочетании с дефицитом железа может прогрессировать до анемии [27]. Количество лейкоцитов также увеличивается в период беременности, особенно во время родов и в раннем послеродовом периоде. Важно отличать этот умеренный физиологический лейкоцитоз от наличия инфекции, развитие которой также возможно в этот же период. Количество тромбоцитов часто снижается, но обычно остается в пределах нормы [37].
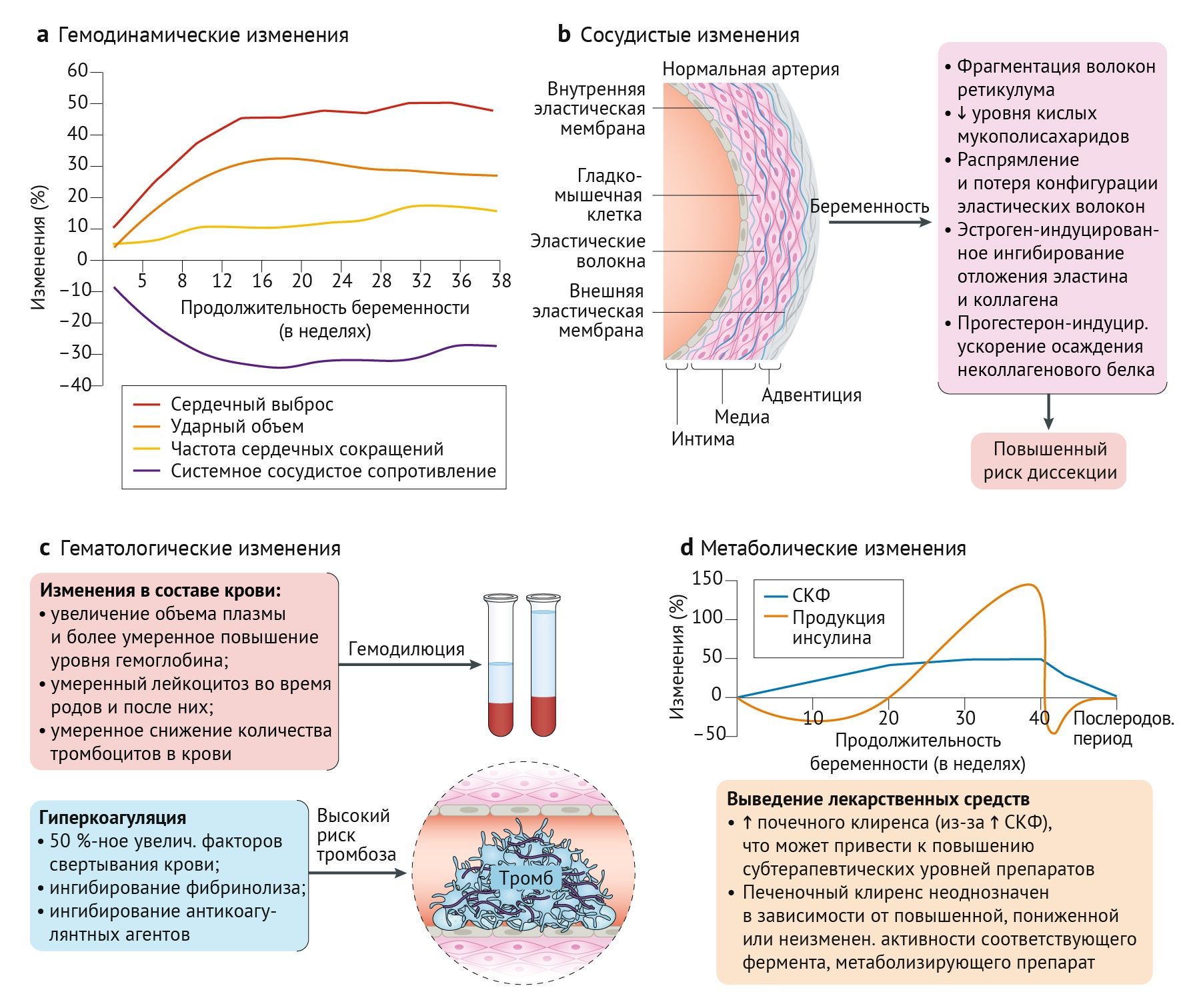
b| Сосудистые изменения. Вызванные беременностью изменения стенки аортального сосуда включают потерю складок эластических волокон, фрагментацию волокон ретикулума и снижение уровня кислых мукополисахаридов [101]. Кроме того, эстроген ингибирует отложение эластина и коллагена, а прогестерон ускоряет отложение неколлагеновых белков в стенке аорты [131], тем самым увеличивая риск диссекции аорты во время беременности.
c| Гематологические изменения. Беременность — это гиперкоагуляционное состояние, которое предрасполагает к развитию тромбоэмболических осложнений. Концентрация всех факторов свертывания крови повышается, за исключением XI и XIII, тогда как фибринолиз и сывороточный уровень антикоагулянтов снижаются. Количество эритроцитов увеличивается в меньшей степени, чем объем плазмы, что приводит к физиологической гемодилюции во время беременности.
d| Метаболические изменения. Плацентарные диабетогенные гормоны увеличивают материнскую выработку глюкозы и инсулинорезистентность для стимулирования роста плода, требуя прогрессивно более высокой выработки инсулина β-клетками поджелудочной железы. Когда β-клетки не могут удовлетворить эту потребность, возникает стойкая гипергликемия, и развивается гестационный сахарный диабет. Увеличение объема плазмы и сердечного выброса усиливает почечную перфузию, вызывая увеличение скорости клубочковой фильтрации (СКФ) и, соответственно, почечного клиренса. Печеночный клиренс зависит от изменений в метаболизирующем ферменте. На основе данных REFS [26,41].
Метаболизм
Метаболизм глюкозы адаптируется в ходе беременности для стимуляции роста плода и подготовки к лактации. Уровень глюкозы у матери натощак снижается на протяжении всей беременности из-за поглощения глюкозы плодом, более высокого периферического потребления и гемодилюции, вызванной увеличением объема [39]. Со второго триместра повышается выработка инсулина и снижается чувствительность к нему, опосредованная гормонами с диабетогенными эффектами, такими как плацентарный лактоген человека, кортизол, пролактин, гормон роста и прогестерон [39–41]. Экологические и генетические факторы вносят свой вклад в способность матери компенсировать повышенную инсулинорезистентность, а сбой компенсаторных механизмов приводит к развитию гестационного сахарного диабета.
Дыхательная система
Высокое потребление кислорода плодом, плацентой и маткой, повышенная выработка углекислого газа и стимулирующий эффект прогестерона в совокупности вызывают гипервентиляцию [42]. При измерении газов артериальной крови можно обнаружить физиологически компенсированный респираторный алкалоз [43]. Растущая матка поднимает диафрагму, что снижает функциональную остаточную емкость на 20–30 % на полном сроке беременности [43–45]. Частота дыхания изменяется минимально или вообще не изменяется, но дыхательный объем увеличивается из-за высоких концентраций прогестерона [42]. Это повышение дыхательного объема приводит к увеличению минутной вентиляции на 20–50 % [42,43].
Почечная система
Изменения объема плазмы и сердечного выброса усиливают почечную перфузию, вызывая повышение СКФ в первом триместре на 40–50 % [23,26]. Объем почек увеличивается на 30 %, а собирательная система расширяется, что предрасполагает беременную женщину к развитию пиелонефрита и гидронефроза [26,46,47]. Помимо задержки воды и натрия посредством активации ренин-ангиотензин-альдостероновой системы повышается протеинурия и экскреция альбумина [48].
Гестационные гипертензивные расстройства
Эпидемиология
Гипертензивные расстройства осложняют 10 % беременностей; наиболее часто встречаются хроническая гипертензия; гипертензия, индуцированная беременностью, (пре)эклампсия и HELLP-синдром (гемолиз, повышенный уровень печеночных ферментов и низкое количество тромбоцитов) [2,49,50]. На этот набор заболеваний приходится 10–16 % материнской смертности во всем мире [51,52]. Заболеваемость преэклампсией на Западе составляет 3,4 % [53], и, хотя смертность от преэклампсии в Великобритании за последнее десятилетие снизилась с 0,83 до 0,13 случаев на 100 тыс. родильниц, преэклампсия по-прежнему ассоциируется со значительной заболеваемостью как в краткосрочной, так и в долгосрочной перспективе [4,5]. По оценкам, гипертензивные расстройства являются причиной 10–15 % материнских смертей в Азии, 16–17 % — в Африке и 22 % — в Латинской Америке и странах Карибского бассейна [54].
Патофизиология
В основе патофизиологии гипертензивных нарушений при беременности лежит сложное взаимодействие материнских и фетальных факторов, которое до конца еще не изучено. Нарушения могут проявляться уже в первые недели беременности, когда аномальная плацентация (I стадия) провоцирует системную эндотелиальную дисфункцию (II стадия). Несмотря на это изменение, симптомы обычно не проявляются до второго или третьего триместров беременности [34,49]. На рис. 3 представлена предложенная многофакторная модель патогенеза преэклампсии. В первые недели нормальной имплантации трофобласты из концептуса реконструируют спиральные артерии матки, создавая низкое сосудистое сопротивление [55]. При преэклампсии этот процесс неоптимален, что приводит к резистентному маточно-плацентарному кровообращению и в итоге к плацентарной ишемии [56]. В результате плацентарной гипоперфузии происходит высвобождение растворимой fms-подобной тирозинкиназы 1 (sFLT1; также известной как растворимый VEGFR1) и растворимого эндоглобина (sENG) клетками плацентарного трофобласта, которые нарушают функцию материнского сосудистого эндотелиального фактора роста, плацентарного фактора роста и трансформирующего фактора роста β, что приводит к системной эндотелиальной дисфункции, гипертонии и почечной недостаточности [57–59]. Типичные симптомы преэклампсии включают головные боли, нарушения зрения, тошноту и/или рвоту, боль в эпигастрии или правом подреберье и периферические отеки, хотя наличие этих симптомов не является необходимым для диагностики [60,61]. Ранняя и поздняя преэклампсия имеют патофизиологические различия, выражающиеся в контрастных гемодинамических состояниях: ранняя преэклампсия связана с меньшим увеличением сердечного выброса, тогда как большее увеличение сердечного выброса может наблюдаться при поздней преэклампсии [62]. Это различие может быть связано с более тяжелой плацентарной дисфункцией при ранней преэклампсии, приводящей к неспособности индуцировать физиологическое снижение системного сосудистого сопротивления.
Диагностика и оценка рисков
Факторами риска гестационных гипертензивных расстройств являются бесплодие, многоплодная беременность, преэклампсия при предыдущих беременностях, хроническая артериальная гипертензия, сахарный диабет, ожирение, возраст матери > 35 лет и ряд хронических системных заболеваний [61]. Гестационная гипертензия определяется как артериальная гипертензия (систолическое/диастолическое артериальное давление > 140/90 мм рт. ст.), возникающая de novo после 20 недель гестационного возраста [61]. Для преэклампсии общепринятое требование наличия как артериальной гипертензии, так и протеинурии (> 30 мг/ммоль) было заменено более комплексными критериями. Преэклампсия в настоящее время определяется как сочетание артериальной гипертензии и протеинурии и/или ограничения роста плода и/или биохимических или гематологических нарушений [63]. Эти аномалии могут привести к развитию HELLP-синдрома у 25 % пациенток с преэклампсией [63]. У 2 % их них преэклампсия прогрессирует до эклампсии — неотложной акушерской ситуации, характеризующейся тонико-клоническими судорогами [64].
Ведение пациенток
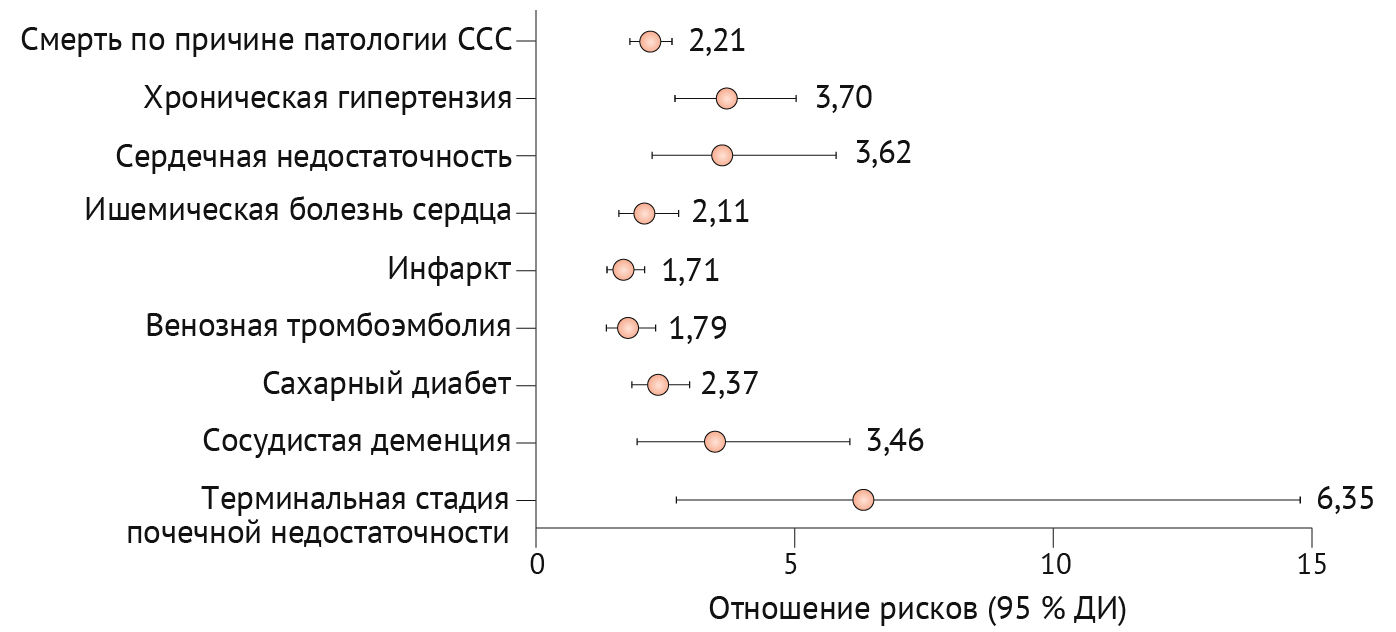
Низкодозная аспириновая профилактика рекомендуется женщинам с высоким риском преэклампсии и должна быть начата до 16 недель (а возможно, и до 12) и продолжена ежедневно до 36–37 недель беременности [63,65–67]. Рекомендуемая суточная доза варьирует в зависимости от региона, при этом Тhe American College of Obstetricians and Gynaecologists рекомендуют 81 мг, а Тhe European Society of Cardiology (ESC) — 100–150 мг [1,61]; но проведенный метаанализ показывает, что дозы ≥ 100 мг более эффективны [66]. При лечении артериальной гипертензии следует стремиться к целевому диастолическому артериальному давлению 85 мм рт. ст. (и систолическому артериальному давлению 110–140 мм рт. ст.) с предпочтительным использованием следующих антигипертензивных препаратов: пероральной метилдопы, блокаторов кальциевых каналов (например, нифедипина) или β-блокаторов (например, лабеталола) [63,68]. Выраженную артериальную гипертензию (≥ 160/110 мм рт. ст.) следует в кратчайшие сроки лечить в условиях стационара нифедипином, внутривенным лабеталолом или внутривенным гидралазином в комбинации с сульфатом магния для нейропротекции [63,64]. Индукция родов показана в 37-недельном гестационном возрасте или раньше в зависимости от тяжести заболевания; при этом нужно учитывать тот факт, что роды считаются единственным средством устранения гестационных гипертензивных расстройств [69]. Тем не менее, послеродовая (пре)эклампсия может возникать до шести недель после родов [70]. У женщин, перенесших гестационные гипертензивные расстройства, в будущем повышается риск развития сердечно-сосудистых заболеваний, вероятно, вследствие наличия у данных состояний общих факторов риска и путей развития (рис. 4) [71]. Таким пациенткам рекомендуется ежегодное наблюдение для оценки артериального давления и кардиометаболического статуса [63].
Гестационный сахарный диабет
Эпидемиология
Гестационный сахарный диабет является наиболее частым метаболическим заболеванием при беременности с общей распространенностью 6–13 % [72]. Велика географическая вариабельность из-за влияния генетических и экологических факторов, причем наибольшая распространенность наблюдается на Ближнем Востоке и в Северной Африке, а наименьшая — в Европе [72]. Сопутствующие неблагоприятные материнские исходы включают преэклампсию, кесарево сечение и послеродовое кровотечение. Неблагоприятные исходы для плода включают макросомию (большой вес плода при рождении) и, следовательно, акушерские осложнения, такие как дистоция плеча и недоношенность, а также повышенный риск мертворождения [73,74]. Отсроченными последствиями для ребенка являются нарушение метаболизма глюкозы, последующее ожирение и проблемы в нервно-психическом развитии (нарушение умственных и психомоторных функций) [75–78].
Патофизиология
Плацентарные гормоны увеличивают материнскую выработку глюкозы и инсулинорезистентность, требуя все более высокой выработки инсулина β-клетками поджелудочной железы. Когда последние не могут удовлетворить эту потребность, может развиться стойкое гипергликемическое состояние [39,40]. Генетические и экологические факторы также играют важную роль в развитии гестационного сахарного диабета [79,80]. Женщины, у которых в итоге развивается гестационный сахарный диабет, имеют более низкую чувствительность к инсулину еще до беременности. Это наблюдение позволяет предположить, что беременность является своеобразным стресс-тестом для выявления субклинической метаболической дисфункции [81].
Диагностика и оценка рисков
Факторами риска развития гестационного сахарного диабета являются возраст матери > 25 лет, ожирение, гестационный сахарный диабет или макросомия при предыдущей беременности, особенности питания и образа жизни, а также этническая принадлежность [79,80,82]. Международные рекомендации расходятся во мнениях относительно того, следует ли проводить универсальный скрининг (как в американских рекомендациях) или выборочный скрининг (как в британских рекомендациях) у женщин с факторами риска [83,84]. Скрининг оптимально проводить между 24 и 28 неделями гестационного возраста посредством перорального теста на толерантность к глюкозе (ГТТ). Диагноз гестационного сахарного диабета подтверждается при уровне глюкозы в плазме крови > 5,6 ммоль/л натощак или > 7,8 ммоль/л через 2 ч после перорального приема 75 г глюкозы [85].
Ведение пациенток
Лечение гестационного сахарного диабета включает контроль уровня глюкозы в крови матери и рекомендации по питанию; медикаментозная терапия вводится, когда для контроля уровня глюкозы одной диеты становится недостаточно. Терапия инсулином предпочтительнее, в качестве альтернативных менее желательных вариантов выступают метформин и глибурид, поскольку они оба проходят через плаценту и менее эффективны для материнского гликемического контроля [83]. Лечение гестационного сахарного диабета способствует снижению веса плода при рождении и уменьшению частоты серьезных перинатальных осложнений, таких как смерть плода, дистоция плеча, перелом костей и паралич нервов [86]. Хотя нормальный метаболизм глюкозы у матери восстанавливается после родов, у женщин с гестационным сахарным диабетом пожизненно сохраняется риск развития сахарного диабета второго типа; он по меньшей мере в семь раз выше, чем у женщин с нормогликемической беременностью [77]. Также у женщин с гестационным сахарным диабетом повышаются риски развития метаболического синдрома и сердечно-сосудистых заболеваний [87]. После родов толерантность к глюкозе у всех женщин с гестационным сахарным диабетом должна быть повторно оценена с помощью ГТТ с приемом 75 г глюкозы через 4–12 недель после родов и каждые два года у пациенток с нормальным уровнем глюкозы [83].
Тромбоэмболическая патология
Эпидемиология
Венозная тромбоэмболия (ВТЭ) осложняет 0,5–2,0 случая на 1000 беременностей и вызывает 1,1 случая смерти на 100 тыс. беременностей [88–90]. ВТЭ включает в себя тромбоз глубоких вен, тромбоэмболию легочной артерии и церебральный венозный тромбоз. Послеродовая заболеваемость ВТЭ составляет до 5 на 1000 беременностей [90]. Тромбоз глубоких вен встречается в три раза чаще, чем тромбоэмболия легочной артерии [89,90]. ВТЭ вызывает 3 % материнских смертей в развивающихся странах, тогда как в развитых странах эта доля оценивается в 14 % [54].
Патофизиология
Беременность — это гиперкоагуляционное состояние, характеризующееся повышением уровня факторов свертывания крови и снижением содержания антикоагулянтных и фибринолитических агентов [35,36]. Кроме того, скорость венозного потока снижается из-за физиологической вазодилатации и компрессии полой вены беременной маткой [91]. У женщин во время беременности риск ВТЭ повышается в пять раз по сравнению с небеременными женщинами [90,92]. Этот эффект достигает максимума в послеродовом периоде и может усугубляться сопутствующими заболеваниями, периодами иммобилизации и медицинскими вмешательствами, такими как кесарево сечение.
Диагностика и оценка рисков
Факторами риска ВТЭ, связанными с беременностью, являются гестационный сахарный диабет, многоплодная беременность, невынашивание беременности, кесарево сечение и преэклампсия [88,89]. Вспомогательные репродуктивные технологии становятся все более актуальным фактором риска, поскольку женщины с синдромом гиперстимуляции яичников имеют в 100 раз больший риск ВТЭ по сравнению с общей популяцией [93]. Общие факторы риска ВТЭ включают предшествующую ВТЭ, ожирение, курение и тромбофилию (например, мутацию фактора V Лейдена и дефицит протеина S, протеина С и антитромбина) [88]. Измерения уровней димеров не должны использоваться при оценке тромбоэмболических осложнений во время беременности из-за их индивидуальной биологической вариабельности [94].
Ведение пациенток
Пациенткам с риском ВТЭ необходимы адекватные профилактические мероприятия [95]. Пероральные антикоагулянты, не являющиеся антагонистами витамина К, проникают через плаценту и оказывают тератогенное действие, поэтому их применение не рекомендовано, особенно в первом триместре беременности [1]. Низкомолекулярный гепарин не проникает через плаценту и является препаратом выбора для профилактики или лечения пациенток с ВТЭ [96]. При лечении острой ВТЭ во время беременности стартовая доза должна основываться на начальной массе тела беременной, а затем корректироваться путем измерения пиковой и минимальной активности против фактора Ха [97].

b| Стадия II: окислительный стресс вызывает высвобождение плацентарных антиангиогенных факторов растворимой fms-подобной тирозинкиназы 1 (sFLT1) и растворимого эндоглобина (sENG), которые ингибируют плацентарный фактор роста (PlGF) и сосудистый эндотелиальный фактор роста (VEGF) в материнском кровотоке. Эти изменения приводят к системной эндотелиальной дисфункции как в плацентарном, так и в материнском кровообращении. Симптомы со стороны матери обусловлены повреждением эндотелия, высвобождением воспалительных цитокинов, таких как IL-6 и фактор некроза опухоли (ФНО), образованием микротромбов, повышением проницаемости капилляров и периферической вазоконстрикцией. На более темном розовом фоне показаны симптомы HELLP-синдрома (гемолиз, повышенное содержание печеночных ферментов и низкое количество тромбоцитов). Осложнения со стороны плода возникают в результате аномальной плацентации или материнской болезни [55–59].
Острый коронарный синдром
Эпидемиология
Острый коронарный синдром (ОКС) является основной причиной материнской смертности в развитых странах; на его долю приходится 20 % сердечно-сосудистых смертей [5]. Эта заболеваемость составляет 6 случаев на 100 тыс. родов и по прогнозам будет продолжать расти, что отражает растущую распространенность сердечно-сосудистых факторов риска среди беременных женщин. Летальность среди беременных составляет 5 % [98]. Аналогичные данные из развивающихся стран отсутствуют.
Патофизиология
По сравнению с общей популяцией, атеросклероз не является самой значимой причиной ОКС у беременных женщин. Спонтанная диссекция коронарных артерий является наиболее частой причиной ОКС (43 %), тогда как атеросклероз составляет 27 % [99]. К другим патологическим механизмам ОКС при беременности относятся тромбообразование (17 %) и спазмы (2 %) [99]. Нормальная коронарная анатомия встречается у 18 % женщин с ОКС во время беременности [99]. Высокая частота спонтанной диссекции коронарных артерий может быть вызвана индуцированными беременностью изменениями структуры сосудов, а также увеличением гемодинамической нагрузки на поздних сроках беременности (рис. 1) [100,101]. ОКС чаще всего наступает в послеродовом периоде, вторая по частоте встречаемость наблюдается в третьем триместре. Левая передняя нисходящая коронарная артерия или левый основной сегмент являются наиболее часто поражаемыми сосудами, при этом преобладают мультисосудистые поражения [99].
Диагностика и оценка рисков
Факторами риска развития ОКС при беременности являются ожирение, возраст > 35 лет, курение, сахарный диабет, хроническая артериальная гипертензия и семейный анамнез ОКС [5,98,99], однако эти факторы риска в первую очередь связаны с атеросклерозом и могут отсутствовать при таких состояниях, как спонтанная диссекция коронарных артерий [99]. Последняя может быть связана с фибромышечной дисплазией или генетически опосредованной васкулопатией [102,103]. ОКС у беременных женщин может проявляться атипичными симптомами. Все жалобы на боль в груди, а также боль в шее, животе, руках или одышку при физической нагрузке следует принимать всерьез и своевременно оценивать с помощью электрокардиограммы (ЭКГ) и лабораторных тестов на тропонины. Однократная рутинная ЭКГ, выполненная во время эпизода боли в груди, не дает ценной диагностической информации, но при сохранении подозрения на ОКС рекомендовано проведение мониторирования ЭКГ [5].
Ведение пациенток
При проведении инвазивной диагностики или лечения необходимо учитывать повышенную частоту ятрогенной коронарной диссекции у беременных [99]. При инфаркте миокарда с подъемом сегмента ST (STEMI) самым предпочтительным методом лечения в третьем триместре беременности является первичное чрескожное коронарное вмешательство с голыми металлическими стентами. Их использование требует двойной антитромботической терапии (DAPT) в течение месяца, что позволяет своевременно прервать ее при наступлении родов для предотвращения осложнений в виде кровотечения. В течение первых двух триместров также возможно использование стентов нового поколения, элюирующих лекарственные средства, несмотря на недостаточный опыт их применения во время беременности и то, что использование этих стентов требует ≥ 3 месяцев DAPT [104]. Слепое применение тромболитического лечения не рекомендуется, поскольку довольно большое количество женщин имеет нормальную коронарную анатомию или предрасположены к спонтанной диссекции коронарных артерий [99]. В условиях низкого риска инфаркта миокарда без подъема сегмента ST может быть рассмотрена неинвазивная терапия. При выборе фармакологического лечения необходимо учитывать безопасность для плода, что затрудняется отсутствием доказательной базы для многих лекарственных препаратов. Применение ингибиторов ангиотензин-превращающего фермента (АПФ) и статинов противопоказано при беременности, хотя за последние два десятилетия появились данные о том, что статины могут быть безопасны [105–108]. Применение антиагрегантов, таких как клопидогрел, во время беременности изучено недостаточно хорошо, и, хотя эти препараты кажутся безопасными, их применение должно быть ограничено. Антиагрегантную терапию низкими дозами аспирина во время беременности считают безопасной [1]. Последующее наблюдение пациенток после спонтанной диссекции коронарных артерий должно включать визуализацию всего сосудистого русла от головного мозга до малого таза по крайней мере один раз с использованием КТ-ангиографии или магнитно-резонансной ангиографии для выявления фибромышечной дисплазии и других некоронарных артериальных аномалий [103].
Кардиомиопатии
Эпидемиология
Частота кардиомиопатий, впервые возникающих во время беременности, в целом изучена недостаточно, за исключением перипартальной кардиомиопатии, которую считают своеобразной особенностью беременности. Частота этой кардиомиопатии сильно варьирует между странами (от 1 на 100 беременностей в Нигерии до 1 на 10 тыс. в Дании), поскольку этническая принадлежность является важным фактором риска [109,110]. Глобальная смертность от перипартальной кардиомиопатии составляет 2,4 % [111]. В общенациональном исследовании 2014 года в США частота перипартальной кардиомиопатии составила 10,3 на 10 тыс. живорожденных, а материнская смертность — 1,3 %, при этом частота кардиогенного шока в результате сердечной недостаточности составила 2,6 %, а частота остановки сердца — 2,1 % [112].
Патофизиология
Во время беременности может проявиться ранее бессимптомная кардиомиопатия, которая может быть как врожденной, так и приобретенной. Увеличение сердечного выброса и объема крови во время беременности, которые и делают ее своеобразным «стресс-тестом» для сердечно-сосудистой системы, может спровоцировать появление симптомов, в частности, дилатационной кардиомиопатии [1,30]. Перипартальная кардиомиопатия диагностируется методом исключения, когда не удается выявить никакой другой причины сердечной недостаточности [113]. Предполагаемым патофизиологическим путем ее развития является провоспалительное состояние, при котором окислительный стресс запускает путь метаболизма пролактина до антиангиогенной формы, вызывающей повреждение миокарда и сосудов [114]. Перипартальная кардиомиопатия обычно приводит к сердечной недостаточности с нарушением фракции выброса левого желудочка (ФВЛЖ), наиболее часто встречающейся на поздних сроках беременности или в послеродовом периоде [111,115]. Возникающая в результате этого левожелудочковая недостаточность может быть постоянной и иметь высокий риск рецидива при следующей беременности [113].
Диагностика и оценка рисков
Симптомами, связанными с развитием сердечной недостаточности, зачастую пренебрегают, так как это может быть частью нормальной физиологической адаптации к беременности. При подозрении на сердечную недостаточность диагностическое обследование должно включать ЭКГ, измерение уровня натрийуретических пептидов, эхокардиографию и рентгенографию грудной клетки. В зависимости от клинической картины, ценную дополнительную информацию могут предоставить такие методы, как КТ, коронарная ангиография или МРТ сердца, если таковые доступны [115]. Перипартальная кардиомиопатия имеет специфические факторы риска, включая африканское происхождение, многоплодную беременность, многодетность, пожилой возраст, диабет, курение и преэклампсию [115]. Следует помнить о том, что перипартальная кардиомиопатия — это диагноз исключения, поэтому сначала следует исследовать пациента на наличие других возможных заболеваний [113].
Ведение пациенток
Стандартная терапия сердечной недостаточности должна быть адаптирована таким образом, чтобы по возможности избегать применения препаратов, оказывающих токсическое воздействие на плод, в первую очередь, ингибиторов АПФ и блокаторов рецепторов ангиотензина II [1]. Руководящие принципы ESC рекомендуют не проводить рано имплантацию кардиостимуляторов, что дает время для улучшения состояния с помощью медикаментозного лечения [1]. У пациенток с перипартальной кардиомиопатией многообещающие результаты показывает блокада пролактина с помощью бромокриптина (в дополнение к стандартному лечению сердечной недостаточности). Было выяснено, что терапия бромокриптином снижает заболеваемость и смертность у пациенток с перипартальной кардиомиопатией и повышает вероятность полного восстановления левого желудочка [116,117], хотя первое плацебо-контролируемое исследование для оценки эффективности данного метода терапии все еще продолжается [118]. Перипартальная кардиомиопатия встречается редко, но чревата серьезными последствиями. Через месяц после постановки диагноза 87 % пациенток все еще находятся в состоянии клинической сердечной недостаточности, у 7 % случаются различные эмболии и 4 % нуждаются в имплантации устройства [111]. Крайне важную роль играет своевременное и многопрофильное консультирование до зачатия, учитывая, что стойкая дисфункция левого желудочка (с ФВЛЖ < 50–55 %) является противопоказанием для последующих беременностей [1].
Эндокардиты
Эпидемиология
Частота возникновения эндокардита во время беременности изучена недостаточно хорошо. В основном сообщается о случаях заболевания женщин с врожденными пороками сердца (общая заболеваемость составляет 0,1 %) или протезированными сердечными клапанами (0,3–1,2 %) [119]. Тем не менее, материнская летальность от эндокардита очень высока (11–33 %) [120–123].
Патофизиология
Нет данных, указывающих на другую этиологию эндокардита, кроме инфекционной, во время беременности. Тяжесть заболевания в случае некоторых патогенов повышается у беременных женщин по сравнению с общей популяцией за счет иммунологических изменений, индуцированных гормонами беременности, однако нет убедительных доказательств того, что восприимчивость к инфекции повышается у беременных женщин по сравнению с общей популяцией [124].
Диагностика и оценка рисков
Среди беременных женщин к группе высокого риска развития эндокардита относятся лица, употребляющие наркотики внутривенно, пациентки с врожденными или ревматическими заболеваниями сердца, а также лица с сердечными протезами [121]. Протезирование клапанов сердца особенно связано с отдаленным риском развития эндокардита [119]. Протезы, не содержащие клапанов, ассоциируются с повышенным риском развития эндокардита только в первые шесть месяцев после имплантации до завершения их эндотелизации [125]. В отношении беременных женщин проводится такая же диагностическая работа, как и для общей популяции, при этом существенная роль отводится проведению посевов крови, эхокардиографии и дополнительной расширенной визуализации [119].
Ведение пациенток
Современные руководства не рекомендуют проводить профилактику ни для вагинальных родов, ни для кесарева сечения даже в группах высокого риска развития эндокардита [1,119], однако доказательная база по этому вопросу еще недостаточно большая; кроме того, высокая материнская летальность от эндокардита может оправдать проведение профилактики у отдельных пациенток. Антибактериальная терапия должна основываться на результатах культуральных тестов и исследований чувствительности бактерий к антибиотикам, а также на безопасности для плода. Учитывая высокую материнскую смертность и потенциально повышенную тяжесть течения инфекции у беременных женщин, эти пациентки должны наблюдаться многопрофильной группой специалистов в соответствующем лечебном учреждении [119,124].
Патология аорты
Эпидемиология
Диссекция аорты встречается лишь в 0,40–0,55 случаях на 100 тыс. беременностей, и, тем не менее, является основной причиной материнской сердечно-сосудистой смертности в развитых странах из-за крайне низкой вероятности выживания (догоспитальная смертность составляет 53 %, а летальность — 60 %) [5,126,127]. У беременных женщин преимущественно поражается восходящая аорта, на долю которой приходится 79 % диссекций [128]. Эпидемиологические данные из стран, расположенных не на западе, пока достаточно скудны.
Патофизиология
Размеры и податливость аорты в норме увеличиваются при беременности, причем с увеличением паритета эти процессы становится все более выраженными [129,130]. В стенке аорты беременных женщин наблюдаются потеря складок эластических волокон, фрагментация волокон ретикулума и снижение уровня кислых мукополисахаридов [101]. Эстроген ингибирует отложение эластина и коллагена, а прогестерон ускоряет отложение неколлагеновых белков в стенке аорты [131]. Сочетание изменений функции и структуры сосудов с повышенным гемодинамическим стрессом повышает риск диссекции аорты у беременных (рис.1) [100,101]. Диссекция чаще всего происходит в послеродовом периоде или ближе к родам, когда сердечный выброс и объем крови достигают пиковых значений [28,29,32].
Диагностика и оценка рисков
Факторами риска диссекции аорты являются пожилой возраст, артериальная гипертензия, преэклампсия и, что самое главное, нарушения соединительной ткани (отношение шансов [ОШ] 4,960) [132]. К таким наследственным соединительнотканным нарушениям относятся синдром Марфана, синдром Лойса-Дитца, синдром Тернера, сосудистый синдром Элерса-Данлоса и другие формы наследственной болезни грудной аорты [127,132]. Другим фактором риска диссекции аорты является наличие врожденных пороков сердца, таких как двустворчатый аортальный клапан или коарктация аорты [127]. В 71 % случаев материнской смертности, вызванной диссекцией аорты, отмечается отсутствие адекватного обследования при боли в груди [5]. Возможность диссекции аорты всегда следует учитывать, когда пациентка испытывает острую боль в груди или спине, требующую опиоидной анальгезии, или когда пациентка находится в шоковом состоянии. Впоследствии визуализацию аорты следует проводить с использованием КТ, МРТ или эхокардиографии (возможно, чреспищеводной).
Ведение пациенток
Для женщин с высоким риском диссекции аорты ее визуализация в идеале должна проводиться до беременности с последующим хирургическим вмешательством, если это необходимо. Диаметр аорты следует регулярно контролировать в течение беременности с помощью УЗИ и/или МРТ. При прогрессирующем расширении аорты хирургическое лечение может проводиться с плодом внутриутробно (если плод нежизнеспособен) или сразу после кесарева сечения (если плод жизнеспособен) [133]. В некоторых случаях (например, неосложненная диссекция аорты типа В) может быть рассмотрена консервативная тактика, включающая строгий контроль артериального давления с терапией β-блокаторами [134]. Пациенткам с острыми диссекциями аорты типа А необходимо срочное хирургическое вмешательство с одновременным кесаревым сечением, если плод жизнеспособен. Угрожающая дилатация аорты (> 45 мм при синдроме Марфана и > 50 мм при других факторах риска) является одним из немногих показаний со стороны сердца к родоразрешению кесаревым сечением [1].
Аритмии
Эпидемиология
Аритмии осложняют 67 на 100 тыс. беременностей [135]. Наиболее частыми аритмиями являются фибрилляция предсердий (27 на 100 тыс. беременностей) и наджелудочковая тахикардия (22 на 100 тыс. беременностей) [135]. Суправентрикулярная тахикардия является наиболее частой симптоматической аритмией при беременности и чаще всего возникает на поздних сроках [136,137]. Несмотря на то, что большинство аритмий, связанных с беременностью, являются доброкачественными, они ассоциированы с высокой материнской смертностью (ОШ 13 при фибрилляции предсердий и ОШ 6 при суправентрикулярной тахикардии) [135]. Желудочковые аритмии редко встречаются во время беременности и чаще всего бывают у женщин с уже существующими сердечно-сосудистыми заболеваниями [138].
Патофизиология
Некоторые изменения анатомии женского организма при беременности могут вызвать новый эпизод аритмии или спровоцировать рецидив ранее существовавших нарушений ритма сердца. Повышенные внутрисосудистые объемные нагрузки создают более высокую нагрузку на предсердия и индуцируют растяжение всех камер сердца. Другими сопутствующими сердечно-сосудистыми факторами риска являются физиологическая тахикардия и повышенная сократительная способность сердца, возникающие при беременности [28,139]. Также предрасполагать беременных женщин к дальнейшему развитию аритмии могут изменения чувствительности к катехоламинам, повышенная симпатическая активность и гормональные изменения [136,139]. Во время беременности частота эктопических сокращений увеличивается, и часто встречаются жалобы на сердцебиение [136].
Диагностика и оценка рисков
Анатомические аномалии сердца и хирургические рубцы повышают риск развития аритмии у женщин с врожденными пороками сердца [140]. Другими факторами риска развития аритмий являются пожилой возраст и африканское происхождение [135]. При подозрении на аритмию следует проводить ЭКГ и холтеровское мониторирование, как и у небеременных.
Ведение пациенток
Все доступные антиаритмические препараты проникают через плаценту, хотя подробные данные о токсическом воздействии на плод для большинства препаратов ограничены. Учитывая доброкачественный и нестойкий характер большинства аритмий, связанных с беременностью, медикаментозной терапии в этот период можно избежать или, по крайней мере, ее можно отложить на время первого триместра. Антиаритмическая терапия показана женщинам с устойчивой наджелудочковой тахикардией и нарушением гемодинамики [1]. Прокаинамид, аденозин, дигоксин и β-блокаторы считаются безопасными лекарственными препаратами, хотя и с потенциальными побочными эффектами (такими как ограничение роста плода при терапии β-блокаторами) [137,141,142]. Иногда пациенткам требуется электрическая кардиоверсия, имплантация кардиостимулятора или катетерная абляция, которые не должны быть отложены только по причине беременности [143,144].
Медикаментозное лечение во время беременности
Более 90 % беременных женщин принимают в этот период по крайней мере одно лекарство, включая средства, отпускаемые по рецепту или без него, а также растительные препараты. Среднее количество лекарств, используемых во время беременности, со временем растет, и 50 % женщин в общей популяции принимают более четырех различных препаратов [145]. Изменяющиеся характеристики беременной популяции, такие как увеличение возраста матери и количества сопутствующих заболеваний, означают, что эта тенденция к росту, вероятнее всего, будет сохраняться [9–11].
Влияние лекарственных средств на будущего ребенка является важной проблемой. Клинические испытания у беременных женщин проводятся редко из этических соображений, что приводит к недостаточному количеству доказательств токсического воздействия определенных лекарств на эмбрион и плод. Для некоторых лекарств тератогенность или другие вредные эффекты очевидны, в отношении же других лекарств имеющегося опыта недостаточно. Этот дефицит данных может вызвать опасения у врачей при назначении лекарств беременным женщинам; это означает, что лекарства могут быть ненадлежащим образом исключены из применения, прекращены или уменьшены в дозе. Фармакокинетика (всасывание, распределение, метаболизм и выведение лекарственных средств) во время беременности изменяется неодинаково и иногда сильно разнится у пациенток. На всасывание препарата могут влиять снижение моторики желудочно-кишечного тракта, повышение рН желудка, а также тошнота и рвота (как правило, в первом триместре) [146]. Распределение препарата меняется за счет увеличения объема плазмы, сдвигов в составе воды и жира в организме и снижения уровня связывающих препараты белков, таких как альбумин [24,147]. Важно отметить, что для средств, которые в основном связываются с белками, уровни свободных (биоактивных) лекарств могут превышаться, несмотря на более низкий уровень в системе циркуляции. Метаболизм препаратов посредством печеночных ферментов зависит от влияния беременности на активность каждого из них, которая может значительно варьировать [148]. Выведение препарата может быть ускорено из-за прогрессирующего увеличения сердечного выброса во время беременности, что приводит к высокой СКФ и увеличению печеночного кровотока [26,28,29,149].
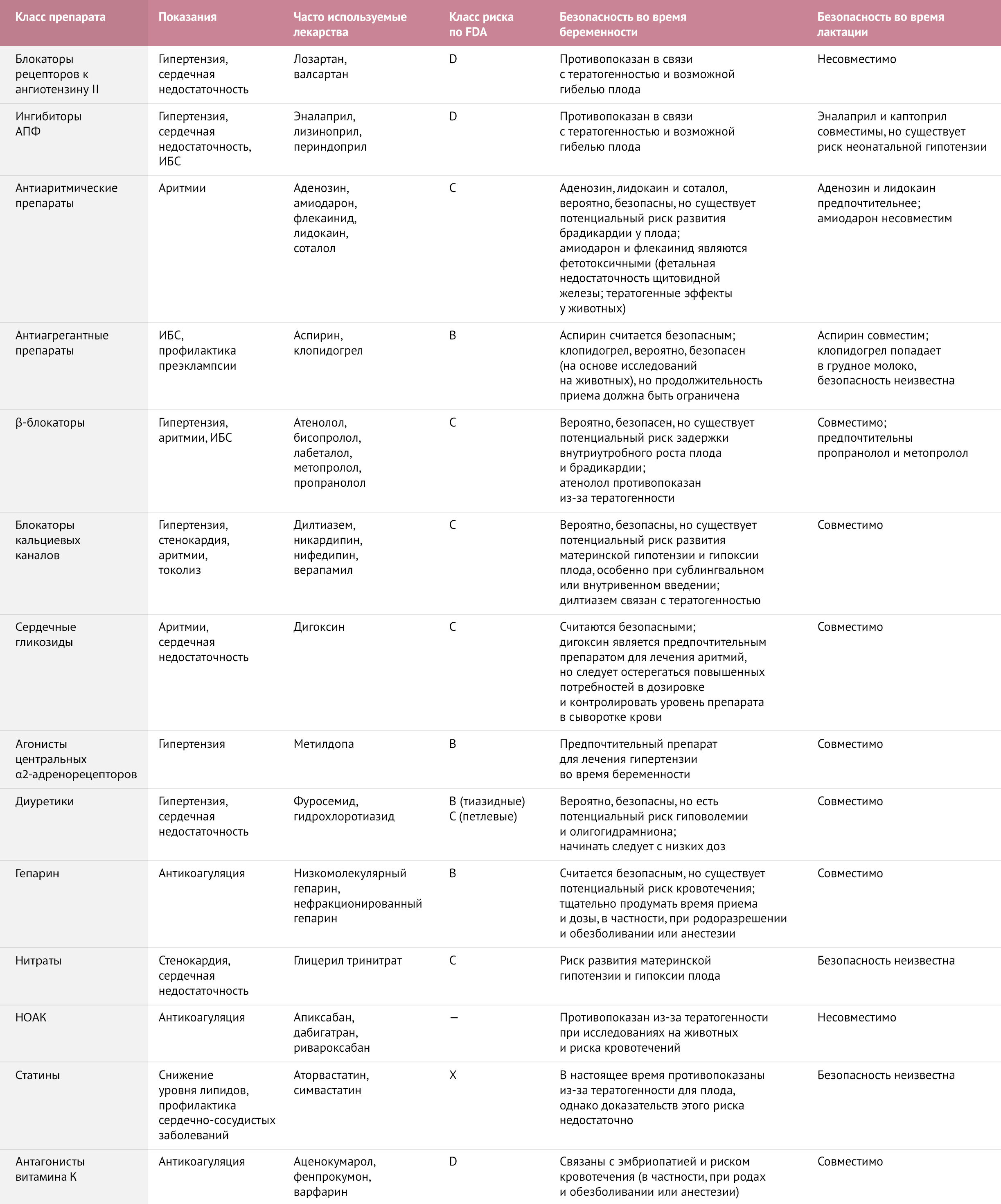
Хотя точное влияние беременности на фармакокинетику препаратов различается для каждого из-за многочисленных связанных с этим факторов, путь элиминации является наиболее важным вопросом. Если элиминация препарата происходит через почки (например, для дигоксина), то концентрация препарата обычно снижается во время беременности из-за увеличения почечного клиренса и может даже достигать субтерапевтических уровней. Для этих препаратов во время беременности необходимо повышение дозировки. Если препарат выводится через печень, то чистый эффект при беременности выглядит более противоречиво, и концентрация препарата может быть снижена, увеличена или неизменнна в зависимости от изменений в метаболизирующем ферменте, участвующем в этом процессе [148]. Учитывая, что влияние на фармакокинетику препарата возрастает с увеличением продолжительности беременности, для обеспечения безопасного терапевтического уровня препарата могут потребоваться регулярные измерения концентрации препарата в сыворотке крови. В таблице 1 представлен обзор широко используемых сердечно-сосудистых препаратов и их известных эффектов на мать и ребенка.
Родоразрешение и послеродовый период
Для всех женщин с сердечно-сосудистыми заболеваниями во время беременности (предпочтительно до 26 недель) должен быть составлен план родов. Решающее значение имеет междисциплинарный подход, включающий акушеров-гинекологов, кардиологов и анестезиологов, но не ограничивающийся только этими специалистами. Индукция родов рекомендуется на сроке не позднее 40 недель беременности, поскольку такой подход снижает количество осложнений у матери и плода [150]. В когорте женщин с сердечно-сосудистыми заболеваниями плановое кесарево сечение не улучшает исход со стороны матери и отрицательно сказывается на исходе со стороны плода [151], поэтому почти всем пациенткам рекомендуются вагинальные роды, а кесарево сечение следует назначать лишь отдельным женщинам с тяжелой патологией (например, критической острой сердечной недостаточностью или легочной гипертензией, угрожающей дилатацией аорты или самопроизвольными родами при пероральном применении антикоагулянтов) [1].
Для индукции родов можно безопасно использовать трансцервикальные двухбаллонные катетеры и мизопростол [152]. Для индукции родов или при отсутствии прогресса в их течении можно применять инфузию окситоцина. Сообщалось о тахикардии, гипотензии и ишемии миокарда при введении окситоцина в виде обычно используемого внутривенного болюсного введения 10 ЕД непосредственно после родов или кесарева сечения [153], поэтому рекомендуется медленное введение низких доз окситоцина (2 ЕД в течение 10 мин в сочетании с 10 ЕД со скоростью 12 мЕД/мин), поскольку эта дозировка снижает риск кровотечений, не вызывая неблагоприятных эффектов у женщин с сердечно-сосудистыми заболеваниями [154].
Эпидуральную анальгезию для облегчения боли у женщин с сердечно-сосудистыми заболеваниями следует титровать медленно, чтобы избежать гипотензии. Родовспоможение может ограничить нагрузку на сердечно-сосудистую систему матери [1]. В силу физиологической картины гемодинамических изменений частота большинства сердечно-сосудистых заболеваний при беременности достигает максимума в третьем триместре, но, что немаловажно, также и в послеродовом периоде [5,33,90,99,111]. Сдвиги в количестве и составе жидкостных сред организма в послеродовом периоде могут способствовать развитию декомпенсации и сердечной недостаточности у женщин с сердечно-сосудистыми заболеваниями [33], поэтому женщинам с умеренными и сложными заболеваниями сердца показано стационарное наблюдение в течение первых 24–48 ч после родов; при тяжелых заболеваниях сердца этот срок может быть увеличен [1].
Недостатки в доказательствах
Крупные международные регистры, такие как The Registry of Pregnancy and Cardiac Disease, важны для получения необходимого количества пациенток для описания эпидемиологии нечастых сердечно-сосудистых заболеваний. Большинство данных о гемодинамической физиологии беременности относится к периоду 1950–1980 годов, и сохраняется неопределенность в отношении точной картины сердечного выброса в третьем триместре и в родах. До сих пор неясно, приводит ли медикаментозная терапия при гипертензивных расстройствах беременности к лучшим результатам у женщин с легкой и умеренной артериальной гипертензией по сравнению с отсутствием терапии. Кроме того, следует изучить оптимальные сроки индукции родов у женщин с тяжелой преэклампсией на сроке > 34 недель беременности. При ВТЭ необходимы рандомизированные контролируемые исследования оптимальных схем назначения антикоагулянтов. При ОКС недостаточно изучены варианты лечения спонтанной диссекции коронарных артерий, в частности, результаты инвазивного и неинвазивного вариантов лечения. Также остается неопределенным риск рецидива спонтанной диссекции коронарных артерий при последующих беременностях. Неясны данные о применении β-блокаторов у женщин с дилатацией аорты или кардиомиопатией. Современная терапия перипартальной кардиомиопатии ограничена и требует дополнительного изучения. Недостаточно проспективных данных и рандомизированных контролируемых исследований для оценки эффективности, безопасности и оптимальной дозы препаратов во время беременности. Эффекты, в том числе долгосрочные, для матери и ребенка многих используемых в настоящее время лекарств не очень хорошо известны. Учитывая, что клиническим испытаниям лекарств во время беременности всегда будут сопутствовать этические проблемы, этот пробел в знаниях могут заполнить лишь крупные перспективные реестры.
Таблица 1 | Часто используемые классы сердечно-сосудистых препаратов и их безопасность во время беременности и лактации (скачать)
Выводы
Сердечно-сосудистые заболевания во время беременности — это актуальная проблема, которая может иметь отдаленные последствия для здоровья матери и ребенка. Сердечно-сосудистые заболевания являются основной причиной материнской смертности. Популяция беременных в будущем, вероятно, будет иметь больше сопутствующих заболеваний и сердечно-сосудистых факторов риска, и, следовательно, будет подвержена более высокому риску сердечно-сосудистой заболеваемости и смертности, чем нынешняя популяция беременных, поэтому очевидно, что необходимо уделять больше внимания пропаганде здорового образа жизни. Обширные гемодинамические, метаболические и гормональные изменения во время беременности создают значительную физиологическую нагрузку на сердечно-сосудистую систему. Это давление делает женщин во время беременности и в послеродовый период особенно уязвимыми к развитию сердечно-сосудистых заболеваний de novo или к обострению ранее бессимптомных сердечно-сосудистых заболеваний. Кроме того, изменения физиологии при беременности могут маскировать симптомы заболевания, затрудняя своевременную диагностику. Для раннего выявления сердечно-сосудистых осложнений необходима высокая врачебная настороженность, при необходимости во время беременности следует использовать диагностическую визуализацию. Для успешного лечения осложнений необходим междисциплинарный подход, включающий акушеров-гинекологов, кардиологов, анестезиологов (и, когда это уместно, специалистов акушерской медицины и неонатологов). Данной командой для каждой женщины с сердечно-сосудистыми заболеваниями уже во время беременности должен быть согласован план родов. Реферативные центры с профильным опытом работы и оборудованием являются оптимальными местами для ведения таких пациенток. Данный обзор также подчеркивает многие пробелы в обосновании лечебной тактики, поскольку в ряде случаев отсутствуют проспективные данные и результаты рандомизированных контролируемых исследований, на которых можно было бы основывать решения по ведению пациенток. Для снижения риска сердечно-сосудистых заболеваний во время беременности необходима лучшая доказательная база.
