Кардиоваскулярные эффекты и безопасность НПВП

Аннотация
Нестероидные противовоспалительные препараты (НПВП) являются эффективными, широко используемыми анальгетиками. В течение последних двух десятилетий значительное внимание уделялось их безопасности по отношению к сердечно-сосудистой системе. После ранних исследований, указывающих на связь между использованием НПВП и повышенным риском развития сердечной недостаточности и артериальной гипертензии, последующие исследования обнаружили связь между использованием НПВП и повышенным риском тромботических явлений. Селективные ингибиторы циклооксигеназы-2 (ЦОГ-2) (также известные как коксибы) были связаны с наибольшим риском неблагоприятных сосудистых эффектов, но обеспокоенность также связана с неселективными НПВП, особенно с сильными ингибиторами ЦОГ-2, такими как диклофенак.
Хотя применение НПВП не рекомендуется пациентам с сердечно-сосудистыми заболеваниями, для них часто требуются обезболивающие препараты, и в отсутствие анальгетиков, которые по меньшей мере столь же эффективны, но безопасны, часто назначаются НПВП. Кроме того, безрецептурное применение НПВП даже среди людей с предрасположенностью к развитию сердечно-сосудистых заболеваний в значительной степени не контролируется и широко варьируется в разных странах. По мере роста обеспокоенности по поводу недостатков альтернатив НПВП (таких как опиоиды) для обезболивания, использование НПВП, вероятно, будет расти. Учитывая, что в фармацевтической разработке нет новых анальгетиков, медицинские работники, пациенты и органы министерства здравоохранения сосредоточены на оптимизации безопасного использования НПВП. В этом обзоре мы резюмируем современные данные о сердечно-сосудистой безопасности НПВП и представляем подход для их использования в контексте комплексного лечения боли.
Ключевые моменты
- Нестероидные противовоспалительные препараты (НПВП) ассоциированы с повышенным сердечно-сосудистым риском, но, тем не менее, часто используются для купирования болевого синдрома.
- Даже при кратковременном использовании (< 7 дней) НПВП ассоциируются с повышенным риском развития тромботических сердечно-сосудистых осложнений.
- Стареющее население, обеспокоенность по поводу недостатков альтернативных анальгетиков (таких как опиоиды) и ограниченный процесс разработки анальгетиков — все это говорит о том, что использование НПВП в будущем возрастет.
- Немедикаментозные меры (физиотерапия, физические упражнения и контроль веса) являются приемлемыми вариантами для многих пациентов для прогресса управления болью при минимизации фармакологических потребностей в анальгетиках с дополнительными преимуществами по отношению к развитию сердечно-сосудистого риска и благосостоянию.
Нестероидные противовоспалительные препараты (НПВП) используются во всем мире для купирования боли, но уже более десяти лет вопрос о безопасности по отношению к сердечно-сосудистой системе широко используемых НПВП (целекоксиб, диклофенак, ибупрофен и напроксен) привлекает значительное внимание. Мета-анализы как рандомизированных, так и обсервационных данных сообщают о сердечно-сосудистых рисках [1, 2], связанных с использованием НПВП, и специалисты в области кардиологии предостерегают от использования этих препаратов [3, 4]. Органы контроля в области медицины, включая управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Европейское агентство по лекарственным средствам, выпустили как классовые, так и индивидуальные предостережения против НПВП [5, 6]. Тем не менее, данные препараты все еще часто используются пациентами с сердечно-сосудистыми заболеваниями, а также лицами, находящимися в группе высокого риска развития сердечно-сосудистой патологии. К примеру, в Дании за 13-летний период НПВП назначались 46 % пациентам с инфарктом миокарда в анамнезе [7, 8]. Даже при кратковременном применении — менее 7 дней — НПВП были связаны с повышенным риском тромботических сердечно-сосудистых явлений [9]. При одновременном назначении НПВП с антикоагулянтами пациентам с сердечно-сосудистыми заболеваниями кратковременное применение ассоциировалось со значительным, не связанным с основной патологией риском кровотечения [10, 11].
Эти риски вызывают серьезные опасения в области общественного здравоохранения, особенно среди пожилых пациентов, учитывая, что распространенность как сердечно-сосудистых заболеваний, так и хронической патологии увеличивается с возрастом и что в некоторых частях мира на население приходится большая доля пожилых людей. Кроме того, во многих странах некоторые НПВП (чаще всего ибупрофен, а также диклофенак, мефенамовая кислота и напроксен) доступны без рецепта в аптеках и розничных магазинах, включая интернет-магазины, с различными ограничениями на количество, которое можно приобрести, и часто без требования к продавцу предоставлять профессиональные консультации потребителям. Нет систематических данных о сердечно-сосудистых рисках для потребителей безрецептурных НПВП или об исходах, полученных этой группой.
Растущее беспокойство по поводу недостатков альтернативных анальгетиков, таких как опиоиды, также свидетельствует о том, что использование НПВП будет расти в будущем. В сочетании с данными отдела фармацевтических разработок о том, что новые анальгетики отсутствуют, медицинские работники, пациенты и регулирующие медицинские органы должны оптимизировать безопасное использование НПВП. Эта потребность особенно актуальна для групп с высоким исходным риском, таких как пациенты с сердечно-сосудистыми заболеваниями или с риском их развития. В этом обзоре мы рассматриваем безопасность НПВП в отношении сердечно-сосудистой системы. Мы начинаем с описания биологических механизмов НПВП-ассоциированных преимуществ и недостатков. Затем мы резюмируем факты об их влиянии на сердечно-сосудистый риск и обсуждаем информацию об исходах, когда НПВП принимаются одновременно с антитромботическими препаратами, предназначенными для снижения сердечно-сосудистого риска. Далее мы рассмотрим использование НПВП в контексте имеющихся альтернативных анальгетиков, рекомендаций, выдаваемых специализированными группами, и процесса разработки анальгетиков. В заключение мы предлагаем комплексный подход к лечению боли, направленный на минимизацию использования НПВП и выбор вариантов с наименьшим риском в отношении сердечно-сосудистой системы в соответствии с нашей интерпретацией полученных данных.
Биологические механизмы эффектов НПВП
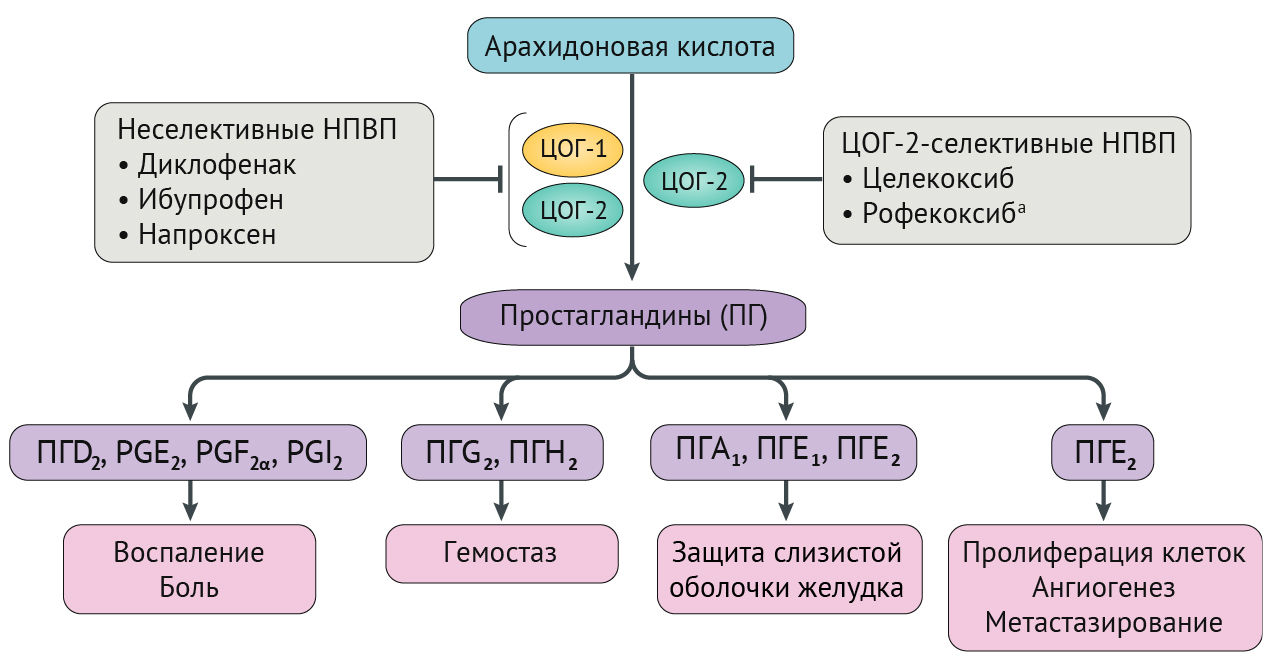
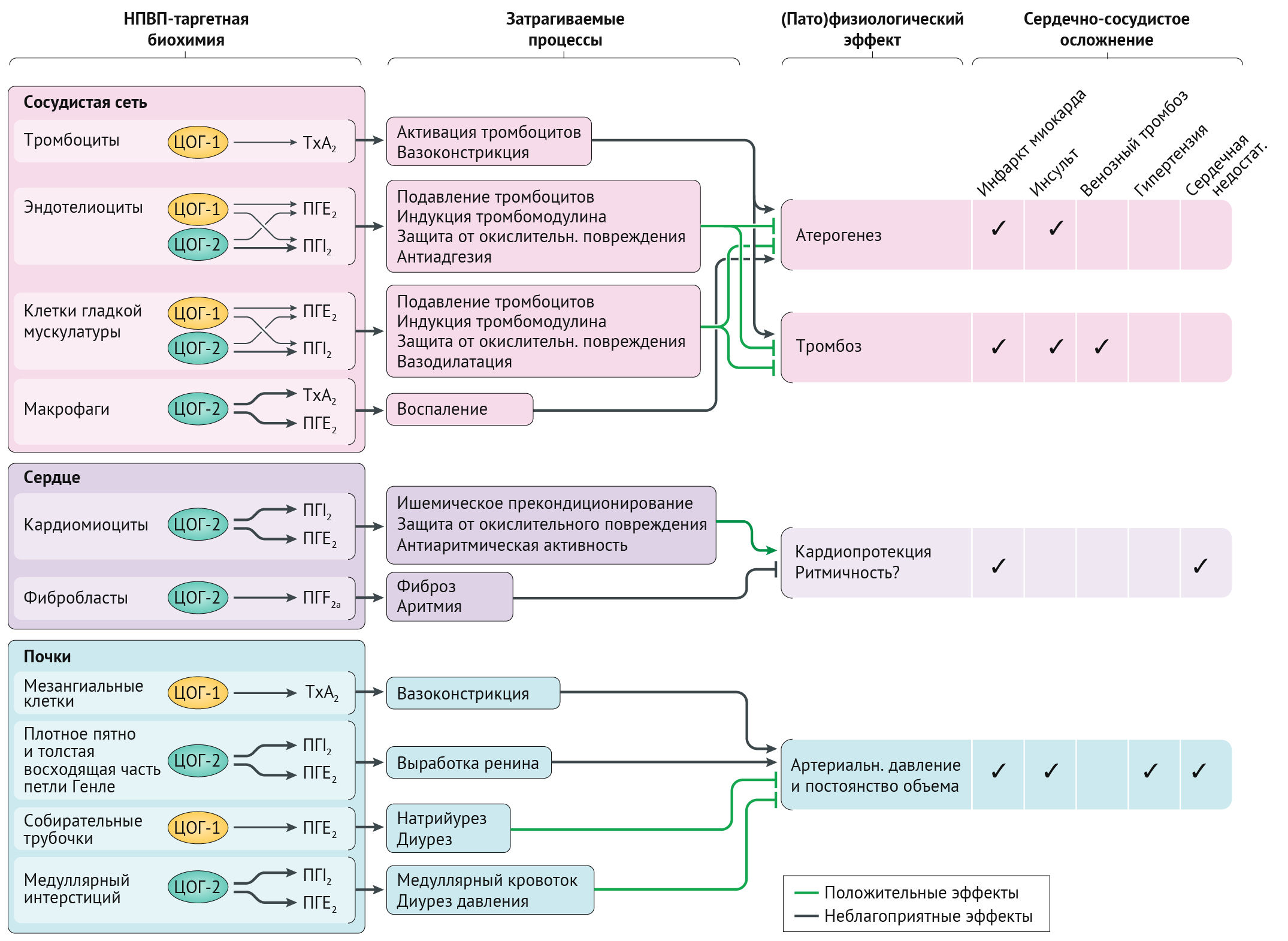
НПВП ингибируют ферменты циклооксигеназы (ЦОГ), которые участвуют в выработке простагландинов [12–16]. Двумя основными изоферментами ЦОГ являются ЦОГ-1 (также известный как простагландин G/H синтаза-1) и ЦОГ-2 (также известный как простагландин G/H синтаза-2), оба из которых образуют простагландин H2 из арахидоновой кислоты. Простагландин H2 дополнительно катализируется простагландинсинтазами и изомеразами для получения биологически активных липидов (простаноидов), таких как тромбоксан А2, простагландин D2, простагландин Е2, простагландин F2 и простациклин (также известный как простагландин I2), которые влияют на иммунную, сердечно-сосудистую, желудочно-кишечную, реноваскулярную, легочную, центральную нервную систему и репродуктивные функции (рис. 1) [3, 15]. Изоферменты ЦОГ присутствуют в различных тканях человеческого организма и влияют на гемостаз с помощью различных простаноидов [17, 18]. ЦОГ-1 в тромбоцитах и в миокардиальных, париетальных и почечных клетках регулирует такие процессы, как агрегация тромбоцитов, тромбоз, цитопротекция желудка и функционирование почек. ЦОГ-1 повышается в ответ на воспалительные цитокины и митогены в таких ситуациях, как атерогенез, ревматоидный артрит, ишемия и новообразования. ЦОГ-2 экспрессируется в нормальных эндотелиальных клетках в ответ на механическое напряжение, и его ингибирование приводит к подавлению продукции защитного простациклина. Другие сосудистые преимущества простациклина включают расширение сосудов и ингибирование как пролиферации гладкомышечных клеток, так и агрегации тромбоцитов.
Фармакологически «селективные» ингибиторы ЦОГ-2 (также известные как коксибы), такие как целекоксиб и рофекоксиб (изъяты во всем мире в 2004 году, однако изученные во многих исследованиях НПВП), характеризуются селективным ингибированием ЦОГ-2, в то время как неселективные НПВП, такие как диклофенак, ибупрофен и напроксен, ингибируют оба изофермента ЦОГ. Селективные ингибиторы ЦОГ-2 были предназначены для снижения частоты осложнений со стороны желудочно-кишечного тракта (кровотечения из верхних отделов ЖКТ), но также они связаны с повышенным сердечно-сосудистым риском [19]. Коксибы можно расположить по степени их селективности к ингибированию COX2 и COX1: рофекоксиб > эторикоксиб > вальдекоксиб > парекоксиб > целекоксиб [20]. Другие НПВП включают в себя неселективные ингибиторы ЦОГ, такие как ибупрофен и напроксен, и те, которые обладают некоторой селективностью в отношении ЦОГ-2, а также ингибируют ЦОГ-1, такие как диклофенак, этодолак и мелоксикам (которые обладают селективностью в отношении ЦОГ-2, аналогичной селективности целекоксиба) [21].
Сосудистые эндотелиальные клетки экспрессируют как ЦОГ-1, так и ЦОГ-2, тогда как тромбоциты экспрессируют только ЦОГ-1 и играют важную роль в сердечно-сосудистом гемостазе. Тромбоциты ЦОГ-1 продуцируют тромбоксан A2, который стимулирует агрегацию тромбоцитов и вазоконстрикцию, а также усиливает сосудистое и сердечное ремоделирование. ЦОГ-2 опосредует синтез простациклина, мощного вазодилататора, который также ингибирует функцию тромбоцитов и способствует выведению натрия почками. Одним из предложенных механизмов сердечно-сосудистого риска НПВП является наблюдаемый сдвиг протромботическо-антитромботического баланса на эндотелиальных поверхностях в сторону тромбоза [3, 13, 15].
Также наблюдалась связь между степенью ингибирования ЦОГ-2 и риском развития тромбоза [3, 13, 22]. Простейшая гипотеза состояла в том, что чем больше ингибирование ЦОГ-2 оказывает НПВП по отношению к ингибированию ЦОГ-1, тем выше риск сердечно-сосудистых осложнений. Однако эта теория сбалансированного и несбалансированного ингибирования ЦОГ обсуждается, поскольку неселективные НПВП также были связаны с повышенным сердечно-сосудистым риском. Другие механизмы могли бы объяснить опасное воздействие НПВП; например, было обнаружено, что простациклин действует как ограничитель на многие протромботические стимулирующие вещества, включая АДФ, адреналин, коллаген, серотонин,тромбин и тромбоксан А2 [15, 21].
При анализе сердечно-сосудистых рисков, связанных с НПВП, факторами, которые имеют большое значение для пациентов и назначающих их лиц, являются характер рисков, кто (больше всего) подвержен риску, имеют ли все НПВП одинаковые риски и существует ли «безопасное» время для использования НПВП. Соответствующая информация была получена главным образом в результате эпидемиологических исследований и обсуждается ниже. Рандомизированные исследования, специально предназначенные для изучения сердечно-сосудистой безопасности при терапии НПВП, являются редкими, но они также обсуждаются, если таковые имеются.
a — изъят с рынка
НПВП и инфаркт миокарда
Биологическое объяснение ассоциированного с НПВП риска развития инфаркта миокарда в первую очередь подчеркивает описанные выше протромбоэмболические эффекты, но было также обнаружено, что НПВП влияют на функцию почек и регуляцию баланса жидкости, вызывая задержку жидкости и усугубление сердечной недостаточности; все вышеперечисленное способствует риску развития инфаркта миокарда (рис. 2) [23]. Кроме того, было обнаружено, что НПВП взаимодействуют с антигипертензивными препаратами, такими как ингибиторы ангиотензинпревращающего фермента, через механизмы, связанные с ингибированием синтеза простагландинов, что нарушает работу сосудистой системы почек и регуляцию артериального давления [24]. Также НПВП могут повышать уровень альдостерона в сыворотке крови, что приводит к задержке натрия и гипертонии [25, 26].
Индивидуальные обсервационные исследования и мета-анализ данных многочисленных исследований изучили связанный с НПВП риск развития инфаркта миокарда в широких популяциях потребителей с уточнением выявленных сердечно-сосудистых факторов риска и показали, что по сравнению с отказом от использования применение НПВП повышает риск развития инфаркта миокарда [27, 28]. Исследования, в которых пациенты распределены по сердечно-сосудистому риску, или которые специально фокусируются на пациентах с доказанным сердечно-сосудистым риском, сообщают о сходных оценках относительного риска им при применении НПВП [29, 30]. Как селективные, так и неселективные НПВП были связаны с повышенным риском сердечно-сосудистых заболеваний и смерти вследствие сердечно-сосудистой патологии [27–31]. В нескольких исследованиях сообщалось, что напроксен является НПВП, ассоциированным с самым низким сердечно-сосудистым риском, но связан с более высоким риском желудочно-кишечного кровотечения, в отличие от ингибиторов ЦОГ-2 и других неселективных НПВП; у больных с инфарктом миокарда желудочно-кишечное кровотечение ассоциируется с неблагоприятным прогнозом [32, 33]. Однако связанные с НПВП желудочно-кишечные осложнения могут быть снижены применением гастропротекторных препаратов [34].
Ранее считалось, что использование НПВП в течение коротких периодов лечения и в низких дозах не связано с риском, что может (частично) объяснить, почему НПВП все еще используются у пациентов с заболеваниями сердца. Однако исследования впоследствии показали, что для пациентов с сердечно-сосудистыми заболеваниями, принимающих НПВП, не существует безопасного времени лечения. В ходе обсервационных исследований были изучены сроки реализации риска. В 2011 году наша группа сообщила о повышенном риске смерти и рецидива инфаркта миокарда в зависимости от продолжительности лечения НПВП у пациентов с уже имеющимся инфарктом в анамнезе [9]. Среди датских пациентов, впервые перенесших инфаркт миокарда в период с 1997 по 2006 год, был обнаружен повышенный сердечно-сосудистый риск после 7 дней лечения рофекоксибом [9]. Следует отметить, что в том же исследовании риск смерти и рецидива инфаркта миокарда, связанный с широко используемым неселективным НПВП диклофенаком, повышался сразу же после начала лечения и сохранялся в дальнейшем [9].
Полученные результаты свидетельствуют о том, что диклофенак был связан с более высоким риском смерти и рецидива инфаркта миокарда, чем селективный ингибитор ЦОГ-2 рофекоксиб, который был изъят с рынка в 2004 году. Систематические обзоры обсервационных исследований сообщают о повышенном риске в течение первой недели лечения диклофенаком, ибупрофеном и (по-разному) напроксеном [1, 27, 28]. Риск, по-видимому, зависел от дозы и был наиболее выражен при высоких дозах целекоксиба, ибупрофена и напроксена, в то время как как низкие, так и высокие дозы диклофенака были связаны со стабильно повышенным риском развития инфаркта [27, 28]. В исследовании 2012 года сообщалось о долгосрочных сердечно-сосудистых рисках, связанных с применением НПВП среди датских пациентов после инфаркта миокарда [35]. Риск смерти и комбинированной конечной точки коронарной смерти или несмертельного рецидива инфаркта миокарда постоянно повышался, независимо от времени, прошедшего с момента первого случая данной патологии.
Рандомизированные исследования
Среди ранних исследований рандомизированных данных мета-анализ рандомизированных исследований 2006 года показал, что селективные ингибиторы ЦОГ-2 ассоциированы с повышенным риском серьезных сосудистых ишемических осложнений (преимущественно инфаркт миокарда), как и высокие дозы диклофенака и ибупрофена, но не напроксена [36]. В 2011 году сетевой мета-анализ включал данные 31 рандомизированного исследования и показал, что сердечно-сосудистые риски были повышены при применении селективных ингибиторов ЦОГ-2 (эторикоксиб, люмиракоксиб и рофекоксиб), а также диклофенака и ибупрофена, но не напроксена [31].
В 2013 году мета-анализ индивидуальных данных пациентов, включая более 350 000 участников из 757 различных рандомизированных исследований, показал, что селективные ингибиторы ЦОГ-2 (относительный риск [ОР] 1,37, 95 % доверительный интервал [ДИ] 1,14–1,66) и диклофенак (ОР 1,41, 95 % ДИ 1,12–1,78) ассоциированы с повышенным риском сосудистых событий по сравнению с плацебо [32]. Ингибиторы ЦОГ-2 также были связаны с повышением частоты сосудистой смерти (ОР 1,58, 95 % ДИ 1,00–2,49). Однако напроксен не увеличивал риск развития сосудистых осложнений или сосудистой смерти. Эти оценки риска в целом согласуются с данными обсервационных исследований.
Результаты этого мета-анализа позволили получить представление о важности исходного сердечно-сосудистого риска для величины ежегодного риска воздействия НПВП. Соответственно, воздействие НПВП на пациентов с низким риском дает незначительное абсолютное увеличение риска, в то время как лечение пациентов с более высоким риском ингибитором ЦОГ-2 или диклофенаком связано со значительными сердечно-сосудистыми осложнениями, причем некоторые из которых могут привести к летальному исходу.
Например, абсолютный избыточный риск смертельных или несмертельных сосудистых осложнений у пациентов с низким исходным сердечно-сосудистым риском, получавших высокие дозы ингибитора ЦОГ-2, диклофенака или ибупрофена, составлял два случая на 1000 пациентов. Для пациентов с высоким исходным сердечно-сосудистым риском повышенный риск смертельных или несмертельных сосудистых осложнений при применении высоких доз ингибитора ЦОГ-2, диклофенака или ибупрофена составил 9, 10 и 12 случаев на 1000 пациентов соответственно.
Взаимодействие НПВП и аспирина
Фармакодинамические взаимодействия происходят между аспирином и ибупрофеном и напроксеном, но не между аспирином и диклофенаком или целекоксибом. Ибупрофен и напроксен являются конкурентными ингибиторами аспирина и снижают доступ к его участку связывания с ЦОГ-1, тем самым снижая степень ингибирования тромбоцитов тромбоксаном, которую аспирин может достичь в ином случае. Высокие уровни ингибирования тромбоксана аспирином, по-видимому, необходимы для надежного блокирования тромбоксан-индуцированной агрегации тромбоцитов, но клинический эффект фармакодинамического взаимодействия с ибупрофеном или напроксеном с точки зрения тромботического риска остается неопределенным [37, 38]. Эта неоднозначность отражена в информации о препаратах, утвержденных регулирующими органами Европы и США, для ибупрофена и напроксена.
НПВП и фибрилляция предсердий
НПВП были связаны с повышенным риском развития фибрилляции предсердий. Биологическое объяснение не вполне понятно, но предполагается, что оно связано с неблагоприятным воздействием на задержку жидкости, электролиты сыворотки и артериальное давление [23, 39–42]. В нескольких обсервационных исследованиях сообщалось о повышенном риске развития фибрилляции предсердий при применении НПВП [43–47]. Эти данные были объединены в мета-анализе, включающем более 400 000 случаев фибрилляции предсердий [48]. По сравнению с лицами, не принимавшими НПВП, общее применение НПВП ассоциировалось с умеренным повышением риска развития фибрилляции предсердий на 12 % (ОР 1,12, 95 % ДИ 1,06–1,18); как в случае контроля, так и в случае когортных исследований были получены аналогичные результаты [43–47]. При стратификации по длительности применения НПВП новые пациенты имели самый высокий риск (ОР 1,53, 95 % ДИ 1,37-1,70) [48]. Это наблюдение объясняется тем, что у восприимчивых пациентов после начала терапии может наблюдаться сердечная недостаточность или нарушение функции почек, но однозначного объяснения до сих пор не существует.
Среди отдельных НПВП диклофенак ассоциировался с самым высоким риском развития фибрилляции предсердий [46, 48]. Подгруппы пациентов с уже существующей сердечной недостаточностью (ОР 1,82, 95 % ДИ 1,42–2,32) или хронической болезнью почек (ОР 1,58, 95 % ДИ 1,34–1,85) имели высокий риск развития фибрилляции предсердий после начала терапии НПВП [48]. Мета-анализ в 2006 году, включавший 114 рандомизированных исследований, показал, что рофекоксиб ассоциирован с повышенным риском развития сердечной аритмии (ОР 2,90, 95 % ДИ 1,07–7,88) [43]. Однако мета-анализ был ограничен включением только 286 эпизодических аритмий, поэтому анализ подтипов был невозможен.
НПВП и сердечная недостаточность
Для пациентов с сердечной недостаточностью применение НПВП не рекомендуется в клинических рекомендациях из-за повышенного риска задержки жидкости и прогрессирования сердечной недостаточности. Тем не менее, датское исследование показало, что более 34 % пациентов с хронической сердечной недостаточностью получали НПВП после выписки из стационара [7]. Популяционное исследование из Канады сообщило о повышенном риске госпитализации по поводу сердечной недостаточности, связанной с неселективными НПВП и рофекоксибом, но не с целекоксибом (по сравнению с неиспользованием) [49]. Когортное исследование типа «случай-контроль», основанное на реальных данных более десяти миллионов пациентов из четырех европейских стран, показало, что НПВП в целом повышают риск госпитализации по поводу сердечной недостаточности и смерти у пациентов с установленной сердечной недостаточностью, но риск варьирует в зависимости от дозы и конкретного используемого НПВП (по сравнению с прошлым использованием) [50].
Основной причиной для опасений было то, что обычно используемые НПВП, такие как диклофенак, ибупрофен и напроксен, были связаны с повышенным риском госпитализации по поводу сердечной недостаточности и что высокие дозы диклофенака или ибупрофена более чем удвоили риск. Обсервационное исследование, включавшее пациентов, поступивших в больницу с сердечной недостаточностью в Дании, показало, что применение НПВП ассоциировалось с повышенным риском смерти и повторной госпитализации по поводу сердечной недостаточности (по сравнению с неиспользованием) [7]. Наблюдалось явное дозозависимое увеличение риска, и риск смерти был особенно повышен при высоких дозах диклофенака (> 100 мг в сутки; коэффициент риска [КР] 5,54, 95 % ДИ 5,08-6,03) и рофекоксиба (> 25 мг в сутки; КР 3,54, 95 % ДИ 3,12–4,02), тогда как риск смерти был несколько ниже при высоких дозах ибупрофена (> 1200 мг в сутки; КР 2,83, 95 % ДИ 2,64–3,02) и целекоксиба (> 200 мг в сутки; КР 2,72, 95 % ДИ 2,45–3,02). Высокие дозы НПВП также ассоциировались с повышенным риском повторной госпитализации по поводу сердечной недостаточности: рофекоксиб (КР 1,86, 95 % ДИ 1,46–2,35), диклофенак (КР 1,42, 95 % ДИ 1,17–1,73), целекоксиб (КР 1,26, 95 % ДИ 1,04–1,53) и ибупрофен (КР 1,18, 95 % ДИ 1,04–1,33).
Напроксен считался самым безопасным неселективным НПВП в отношении сердечно-сосудистого риска, но данные этого обсервационного исследования показали, что применение высоких доз напроксена (> 500 мг в сутки) также связано с повышенным риском смерти (КР 1,97, 95 % ДИ 1,64–2,36) и повторной госпитализации по поводу сердечной недостаточности (КР 1,18, 95 % ДИ 1,00–1,40). В исследовании типа «случай–контроль» из Канады, включающем 2256 пожилых пациентов с сердечной недостаточностью, сообщалось о более высоких рисках смерти и рецидивирования сердечной недостаточности, связанных с применением рофекоксиба или неселективных НПВП, по сравнению с применением целекоксиба [51]. В другом исследовании типа «случай-контроль» сообщалось о повышенном риске развития сердечной недостаточности при применении рофекоксиба или индометацина по сравнению с применением целекоксиба [52]. При мета-анализе данных рандомизированных исследований двукратное увеличение риска развития сердечной недостаточности было связано со всеми НПВП (по сравнению с их неиспользованием) [32]. Следует отметить, что риск был одинаковым как для селективных ингибиторов ЦОГ-2, так и для неселективных НПВП. Поэтому применение НПВП вызывает беспокойство у групп населения с высоким первоначальным сердечно-сосудистым риском, таких как пациенты с сердечной недостаточностью. Хотя различия в риске могут существовать между отдельными НПВП, ограничение применения всех НПВП — как селективных ингибиторов ЦОГ-2, так и неселективных НПВП — у пациентов с сердечной недостаточностью представляется разумным.
Кардиоваскулярные исходы рандомизированных исследований
До последних 5 лет отсутствовали данные рандомизированных клинических исследований, которые непосредственно касались сердечно-сосудистой безопасности НПВП. Предыдущие рандомизированные исследования были в основном сосредоточены на безопасности в отношении желудочно-кишечного тракта при применении ингибиторов ЦОГ-2 по сравнению с неселективными НПВП [53, 54] или на профилактике колоректальной аденомы с ингибиторами ЦОГ-2 по сравнению с плацебо [55–60]. В этих исследованиях сердечно-сосудистая безопасность не была основной целью, а сердечно-сосудистые исходы были вторичными конечными точками. Поэтому результаты исследования PRECISION, опубликованного в 2016 году, ожидались с нетерпением [61]. В исследовании PRECISION были включены пациенты с остеоартрозом или ревматоидным артритом, которые подвергались повышенному сердечно-сосудистому риску и которым было назначено лечение целекоксибом, ибупрофеном или напроксеном.
Основной комбинированный критерий оценки состоял из сердечно-сосудистой смерти, несмертельного инфаркта миокарда или несмертельного инсульта. Более 24 000 пациентов были включены в исследование в течение восьми лет и наблюдались в среднем в течение 20 месяцев. Первичный исход наблюдался у 2,3 %, 2,7 % и 2,5 % пациентов, получавших целекоксиб, ибупрофен и напроксен соответственно (достоверных межгрупповых различий не было). Однако достоверность исследования была снижена из-за того, что 69 % пациентов прекратили прием исследуемого препарата и 27 % прекратили последующее наблюдение. Кроме того, назначенные дозы целекоксиба (в среднем 209 ± 32 мг) были ниже, чем те, которые использовались в предыдущих исследованиях, сообщивших о повышении сердечно-сосудистого риска; низкие дозы, вероятно, были неоптимальными для адекватного облегчения боли [53, 56, 62]. Дозы напроксена (средняя доза 852 ± 103 мг) и ибупрофена (2,045 ± 246 мг) были аналогичны или выше тех, которые использовались в предыдущих рандомизированных исследованиях. К тому же наблюдаемая низкая частота случаев не отражает группу высокого риска, на которую было направлено исследование.
Роль аспирина в снижении сердечно-сосудистого риска НПВП остается нерешенной. В исследовании PRECISION пациенты были распределены в соответствии с их анамнезом применения аспирина,но фактическое применение аспирина или дозировки, используемые одновременно с применением НПВП, не регистрировались [63]. Исследование PRECISION не выявило значимого взаимодействия между использованием аспирина и НПВП, но из-за методологических проблем исследование не выяснило, защищает ли аспирин от связанного с НПВП сердечно-сосудистого риска [38]. Хотя исследование PRECISION дает представление о сердечно-сосудистой безопасности неселективных НПВП и ингибиторов ЦОГ-2, в нем есть серьезные замечания, которые ограничивают обобщаемость и интерпретацию его результатов.
В исследование SCOT были включены пациенты в возрасте более 60 лет, страдающие остеоартрозом или ревматоидным артритом, не имеющие установленных сердечно-сосудистых заболеваний и постоянно принимающие неселективные НПВП [64]. Пациентам случайным образом было назначено перейти на целекоксиб или продолжить лечение неселективными НПВП. Первичным исходом было сочетание сердечно-сосудистой смерти, несмертельного инфаркта миокарда или инсульта или госпитализации по поводу острого коронарного синдрома. Медиана продолжительности наблюдения составила три года, и в исследование было включено 7297 пациентов. Первичная конечная точка наступила у 0,95 % и 0,86 % пациентов, получавших целекоксиб и неселективные НПВП соответственно.
Хотя исследование SCOT показало, что целекоксиб не уступает неселективным НПВП в отношении сердечно-сосудистых осложнений, это исследование имело гораздо более низкую частоту случаев, чем ожидалось, а также имело высокие показатели отмены исследуемого препарата (50,9 % в группе целекоксиба и 30,2 % в группе неселективных НПВП). Как для PRECISION, так и для SCOT исследований вопрос о том, были ли используемые дозы целекоксиба фармакоэквивалентны к дозам неселективных НПВП, остается спорным [65]. Более низкая эффективная доза целекоксиба делала бы его более предпочтительным из-за снижения риска побочных эффектов. Таким образом, недостатки PRECISION и SCOT исследований приводят к тому, что данные о безопасности целекоксиба являются неубедительными.
НПВП, антикоагулянты и кровотечение
В нескольких исследованиях сообщалось о риске кровотечений у пациентов с острыми коронарным синдромом, получавших антитромботические препараты [33, 66]. Сообщалось, что одновременное применение НПВП и антитромботических препаратов, особенно целекоксиба и диклофенака, а также широко доступных безрецептурных НПВП, таких как ибупрофен, повышает риск кровотечения у пациентов после инфаркта миокарда [10]. Не существует безопасного времени продолжительности одновременного применения НПВП и антитромботических препаратов, учитывая, что даже кратковременное лечение (0–3 дня) связано с повышенным риском кровотечения по сравнению с отсутствием применения НПВП [10]. В рандомизированных исследованиях пероральные антикоагулянты, не являющиеся антагонистами витамина К (НОАК), ассоциировались с более низкими общими показателями кровотечений, чем варфарин; однако это снижение было в основном связано с уменьшением внутримозгового кровотечения, и не было отмечено явного преимущества по отношению к риску желудочно–кишечного кровотечения [67–69]. В апостериорных анализах исследования RE-LY [70] и исследования EINSTEIN [71] применение НПВП у пациентов, принимавших НОАК, было связано с повышенным риском развития серьезных кровотечений, в том числе желудочно-кишечных, по сравнению с отсутствием применения НПВП.
Обсервационное исследование показало, что НОАК ассоциировались с меньшим количеством желудочно-кишечных кровотечений, в отличие от антагонистов витамина К, но одновременное применение НПВП сводило это преимущество на нет [72]. Тем не менее во всем мире НОАК все чаще становятся предпочтительным вариантом антикоагулянтной терапии у пациентов с впервые диагностированной фибрилляцией предсердий [73]. У пациентов с венозной тромбоэмболией, принимающих ривароксабан или комбинацию эноксапарина и антагониста витамина К, одновременное применение НПВП ассоциировалось с повышением риска клинически значимых кровотечений в 1,8 раза и повышением риска крупных кровотечений в 2,4 раза [71].
Сильные и слабые стороны данных
Были собраны данные о повышенном сердечно-сосудистом риске как неселективных НПВП, так и селективных ингибиторов ЦОГ-2, которые подтверждаются предложенными физиологическими механизмами сердечно-сосудистого риска и фармакологическими свойствами НПВП [15, 74]. Большая часть подробных данных об индивидуальных рисках применения НПВП, о связях между дозой и риском, длительностью применения и риском, поступает из обсервационных исследований, которые не могут твердо установить причинно-следственную связь, с влиянием неучтенных вмешивающихся факторов. Мета-анализы данных наблюдений, в том числе данных на уровне отдельных пациентов, помогли дать некоторую общую перспективу, хотя они и не могут устранить все недостатки исходных данных [1, 27, 28, 32].
Вторичные результаты рандомизированных исследований по лечению боли при артрите и профилактическому лечению аденом желудочно-кишечного тракта подтвердили результаты наблюдений [53–57]. Золотым стандартом в иерархии доказательств являются хорошо продуманные рандомизированные клинические исследования с надежными конечными точками. Немногочисленные рандомизированные клинические исследования, в которых основное внимание уделялось сердечно-сосудистой безопасности НПВП, были затруднены медленным набором пациентов, высокими показателями прекращения лечения, большим числом пациентов, потерянных для последующего наблюдения, низкой частотой событий и отсутствием фармакоэквивалентных дозировок сравниваемых препаратов [61, 64]. Таким образом, несмотря на включение более 30 000 пациентов, эти исследования не дали заслуживающих внимания доказательств сравнительной безопасности отдельных НПВП у пациентов с риском сердечно-сосудистых осложнений. Следовательно, возможности регулирующих органов и медицинских обществ предоставлять научно обоснованные рекомендации по применению НПВП значительно ограничены.
Закономерности применения анальгетиков
Широкое применение НПВП среди лиц с повышенным сердечно-сосудистым риском, несмотря на недостатки этих препаратов, может свидетельствовать о высоком уровне анальгетической эффективности. Однако более реалистично то, что применение НПВП, вероятно, отражает ограниченные терапевтические возможности, доступные при распространенных заболеваниях, особенно при заболеваниях опорно-двигательного аппарата, таких как остеоартрит и боли в спине, и особенно среди пожилых людей с сопутствующими заболеваниями или с риском их развития. В широком смысле основными альтернативами НПВП являются опиоиды и парацетамол (ацетаминофен). При некоторых специфических болевых синдромах могут быть полезны препараты из других терапевтических групп, такие как антиэпилептики и антидепрессанты. Свободно доступные международные данные о применении анальгетиков ограничены, и опубликованные исследования по применению анальгетиков обычно ограничиваются терапевтической группой или конкретным болевым синдромом [75–78].
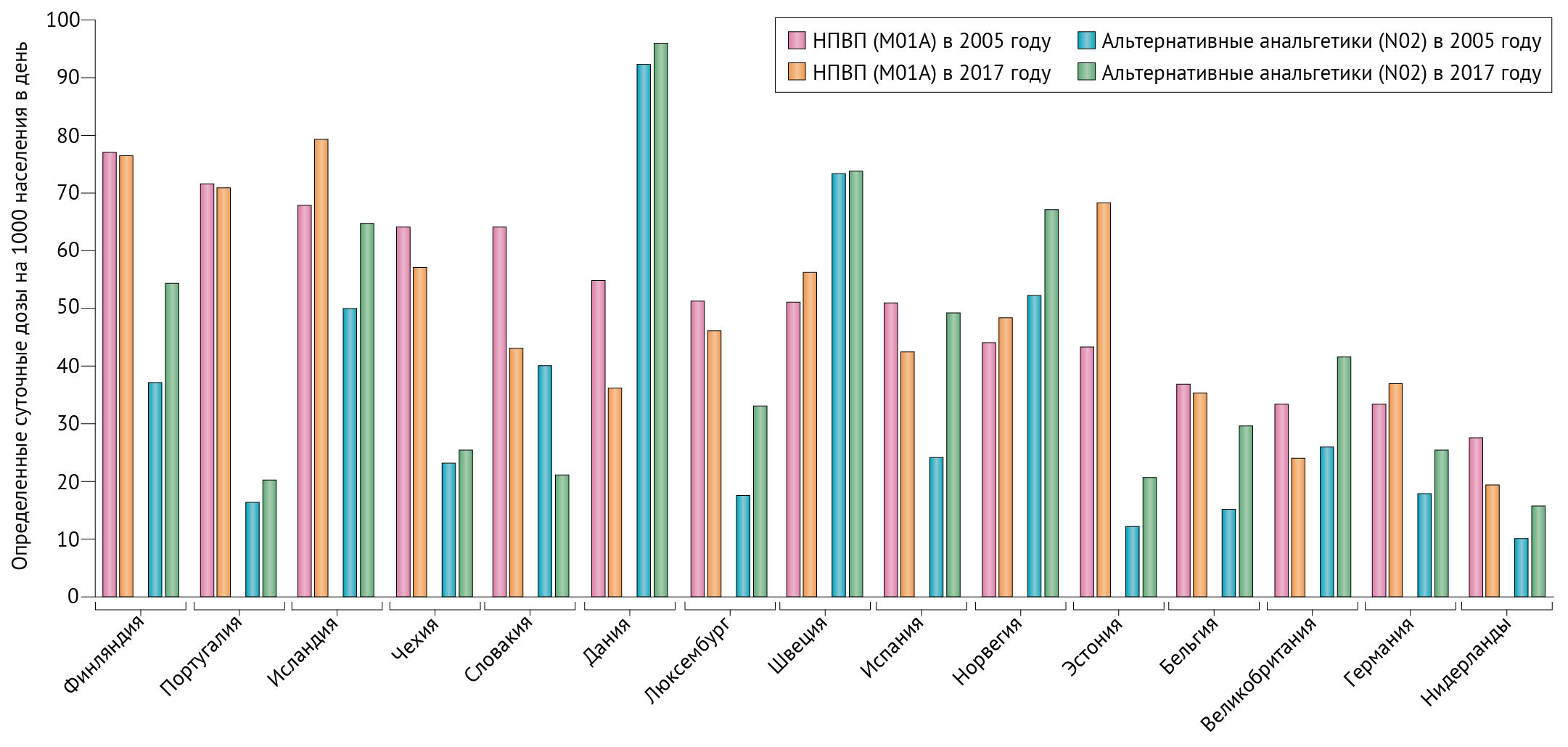
Несмотря на то, что препараты не были широко исследованы, практика отдельных врачей, по-видимому, значительно отличается, в том числе при назначении людям с риском развития осложнений, связанных с НПВП [79]. Национальные объемы потребления НПВП и их альтернатив также различаются, о чем свидетельствуют определенные суточные дозы, потребляемые на 1000 населения в день в соответствии с данными статистики здравоохранения Организации экономического сотрудничества и развития за 2019 год (рис. 3). Анальгетики классифицируются в соответствии с Анатомо-терапевтическо-химической классификацией (АТХ) на уровень 3 для НПВП (группа М01А) и на уровень 2 для наиболее распространенных альтернатив (группа Н02, которая включает опиоиды, парацетамол, аспирин в анальгетической дозе и противомигренозные препараты). Из-за различий в методах сбора данных между странами объемы потребления в странах не следует сравнивать, но можно изучить закономерности использования внутри каждой страны.
После 2005 года, когда сердечно-сосудистые риски НПВП стали признаваться повсеместно, потребление НПВП (код АТС M01A) во многих странах снизилось, в то время как потребление альтернативных вариантов (код АТС N02) в целом возросло (рис. 3). Эти закономерности не поддаются детальному анализу, поскольку информация об отдельных препаратах или профилях потребителей отсутствует, но полученные данные свидетельствуют о том, что информация о потенциальном вреде НПВП оказала некоторое влияние на выбор анальгетиков после 2005 года. Предпочтительный выбор НПВП различается в разных странах, как это было продемонстрировано в исследовании, изучающем данные о коммерческих продажах в 2011 году в 15 странах с низким, средним и высоким уровнем дохода [80]. Некоторые страны имели высокие продажи НПВП, которые почти не использовались в других странах; например, мефенамовая кислота в Пакистане и на Филиппинах, пироксикам в Индонезии и Таиланде и напроксен в Канаде и Англии.
В целом наибольшие продажи, исходя из показателей определенных суточных доз, имели диклофенак, ибупрофен, напроксен, мефенамовая кислота и целекоксиб [80].
Потребление анальгетиков не зависит полностью от выбора врача, потому что пациенты могут самостоятельно приобретать НПВП, которые доступны для покупки без рецепта врача.
Наиболее распространенные НПВП включают ибупрофен (широко продаваемый в аптеках и супермаркетах), диклофенак и мефенамовую кислоту (оба доступны в некоторых странах в качестве безрецептурных лекарств только в аптеках) и напроксен (продаваемый безрецептурно в аптеках в некоторых странах, а также в супермаркетах в других странах, таких как США). Большинство НПВП также широко доступны для покупки в интернете. Аналогичным образом, среди альтернативных анальгетиков парацетамол, кодеин в низких дозах и аспирин в анальгетических дозах широко доступны без рецепта, в то время как кодеин в высоких дозах и другие опиоиды являются лекарствами только по рецепту врача. Разрешая продажу НПВП без необходимой профессиональной консультации по правильному применению и возможным побочным эффектам, органы здравоохранения сигнализируют широкой общественности о том, что эти препараты безопасны для использования. Эта безопасность также воспринимается потребителями с сопутствующими заболеваниями и повышенным сердечно-сосудистым риском, которые могут использовать другие лекарственные средства и которые подвергаются риску серьезных медикаментозных взаимодействий, неэффективности лечения или ухудшения состояния.
Руководство по применению НПВП
Нет единого современного научно обоснованного междисциплинарного руководства от специализированных профессиональных групп по совместному применению НПВП у пациентов с риском развития побочных эффектов, в том числе с сердечно-сосудистыми рисками. Однако рекомендации отдельных профессиональных групп в значительной степени совпадают. Например, руководство по лечению заболеваний опорно-двигательного аппарата, таких как остеоартрит и боли в спине, по-видимому, совпадает в достаточной степени в Австралии, Европе и США [81–84]. Как правило, при остеоартрозе сначала предлагается немедикаментозное лечение, а затем медикаментозное, начиная с местных НПВП и затем системных НПВП в самой низкой эффективной дозе в течение как можно более короткого периода времени.
Пероральный парацетамол рекомендуется некоторым пациентам, несмотря на доказательства того, что этот препарат мало полезен при монотерапии и не лишен проблем безопасности [85]. Опиоиды рекомендуются с осторожностью, если не исключаются полностью [81]. Руководство Американского колледжа ревматологии (The American College of Rheumatology) «условно рекомендует» не использовать опиоиды [83], а австралийское руководство «настоятельно рекомендует» не использовать опиоиды [84]. НПВП обеспечивают большую симптоматическую эффективность, несмотря на сердечно-сосудистые риски [81]. Европейская лига по борьбе с ревматизмом (The European League Against Rheumatism) выпустила рекомендации по контролю сердечно-сосудистого риска у пациентов с воспалительными заболеваниями суставов и рассматривает вопрос о применении НПВП (рекомендация 9), отмечая, что среди широко используемых НПВП диклофенак, по-видимому, имеет самый высокий сердечно-сосудистый риск, а напроксен — самый низкий [82].
С мультидисциплинарной точки зрения в резюме рекомендаций профессиональных групп гастроэнтерологов, ревматологов и гериатров по надлежащему применению НПВП, опубликованном в 2013 году, отмечалось, что анальгетиком первого выбора, рекомендованным всеми группами, как правило, является парацетамол (несмотря на отсутствие эффекта), за которым следуют НПВП в минимально возможной дозе в течение самого короткого времени, назначаемые совместно с гастропротекцией, если требуется хроническое применение, и что следует избегать применения НПВП у пациентов с сердечно-сосудистыми заболеваниями [86].
Профессиональные группы кардиологов выпустили несколько руководств по применению НПВП среди пациентов с сердечно-сосудистыми заболеваниями или с риском их развития. Ни Британский фонд сердца (British Heart Foundation), ни Европейское кардиологическое общество (ESC, European Society of Cardiology, надзорная организация для 57 национальных кардиологических обществ) не имеют официальных руководящих положений, хотя в 2016 году рабочая группа ESC по сердечно-сосудистой фармакологии опубликовала установочную статью по НПВП [87]. Более десяти лет назад Фонд американского колледжа кардиологии (ACC Foundation), Американский колледж гастроэнтерологии (American College of Gastroenterology) и Американская ассоциация госпиталей (AHA, American Hospital Association) опубликовали экспертное консенсусное заявление о снижении риска в отношении желудочно-кишечного тракта при использовании антитромбоцитарной терапии и НПВП [88]. В 2005 году AHA опубликовала научную-консультативный документ по сердечно-сосудистому риску, но никаких обновленных данных опубликовано не было [89].
Австралийский фонд сердца (The Australian Heart Foundation) вкратце советует избегать НПВП, а вместо них использовать парацетамол (отдельно или в сочетании с кодеином) [90]. Основные специализированные профессиональные группы, включая сердечно-сосудистые, ревматологические, болевые и гастроэнтерологические общества, должны согласовать свои взгляды и представить современное, основанное на фактических данных консенсусное заявление о применении НПВП в контексте как пациентов, так и лекарственных рисков. Учитывая сложности и ценные суждения о преимуществах и рисках, присущих контролю боли, алгоритм, помогающий принимать решения, будет полезен как пациентам, так и врачам, назначающим лечение. В модуле 1 предлагается целостный подход к применению НПВП у пациентов с сердечно-сосудистыми рисками и нуждающихся в обезболивании.
Модуль 1 | Клиническое руководство по применению НПВП у пациентов с сердечно-сосудистым риском

Нормативные рекомендации по применению НПВП
Регулирующие органы в медицине требуют, чтобы информация о продукте для отдельных НПВП включала информацию об их побочных эффектах, включая их сердечно-сосудистые риски. В США в 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) утвердило предупреждающую этикетку, необходимую для всех рецептурных НПВП в отношении риска развития инфаркта миокарда или инсульта [5]. Кроме того, органы надзора предоставили рекомендации по применению НПВП у пациентов с сердечно-сосудистыми рисками. Европейское агентство лекарственных средств (EMA, European Medicines Agency) выпустило рекомендации по рискам, связанным с высокими дозами ибупрофена в 2015 году, о диклофенаке в 2012 году, о неселективных НПВП в 2006 году и о селективных ингибиторах ЦОГ-2 в 2005 году [91–94]. В Европе национальные регулирующие органы издали аналогичные рекомендации. В Австралии в 2014 году Агентство по контролю за медицинской продукцией (Therapeutic Goods Administration) опубликовало подробный обзор сердечно-сосудистой безопасности НПВП и включило рекомендации по применению и маркировке рецептурных и безрецептурных препаратов [95, 96]. Национальный институт здоровья и клинического совершенствования (The National Institute for Health and Care Excellence — NICE) в Великобритании ранее предоставлял «ключевые терапевтические рекомендации» — неформальное руководство по назначению НПВП, в том числе для людей с сердечно-сосудистыми рисками, но удалил эти рекомендации из своего обновления 2018 года [97].
Ассортимент препаратов в фармацевтической разработке
Токсичность НПВП, ограниченная эффективность парацетамола и растущее признание медицинских, социальных и экономических недостатков опиоидов подчеркивают необходимость эффективных анальгетиков с низким риском причинения вреда здоровью для облегчения бесчисленных «повседневных» болей, от которых страдают люди [98, 99]. К сожалению, препараты, находящиеся в фармацевтической разработке, не являются многообещающими. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и разработчики лекарств уделяют значительное внимание «препятствующим злоупотреблению» опиоидным препаратам, но их эффективность в этом отношении не доказана, и они могут просто отклонить выбор потребителей [100–103].
Ни одно из лекарственных средств не получило широкого признания, а несколько препаратов, одобренных FDA, никогда не продавались на рынке. Препараты включают комбинации опиоида со сдерживающим агентом, таким как налтрексон, или с гелеобразующими наполнителями. Если таблетка измельчается для парентерального применения, то сдерживающее средство высвобождается или образуется липкий гель, который нельзя вводить [104].
Неопиоидные препараты, недавно лицензированные FDA или находящиеся в стадии разработки, включают инъекционный липосомальный анестетик (бупивакаин) для послеоперационной анальгезии и переработку ранее одобренной, но прекращенной комбинации фиксированных доз аспирина, орфенадрина и кофеина [105].
Бупивакаин был принят для рассмотрения Европейским агентством лекарственных средств (ЕМА). Исследуемые неопиоидные анальгетики и их рассмотрение заявки на регистрацию включают μ-опиоидный агонист (NKTR-181) [106], антитела, блокирующие фактор роста нервов (такие как фасинумаб [107] и танезумаб [108]) и инъекционную форму синтетического транс-капсаицина (CNTX-4975) [109]. Обзор FDA NKTR-181, как сообщается, вызвал опасения по поводу безопасности, хотя финансируемое компанией исследование показало, что он был безопасным и эффективным [110]. Проблемы безопасности также замедлили рассмотрение заявки на регистрацию танезумаба [111].
Выводы
НПВП являются одними из наиболее часто используемых лекарств во всем мире. Несмотря на их хорошо документированные сердечно-сосудистые риски, отсутствие многообещающих новых, эффективных и безопасных альтернатив способствует их дальнейшему широкому использованию, поскольку они обеспечивают эффективную анальгезию во многих болевых ситуациях. По сравнению с основными альтернативами НПВП более эффективны, чем парацетамол, и не вызывают привыкания, что является огромным преимуществом, учитывая медицинские, социальные и экономические проблемы, связанные с высоким уровнем хронического употребления опиоидов [81, 112]. С точки зрения их основных недостатков, проблемы в отношении желудочно-кишечного тракта могут быть в некоторой степени ослаблены [34]. Однако необходима значительная осторожность для эффективного контроля сердечно-сосудистых рисков НПВП у отдельных пациентов, а также контроля риска кровотечения, возникающего при совместном назначении НПВП с другими агентами, которые увеличивают кровоточивость.
Баланс должен быть четко выражен в сторону пользы для пациента, и это тщательно оценивается как самим пациентом, так и лечащим врачом, заключение должно включать регулярную повторную оценку показаний и необходимость продолжения лечения (модуль 1). Учитывая немногочисленность альтернатив НПВП, контроль боли у пациентов высокого риска с сердечно-сосудистыми заболеваниями должен рассматриваться как важный аспект и включать в себя множество медицинских дисциплин для адаптации лечения к индивидуальным потребностям пациента и минимизации риска побочных эффектов, а также обеспечения адекватного контроля боли. Эта процедура может включать в себя специалистов по боли, физиотерапевтов, ревматологов, гериатров, клинических фармакологов и кардиологов, чтобы прийти к консенсусу относительно оптимального лечения и цели для некоторых отдельных пациентов.
Физиотерапия, физические упражнения и контроль веса могут быть возможными вариантами для многих пациентов для достижения лучшего контроля боли при минимизации фармакологических потребностей в анальгетиках и с дополнительными преимуществами в виде улучшенного контроля сердечно-сосудистого риска (модуль 1). В условиях старения населения борьба с болью становится все более сложной задачей для систем здравоохранения во всем мире. Хороший уход за пациентами с хронической болью, особенно пожилыми пациентами высокого риска, оказывает давление на системы социального обеспечения. Тем не менее, адекватный контроль боли оптимизирует индивидуальную независимость в повседневной жизни и сводит к минимуму потребность в домашнем уходе или помощи по месту жительства. Поддержание высокого качества жизни без хронической боли должно быть главным приоритетом для нашего общества, а также основным правом для отдельных людей. Поэтому органы здравоохранения и руководящие органы должны сотрудничать с пациентами, клиницистами, учеными и фармацевтической промышленностью в разработке новых и альтернативных решений для лечения боли в качестве неотложного приоритета.
