Фурин-протеаза расщепляет последовательность активации S-протеина COVID-19
Исследователи выяснили, что активационная последовательность S-белка SARS-CoV-2 расщепляется клеточным ферментом фурином, что способствует инфицированию легочной ткани.
Группа исследователей обнаружила, что последовательность активации spike-белка (S) вируса SARS-CoV-2, возбудителя COVID-19, расщепляется клеточным ферментом фурином. Эта реакция является важным звеном в патогенезе инфицирования легочной ткани.
Исследование проводилось в Отделении биологии инфекций немецкого центра изучения приматов Ассоциации Лейбница, Гёттинген (Infection Biology Unit of the German Primate Center [DPZ] – Leibniz Institute for Primate Research). По мнению исследователей, эти результаты дают новые отправные точки в поиске вакцины и лекарства от коронавирусной инфекции.
Белок S на поверхности вирусной частицы SARS-CoV-2 служит ключом для проникновения вируса в клетки хозяина. Белок облегчает адгезию вируса и объединяет мембраны вируса и атакуемой клетки. Это позволяет геному вируса проникнуть в клетку и запустить репликацию. Для запуска активационной последовательности белок S должен быть расщеплен клеточной протеазой.
Активационная последовательность, закодированная в сайте расщепления S1/S2, аналогична у высокопатогенного вируса птичьего гриппа, однако до сих пор этот механизм не наблюдался у вирусов, родственных SARS-CoV-2.
В этом исследовании биологи-инфекционисты смогли доказать, что S1/S2 расщепляется клеточной протеазой фурином и что эта реакция имеет важное значение в клеточной инвазии вируса. Она также позволяет мембранам инфицированных клеток сливаться с клеточными стенками «здоровых» соседей, таким образом вирус может распространяться по организму, не покидая пораженные клетки.
«Наши результаты показывают, что ингибиторы фурина должны блокировать распространение SARS-CoV-2 в легких», — рассказал один из ведущих исследователей Стефан Полман (Stefan Pöhlmann), руководитель отделения биологии инфекций DPZ. «Кроме того, настоящее исследование и наши предыдущие работы демонстрируют, что вирус использует двухэтапный механизм активации: в инфицированных клетках белок S должен сначала расщепляться фурин-протеазой, чтобы вирусы могли затем самостоятельно использовать протеазу TMPRSS2 для дальнейшего расщепления Spike-белка, что обеспечивает проникновение в клетки легких», — объяснил Полман.
По мнению исследователей, чтобы живая аттенуированная вакцина была эффективна, она должна обладать свойством ограниченной репликации в организме, например, только в месте введения препарата. «Штаммы SARS-CoV-2 с удаленной активационной последовательностью S1/S2 могли бы лечь в основу разработки таких вакцин, поскольку отсутствие этого механизма значительно ограничивает распространение вируса в организме. Достаточно ослабленный вирус больше не сможет вызывать болезнь, но все же позволит иммунной системе реагировать на патоген и, например, производить нейтрализующие антитела», — считает один из ведущих исследователей Маркус Хоффман (Markus Hoffmann), первый автор работы.
Исследование опубликовано в Molecular Cell.
.
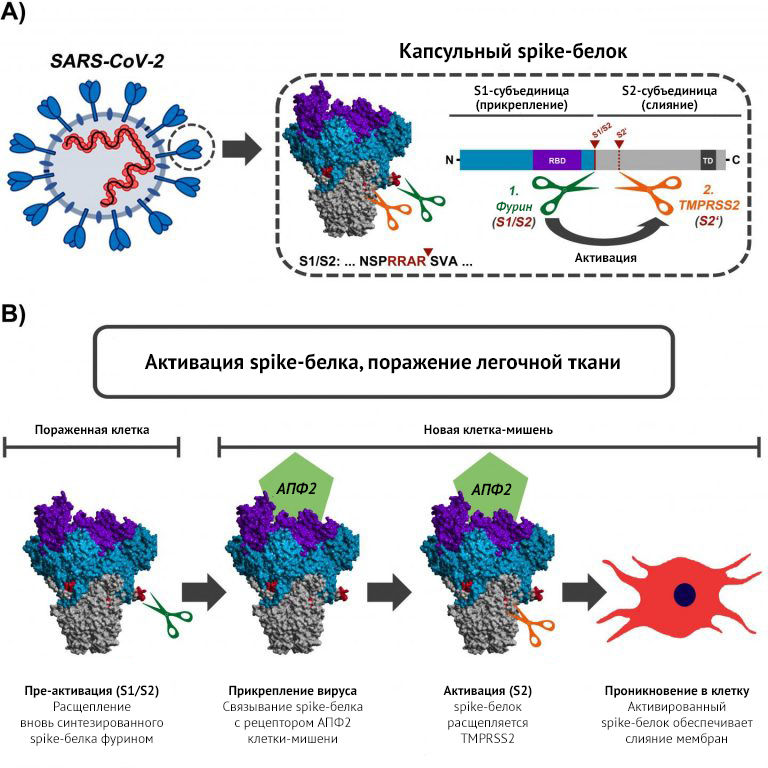
(B) В инфицированных клетках фермент фурин разрезает белок S на участке S1/S2. Белок S затем обеспечивает прикрепление вируса к новой клетке-хозяину. Для эффективного проникновения в клетку белку также необходима активация ферментом TMPRSS2. Активация с помощью TMPRSS2 возможна только в том случае, если белок S ранее был активирован фурином [комментарий Маркуса Хоффмана].
