Новый вид противоопухолевой терапии

Антагонисты глутамина могут стать перспективными средствами терапии опухолей.
Опухоли отличаются крайне высокой метаболической активностью, позволяющей злокачественно измененным клеткам быстро получать достаточное количество нутриентов для пролиферации. Именно на этом эффекте может быть основано новое направление лечения пациентов со злокачественными новообразованиями. В 2019 году был разработан экспериментальный препарат, блокирующий метаболизм аминокислот в ткани опухоли.
Новый экспериментальный антагонист глутамина носит кодовое название JHU083. По химической структуре он представляет собой 6-диазо-5-оксо-L-норлейкин (ДОН), являющийся структурным аналогом глутамина. Он связывает и блокирует ферменты, использующие глутамин в качестве субстрата. Терапевтические эффекты данного средства были описаны в конце 2019 года: сообщается, что введение препарата приводит к голоданию опухолевых клеток и снижает скорость их пролиферации. Кроме того, блокирование метаболизма глутамина приводит к повышению активности Т-лимфоцитов, что усиливает противоопухолевый иммунитет, даже если JHU083 не комбинируется с иммуномодуляторами и используется в качестве монотерапии.
Препараты, влияющие на метаболизм опухолей, уже широко используются в некоторых направлениях онкологии. Например, блокаторы метаболизма аспарагина применяются в лечении острого лимфобластного лейкоза. В недавнем исследовании изучалась возможность аналогичного использования в терапии широкого спектра опухолей блокаторов метаболизма глутамина. Глутамин утилизируется клетками опухоли с образованием большого количества углерода и азота, что обеспечивает субстратами процесс синтеза нуклеотидов, глутатиона и других молекул, необходимых для роста опухоли. На основании этого была предложена гипотеза о том, что блокирование метаболизма глутамина будет способствовать снижению темпов пролиферации опухолевых клеток [1].
Блокаторы метаболизма аминокислот имеют ряд ограничений в терапии опухолей по нескольким причинам. Во-первых, лишь немногие метаболические пути характерны только для злокачественно измененных клеток — чаще блокирование метаболизма нутриентов затрагивает и нормальные клетки, что повышает риск возникновения токсических эффектов при применении препарата. Так системная блокада утилизации глутамина влияет на функционирование головного мозга, печени и сердца. Использование JHU083 устраняет эти побочные эффекты, так как данное средство является пролекарством, активирующимся в ткани опухоли при взаимодействии с катепсинами, что лимитирует его эффект в неизмененных клетках. В одном из первых исследований была доказана эффективность JHU083 в отношении медуллобластомы, связанной с амплификацией гена MYC [2].
Еще одной проблемой является необходимость учета состава микроокружения опухоли, так как при применении любого терапевтического агента крайне важно не вовлекать в развитие токсических эффектов компоненты микроокружения, реализующие противоопухолевый эффект. Главными среди таких компонентов являются Т-лимфоциты, которые также используют глутамин для обеспечения процессов активации и пролиферации. Было отмечено, что JHU083 реализует различные метаболические эффекты в клетках опухоли и Т-лимфоцитах. В злокачественно измененных клетках внедрение в метаболизм глутамина предотвращает функционирование сигнальных путей, ответственных за выживание клеток. Т-лимфоциты, напротив, стимулируются данным пролекарством и демонстрируют усиление эффекторных функций и иммунной памяти. Один из механизмов активации Т-лимфоцитов при приеме JHU083 связан с тем, что данный препарат повышает доступность питательных веществ для неизмененных клеток микроокружения опухоли и снижает внеклеточные гипоксию и ацидоз [3].
.
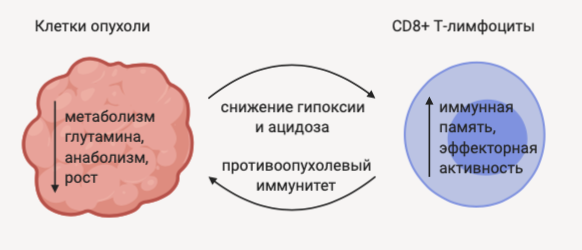
Рисунок 1 | Двойственный эффект действия JHU083 в отношении клеток опухоли и Т-лимфоцитов
Терапевтические эффекты препарата JHU083 были продемонстрированы на сингенных мышиных моделях, при этом в нескольких случаях опухоль была полностью устранена. В этих моделях также было отмечено, что блокирование метаболизма глутамина в опухолевых клетках прекращает функционирование сразу нескольких метаболических путей, что возводит данную аминокислоту на вершину нутритивной иерархии. При этом средство обладало крайне высокой биодоступностью при оральном введении, что теоретически делает его удобным для длительного лечения пациентов. В данный момент является крайне важным обнаружить аналогичные закономерности в генетических моделях, в которых опухоли развиваются через стадии, более характерные для онкогенеза в организме человека. Кроме того, назначение такого препарата у человека обязательно должно быть дополнено позитронно-эмиссионной томографией, показывающей интенсивность захвата глутамина клетками конкретной опухоли. В опухолях, демонстрирующих повышенный аппетит в отношении этой удивительной аминокислоты, введение JHU083 может оказаться крайне терапевтически эффективным.
Источники:
- Tumor microenvironment, metabolism, and immunotherapy. / DeBerardinis NJ. // N Engl J Med. - 2020. - Vol. 382, №9. - p. 869-871.
- Orally bioavailable glutamine antagonist prodrug JHU-083 penetrates mouse brain and supresses the growth of MYC-driven medulloblastoma. / Allison R Hanaford, Jesse Alt, Rana Rais [et al]. // Trans Onc. - 2019. - Vol. 12, №10. - p. 1314-1322.
- Glutamine blockade induces divergent metabolic programs to overcome tumor immune evasion. / Robert D Leone, Liang Zhao, Judson M Englert [et al]. // Science. - 2019. - Vol. 366, №6468. - p. 1013-1021.
