Порфирии
Порфирии являются группой метаболических заболеваний, вызванных нарушениями (обычно генетической природы) в активности конкретных ферментов биосинтеза гема, приводящими к сверхсинтезу и накоплению промежуточных продуктов. Промежуточные продукты, которые накапливаются, включают порфирины и предшественников порфиринов — дельта-аминолевулиновую кислоту и порфобилиногена и их производных. Клиника болезни проявляется при токсических концентрациях. Образцы этих веществ в плазме, эритроцитах, моче и фекалиях характерны для каждой порфирии и являются основой для скрининговых тестов и более полной биохимической характеристики болезни [3].
Биосинтез гема включает 8 ферментативных стадий в превращении глицина и сукцинил-коэнзима в гем. Первый и последние 3 фермента в пути находятся в митохондрии, тогда как другие 4 находятся в цитозоле (рис. 1).
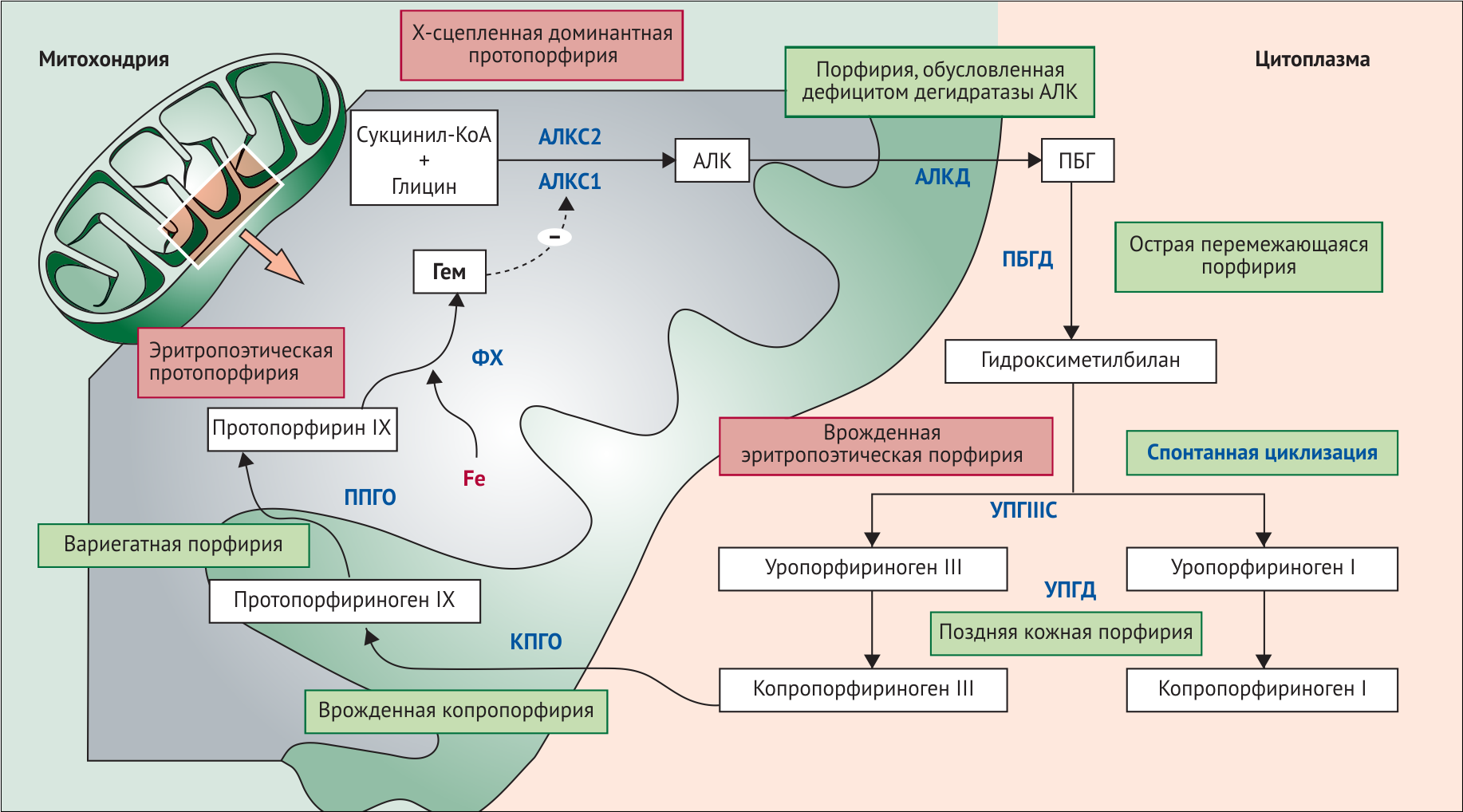
Рисунок 1.
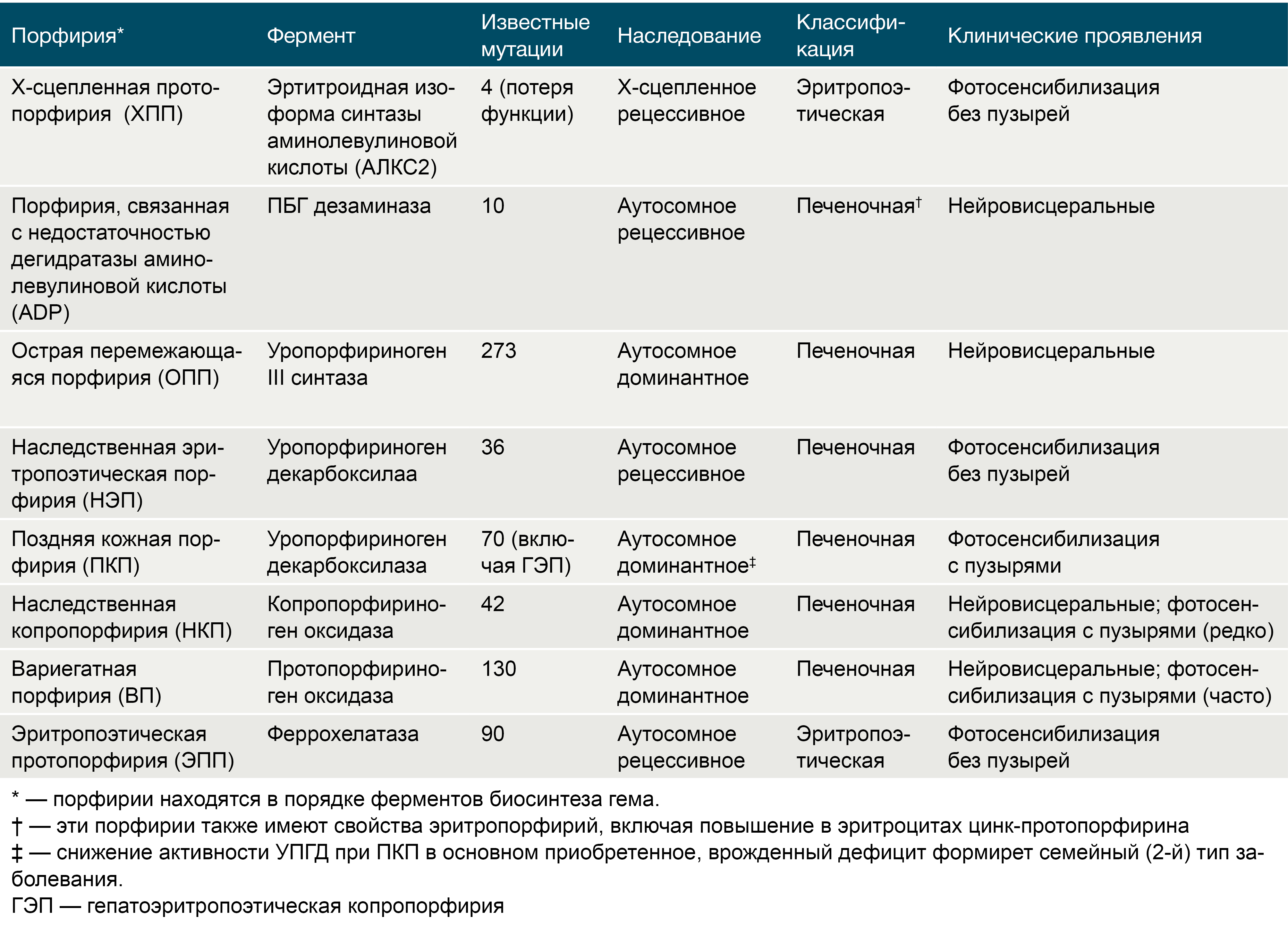
Они кодируются 9 генами, т.к. первый фермент — дельта-аминолевулинатсинтаза имеет 2 гена, которые кодируют уникальные печёночный (housekeeping) и костномозговой изоферменты, ALAS1 и ALAS2 соответственно. Все эти гены были клонированы, и мутации в них были идентифицированы (таб. 1).
Таблица 1.
Обратная негативная связь является важной частью регуляции биосинтеза гема в печени. Гем с помощью белка репрессора связывается с ДНК, что приводит к подавлению транскрипции и прекращению синтеза аминолевулинатсинтазы (ALAS1), скорость-лимитирующего фермента в биосинтезе гема. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, сульфаниламиды, стероиды, НПВС, барбитураты) — при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента. Что касается костного мозга, то здесь регуляция осуществляется с помощью ионов железа. Железо, связываясь с особым железосвязывающим белком, инициирует синтез костномозгового изофермента ALAS2, то есть оказывает положительный эффект (рис. 2).
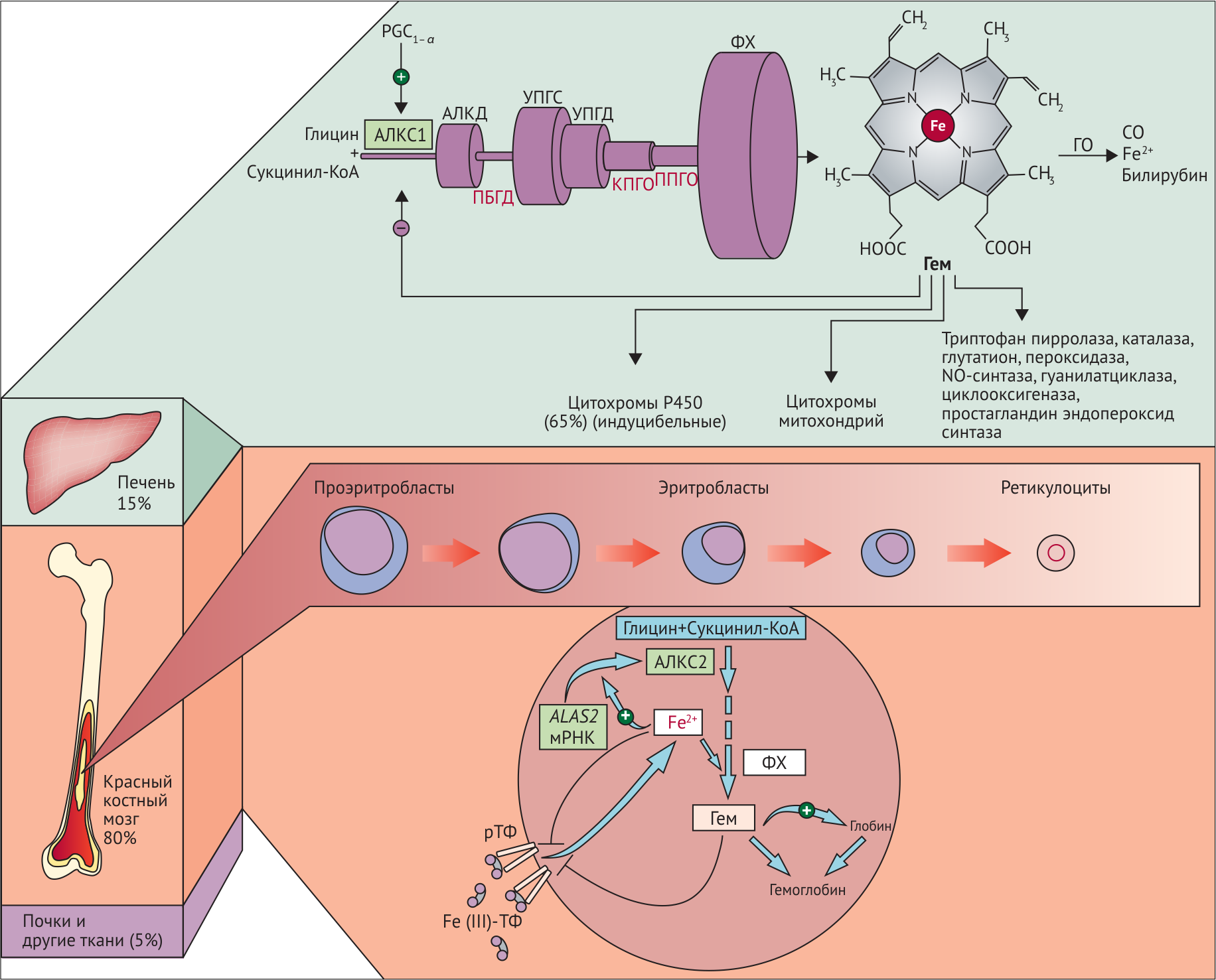
Рисунок 2.
Порфирии классифицируются как эритропоэтические или печёночные в зависимости от места синтеза и накопления промежуточных продуктов метаболизма гема.
Эритропоэтические порфирии — это врождённая эритропоэтическая порфирия (порфирия Гюнтера), эритропоэтическая протопорфирия и X-сцепленная протопорфирия, которая широко распространена, особенно среди детей. Печёночные порфирии включают острые порфирии (их 4), которые вызывают неврологические симптомы, обычно в виде острых приступов, и позднюю кожную порфирию, которая является наиболее распространённой из порфирий. Острые порфирии включают порфирию, обусловленную дефицитом дегидратазы аминолевулиновой кислоты, острую перемежающуюся порфирию, наследственную копропорфирию и вариегатную порфирию. Все формы острой порфирии наследуются аутосомно-доминантно и имеют низкую (около 10%) пенетрантность, что указывает на то, что мутация по крайней мере в одном ферменте биосинтеза гема важна, но недостаточна для клинического проявления заболевания. Необходимо задействовать некоторые дополнительные генетические факторы, которые необходимы для патологического фенотипа у гетерозиготных носителей мутантного гена [1,3].
1. Врождённая эритропоэтическая порфирия (болезнь Гюнтера).
Это аутосомно-рецессивное генетическое заболевание, характеризуемое заметно сниженной ферментативной активностью уропорфироген-III-синтазы, четвёртого фермента в пути биосинтеза гема. Дефекты uros, гена, кодирующего этот фермент, являются чрезвычайно гетерогенными на молекулярном уровне. Известны по меньшей мере 36 различных мутаций этого гена, а также одна мутация GATA-1 (кодирует эритроидный фактор транскрипции). Болезнь характеризуется гиперсинтезом уропорфирина I, который проявляется при рождении и в неонатальном периоде. Уропорфирогенсинтаза катализирует превращение гидроксиметилбилана (ГМБ), линейного тетрапиррола, в циклический тетрапиррол — уропорфириноген III. В отсутствие этого фермента ГМБ подвергается спонтанному замыканию кольца до уропорфириногена I, который может быть дополнительно метаболизирован только до копропорфириногена I. Они спонтанно окисляются до уропорфирина и копропорфирина, которые являются фотосенсибилизирующими порфиринами и вызывают кожные проявления этой патологии [4].
Клиника болезни может варьироваться в зависимости от тяжести унаследованных мутаций uros и уровня порфиринов в плазме и эритроцитах. Тяжёлое заболевание может проявлять себя ещё во внутриутробном периоде (неиммунная водянка плода) или вскоре после рождения выделением красной мочи, сильной фоточувствительностью, гемолитической анемией, спленомегалией и эритродонтией (рис. 3). Повторное воздействие солнечного света может привести к образованию рубцов, инфекции. Изменения со стороны скелета могут быть результатом дефицита витамина D. Характерные субэпидермальные буллёзные поражения прогрессируют и образуют корковые эрозии, заживающие с образованием рубцов и участков гипер- и гипопигментации. Также распространённым является гипертрихоз и алопеция. Потеря черт лица и пальцев встречаются часто и являются результатом рецидивирующих пузырей, инфекций и рубцевания [3,4].
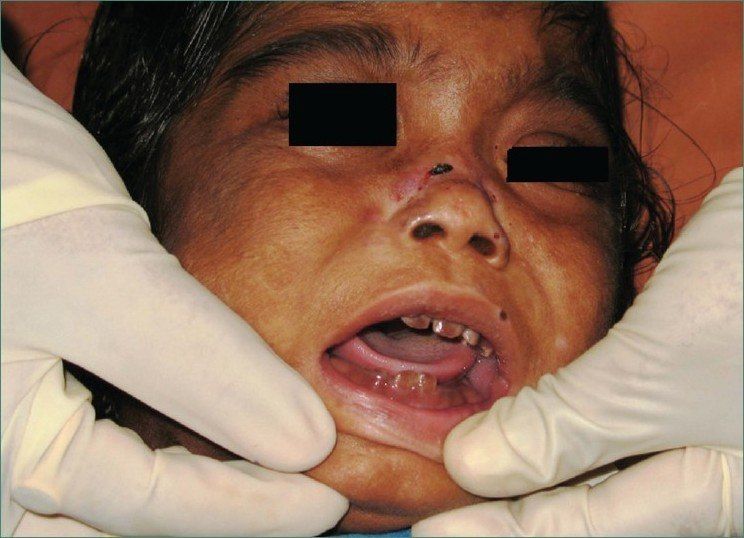
Рисунок 3.
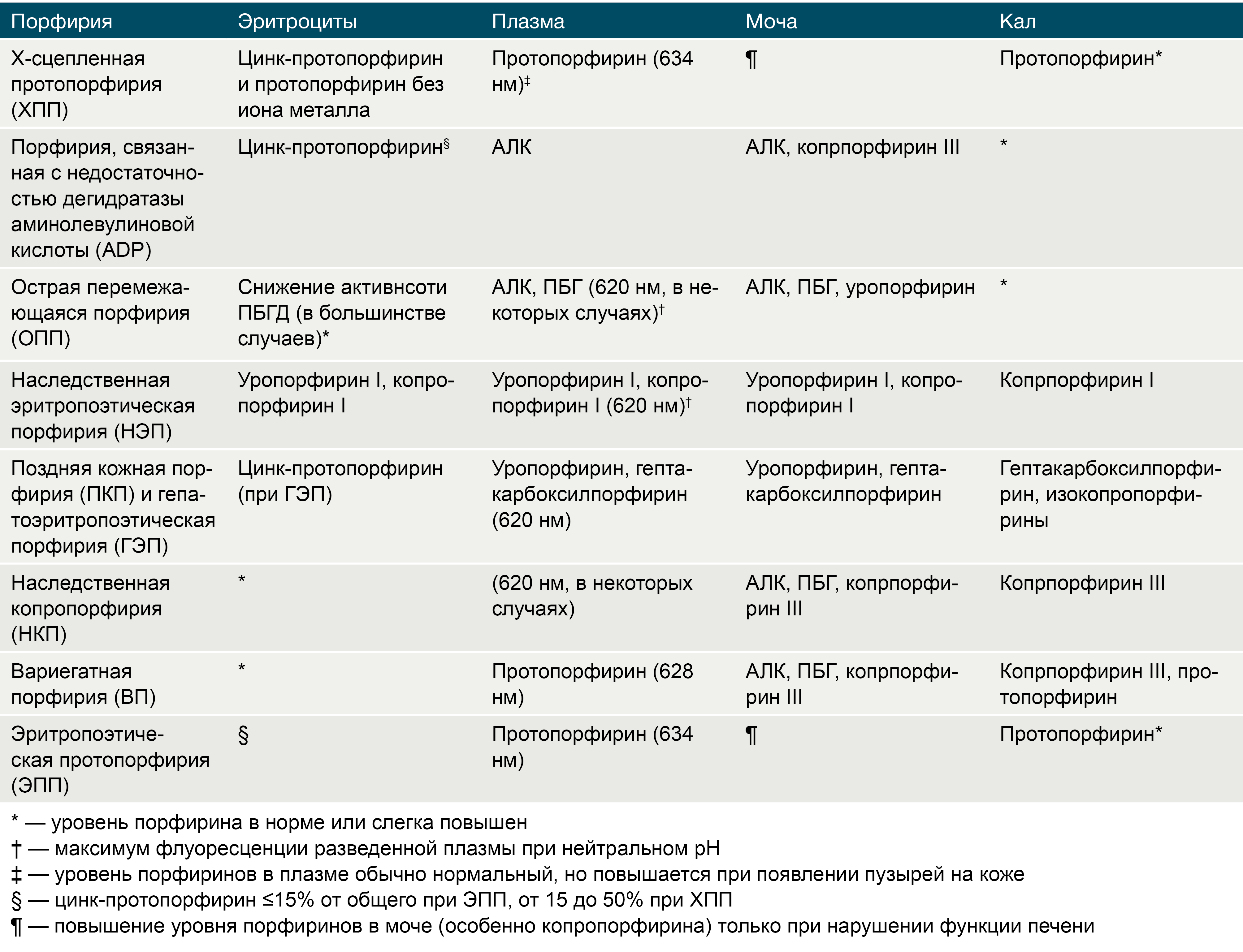
Диагноз часто ставится после рождения, когда начинается тяжёлая фотосенсибилизация и окрашивание мочи в красный цвет. Для подтверждения диагноза исследуют ДНК для выявления причинных мутаций. Это особенно важно для генетического консультирования и для пренатальной диагностики в последующей беременности. Болезнь Гюнтера следует дифференцировать от других поражений кожи (солнечная эритема, травмы, аллергические, инфекционные поражения и др.). Для этого используют различные биохимические тесты и флуоресцентную спектроскопию (таб. 2).
Лечение начинается с защитных мер от солнца. Следует соблюдать осторожность, чтобы избежать травм кожи; и раннее лечение кожных инфекций является оправданным. Длительная трансфузионная терапия устраняет анемию и эффективно подавляют эритропоэз. Однако они могут привести к избытку железа, что может потребовать парентерального дефероксамина или орально-активных хелаторов железа, деферазирокса или деферипрона. Более инвазивные процедуры, такие как спленэктомия, были направлены на снижение гемолиза, но долгосрочная эффективность по-прежнему вызывает сомнение. Трансплантация гемопоэтических стволовых клеток — это метод выбора, когда имеется подходящий донор, особенно для молодых пациентов. При успешной трансплантации наблюдается заметное улучшение состояния больного и снижение уровней порфирина, даже если они не полностью нормализуются [3,4].
2. Эритропоэтическая протопорфирия (ЭПП).
ЭПП также является наследственным нарушением, характеризующимся накоплением протопорфирина в крови, эритроцитах и тканях, что приводит к болезненной фоточувствительности. Сообщается, что во всём мире она распространена с частотой от 1:75000 до 1:200000. Важной особенностью ЭПП является то, что она отличается широкой распространённостью среди детей.
Классическая ЭПП возникает в результате наследования мутантного аллеля fech, кодирующего феррохелатазу, которая катализирует включение железа в кольцо протопорфирина для получения гема. Феррохелатаза также катализирует включение цинка в это кольцо с образованием цинк-протопорфирина из любого протопорфирина, который остаётся после завершения синтеза гема. При ЭПП безметалловый протопорфирин накапливается в ретикулоцитах костного мозга, поскольку нарушается образование как гема, так и цинк-протопорфирина. Безметалловый протопорфирин поступает в плазму из костного мозга и циркулирующих эритроцитов, а затем переносится на кожу, вызывая фоточувствительность, и в печень для экскреции с желчью. Более 130 идентифицированных мутаций в гене, находящемся в 18-й хромосоме, относятся к мутациям с потерей функций. Совсем недавно было обнаружено, что у 5‒10% пациентов с типичным фенотипом ЭПП Х-сцепленно передаётся мутантный ген Alas2, и сейчас этот вариант ЭПП называют Х-сцепленной протопорфирией [4].
Накопление жирорастворимого свободного протопорфирина в коже и кожных кровеносных сосудах и последующая фотоактивация солнечным светом приводят к характерным кожным проявлениям ЭПП. У детей с этим расстройством развиваются боль, покраснение, отёк и зуд в течение нескольких минут после воздействия солнечного света. Эти симптомы могут длиться от нескольких часов до нескольких дней. В отличие от болезни Гюнтера, везикулы и буллы нехарактерны, встречаются только в 10% случаев. Хронические изменения кожи, такие как лихенизация и псевдовезикулы, могут развиться после повторных эпизодов фоточувствительности. Они наиболее заметны в скуловой области и кисти рук. Также могут развиться различные гепатобилиарные осложнения. Обструкция жёлчевыводящих путей жёлчными камнями, в состав которых входит протопорфирин, наблюдается у 20% пациентов. У 3‒5% пациентов снижение оттока желчи может привести к пигментному циррозу.
Наблюдается умеренная гипохромная анемия с микроцитозом. Уровень сывороточного железа и растворимых рецепторов трансферрина не изменяется. Нейровисцеральные проявления могут быть у пациентов с осложнённой ЭПП (гепатопатия), у которых развиваются двигательные нейропатии, аналогичные той, которая наблюдалась в острых порфириях.
Проводят биохимические тесты для определения уровня протопорфирина в плазме и эритроцитах, потому что при ЭПП наблюдается заметное повышение уровня протопорфирина. Поскольку протопорфирин не выводится с мочой, уровни предшественников порфирина в моче являются нормальными. Для подтверждения диагноза возможен анализ генов fech и Alas2. Дополнительно исследуют гепатобилиарную функцию в прогностических целях.
Как и при болезни Гюнтера, защитные меры от солнца являются неотъемлемой частью ведения пациентов с ЭПП. Пациентам назначается аналог альфа-меланоцитстимулирующего гормона (афамеланотид). При наличии осложнений со стороны печени рекомендуют секвестранты жёлчных кислот (холестирамин по 4‒16 г/сут) и желчегонные — уродезоксихолевую кислоту.
3. Порфирия, обусловленная дефицитом дегидратазы аминолевулиновой кислоты.
Это очень редкое аутосомно-рецессивное заболевание, вызванное серьёзным дефицитом аминолевулинатдегидратазы (порфобилиногенсинтазы). Этот фермент катализирует образование порфобилиногена из двух молекул аминолевулината. Фермент кодируется геном alad, локализованным на хромосоме 9q34. Для полной активности фермента требуется сульфгидрильная группа и один атом цинка на субъединицу (всего 8 одинаковых субъединиц). Из-за дефицита фермента уровень аминолевулината существенно повышается в плазме и моче у пациентов с этой болезнью. ALA дополнительно метаболизируется с образованием других предшественников гема, и в результате копропорфирин III выделяется с мочой в больших количествах, а количество протопорфирина IX увеличивается в эритроцитах. Следует сказать, что, как и в других острых порфириях, механизм неврологического повреждения недостаточно изучен [3,4].
На сегодняшний день зарегистрировано всего 6 случаев этой болезни. В 4 случаях симптомы манифестировали только в подростковом периоде. У больных наблюдались нейровисцеральные симптомы и отсутствовали кожные проявления, что является характерной особенностью острых порфирий.
При лабораторной диагностике определяется недостаточная активность дефектного фермента, выраженное повышение уровня копропорфирина III в моче.
Дифференциальная диагностика должна включать другие печёночные порфирии, отравление свинцом, наследственную тирозинемию 1 типа, в которых подавляется активность аминолевулинатдегидратазы.
Поскольку было зарегистрировано всего несколько случаев, рекомендации по лечению основаны на ограниченном опыте. На данный момент используется гемин, который в какой-то степени улучшает клиническую картину. Он по механизму отрицательной обратной связи устраняет дефицит гема, подавляет активность синтазы дельта-аминолевулиновой кислоты — ключевого фермента синтеза порфиринов, в результате чего уменьшается синтез порфиринов и токсичных метаболических предшественников гема. Таким образом гемин осуществляет коррекцию патофизиологических нарушений, сопровождающих порфирию.
4. Острая перемежающаяся порфирия (ОПП).
Острая перемежающаяся порфирия (шведская порфирия, пирролопорфирия), наследуемая аутосомно-доминантно, является наиболее распространённой из острых порфирий во всем мире с предполагаемой распространённостью приблизительно 5:100000 в Соединенных Штатах, 1‒2:100000 в Европе. Болезнь была впервые описана голландским врачом Стоквисом в 1889 г., который пришел к выводу, что симптомы у его пациента были вызваны барбитуратом (сульфоналом). Вальденстрём в 1937 г. отметил высокую распространённость болезни в районе северной Швеции и более подробно описал болезнь. В Швеции распространенность пирролопорфирии примерно в 4 раза выше, чем в других частях Европы из-за эффекта основателя, сосредоточенного в Лапландии [3,4].
ОПП развивается у лиц, которые являются гетерозиготными по мутациям порфибилиногендезаминазы (ПБГД, третий фермент в пути биосинтеза гема). Она катализирует превращение четырёх молекул порфобилиногена в гидроксиметилбилан, в линейный тетрапиррол. Частичный дефицит ПБГД редко вызывает клиническую картину шведской порфирии, и большинство людей, которые наследуют мутантный ген этого фермента, остаются здоровыми на протяжении всей жизни. Определённые препараты и гормоны (сульфаниламиды, барбитураты, противосудорожные, НПВС, эстроген) могут непосредственно индуцировать работу аминолевулинатсинтазы, а также ферментов CYP. Это приводит к увеличению синтеза гема, поскольку повысилась потребность в нём. Когда стимулируется синтез гема, дефицит ПБГД даёт о себе знать, потому что синтез гема прерывается в середине пути. По отрицательной обратной связи индуцируется работа скорость-лимитирующего фермента — дельта-аминолевулинатсинтазы, что приводит к сверхсинтезу аминолевулината и порфобилиногена, которые накапливаются в токсических концентрациях и вызывают клиническую картину болезни.
Чаще всего заболевание манифестирует после достижения пубертатного возраста. Среди заболевших преобладают лица женского пола, что связано с функционированием их репродуктивной системы. В клинике ОПП доминирует поражение нервной системы, обусловленное избытком аминолевулината и порфобилиногена в тканях, приводящих к сегментарной демиелинизации нервных волокон с нарушением их проводимости. Течение болезни носит интермиттирующий характер, имеются острые приступы абдоминальных болей без перитонеальных признаков, которые сопровождаются диспепсией, тахикардией, психическими расстройствами (галлюцинации, беспокойство, инсомния), судорогами, периферической нейропатией (может прогрессировать до респираторного паралича) и выделением красной/бурой мочи. Приступы провоцируются голоданием, стероидными гормонами или их метаболитами, некоторыми лекарствами и стрессом. Бульбарные нарушения — дисфония, дисфагия, дизартрия — характерны для запущенных случаев. Судороги могут быть связаны с гипонатриемией, возникающей в результате поражения гипоталамуса и чрезмерно высоких уровней АДГ. Другие причины гипонатриемии — увеличенная потеря натрия почками и снижение абсорбции в ЖКТ. Судороги в данном случае плохи тем, что ряд противосудорожных препаратов являются порфириногенными и могут усугублять тяжесть заболевания. Кроме этого, предшественники порфирина имеют цитотоксическое и вазоспастическое воздействие на нефрон, что приводит к почечной недостаточности [1,3,4].
Клиническое улучшение после трансплантации печени у пациентов с тяжёлым ОПП чётко указывает на то, что печень играет важную роль в нейропатических процессах острых порфирий. Механизм неврологической дисфункции в острых порфириях не ясен, и имеются следующие гипотезы [3]:
- Нейротоксичность промежуточных продуктов биосинтеза гема является основой неврологической дисфункции. Эта гипотеза наиболее предпочтительна, хотя доказательства не убедительны.
- Дефицит ПБГД в тканях нервной системы может ограничивать синтез гема и образование важных гемопротеинов. Например, снижение активности NO-синтазы может уменьшить производство NO и вызвать вазоспазм, что объясняет некоторые церебральные проявления ОПП. Однако регулирование синтеза гема и гемопротеинов в нервной ткани и кровеносных сосудах трудно изучать, и на данный момент убедительных доказательств не хватает.
- Нарушение синтеза гема в печени во время острых атак может привести к снижению активности триптофанпирролазы, которая может увеличить уровни триптофана в плазме и головном мозге, что приведёт к усилению синтеза серотонина и накоплению нейротоксических доз.
Диагноз острая порфирия верифицируется при помощи количественного определения порфиринов и их предшественников в моче. Для острых приступов характерно высокое содержание общих порфиринов и их предшественников: аминолевулината и порфобилиногена в моче. Кроме того, высокие показатели 2 вышеперечисленных предшественников гема часто остаются высокими в период латентного течения, что является отличительной чертой ОПП при сравнении с другими формами острых порфирий. По сочетанию характерных клинических признаков с увеличенным содержанием общих порфиринов и их предшественников в моче, кале и крови, а также со сниженной активностью ПБГД в эритроцитах удаётся установить правильный диагноз больным ОПП. Для асимптомных носителей дифференциальная биохимическая диагностика затруднительна. Измерение активности ПБГД в эритроцитах далеко не всегда даёт однозначный ответ на вопрос о наличии заболевания, поскольку диапазоны уровней активности фермента у таких пациентов перекрываются с нормальными значениями. В этом случае единственным способом уточнить диагноз является молекулярно-генетическое исследование для выявления мутации в гене ПБГД (рис. 4: схема дифдиагностики).
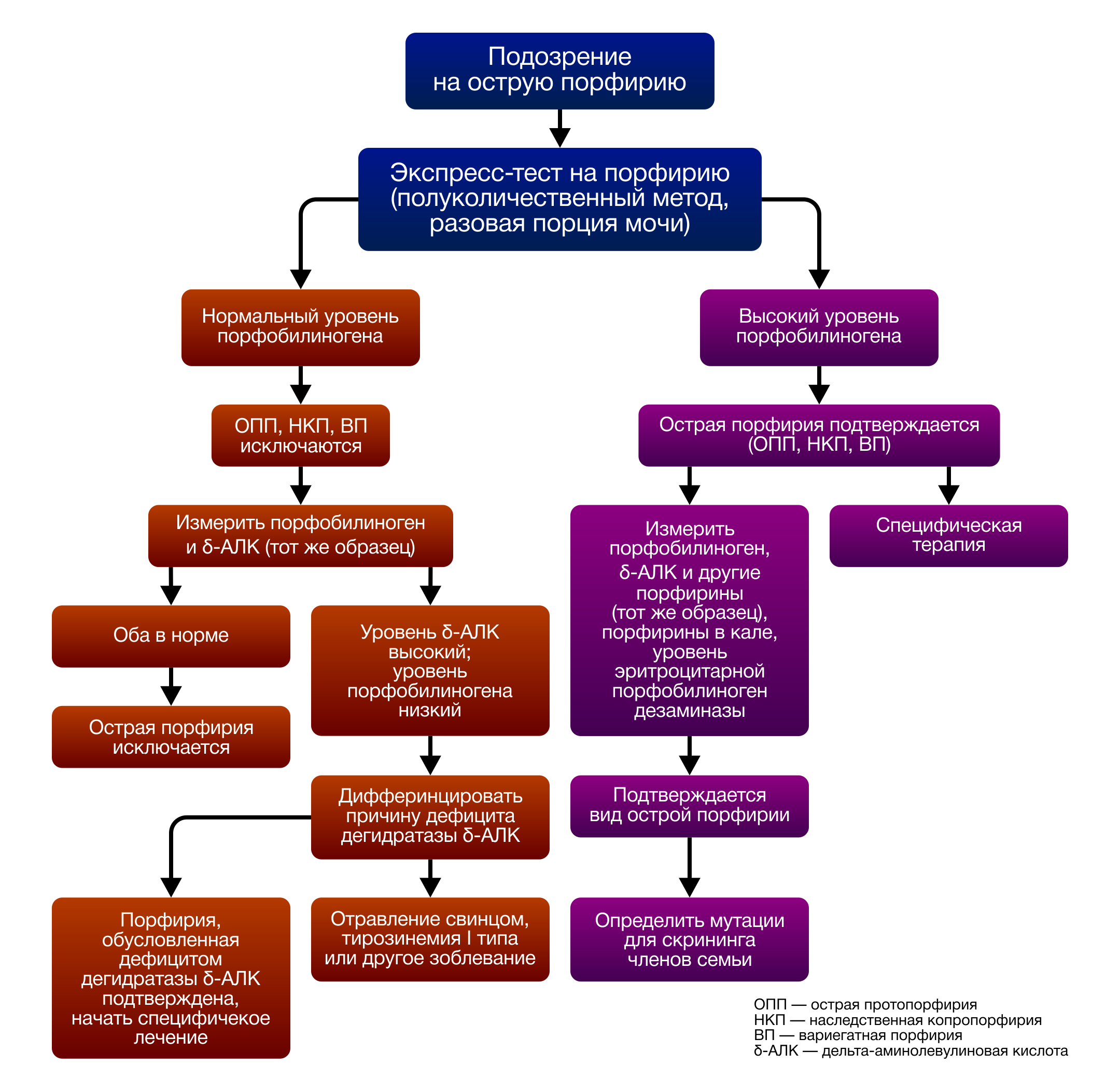
Рисунок 4.
Если диагноз установлен, для профилактики острых атак следует исключить приём потенциально опасных лекарств. У женщин атаки могут быть связаны с лютеиновой фазой менструального цикла. Для подавления овуляции им назначают аналоги гонадотропин-рилизинг гормона (ГРГ). Вследствие приёма аналогов ГРГ возможно снижение плотности костной ткани. Для предотвращения переломов назначаются бисфосфонаты. Кроме того, пациентам старше 50 лет рекомендуется длительный мониторинг функции печени, почек и уровня АД.
При атаке необходимо немедленно начать купирование тяжёлых симптомов, инфузионную терапию и коррекцию электролитных нарушений, мониторинг жизненно важных функций. По возможности устраняют провоцирующие факторы и начинают симптоматическую терапию:
- анальгетики — для купирования болевого синдрома;
- бензодиазепины короткого действия в низких дозах — для устранения психических нарушений;
- хлорпромазин — для купирования тошноты и рвоты;
- бета-блокаторы — для контроля гипертензии и тахикардии.
Относительно безопасными противосудорожными препаратами являются габапентин, вигабатрин и клоназепам. При тяжёлом течении показана внутривенная инфузия гемина, который по отрицательной обратной связи подавляет транскрипцию печеночной аминолевулинатсинтазы (ALAS1). Это снижает образование предшественников порфирина.
5. Наследственная копропорфирия (НКП).
Наследственная копропорфирия наследуется по аутосомно-доминантному типу, часто протекает латентно из-за низкой пенетрантности. НКП является наименее распространённой среди острых порфирий. При этой болезни обнаруживается нарушение активности копропорфириногеноксидазы, митохондриального фермента, который превращает копропорфириноген III в протопорфириноген IX. Когда активность фермента нарушена, накапливается копропорфириноген III, который выделяется с фекалиями и мочой. НКП по клиническим проявлениям напоминает острую перемежающуюся порфирию.
НКП является острой печеночной порфирией с выраженными нейровисцеральными симптомами. Острые атаки часто связаны с использованием определённых препаратов, голоданием и менструацией. Атаки обычно начинаются со слабой боли в животе, которая медленно усиливается в течение нескольких часов или дней, часто сопровождается тошнотой и рвотой. Обычно боль плохо локализована, но в некоторых случаях имитирует острое воспаление жёлчного пузыря, аппендикса или другого внутрибрюшного органа. Иногда боль преобладает в спине или конечностях. Моторная невропатия может развиваться в течение нескольких дней или недель, если отсутствует лечение. Дыхательная недостаточность может быть следствием нарушения иннервации диафрагмы и респираторных мышц. Кожные проявления встречаются очень редко. Следует сказать, что у пациентов с любым типом острой порфирии, если они гетерозиготны по соответствующим мутантным генам, в почках и печени могут развиться хронические изменения, которые часто являются субклиническими. Одним из проявлений этих изменений в печени является гепатоцеллюлярная карцинома, которая возникает в основном после 60 лет [3,4].
Диагноз ставится после количественного анализа порфиринов как в моче, так и в фекалиях. В моче определяется трёхкратное увеличение порфобилиногена и копропорфирина. Молекулярно-генетические тесты используются для подтверждения диагноза. Дифференциальная диагностика должна включать другие печёночные порфирии, отравление свинцом, синдром Ротора (наследственный пигментынй гепатоз) и неспецифическая копропорфиринурию, в которых также имеется повышение уровня предшественников порфирина [2] (рис.4).
Острые приступы лечатся путём прекращения приёма любых лекарств, которые, как считается, их вызывают. Затем начинают симптоматическую и инфузионную терапию, как при ОПП.
6. Вариегатная протопорфирия (ВП).
Это заболевание называют «вариегатным» (пёстрым), потому что оно может вызывать тяжелые нейровисцеральные симптомы или фотодерматоз, идентичные тем, которые наблюдаются при поздней кожной порфирии. ВП в литературе также упоминается как смешанная или южноафриканская генетическая порфирия. ВП является аутосомно-доминантным генетическим расстройством из-за недостаточной активности митохондриального фермента протопорфириногеноксидазы (ррох). Распространённость ВП составляет 1:300 среди белого населения голландского происхождения в Южной Африке из-за эффекта основателя. Более низкая распространённость ВП была оценена в Финляндии (1,3:100000) и Европе в целом (0,3:100000) [2].
Клинические проявления чаще встречаются у женщин, чем у мужчин. Бывают острые приступы, идентичные тем, которые встречаются при ОПП. Характерными являются боли в животе, груди и конечностях, гипертония, тахикардия, беспокойство, судороги и нервно-мышечная слабость, которая может прогрессировать до квадриплегии и дыхательного паралича. Фототоксические проявления могут включать субэпидермальные везикулы, буллы, эрозии или язвы, которые медленно заживают.
Диагноз ВП устанавливается путём биохимического тестирования и подтверждается идентификацией гетерозиготной мутации в ррох (таб. 2). Тактика ведения пациентов с оcтрыми атаками такая же, как при ОПП. Следует избегать солнца, поскольку эффективное лечение кожных проявлений отсутствует. Важно различать ВП от поздней кожной порфирии, потому что кожные проявления у них очень похожи [4].
Таблица 2.
7. Поздняя кожная порфирия (ПКП).
ПКП представляет собой печёночную порфирию, которая проявляется в виде фотодерматоза и не имеет никаких неврологических признаков. Следовательно, это заболевание отличается от острых печёночных порфирий, о которых говорилось выше. Поскольку ПКП является наиболее распространённой порфирией, в разных странах в диапазоне от 1:5000 до 1:70000, важно отличать её от других порфирий, которые имеют кожные проявления. Болезнь обычно манифестирует в среднем/пожилом возрасте, поэтому называется поздней. Она также известна под многими другими названиями, включая такие, как симптоматическая порфирия, идиосинкразическая порфирия, химическая порфирия или приобретённая печеночная порфирия [4,5].
Это единственная порфирия, которая может развиться в отсутствие наследуемой мутации поражённого фермента. Только 20% пациентов с этой болезнью имеют гетерозиготную мутацию urod (уропорфириногендекарбоксилазы), которая снижает активность urod во всех тканях до половины от нормы. Эти мутации повышают восприимчивость к развитию ПКП, но необходимо присутствие дополнительных факторов. Всё это приводит к тому, что активность фермента снижается на 20% от нормального уровня и болезнь манифестирует. Таким образом, ПКП является гетерогенным расстройством, в котором взаимодействуют экологические, инфекционные и генетические факторы, вызывающие существенный дефицит активности фермента в печени. Заболевание имеет 3 формы в зависимости от наличия мутаций в гене urod [3,5]:
- спорадическая форма. Самая частая форма поздней кожной порфирии без мутации urod;
- семейная форма. Пациенты гетерозиготны по мутациям гена urod, наблюдается частичное снижение активности фермента, передаётся аутосомно-доминантно. Сейчас некоторые авторы её называют гепатоэритропоэтической порфирией. Она манифестирует в детском возрасте не только тяжёлыми кожными проявлениями, но и гемолитической анемией, в какой-то степени напоминая ВЭП (рис. 5);
- приобретённая форма. Видимо, существует генетическая предрасположенность, которая приводит к снижению активности фермента в гепатоцитах. Считается, что в развитии этой формы задействованы ещё не идентифицированные гены, отличные от urod [3,4].
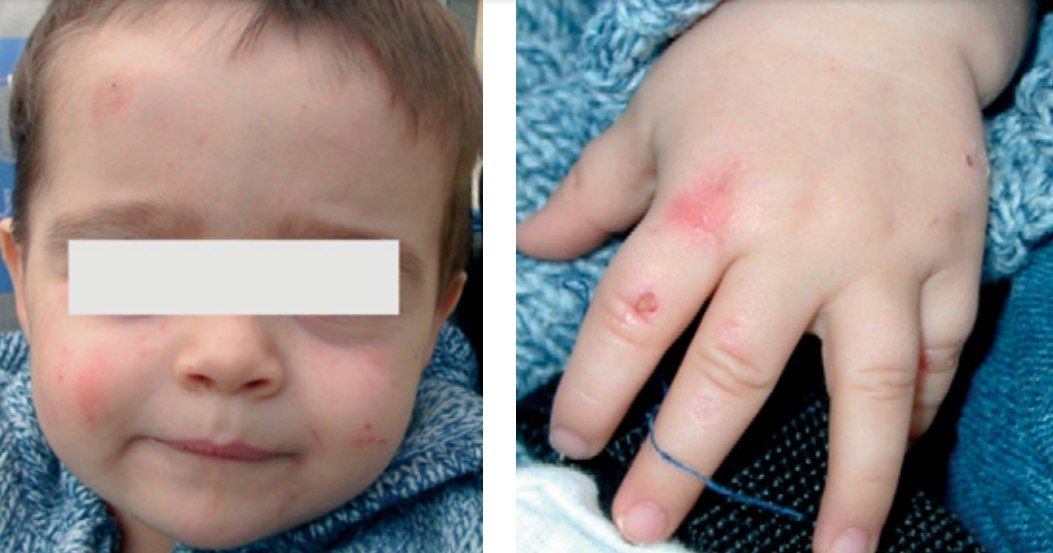
Рисунок 5.
В патогенезе ПКП важную роль играет образование ингибитора уропорфириногендекарбоксилазы, который образуется после окисления уропорфириногена или гидроксиметилбилана. Этот процесс требует присутствия высокого уровня железа, активности CYР-4501А2 и эстрогенов. Но точная структура и характер ингибитора остаются неизвестными. Перегрузка железом и длительный приём эстрогенов являются дополнительными факторами, вызывающими манифестацию латентной ПКП по неизвестным механизмам. Об этом свидетельствуют данные о том, что больше половины пациентов имеют гемосидероз и повышенный уровень плазменного ферритина. Кроме того, удаление железа из организма возвращает активность фермента в нормальный уровень в спорадической форме болезни [4].
Основными факторами риска ПКП являются чрезмерное потребление алкоголя, курение, перегрузка железом, вирус гепатита С, ВИЧ и приём эстрогенов (оральные контрацептивы, лечение рака простаты). Один или несколько из этих факторов могут быть обнаружены у более 80% пациентов. Генетическая предрасположенность является важным фактором, но она сама по себе недостаточна для развития ПКП, необходимы и другие факторы [5].
Существует несколько предложенных механизмов, по которым алкоголь приводит к снижению активности уропорфириногендекарбоксилазы. Алкоголь увеличивает абсорбцию железа, что приводит к накоплению железа в печени, активирует печёночный ALAS-1, образование свободных радикалов и является гепатотоксичным. Алкоголь также ингибирует другие ферменты в пути синтеза гема. Алкоголь, наряду с другими вышеперечисленными факторами, вызывает дефицит фермента, что приводит к накоплению порфиринов в печени [5].
Было показано, что вирусный гепатит С и ВИЧ-инфекция связаны с ПКП. Роль гепатита С не совсем понятна. Возможная гипотеза заключается в том, что он вызывает клинические проявления болезни у генетически предрасположенных лиц. Что же касается ВИЧ-инфекции, то она каким-то образом влияет на биосинтез гема и нарушает функционирование системы цитохрома Р-450.
Уропорфириногендекарбоксилаза катализирует ступенчатое декарбоксилирование уропорфириногена в копропорфириноген. Снижение активности фермента приводит к увеличению продуцирования уропорфиринов. Эти соединения автоматически окисляются до порфиринов, которые накапливаются в печени в больших количествах и через кровь переносятся на кожу, где они действуют как фотосенсибилизаторы. Они взаимодействуют со светом длиной волны около 400 нм; активируясь, генерируют активные формы кислорода, которые вызывают повреждение кожи - буллы, милии (рис. 6). Хроническое повреждение кожи может привести к образованию рубцов и изменению кожной пигментации. Другие кожные проявления могут включать гелиотропную гиперемию периорбитальных областей, хлоракне, гипертрихоз, алопецию и онихолизис [5].
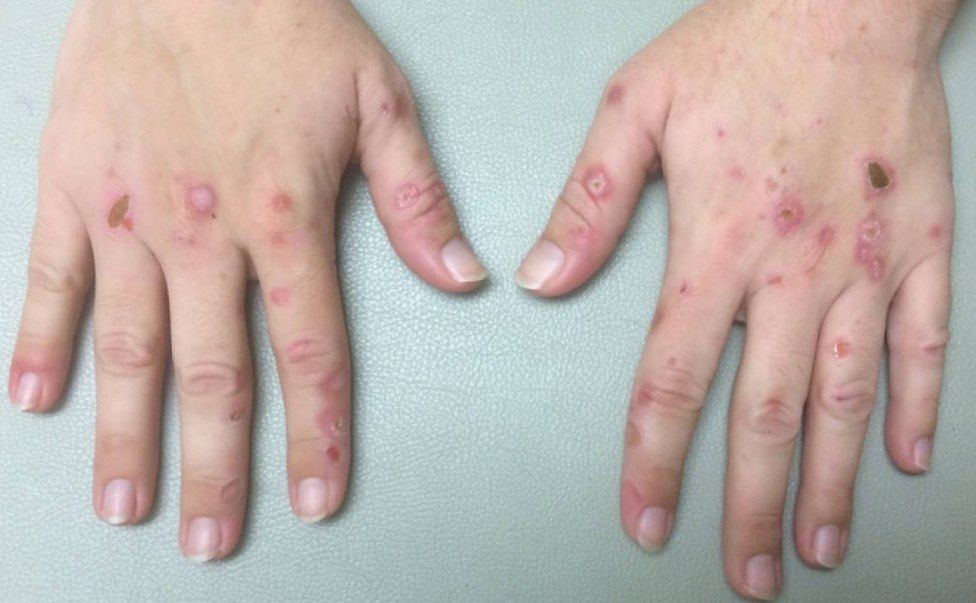
Рисунок 6.
У пациентов моча имеет розово-красный цвет. Диагноз ставится путём нахождения существенного повышения количества порфиринов в моче или плазме с преобладанием карбоксилированных порфиринов (уропорфирин и гепта-, гекса- и пентакарбоксипорфирины). Копропорфирины также увеличиваются. Уровни дельта-аминолевулиновой кислоты и порфобилиногена в моче нормальны, либо слегка повышены. Как правило, лица с ПКП имеют слегка повышенные уровни аминотрансфераз в сыворотке и уровень гамма-глутамилтранспептидазы тоже повышен. Неспецифические результаты обычных лабораторных тестов дают понять, что для диагностики ПКП необходимы специальные исследования. Высокая чувствительность у флуометрических методов. Последние помогают отличать ПКП от других печёночных порфирий (наследственная копропорфирия, вариегатная порфирия), которые также имеют кожные проявления [4,5].
Как и при других типах кожной порфирии, избегание воздействия солнца является наиболее эффективным способом предотвращения кожных проявлений. Терапия направлена на патогенетический механизм ПКП и включает снижение уровня железа, прием противомалярийных средств, которые удаляют порфирины из печени и других тканей, и флеботомию. Пациентам в первую очередь рекомендуют прекращение курения, употребления алкоголя и приёма эстрогенов. Кроме того, рекомендуется соблюдение диеты для предотвращения компенсаторного увеличения абсорбции железа в ЖКТ. Флеботомия является достаточно безопасным и эффективным методом лечения. Она заключается в том, что еженедельно или ещё реже забирают 400‒500 мл крови до тех пор, пока уровень сывороточного ферритина не станет <25 мкг/л. Клиническая ремиссия обычно проявляется после удаления 2‒4 л крови. Кожные проявления постепенно улучшаются с разрешением булл за 2‒3 месяца, а полная биохимическая ремиссия наблюдается после 13 месяцев. При флеботомии необходимо соблюдать осторожность, чтобы предотвратить снижение уровня гемоглобина ниже 110 г/л. Предсуществующая анемия, тяжёлая сывороточная белковая недостаточность (например, из-за цирроза и кровотечений) являются относительными противопоказаниями к флеботомии [5].
Если флеботомия противопоказана, низкая доза хлорохина (125 мг через день) является следующим методом выбора. Хлорохин связывает карбоксипорфирины, которые накапливаются в лизосомах, и, образуя с ними водорастворимые комплексы, он приводит к увеличению их экскреции мочой. Однако он гепатотоксичен. Подкожное введение хелатора железа — дефероксамина — также является альтернативой флеботомии. Хотя это не так дёшево, как терапевтическая флеботомия, дефероксамин способен удалять токсическое железо, вовлечённое в патогенез болезни. Кроме того, он может уменьшить компенсаторное увеличение поглощения железа в кишечнике, часто наблюдаемое при ремиссии, вызванное большей степенью снижения железа, достигаемой флеботомиями. Оральные хелаторы железа (деферазирокс, деферипрон) доступны в некоторых странах. Они также могут быть эффективными и относительно безопасными для лечения ПКП [5].
Источники:
- Пустовойт Я. С. Федеральные клинические рекомендации по диагностике и лечению острых порфирий. – 2013.
- DiMauro S. et al. Gene Reviews //University of Washington: Seattle, WA, USA. – 2010.
- Kaushansky K., Lichtman M. A. Williams Hematology. – 2016. – C. 2528.
- Ramanujam V. M. S., Anderson K. E. Porphyria diagnostics—part 1: a brief overview of the porphyrias //Current protocols in human genetics. – 2015. – С. 17.20. 1-17.20. 26.
- Ryan Caballes F., Sendi H., Bonkovsky H. L. Hepatitis C, porphyria cutanea tarda and liver iron: an update //Liver International. – 2012. – Т. 32. – №. 6. – С. 880-893.
