PTEN как метаболический регулятор. Часть 1: системный гомеостаз

В 1997 году был открыт ген и его белковый продукт PTEN — гомолог тензина и фосфатазы, экспрессия которого была значительно снижена при различных злокачественных новообразованиях. Онкосупрессорная активность PTEN связана c ингибированием передачи сигналов по основному пути роста и выживания клеток — пути фосфатидилинозитол-3-киназы (PI3K)/Akt.
Белок PTEN способен дефосфорилировать фосфопептиды, а также фосфолипиды. Таким образом, он является двойной фосфатазой — липидной и протеиновой. Биологические эффекты PTEN определяются его способностью дефосфорилировать липидный субстрат — фосфатидилинозитол-3,4,5-трифосфат (PIP3), тогда как белковые субстраты PTEN все еще не идентифицированы. При превращении PIP3 в PIP2 содержание PIP3 уменьшается, что приводит к торможению зависимой передачи внутриклеточных сигналов [1].
В то время как утрата экспрессии PTEN способствует канцерогенезу в различных тканях, также это приводит к ряду метаболических изменений, улучшающих системную чувствительность к инсулину. Это связано с мультифункциональностью сигнального пути Аkt. Блокирование его активным PTEN обеспечивает противоположные эффекты (см. рис.) [2].
В регуляции метаболизма глюкозы задействован в том числе и путь PTEN/PI3K. Инсулин и инсулиноподобные факторы роста (IGF), такие как IGF-1 и IGF-2, связываются с рецепторами инсулина и рецепторами IGF. Эта связь либо непосредственно индуцирует активацию PI3K, либо приводит к фосфорилированию субстрата рецептора инсулина (IRS). Далее IRS действует в качестве адапторного белка для рекрутирования и активации PI3K (непрямой путь активации). Благодаря этому и последующей активации Аkt адипоциты и миоциты «чувствуют» повышение уровня инсулина и усиливают в ответ поглощение глюкозы, при этом в адипоцитах серин/треонинкиназа Akt фосфорилирует свой субстрат AS160.
Кроме того, Аkt фосфорилирует различные мишени, участвующие в регуляции обмена веществ. Фосфорилирование и ингибирование киназы гликогенсинтазы 3 (glycogen synthase kinase-3, GSK3) не только способствуют регуляции β-катенина и клеточного цикла, но также активируют гликогенсинтазу. При неактивном PTEN происходит фосфорилирование GSK3, и в результате гликоген накапливается в гепатоцитах.
Фосфорилирование транскрипционного фактора FOXO с помощью Akt блокирует транскрипцию глюкозо-6-фосфатазы (G6Pase) и фосфоенолпируваткарбоксикиназы (PEPCK), что снижает интенсивность глюконеогенеза. Akt непосредственно фосфорилирует 1-альфа-коактиватор гамма-рецептора, активируемого пролифераторами пероксисом (PGC-1), и таким образом опосредует репрессию транскрипции G6Pase и PEPCK. Все эти сигналы, регулируемые Akt, блокируются PTEN [3].
В эксперименте делеция гена PTEN в печени приводила к сильному снижению PEPCK и умеренному снижению G6Pase. В жировой ткани аналогичная делеция обусловила рост чувствительности к инсулину и устойчивости к длительной гипергликемии в стрептозотоциновой модели экспериментального диабета (моделирование гипергликемии за счет разрушения β-клеток островков Лангерганса стрептомицином). У таких мышей наблюдалось повышенное количество инсулинозависимых переносчиков GLUT4 на поверхности клеточной мембраны адипоцитов [4].
PTEN-регулируемая передача сигналов через PI3K также контролирует липидный обмен. Белки, связывающие стерол-регулирующие элементы (SREBP), служат ключевыми транскрипционными факторами для генов, участвующих в биосинтезе жирных кислот и их дальнейшем включении в триглицериды и холестерин. SREBP связываются с промоторами многих генов, кодирующих липогенные ферменты — с генами синтазы жирных кислот (FASn) и ацетил-КоА-карбоксилазы, а также с генами, контролирующими продукцию никотинамидадениндинуклеотидфосфата (NADPH). Процессинг SREBP зависит от двух протеинов: белка, активирующего расщепление SREBP (SCAP), и продукта гена, индуцированного инсулином (Insig). В ответ на потребность в стеролах SCAP расщепляет SREBP с образованием зрелой активной формы транскрипционного фактора, которая перемещается в клеточное ядро. Связь Insig с SCAP блокирует это действие и, следовательно, транскрипционную активность SREBP. Аkt способствует образованию такого комплекса. Ингибирование активности PI3K/Akt пути (в том числе PTEN) не дает сформироваться этой связи, что позволяет SREBP реализовать свою функцию. Действие активного Аkt на SREBP может быть как mTORC1-зависимым, так и mTORC1-независимым [2, 5].
Действие PTEN в гепатоцитах приводит к усилению липогенеза de novo посредством сильной индукции SREBP и экспрессии FASn [6].
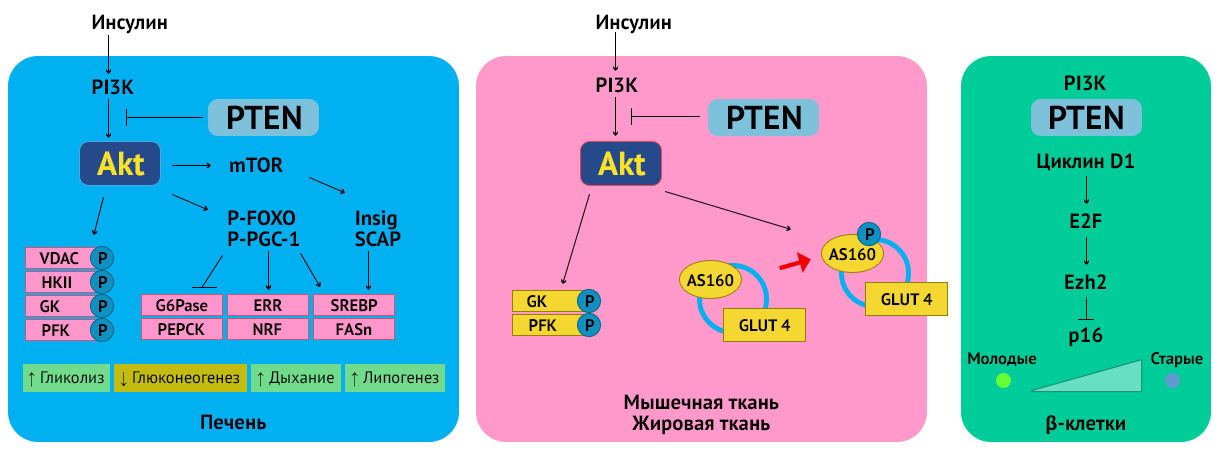
В жировой ткани и мышцах Akt также фосфорилирует AS160 (субстрат Аkt массой 160 кДа) для мобилизации транспортера глюкозы GLUT4 на поверхность клеточной мембраны в ответ на условия гипергликемии. Экспонирование GLUT4 запускает транспорт глюкозы в клетки.
Блокирование PTEN снижает возрастную утрату регенерационной способности β-клеток поджелудочной железы. PTEN ингибирует регулятор старения p16, что позволяете клеткам переходить в синтетическую фазу клеточного цикла [2].
Передача сигналов PI3K/Akt играет важную роль в функционировании митохондрий. Akt способствует связыванию гексокиназы II (НК II) с митохондриальным потенциал-зависимым анионным каналом (VDAC) на внешней мембране митохондрий. Это позволяет быстро фосфорилировать имеющиеся молекулы глюкозы и эффективно синтезировать АТФ в ходе гликолиза. В митохондриальной матрице Akt фосфорилирует митохондриальный пул киназы гликогенсинтазы-3β (GSK3β) и регулирует клеточное дыхание посредством фосфорилирования пируватдегидрогеназы (PDH). Кроме того, митохондриальная Akt также играет роль в регуляции транскрипции митохондриальной ДНК.
В ядре передача сигналов PI3K/Akt контролирует сеть транскрипции митохондриальных генов с помощью множества различных механизмов. Одним из самых многогранных является PGC-1. В качестве транскрипционного коактиватора эти белки обладают способностью взаимодействовать с рядом различных транскрипционных факторов, необходимых для окисления жирных кислот (PPAR), липогенеза (FOXO1), глюконеогенеза (FOXO1 и глюкокортикоидный рецептор — GR), митохондриальной функции (эстроген-связанные рецепторы, ERR) [7].
Коактиватор значительно увеличивает транскрипционную активность вышеперечисленных факторов транскрипции. Например, индукция ERR приводит к росту потребления кислорода и увеличению выработки его активных форм, что фенотипически проявляется в повреждения гепатоцитов с накоплением внутриклеточных липидов. Такая картина наблюдается при потере PTEN (а значит, активном Аkt) [8].
PTEN является критическим регулятором не только роста и выживания клеток, но также и системного метаболизма. РTEN вовлечен в процессы гликолиза, глюконеогенеза, синтеза гликогена, а также в липидный метаболизм и регулирование митохондриальной функции.
Список сокращений:
- Аkt — протеинкиназа B;
- AS160 — (Akt Substrate of 160 kDa) — субстрат протеинкиназы Act. Фактор обмена гуаниловых нуклеотидов малых ГТФаз семейства Rab; фосфорилируется и активируется Akt;
- E2F — транскрипционный фактор, необходимый для транскрипции многих генов, вовлеченных в синтез ДНК;
- ERR — эстроген-связанные рецепторы;
- Ezh2 (Enhancer of Zester Homolog 2) — метилтрансфераза гистонов и негистоновых белков, обнаруживается преимущественно в слабо дифференцированых и активно делящихся клетках. Активность Ezh2 способствует регенеративной пролиферации прогениторных клеток, что обеспечивает восстановление тканей;
- FASn – гены синтазы жирных кислот;
- FOXO1 — транскрипционный фактор; после фосфорилирования киназой Аkt (P-FOXO) удерживается в цитоплазме и снижает свою активность;
- G6Pase — глюкозо-6-фосфатаза;
- GK (glucokinase) — глюкокиназа;
- GLUT 4 — глюкозный транспортер тип 4, присутствует в миоцитах и адипоцитах, в отличие от гепатоцитов; инсулин вызывает его мобилизацию на клеточную поверхность, что активирует транспорт глюкозы в клетку;
- GR — глюкокортикоидный рецептор;
- GSK3 — киназа гликогенсинтазы-3 (glycogen synthase kinase-3); GSK3β — киназа гликогенсинтазы-3β;
- НК II — гексокиназа II;
- IGF — инсулиноподобные факторы роста (IGF1 и IGF2);
- IRS — субстрат рецептора инсулина;
- Insig — белок, индуцированный инсулином;
- mTOR — мишень рапамицина у млекопитающих — серин-треониновая протеинкиназа; содержит два комплекса — mTORC1 и mTORC2;
- NADPH — никотинамидадениндинуклеотидфосфат;
- NRF — ядерные респираторные факторы;
- p16 — онкобелок, ингибитор циклинзависимой киназы; выполняет ключевую роль в контроле клеточного цикла, блокируя сигнальный путь циклина и запрещая переход клетки из фазы покоя в фазу деления клеточного цикла;
- PDH — пируватдегидрогеназа;
- PEPCK — фосфоенолпируваткарбоксикиназа;
- PGC-1 — 1-альфа-коактиватор гамма-рецептора, активируемого пролифераторами пероксисом;
- PI3K — фосфатидилинозитол-3-киназа;
- PIP3 — фосфатидилинозитол-3,4,5-трифосфат;
- PPAR — рецепторы, активируемые пролифераторами пероксисом;
- PTEN — гомолог тензина и фосфатазы;
- SREBP — белки, связывающие стерол-регулирующие элементы (Sterol Regulatory Element Binding Protein). Являются транскрипционными факторами;
- SCAP — белок расщепления-активации стероидных регуляторных связывающих белков (SREBP) (SREBP cleavage-activating protein). Это мембранный белок, расположенный в эндоплазматической сети. В присутствии холестерина SCAP претерпевает конформационные изменения, которые не позволяют ему активировать SREBP, и синтез холестерина не происходит;
- VDAC — voltage-dependent anion channels — селективные потенциал-зависимые ионные каналы (митохондриальные порины);
- Циклин D1 — способствует прогрессированию клеточного цикла от фазы G к S (переход к делению).
Источники:
- Ersahin T., Tuncbag N., Cetin-Atalay R. The PI3K/Akt/mTOR interactive pathway. Mol Biosyst. 2015;11(7):1946-54.
- Chen C.Y., Chen J., He L., Stiles B.L. PTEN: Tumor Suppressor and Metabolic Regulator. Front Endocrinol (Lausanne). 2018;9:338.
- Chatterjee N.et al. Synthetic Essentiality of Metabolic Regulator PDHK1 in PTEN-Deficient Cells andCancers. Cell Rep. 2019;28(9):2317-2330.e8.
- Kurlawalla-Martinez C. et al.Insulin hypersensitivity and resistance to streptozotocin-induced diabetes in mice lacking PTEN in adipose tissue. Mol Cell Biol.2005;25:2498–510.
- Zeng H, Yu M, Tan H, et al. Discrete roles and bifurcation of PTEN signaling and mTORC1-mediated anabolic metabolism underlie IL-7-driven B lymphopoiesis. Sci Adv. 2018;4(1):eaar5701.
- Ortega-Molina A., Serrano M. PTEN in cancer, metabolism, and aging. Trends Endocrinol Metab. 2013;24(4):184-9.
- Di W. et al. PGC-1: the energetic regulator in cardiac metabolism. Curr Issues Mol Biol. 2018;28:29–46.
