Использование мышиных моделей для изучения легочных инфекций человека

Исследования патогенов человека затруднены отсутствием соответствующих животных моделей, отражающих нормальный цикл инфекции и ее патогенез. Многие патогены человека не размножаются в организме экспериментальных животных. Ученые предлагают мышиные модели для изучения респираторных патогенов, которые являются основной причиной смерти от инфекционных заболеваний во всем мире и четвертой наиболее распространенной причиной смерти в целом.
Авторы десятилетиями работали над созданием мышиных моделей с иммунодефицитом, которым можно было бы трансплантировать иммунные клетки и ткани человека (рис. 1). Человеческие гемопоэтические стволовые клетки обычно приживаются в организме мышей с определенными мутациями. Речь о мутациях, инактивирующих гены, ответственные за перегруппировку генов, кодирующих рецепторы Т-клеток и В-клеток (гены, активирующие рекомбиназу или ДНК-зависимую серин/треонин протеинкиназу) и в γ-цепи рецептора интерлейкина-2 (IL-2). Это имеет решающее значение для развития естественных клеток-киллеров. У всех этих экспериментальных мышей отсутствуют Т-, В-клетки и врожденные лимфоидные клетки, включая естественные клетки-киллеры. Часто используемая модель — мышь без ожирения и диабета с тяжелым комбинированным иммунодефицитом, мутацией ДНК-зависимой серин/треонин протеинкиназы и дефицитом IL2Rγ — NSG модель.
.
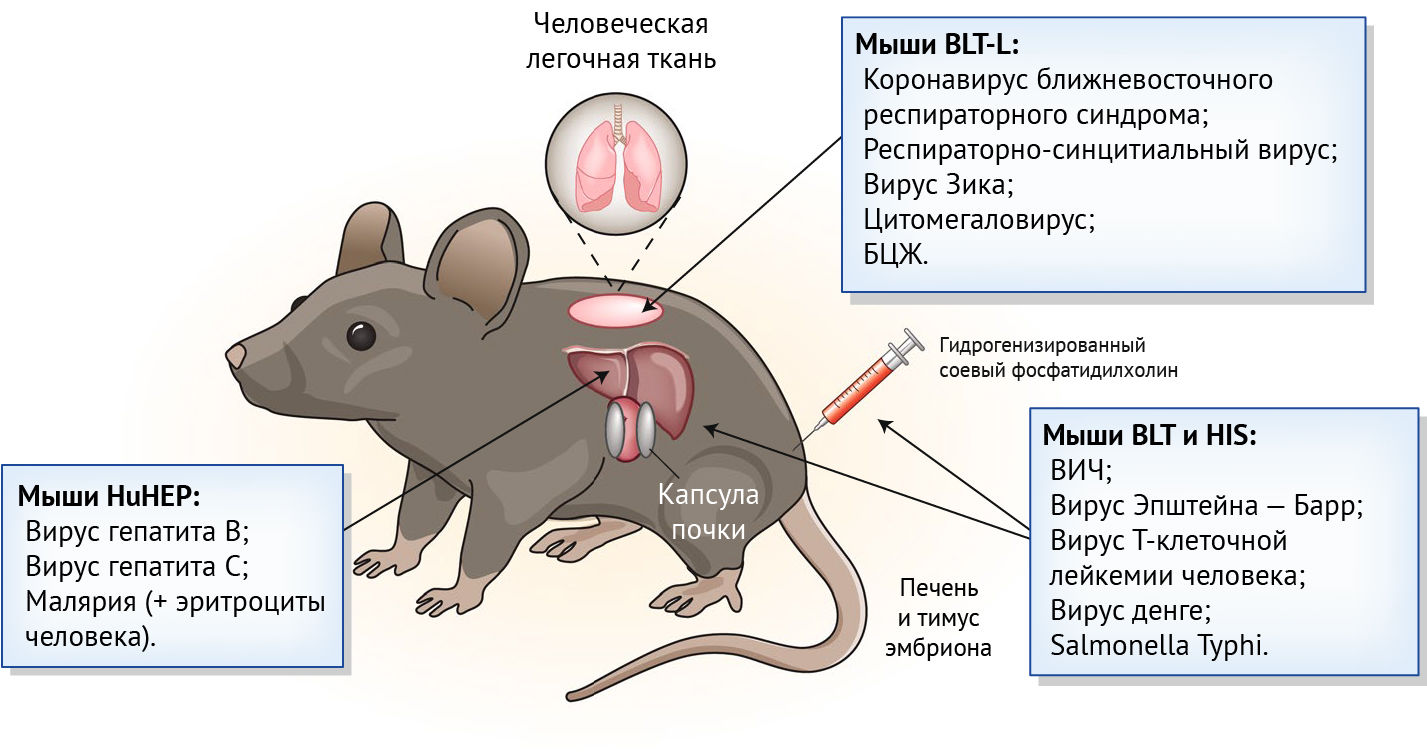
Из этих моделей создают два типа мышей с иммунной системой, приближенной к человеческой. Модели иммунной системы человека (HIS) получают, просто вводя мышам гемопоэтические стволовые клетки человека. У этих мышей Т-клетки человека развиваются в тимусе. Создать модели с трансплантированным костным мозгом, печенью и тимусом (BLT) сложнее, это требует трансплантации печени и тимуса эмбриона человека под капсулу почки с последующей инъекцией гемопоэтических стволовых клеток костного мозга от того же донора.
Как у мышей HIS, так и у мышей BLT клетки из различных гемопоэтических линий человека, включая В-клетки и Т-клетки, присутствуют в первичных и вторичных лимфоидных органах, а также в периферической крови. Оба типа являются отличными моделями для изучения специфичных для человека патогенов, нацеленных на гемопоэтические клетки, такие как ВИЧ, вирус Эпштейна-Барр и вирус Т-клеточной лейкемии человека. Чтобы изучить патогены, поражающие негемопоэтические клетки, исследователи могут трансплантировать ткани человека вместе с гемопоэтическими клетками. Например, мышей с трансплантированными иммунными клетками человека и гепатоцитами человека (мыши HIS-HuHEP) использовали для изучения иммунных реакций против вирусов, поражающих печень человека, например, вирус гепатита В.
Новое исследование существенно расширяет возможности моделирования реакций на патогены человека. Чтобы создать модели для изучения только болезней легких, авторы сначала пересаживают кусочки легкого человеческого эмбриона подкожно в спину NSG мышей, далее с помощью акустической ангиографии ученые демонстрируют возникновение активного ангиогенеза внутри и вокруг имплантатов. Авторы показывают, что клинически значимые респираторные патогены человека, в том числе респираторный коронавирус Ближнего Востока, вирус Зика, респираторно-синцитиальный вирус и цитомегаловирус, с ограниченным и неограниченным тропизмом, хорошо размножаются в трансплантатах. Исследователи также изучают БЦЖ, которая используется для вакцинации против M. tuberculosis. Более того, впервые изучили экспрессию вирусных генов во время литической репликации цитомегаловируса in vivo.
Поскольку у мышей LoM отсутствует иммунная система, репликация патогена происходит бесконтрольно. Чтобы имитировать инфекцию, возникающую у здоровых людей, авторы продолжают работать, комбинируя модели LoM и BLT, чтобы создать модели с трансплантированными органами и тканями иммунной системы и легкими. Это будут мыши BLT-L. Для этого мышам NSG сначала трансплантируют печень и тимус эмбриона человека под капсулу почки с последующей имплантацией аутологичной ткани легкого и, наконец, инъекцией аутологичных гемопоэтических стволовых клеток печени.
Авторы приводят убедительные доказательства того, что иммунный ответ на цитомегаловирус у мышей BLT-L является функциональным и может контролировать репликацию вируса. Плазменные уровни про- и противовоспалительных цитокинов, включая интерферон-γ, IL-6, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и хемокины, такие как IL-8 и интерферон-γ-индуцированный белок 10 (IP10), были повышены после инфекции, что свидетельствовало о продолжающемся иммунном ответе. Адаптивный иммунный ответ у этих мышей включает как антиген-специфические, цитокин-продуцирующие Т-клетки, так и вирус-специфические антитела. Иммуноглобулин М выявляется через 14 дней после первичной инфекции. Выявление ЦМВ-специфического иммуноглобулина G не наблюдалось при однократном воздействии, но обнаруживалось почти у 75 % мышей, повторно зараженных цитомегаловирусом.

