Биологическая роль гистондеацетилаз и перспективы использования их ингибиторов
Гистондеацетилазы — группа ферментов, которые участвуют в регуляции огромного количества клеточных процессов. Отщепляя от гистоновых белков ацетильные радикалы, деацетилазы вызывают конденсацию хроматина и прекращение экспрессии содержащихся в нем генов. Кроме того, у различных представителей данного семейства есть и свои уникальные функции.
В серии исследований было продемонстрировано, что гистондеацетилазы могут принимать участие в различных патологических процессах, вследствие чего были синтезированы ингибиторы данных ферментов, которые уже находятся в двух шагах от применения в клинической медицине (большей частью это касается онкологии).
Биологическая роль HDAC
Итак, гистондеацетилазы (HDAC) представляют собой целое суперсемейство, чья прямая функция заключается в деацетилировании гистоновых белков, что влияет на экспрессию тех или иных генов. Основная сложность при изучении функционирования HDAC состоит в том, что роль данных белков вовсе не ограничена их ферментативной активностью. Начав изучать эти деацетилазы, исследователи с удивлением обнаружили, что знание биохимических свойств HDAC in vitro совершенно не предсказывает работу этих ферментов in vivo [1].
Суперсемейство HDAC — обширный комплекс очень древних белков, которые появились еще у прокариот. Для млекопитающих количество «классических» гистондеацетилаз ограничено одиннадцатью пептидами, которые принято делить на 4 класса: I, IIa, IIb и IV (рис. 1). К HDAC III класса относят особую группу деацетилаз — сиртуины. Они обладают несколько другими свойствами, поэтому по обыкновению сиртуины рассматриваются отдельно от «классических» HDAC [2].
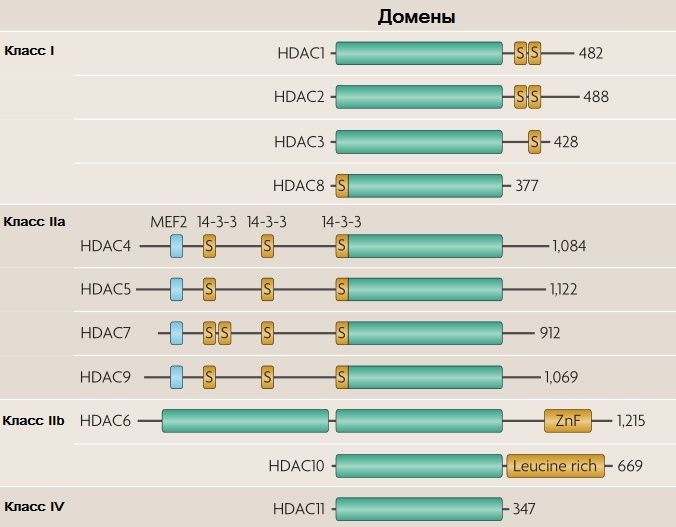
S — участки с аминокислотными остатками серина, сайты связывания со специфическими киназами;
ZnF — цинковый палец (zinc finger);
«Leucine rich» — т. н. «лейцин-богатый» мотив, участок из 20–30 остатков лейцина, имеющий пространственную конформацию в виде подковы [2].
В целом деацетилазы работают следующим образом. Ацетилированные гистоновые белки дают возможность хроматину находиться в деконденсированном состоянии — в виде эухроматина. Считывание генетической информации происходит свободно. Гистондеацетилазы «отрезают» от пептида ацетильные радикалы, гистоны меняют свою конформацию — происходит конденсация и образование гетерохроматина (спирализованного и неактивного). Однако мы уже заметили, что функций у HDAC гораздо больше, нежели просто участие в конденсации хроматина.
Рассмотрим общепринятую классификацию данного семейства:
Класс I.
К нему относят HDAC1, 2, 3 и 8. Эти белки называют гомологичными к Rpd3 (последний — регулятор транскрипции дрожжей). Их можно найти в самых разных клетках, они локализуются рядом с ядром и обладают высокой каталитической активностью в отношении гистонов.
Генетический дефект любого представителя этих HDAC оказывается летальным.
Класс IIa.
Включает в себя HDAC4, 5, 7 и 9. У всех представителей данного класса на N-конце имеется особый домен для связывания с MEF2 — миоцитарным энхансерным фактором 2 (транскрипционный фактор-репрессор) и белком-шапероном 14-3-3. Работает это все следующим образом. HDAC в неактивном состоянии связаны с MEF2. Когда протеинкиназа фосфорилирует эти HDAC (например, протеинкиназа D — PKD, или кальций/кальмодулин-зависимая протеинкиназа — CaMK), данные ферменты связываются с белком 14-3-3 и переносятся из ядра в цитоплазму. Диссоциация MEF2 и HDAC позволяет еще одному белку — HAT p300 — занять место деацетилазы. MEF2 под действием HAT p300 превращается из репрессора в активатор. Экспрессия генов изменяется.
В отличие от HDAC I класса, деацетилазы класса IIa представлены в органах и тканях крайне неоднородно. HDAC5 и 9 находятся в основном в мышцах, сердце и мозге, 4 — в мозге, 7 — в тимоцитах и эндотелии. Также особенностью ферментов этого класса является крайне низкая каталитическая активность.
Класс IIb.
Его представители — HDAC6 и 10. Сведений о последнем достаточно мало, зато HDAC6 известен как главная цитозольная деацетилаза. Мишенями этого фермента являются белки цитоскелета: α-тубулин, контрактин, трансмембранные рецепторы (например, рецептор интерферона-α) и шапероны.
Класс IV представлен всего одним белком — HDAC11. О нем пока ничего особенного не известно; обнаруживается в мозге, мышцах, сердце, почках и яичках [2].
Необходимо отметить, что дефект хотя бы одного из HDAC у мышей приводил к летальным порокам развития.
HDAC в качестве мишеней для терапии различных заболеваний
Поскольку данные белки задействованы во множестве разнообразных процессов (в том числе патологических), очень любопытна идея попробовать ингибировать работу данных регуляторов. Прежде чем рассмотреть имеющиеся по этому вопросу данные, следует разобраться с парадоксом: почему делеция гена любого из HDAC зачастую летальна, а их фармакологическое ингибирование может принести пользу?
Авторы данной работы [2] приводят три возможные гипотезы, которые могут и не исключать друг друга:
- Генетическая делеция приводит к полному отсутствию фермента, тогда как фармакологическое ингибирование может не угнетать работу ферментов на все 100 %;
- Делеция генов HDAC носит постоянный характер, а ингибиторы действуют какое-то время, после чего возможно возобновление работы ферментов;
- Делеция генов HDAC нарушает работу не только самих гистондеацетилаз, но также и всех комплексов, которые ассоциированы с деацетилазами. Ингибирование же ферментативной активности HDAC совершенно не обязательно будет влиять на другие белки (например, MEF2).
Последнюю гипотезу исследователи считают наиболее достоверной.
Противоопухолевое действие ингибиторов гистондеацетилаз
Традиционно ведущей ролью в развитии опухоли наделяются генетические дефекты — делеции, транслокации и т. д., которые приводят к снижению функции противоопухолевых регуляторов или к гиперэкспрессии онкогенов. Однако в последнее время мы получаем все больше свидетельств о важной роли в онкогенезе и эпигенетических факторов, основным из которых является ремоделирование хроматина.
Перевод хроматина в конденсированное состояние — прямая функция HDAC. Вместе с гистонацетилтрансферазами они регулируют, какие участки ДНК будут считываться, а какие — нет.
HDAC действуют как ингибиторы экспрессии различных генов, и, согласно одной из гипотез, если среди таких генов окажется противоопухолевый фактор, это повысит риск развития опухоли [3]. Поэтому разработка ингибиторов HDAC (HDACi) — достаточно интересный и перспективный подход в лечении онкологических заболеваний.
Вспомним немного строение нуклеосомы. Она состоит из пар гистоновых белков H2A, H2B, H3 и H4, формирующих кору, на которую «наматываются» 146 пар оснований нуклеотидов. Гистон H1 также принимает важное участие в формировании нуклеосомы (связывает линкерные ДНК), но не регулируется ацетилированием, а потому выходит за рамки нашей темы.
Коровые гистоны богаты положительно заряженными лизином и аргинином, концевые их участки называют «хвостами». N- и С-хвосты участвуют в посттрансляционных модификациях гистоновых белков. Ацетилирование/деацетилирование происходит на N-концевом «хвосте».
Итак, HDAC, удаляя с N-концевого участка гистонов ацетильный радикал, приводят к конденсации хроматина. Это может способствовать развитию опухоли. Например, онкогенные белки PML-RARα, PLZF-RARα и AML1-ETO являются индукторами лейкемии. Происходит это с помощью особого белкового комплекса (который содержит HDAC), который препятствует экспрессии специфических противоопухолевых генов.
Также при различных видах онкологических заболеваний можно наблюдать повышенную экспрессию индивидуальных HDAC. Например, уровень HDAC1 повышается при раке простаты, желудка, толстого кишечника, раке груди; HDAC2 — при колоректальном, раке груди и шейки матки. Однако точные молекулярные механизмы такой корреляции пока не установлены [3].
Несмотря на множество пробелов в нашем понимании о работе HDAC, разработка различных HDACi показала себя достаточно перспективной. При исследованиях in vitro было выяснено, что HDACi обладают рядом противоопухолевых свойств: они тормозят клеточный цикл на G1 (и/или G2) фазе и инициируют апоптоз. Практически во всех типах трансформированных клеток применение HDACi снижало рост опухолей (исследовались в том числе лейкемия, миелома, карциномы различного вида) [4].
В последнее время обсуждается вопрос о разработке селективных ингибиторов конкретных HDAC, так как функции последних могут быть крайне разнообразны. Например, они обладают довольно противоречивым эффектом в отношении аутофагии: HDAC6 инициирует аутофагию, когда убиквитин-протеасомная система не справляется; дефект HDAC2 приводит к отсутствию аутофагии в кардиомиоцитах. Совершенно другим влиянием обладает HDAC1: при нокдауне этого белка в клетках HeLa, наоборот, начинают образовываться аутофагосомы [5].
В целом же HDACi влияют на множество разнообразных процессов: инициируют апоптоз, тормозят клеточный цикл, способствуют аутофагии, тормозят ангиогенез в опухоли и даже способны модулировать иммунный ответ [3, 5].
Перспективы использования ингибиторов гистондеацетилаз в лечении воспалительных и других заболеваний
HDAC конденсируют самые разнообразные гены, в числе которых могут оказаться не только регуляторы клеточного цикла. Изменение экспрессии различных генов может быть полезным в том числе в терапии воспалительных заболеваний.
Действие HDACi на клетку довольно неоднозначно. Различные препараты могут оказать как про-, так и противовоспалительный эффект. К примеру, трихостатин А (один из HDACi) усиливал синтез ЦОГ-2 в макрофагах у мышей и вместе с тем ингибировал синтез провоспалительных медиаторов (TNFα, IL-6) [6].
Представители ряда HDACi могут быть полезны при терапии артритов (ревматоидного и/или остеоартрита). Предполагается, что также возможно применение HDACi для лечения и профилактики остеопороза, воспалительных заболеваний кишечника (например, при болезни Крона), нейродегенеративных заболеваний, сердечной недостаточности, диабета и бронхиальной астмы [1, 6, 7]. Для всего этого спектра самых разных заболеваний существуют определенные предпосылки, однако, пока данные не будут подкреплены серией РКИ, сделать какие-то выводы не представляется возможным.
Источники:
- C. A. Dinarello, G. Fossati, and P. Mascagni, ‘Histone deacetylase inhibitors for treating a spectrum of diseases not related to cancer’, Mol. Med., vol. 17, no. 5 —6, pp. 333 —352, 2011.
- M. Haberland, R. L. Montgomery, and E. N. Olson, ‘The many roles of histone deacetylases in development and physiology: Implications for disease and therapy’, Nat. Rev. Genet., vol. 10, no. 1, pp. 32 —42, 2009.
- J. E. Bolden, M. J. Peart, and R. W. Johnstone, ‘Anticancer activities of histone deacetylase inhibitors’, Nat. Rev. Drug Discov., vol. 5, no. 9, pp. 769 —784, 2006.
- M. P.A., R. R.A., R. V.M., B. R., M. T., and K. W.K., ‘Histone deacetylases and cancer: Causes and therapies’, Nat. Rev. Cancer, vol. 1, no. 3, pp. 194 —202, 2001.
- T. Eckschlager, J. Plch, M. Stiborova, and J. Hrabeta, ‘Histone deacetylase inhibitors as anticancer drugs’, Int. J. Mol. Sci., vol. 18, no. 7, pp. 1 —25, 2017.
- M. Halili, M. Andrews, M. Sweet, and D. Fairlie, ‘Histone Deacetylase Inhibitors In Inflammatory Disease’, Curr. Top. Med. Chem., vol. 9, no. 3, pp. 309 —319, 2009.
- Y. H. Kao et al., ‘Histone deacetylase inhibition improved cardiac functions with direct antifibrotic activity in heart failure’, Int. J. Cardiol., vol. 168, no. 4, pp. 4178 —4183, 2013.
